A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
3D Bioprinting الهلاميات المائية الضوئية لدراسة تنشيط الخلايا الليفية
In This Article
Summary
توضح هذه المقالة كيفية الطباعة الحيوية للهلاميات المائية القابلة للطباعة الضوئية 3D لدراسة تصلب المصفوفة خارج الخلية وتنشيط الخلايا الليفية.
Abstract
يمكن أن تتحول الهلاميات المائية القابلة للتعديل الضوئي مكانيا وزمانيا استجابة للتعرض للضوء. إن دمج هذه الأنواع من المواد الحيوية في منصات زراعة الخلايا وإحداث تغييرات ديناميكية ، مثل زيادة صلابة البيئة الدقيقة ، يمكن الباحثين من نمذجة التغييرات في المصفوفة خارج الخلية (ECM) التي تحدث أثناء تطور المرض الليفي. هنا ، يتم تقديم طريقة للطباعة الحيوية 3D مادة حيوية هيدروجيل قابلة للتعديل الضوئي قادرة على تفاعلين بلمرة متتاليين داخل حمام دعم الجيلاتين. تم تكييف تقنية التضمين الحر القابل للانعكاس للهلاميات المائية المعلقة (FRESH) عن طريق ضبط الرقم الهيدروجيني لحمام الدعم لتسهيل تفاعل إضافة مايكل. أولا ، تم تفاعل الحبر الحيوي الذي يحتوي على بولي (جلايكول الإثيلين) - ألفا ميثاكريلات (PEGαMA) خارج القياس المتكافئ مع رابط متشابك قابل للتحلل الخلوي لتشكيل هلاميات مائية ناعمة. تعرضت هذه الهلاميات المائية اللينة لاحقا للضوء والضوء للحث على البلمرة المتجانسة للمجموعات غير المتفاعلة وتقوية الهيدروجيل. يغطي هذا البروتوكول تخليق الهيدروجيل ، والطباعة الحيوية ثلاثية الأبعاد ، والتقوية الضوئية ، وتوصيف نقطة النهاية لتقييم تنشيط الخلايا الليفية داخل هياكل ثلاثية الأبعاد. تمكن الطريقة المعروضة هنا الباحثين من الطباعة الحيوية ثلاثية الأبعاد لمجموعة متنوعة من المواد التي تخضع لتفاعلات البلمرة المحفزة بالأس الهيدروجيني ويمكن تنفيذها لهندسة نماذج مختلفة من توازن الأنسجة والمرض والإصلاح.
Introduction
الطباعة الحيوية ثلاثية الأبعاد هي تقنية تحويلية تمكن الباحثين من إيداع الخلايا والمواد الحيوية بدقة داخل مجلدات ثلاثية الأبعاد وإعادة إنشاء الهيكل الهرمي المعقد للأنسجة البيولوجية. على مدى العقد الماضي ، أدى التقدم في الطباعة الحيوية ثلاثية الأبعاد إلى نبض أنسجة القلب البشرية1 ، والنماذج الوظيفية لأنسجة الكلى2 ، ونماذج تبادل الغازات داخل الرئة3 ، ونماذج الأورام لأبحاث السرطان4. إن اختراع تقنيات الطباعة الحيوية ثلاثية الأبعاد المضمنة ، مثل التضمين الحر القابل للانعكاس للطباعة الحيوية للهيدروجيل المعلق (FRESH) ، جعل من الممكن إعادة إنتاج هياكل الأنسجة الرخوة المعقدة مثل الأوعية الدموية الرئوية5 وحتى قلب الإنسان6 في 3D. تسهل الطباعة الحيوية ثلاثية الأبعاد FRESH الطباعة طبقة تلو الأخرى للأحبار الحيوية الناعمة ومنخفضة اللزوجة من خلال البثق في حمام دعم ترقق القص. يتكون حمام الدعم من مادة مثل جزيئات الجيلاتين الدقيقة المعبأة بشكل وثيق والتي تعمل كبلاستيك بينغهام وتحافظ على الشكل والهيكل المقصودين للحبر الحيوي بعد الطباعة. بمجرد أن تصلب البنية المطبوعة ، يمكن بعد ذلك إذابة حمام الدعم عن طريق زيادة درجة الحرارة إلى 37 درجة مئوية7.
لخصت مقالة مراجعة حديثة المواد التي تم طباعتها بيولوجيا 3D في منشورات مختلفة باستخدام تقنية FRESH. تتراوح هذه المواد المشتقة بشكل طبيعي من الكولاجين من النوع الأول إلى حمض الهيالورونيك الميثكريلاتي وتمثل العديد من آليات الهلام المختلفة7. معظم الدراسات البحثية التي أجريت باستخدام هذه التقنية 3D bioprinting تستخدم المواد الحيوية الثابتة التي لا تتغير استجابة للمنبهات الخارجية. تم استخدام المواد الحيوية الهيدروجيل الديناميكية القابلة للتعديل الضوئي من قبل مختبرنا وآخرين8،9،10،11،12 لنمذجة مجموعة متنوعة من الأمراض الليفية. على عكس المواد الحيوية الثابتة ، تسمح الأحبار الحيوية القابلة للتعديل الضوئي بإنشاء نموذج مخفف مع قيمة معامل مرونة أقل وتقويته لاحقا لاستكشاف الاستجابات الخلوية للزيادات في تصلب البيئة الدقيقة.
تتميز الأمراض الليفية بزيادة في إنتاج المصفوفة خارج الخلية التي يمكن أن تسبب تندب وتصلب13. يمكن أن يؤدي تصلب الأنسجة إلى مزيد من الإصابات وتدمير الأنسجة المتأثرة ، مما يتسبب في تلف دائم للأعضاء وحتى الموت. الاضطرابات الليفية مسؤولة عن ثلث الوفيات في جميع أنحاء العالم. تنتج الخلايا الليفية مصفوفة زائدة وشاذة خارج الخلية في حالة المرضهذه 14,15. تؤدي زيادة تكاثر الخلايا الليفية وترسب المصفوفة خارج الخلية إلى زيادة تصلب الأنسجة وتنشيط حلقة التغذية المرتدة الإيجابية البروليفية16،17،18،19. دراسة تنشيط الخلايا الليفية أمر حيوي لفهم الأمراض الليفية. نقدم هنا ارتفاع ضغط الدم الشرياني الرئوي البشري (PAH) كمثال على اضطراب ليفي واحد حيث من المهم تقليد هندسة 3D للأوعية الدموية باستخدام الطباعة الحيوية ثلاثية الأبعاد وإدخال قدرات التقوية الديناميكية للهلاميات المائية القابلة للضوء. PAH هي حالة يتجاوز فيها الضغط في الشرايين الرئوية الرئيسية المستويات الطبيعية ويطبق ضغطا على القلب ، مما يزيد من تنشيط الخلايا الليفية العرضية للشريان الرئوي البشري (HPAAF) ويتصلب أنسجة الأوعية الدموية16،17،18،19. تسمح تركيبة الحبر الحيوي بولي (جلايكول الإثيلين) ألفا ميثاكريلات (PEGαMA) القابلة للتعديل الضوئي بالتصلب الزمني في التركيبات وتساعد على نمذجة كل من الأنسجة السليمة وتطور المرض5،8،9،10. يتيح استغلال هذه الميزة الفريدة القياس الكمي لتنشيط HPAAF وانتشاره استجابة لتقوية البيئة الدقيقة في 3D وقد يوفر نظرة ثاقبة قيمة للآليات الخلوية المشاركة في هذا المرض. سيسمح البروتوكول الموصوف هنا للباحثين بإنشاء نماذج 3D تلخص التغيرات في البيئة المكروية خارج الخلية أثناء تطور المرض أو إصلاح الأنسجة ودراسة تنشيط الخلايا الليفية.
Protocol
1. توليف وتوصيف PEGαMA
ملاحظة: تم تكييف تخليق بولي (جلايكول الإثيلين) - ألفا ميثاكريلات (PEGαMA) من Hewawasam et al . وتم إجراؤه في ظروف خالية من الرطوبة9.
- وزن المتفاعلات.
ملاحظة: على سبيل المثال، تزن 5 جم 10 كجم/مول 8 أذرع من هيدروكسيل البولي إيثيلين جليكول (PEG-OH) و0.38 جم هيدريد الصوديوم (NaH) (انظر جدول المواد). - أضف شريط تقليب إلى 250 مل من قارورة Schlenk ونظفها بالأرجون.
- قم بإذابة PEG-OH في أقل حجم من رباعي هيدروفوران اللامائي (THF) المطلوب للذوبان داخل دورق شلينك.
ملاحظة: حوالي 80 مل من THF سوف يذوب 5 جم PEG-OH. أضف الحد الأدنى من THF المطلوب لإذابة PEG-OH. - أضف 3 مرات من NaH الزائد إلى خليط التفاعل وحركه في درجة حرارة الغرفة (RT) لمدة 30 دقيقة.
- أضف 6 أضعاف الفائض المولي إيثيل 2- (بروموميثيل) أكريليت (EBrMA ، انظر جدول المواد) بالتنقيط إلى دورق Schlenk وقم بتغطية وعاء التفاعل بورق الألمنيوم لحمايته من الضوء. حرك التفاعل في درجة حرارة الغرفة لمدة 48 ساعة تقريبا.
ملاحظة: بالنسبة ل 5 جم PEG-OH و 0.38 جم NaH ، استخدم 3.68 مل EBrMA لهذا التفاعل. - أضف بضع قطرات من 1 N حمض الأسيتيك لإخماد التفاعل. قم بتصفية المحلول بالمكنسة الكهربائية من خلال أداة مساعدة للترشيح.
ملاحظة: ستؤدي إضافة حمض الأسيتيك إلى إنتاج فقاعات غازية. توقف عن إضافة قطرات حمض الأسيتيك عندما تتوقف الفقاعات عن التكون لأن هذا يشير إلى أن الخليط قد تم إخماده بنجاح. - ركز الراشح على مبخر دوار وترسب في 4 °C ثنائي إيثيل الأثير. اترك الراسب محميا من الضوء عند 4 درجات مئوية لمدة 12-18 ساعة.
- أضف ورق ترشيح Whatman إلى قمع Buchner. صب خليط التفاعل ببطء على ورق الترشيح واستخدم الشفط الفراغي لفصل الراسب عن ثنائي إيثيل الأثير. اجمع المادة المترسبة في دورق ترشيح جاف ونظيف.
- جفف المنتج بالمكنسة الكهربائية لمدة 5 ساعات على الأقل أو طوال الليل في درجة حرارة الغرفة وقم بإذابته في الحد الأدنى من حجم الماء منزوع الأيونات المطلوب. نقل المنتج المذاب إلى أنابيب غسيل الكلى (انظر جدول المواد) وغسيل الكلى مقابل 3.5 لتر من الماء منزوع الأيونات لمدة أربعة أيام على الأقل. تغيير ماء غسيل الكلى كل 12 ساعة.
ملاحظة: سيظهر المنتج كمسحوق صلب أبيض نقي جاف تماما بعد التجفيف بالفراغ. - قم بتجميد المنتج بسرعة وجففه لمدة 72 ساعة تقريبا أو حتى يجف تماما.
- حل المنتج في الكلوروفورم D (CDCl3). قم بتشغيل العينة باستخدام 1H NMR مع بروتوكول يقوم بإجراء 248 عملية مسح مع وقت استرخاء 2.5 ثانية.
- تحقق من وظائف ونقاء المنتج عن طريق معايرة ذروة مذيب CDCl3 إلى 7.26 جزء في المليون. دمج ذروة البروتونات الأساسية PEG (d3.71) ومعايرة التكامل إلى 114.
- دمج القمم المتبقية: PEGαMA 1 H NMR (300 ميجاهرتز ، CDCl 3): d (جزء في المليون) 1.36(t ، 3H ، CH 3-) ،3.71 (S ، 114H ، PEG CH 2-CH 2) ، 4.29 (t ، s ، 4H ، -CH 2-C (O) -O-O ، -O-CH 2-C (= CH 2) -) ، 5.93 (q ، 1H ، -C = CH 2) ، 6.34 (q ، 1H ، -C = CH 2) وقارن التكامل لقمم مجموعة نهاية الألكين αMA بالقيمة المتوقعة (1H) بناء على معايرة العمود الفقري PEG (الشكل 1).
ملاحظة: متوسط القمتين المسمى "a" (الشكل 1) واضربهما في 100 للحصول على متوسط النسبة المئوية الوظيفية ل PEGαMA.
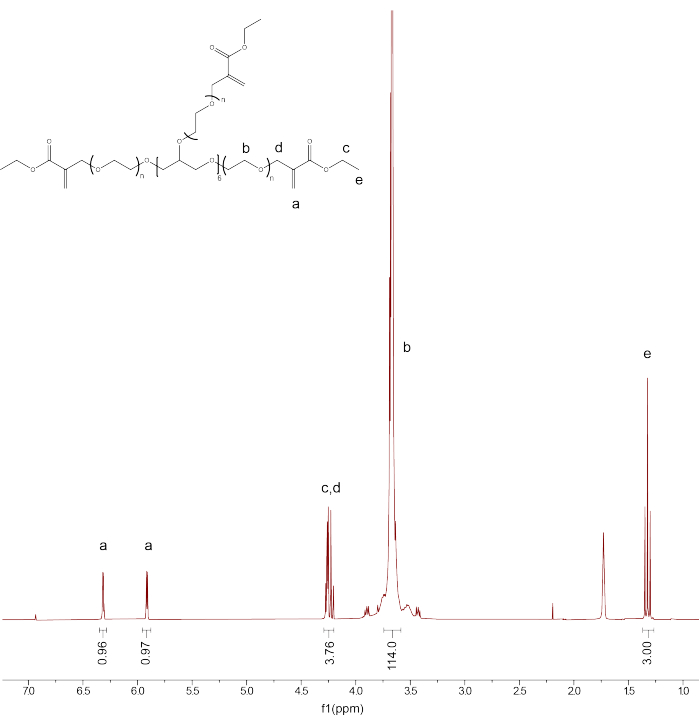
الشكل 1: أكد بروتون الرنين المغناطيسي النووي نجاح تشغيل PEGαMA. تم إجراء تحليل الرنين المغناطيسي النووي في الكلوروفورم D (CDCl3) وأظهر أداء 96.5٪. PEGαMA 1 H NMR (300 ميجاهرتز ، CDCl3): d (جزء في المليون) 1.36(t ، 3H ، CH 3-) ،3.71 (S ، 114H ، PEG CH2-CH 2) ، 4.29 (t ، s ، 4H ، -CH 2-C (O) -O-O ، -O-CH 2-C (= CH 2) -) ، 5.93 (q ، 1H ، -C = CH 2) ، 6.34 (q ، 1H ، -C = CH 2). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تصميم النموذج وإعداد الطابعة الحيوية 3D
ملاحظة: تم تعديل طابعة ثلاثية الأبعاد متوفرة تجاريا (انظر جدول المواد) عن طريق استبدال آلة بثق اللدائن الحرارية بآلة بثق مضخة حقنة مصممة خصيصا وتكييفها من Hinton et al.20. التصاميم مفتوحة المصدر متاحة على الإنترنت: https://3d.nih.gov/users/awfeinberg.
- افتح برنامج Fusion 360 (انظر جدول المواد) وقم بعمل تصميم أسطوانة مجوفة 3D بمساعدة الكمبيوتر.
ملاحظة: يمكن العثور على ملف قابل للتنزيل يمكن استخدامه لهذه الخطوة ويحاكي هندسة الأوعية الدموية في الملف التكميلي 1. - احفظ الملف وافتحه داخل برنامج Slic3r (انظر جدول المواد). تحقق مرة أخرى من أن جميع المعلمات حسب الرغبة ، ثم اضغط على زر تصدير G-code. احفظ رمز G على الكمبيوتر.
- افتح برنامج Pronterface (انظر جدول المواد) وقم بتحميل ملف G-code.
ملاحظة: يتفاعل برنامج Pronterface مع الطابعة الحيوية ويوفر تحكما كافيا في إدخال الأجهزة. يمكن العثور على ملف G-code قابل للاستخدام في الملف التكميلي 2. - انقل الطابعة الحيوية وجميع الأجزاء المرتبطة بها إلى خزانة السلامة البيولوجية (BSC) باستخدام تقنيات التعقيم.
- قم بتجميع طرف إبرة غير حاد بطول 30 جم 0.5 بوصة (انظر جدول المواد) في محقنة زجاج الطباعة واتركها جانبا.
- قم بتوصيل سلك الطاقة الخاص بالطابعة الحيوية بمأخذ. اضغط على زر الطاقة الأحمر في مقدمة الطابعة الحيوية لتشغيلها. قم بتوصيل سلك الناقل التسلسلي العالمي (USB) بين الكمبيوتر والطابعة الحيوية وتأكد من إنشاء جميع توصيلات الأسلاك وتوصيلها.
3. إعداد حمام الدعم والكواشف
ملاحظة: نفذ جميع الخطوات في خزانة السلامة البيولوجية باستخدام تقنيات التعقيم.
- تحضير وسط زراعة الخلايا الذي يتكون من SmBM Basal Medium (CC-3181) ومكملات SmGM-2 SingleQuots (CC-4149) ، باستثناء مصل الأبقار الجنيني (FBS) ، وفقا لتعليمات الشركة المصنعة. يحفظ على حرارة 4 درجة مئوية حتى الاستخدام.
- قسامة 50 مل من وسط زراعة الخلايا وإضافة 1٪ v / v من FBS (CC-4149) (انظر جدول المواد) لعمل وسائط مصل منخفضة. يحفظ على حرارة 4 درجة مئوية حتى الاستخدام.
- أعد تعليق مسحوق ملاط الجيلاتين وفقا لتعليمات الشركة المصنعة باستخدام وسائط زراعة الخلايا المعقمة بدون FBS كمذيب (انظر جدول المواد). قبل الاستخدام مباشرة ، اضبط الرقم الهيدروجيني النهائي لملاط الجيلاتين على الرقم الهيدروجيني 9 باستخدام 2 M هيدروكسيد البوتاسيوم (KOH) و / أو 2 M حمض الهيدروكلوريك (HCl) لضبط درجة الحموضة في المحلول حسب الحاجة باستخدام مقياس الأس الهيدروجيني.
- املأ العدد المطلوب من الآبار من صفيحة مكونة من 24 بئرا ، كل نصف ممتلئ تقريبا باستخدام 1 مل من ملاط الجيلاتين لكل بئر باستخدام حقنة بدون إبرة.
ملاحظة: املأ مركز الآبار بشكل موحد وتأكد من عدم وجود جيوب هوائية. اضغط على اللوحة للمساعدة في توزيع ملاط الجسيمات الدقيقة بالتساوي. اضبط ارتفاع وحجم الملاط لكل بئر حسب الحاجة لاستيعاب كل حجم وشكل من أشكال الطباعة الحيوية. يمكن للمستخدمين إنشاء حقنة محلية الصنع لنقل ملاط الجيلاتين إلى كل بئر. يمكن القيام بذلك عن طريق إضافة مكبس حقنة بحجم صحيح إلى أنبوب اختبار سعة 50 مل يحتوي بالفعل على ملاط الجيلاتين المضغوط في الأسفل. أثناء إدخال المكبس ، أدخل سلك توجيه صغير بجانب أنبوب الاختبار للمساعدة في خروج الهواء ، ثم قم بإزالته عندما يكون المكبس ملامسا لملاط الجيلاتين. قبل الاستخدام مباشرة ، اقطع طرف أنبوب الاختبار بشفرة حلاقة لإنشاء ثقب لملاط الجيلاتين ليخرج منه واضغط لأسفل على المكبس. - ضع اللوحة المملوءة المكونة من 24 بئرا في وسط مرحلة الطابعة الحيوية وقم بتثبيتها على المسرح.
ملاحظة: يوضح الشكل 2 إعداد طابعة حيوية عامة. ضع شريطا مطاطيا حول مرحلة الطباعة لتثبيت لوحة 24 بئرا على المنصة ومنع الحركة.

الشكل 2: إعداد الطباعة الحيوية 3D الأساسية. تم إعداد الطابعة الحيوية داخل بيئة معقمة مثل خزانة السلامة البيولوجية ، وتم تجميع رأس الطباعة بحيث تم إنزال المحقنة الزجاجية والإبرة عموديا في منطقة طباعة حمام الدعم أدناه. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. ثقافة الخلية
ملاحظة: نفذ جميع الخطوات في خزانة السلامة البيولوجية باستخدام تقنيات التعقيم.
- قم بإذابة خلايا HPAAF (التي تم الحصول عليها تجاريا ، انظر جدول المواد) وقم بتوسيعها في قوارير بلاستيكية معالجة بزراعة الأنسجة T-75 تحتوي على SmBM Basal Medium (CC-3181) وجميع مكملات SmGM-2 SingleQuots (CC-4149) وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
ملاحظة: يجب استخدام بروتوكولات زراعة الخلايا القياسية للخلايا الملتصقة ، والحفاظ على الخلايا عند 37 درجة مئوية و 5٪ CO2 وتجديد الوسائط كل بضعة أيام. - بمجرد وصول HPAAFs إلى التقاء ~ 80-90٪ ، قم بشفط الوسائط وشطف الخلايا مرة واحدة بمحلول ملحي مخزن بالفوسفات (PBS).
- أضف ما يقرب من 4 مل من 0.05٪ تربسين-EDTA المسخن مسبقا إلى كل قارورة T-75. قم بإمالة القارورة للتأكد من أن سطح زراعة الخلايا بالكامل مغطى بمحلول Trypsin-EDTA بنسبة 0.05٪. احتضن القوارير لمدة 3-5 دقائق عند 37 درجة مئوية وتحقق من انفصال الخلية.
- بمجرد أن تطفو الخلايا ، أضف ما لا يقل عن 6 مل من وسط النسر المعدل من Dulbecco (DMEM) إلى كل قارورة وانقل الخلايا إلى أنبوب مخروطي سعة 50 مل.
- أجهزة الطرد المركزي تعليق الخلية عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة لتكوير الخلايا. قم بشفط المادة الطافية من حبيبات الخلية وأعد تعليق الخلايا في وسائط 1-3 مل باستخدام FBS باستخدام ماصة 1000 ميكرولتر ، مما يضمن تعليق خلية واحدة.
- نقل 10 ميكرولتر من تعليق الخلية إلى أنبوب الطرد المركزي الدقيق. أضف 10 ميكرولتر من محلول Trypan Blue واخلطه جيدا. استخدم 10 ميكرولتر من هذا الخليط لحساب عدد الخلايا داخل مقياس الدم باستخدام مجهر ضوئي مقلوب.
ملاحظة: لتحقيق تركيز 4 × 106 خلايا / مل من الحبر الحيوي النهائي ، تم تخصيص 800000 خلية ليفية لكل 200 ميكرولتر من الحبر الحيوي.
5. إعداد هيدروجيل الحبر الحيوي
ملاحظة: تم تكييف إعداد Bioink من Davis-Hall et al.5. يمكن إكمال الخطوات 5.1-5.2 بالتوازي مع الخطوات 4.1-4.3 لتقليل الوقت بين جمع الخلايا وإعادة التعليق في الحبر الحيوي. نفذ الخطوات في خزانة السلامة البيولوجية باستخدام تقنية التعقيم.
- قم بإعداد محلول pH 7 20 mM tris (2-carboxyethyl) phosphine (TCEP ، انظر جدول المواد) ومرشح معقم باستخدام مرشح حقنة 0.2 ميكرومتر. قبل الاستخدام مباشرة ، أضف 2 M KOH و / أو 2 M HCl لضبط درجة الحموضة في المحلول حسب الحاجة. قم بالقياس باستخدام مقياس الأس الهيدروجيني واضبطه وفقا لذلك.
ملاحظة: يقلل TCEP من روابط ثاني كبريتيد. - قم بإعداد محلول مخزون 0.25 مجم / مل من PEGαMA المعاد تعليقه في وسائط زراعة الخلايا المعقمة بدون FBS ، وحلول مخزون 250 مللي متر من 1،4-ديثيوثريتول (DTT) ، ورابط متشابك قابل للتحلل MMP2 ، وببتيد CGRGDS (RGD) (انظر جدول المواد) ، وتعليق الكل في TCEP المعقم 20 مللي متر ، ومحلول مخزون 15٪ بالوزن من البولي (أكسيد الإيثيلين) (PEO) في الماء المقطر (DI) باستخدام الماصات حسب الحاجة.
- باتباع الجدول 1 كدليل ، اجمع بين الكميات المطلوبة من PEGαMA و DTT و MMP2 القابلة للتحلل و PEO و CGRGDS ووسائط زراعة الخلايا منخفضة المصل مع الخلايا الليفية في أنبوب مخروطي سعة 50 مل.
ملاحظة: يوصى بفحص الأس الهيدروجيني باستخدام شرائط الأس الهيدروجيني بعد إضافة جميع وسائط زراعة الخلايا باستثناء هذه المجموعة لأن هذا المزيج يجب أن يؤدي إلى أن يكون الرقم الهيدروجيني قريبا جدا من 6.2. إذا كانت هناك حاجة إلى مزيد من تعديلات الأس الهيدروجيني ، فتتبع مقدار الحجم الإضافي المطلوب لضبط الرقم الهيدروجيني لمحلول السلائف. ارفع الحجم الكلي إلى 200 ميكرولتر عن طريق إضافة حجم وسائط زراعة الخلايا المتبقي مطروحا منه أي حجم مضاف أثناء ضبط الأس الهيدروجيني النهائي. - امزج الحبر الحيوي معا باستخدام ماصة إزاحة موجبة للتأكد من أن الخلايا عبارة عن خلايا مفردة وتأكد من أن محلول السلائف النهائي هو الرقم الهيدروجيني 6.2 لمنع البلمرة المحفزة بالقاعدة أثناء الطباعة الحيوية ثلاثية الأبعاد.
- قم بتحميل الحبر الحيوي في المحقنة الزجاجية عن طريق إزالة المكبس واستخدام حقنة منفصلة بطرف إبرة حادة بقياس 15 بوصة بطول 1.5 بوصة (انظر جدول المواد) متصل لنقل الحبر الحيوي من أنبوب الطرد المركزي إلى المحقنة ، مع الحرص على تجنب تكوين فقاعات هواء داخل المحلول.
- ضع المحقنة الزجاجية داخل رأس الطباعة وقم بتوصيل مكونات رأس الطباعة بحيث يتم تجميع كل شيء بإحكام وجاهز للطباعة.
ملاحظة: في هذه المرحلة، يجب أن تحتوي المحقنة الزجاجية الموجودة داخل رأس الطباعة على طرف إبرة غير حاد بقياس 30 بوصة بطول 0.5 بوصة متصل بها للطباعة.
| مكون | تركيز محلول المخزون | المبلغ المراد إضافته |
| بيج ماما | 0.25 مجم / مل | 140 ميكرولتر |
| دي تي تي | 250 مللي متر | 12.24 ميكرولتر |
| MMP2 قابلة للتحلل متشابكة | 250 مللي متر | 5.25 ميكرولتر |
| آر جي دي | 250 مللي متر | 1.6 ميكرولتر |
| بيو | 15 بالوزن٪ | 33.33 ميكرولتر |
| وسائط التنشيط و / أو كواشف تعديل الأس الهيدروجيني | - | 7.58 ميكرولتر |
| الخلايا الليفية | - | 800000 خلية |
الجدول 1: مثال على الأحجام المطلوبة لإعداد 200 ميكرولتر من الحبر الحيوي (محلول سلائف هيدروجيل وخلايا الخلايا الليفية).
6.3D الطباعة الحيوية
ملاحظة: نفذ جميع الخطوات في خزانة السلامة البيولوجية باستخدام تقنيات التعقيم.
- باستخدام أسهم الاتجاه داخل برنامج Pronterface ، اضبط موضع إبرة البثق يدويا في وسط البئر وداخل ملاط حمام الدعم. اترك ملاط حمام الدعم 1 مم على الأقل أسفل طرف الإبرة.
ملاحظة: البرنامج ليس لديه القدرة على معرفة مكان الإبرة داخل الفضاء. الأمر متروك تماما للمستخدم لتحريك الإبرة عن طريق النقر يدويا على الأسهم داخل البرنامج (على سبيل المثال ، سيؤدي النقر فوق السهم لأعلى إلى تحريك الإبرة لأعلى أو بعيدا عن منصة الطباعة ، وما إلى ذلك). قم بمناورة الإبرة بعناية للتأكد من أنها لن تصطدم بأي حدود للبئر. - بمجرد وضع طرف الإبرة في وسط الملاط داخل البئر ، اضغط على زر البدء داخل Pronterface وانتظر حتى تكتمل الطباعة لتحقيق التركيبات ، كما هو موضح في الشكل 3 أ.
ملاحظة: للطباعة الحيوية لبنية واحدة باستخدام الملف المقدم (الملف التكميلي 1) ، سيستغرق الأمر حوالي 3 دقائق. يستغرق توجيه الإبرة وتحريكها حوالي 5 دقائق ثم طباعة بنية واحدة بالكامل من البداية إلى النهاية. - كرر الخطوات 6.1-6.2 حتى يتم استيفاء عدد التركيبات المطبوعة بيولوجيا المطلوبة.
ملاحظة: يوصى بعمل تركيبات أكثر من اللازم لحساب أي مطبوعات غير ناجحة. في حالة حدوث فشل ، انتقل إلى البئر التالي ، وأعد تعيين كل شيء ، وكرر الخطوات 6.1-6.2 مرة أخرى. - اترك لوحة البئر في درجة حرارة الغرفة وقم بتغطيتها في BSC لمدة 1 ساعة بعد انتهاء الطباعة للسماح بالبلمرة المحفزة بالقاعدة للهيدروجيل القابل للتعديل الضوئي.
- ضع لوحة البئر التي تحتوي على تركيبات مطبوعة بيولوجيا ثلاثية الأبعاد في حاضنة معقمة 37 درجة مئوية واتركها لمدة 12-18 ساعة لإذابة ملاط حمام الدعم.
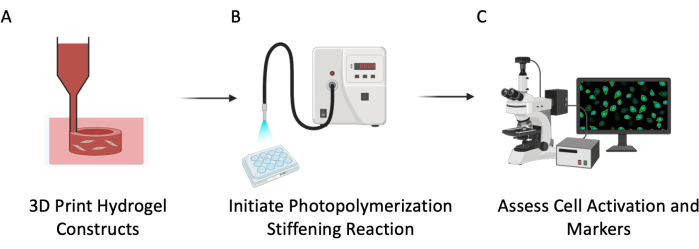
الشكل 3: مخطط تجريبي. تم وصف هذا البروتوكول في ثلاث خطوات رئيسية: (أ) 3D bioprinting PEGαMA أنابيب مجوفة مع خلايا مدمجة لتقليد الأوعية الدموية الرئوية. ب: التحفيز الضوئي لتفاعل البلمرة المتجانسة لتصلب البيئة المكروية الخلوية. (ج) تقييم الواسمات الخلوية للانتشار والتنشيط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7.3D ثقافة البناء المطبوعة بيولوجيا والتقوية الضوئية
ملاحظة: يجب تنفيذ جميع الخطوات في خزانة السلامة البيولوجية باستخدام تقنيات التعقيم.
- قم بإعداد محلول مخزون ليثيوم 2.2 مللي متر فينيل -2،4،6-ثلاثي ميثيل بنزويل فوسفينات (LAP) (انظر جدول المواد) في PBS ومرشح معقم باستخدام مرشح حقنة 0.2 ميكرومتر. حافظ على حل LAP محميا من الضوء.
- بعد 12-18 ساعة ، قم بتغيير الوسائط المحيطة بالتركيبات المطبوعة بيولوجيا. قم بإزالة الوسائط يدويا وحمام دعم الجيلاتين المذاب داخل الآبار واحرص على عدم إزعاج التركيبات المطبوعة بيولوجيا.
ملاحظة: من المفيد إزالة الوسائط ببطء أثناء إمساك اللوحة بزاوية 45 درجة بحيث تظهر التركيبات داخل البئر ويمكن رؤيتها. يجب التعرف على أسطوانة هيدروجيل شفافة في كل بئر مع طباعة ناجحة (الشكل 4 أ). - أضف حجما مناسبا من وسائط المصل المنخفض إلى كل بئر.
ملاحظة: بالنسبة للوحة 24 بئرا ، يجب أن تغطي وسائط 700 ميكرولتر لكل بئر التركيبات المطبوعة بيولوجيا بالكامل. اضبط حسب الحاجة. - أعد اللوحة إلى الحاضنة وقم بتغيير الوسائط على العينات كل 3 أيام أو وفقا للتصميم التجريبي.
- قبل أربع وعشرين ساعة من النقطة الزمنية المطلوبة للتقوية ، قم بإزالة الوسائط من العينات واستبدلها بوسائط مصل منخفضة مكملة ب LAP معقم 2.2 مللي متر.
ملاحظة: لتسمية الهيكل بالفلورسنت ، قم بتضخيم التركيبات المطبوعة بيولوجيا 3D في PBS مع استكمال 10 ميكرومتر ميثاكريلوكسي إيثيل ثيوكاربامويل رودامين B (انظرT قادر على المواد) بين عشية وضحاها ، ثم تصلب كما هو موضح في الخطوة 7.6 لتسمية الهيكل بالفلورسنت. نقل إلى برنامج تلفزيوني لمدة يومين عند 4 درجات مئوية لإزالة الرودامين الزائد والصورة باستخدام مرشح TRITC (الشكل 4B ، C). - في النقطة الزمنية المطلوبة للتقوية ، قم بإزالة نصف الوسائط من الآبار المراد تقويتها وضع اللوحة مع الغطاء تحت ضوء الأشعة فوق البنفسجية. قم بتشغيل ضوء الأشعة فوق البنفسجية وتقوية هذه التركيبات عن طريق تطبيق ضوء 10 ميغاواط / سم2 365 نانومتر لمدة 5 دقائق باستخدام Omnicure (انظر جدول المواد) ومرشح تمرير النطاق 365 نانومتر (الشكل 3B).
ملاحظة: استخدم مقياس الإشعاع / مقياس الضوء للتأكد من صحة شدة الضوء قبل تعريض الخلايا للأشعة فوق البنفسجية. - قم بإزالة الوسائط المتبقية من هذه الآبار وأضف وسائط مصل منخفضة جديدة إلى كل بئر. أعد اللوحة إلى الحاضنة.
- أخرج اللوحة من الحاضنة وقم بإجراء دراسة تنشيط الخلايا الليفية في النقطة الزمنية المطلوبة بعد الخطوة 9.
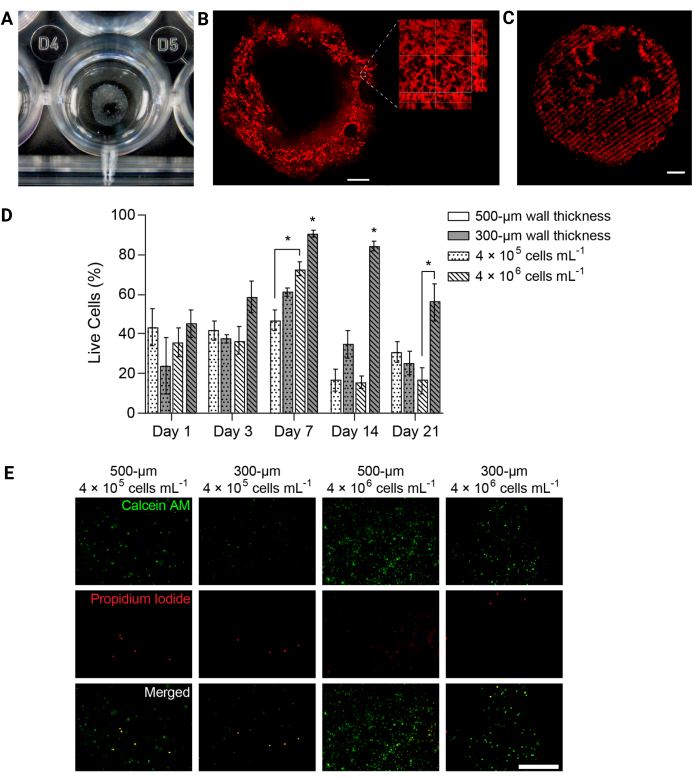
الشكل 4: دعمت هياكل الهيدروجيل المطبوعة بيولوجيا 3D صلاحية الخلية بمرور الوقت. (أ) صورة فوتوغرافية لهيكل هيدروجيل مطبوع بتقنية 3D في صفيحة من 24 بئرا. (ب) الإسقاط الأقصى للكثافة للهيدروجيل المطبوع ب PEGαMA 3D المسمى بالفلورسنت. شريط المقياس = 1 مم. أظهر الفحص المجهري عالي التكبير المسام داخل بنية الهيدروجيل التي تسببها الجسيمات الدقيقة الجيلاتينية في حمام دعم الطباعة الحيوية FRESH. (C) أنبوب PEGαMA مطبوع 3D مع مناطق صلبة موسومة بالفلورسنت تم تصويرها على مجهر متحد البؤر (100 ميكرومتر z-stack معروضة كإسقاط أقصى كثافة) أظهر التحكم المكاني في التصلب في 3D. شريط المقياس = 500 ميكرومتر. (د) جدوى HPAAF في التركيبات المطبوعة بيولوجيا 3D التي تم قياسها بواسطة مقايسات حية / ميتة. تفوقت التركيبات بسمك 300 ميكرومتر و 4 × 106 خلايا / مل على جميع الظروف الأخرى في كل نقطة زمنية. بلغت الجدوى ذروتها في اليوم 7. تم اختيار هذا الشرط والنقطة الزمنية للتجارب المستقبلية. تظهر الأعمدة متوسط ± SEM ، n = 3. * ، ص < 0.05 ، أنوفا ، توكي HSD. (ه) صور تمثيلية متحدة البؤر للخلايا في تركيبات 3D ملطخة بكاشف حي / ميت في اليوم 7 ، وهي النقطة الزمنية التي تتمتع بأكبر قدر من الجدوى الشاملة. قام Calcein AM بتمييز الخلايا الحية باللون الأخضر والبروبيديوم يوديد الخلايا الميتة باللون الأحمر. يوضح العمود الموجود في أقصى اليمين أن الحالة الأفضل أداء لها توزيع موحد للخلايا ونسبة عالية من الخلايا الحية. شريط المقياس = 500 ميكرومتر. مستنسخة بإذن من Davis-Hall et al.5. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. تقييم صلاحية الخلايا الليفية
- في النقاط الزمنية المرغوبة ، قم بتلطيخ باستخدام الكالسيين AM ويوديد البروبيديوم (انظر جدول المواد).
ملاحظة: للتلخيص ، يجب إزالة الوسائط من كل بئر ويجب شطف التركيبات باستخدام برنامج تلفزيوني معقم. احتضان التركيبات في محلول تلطيخ حي / ميت لمدة 40 دقيقة عند 37 درجة مئوية على الروك. يجب أن يحتوي محلول التلوين على الكالسيين AM (تخفيف 1: 1000) ويوديد البروبيديوم (تخفيف 1: 1000) لتحديد الخلايا الحية أو الميتة عند التصوير. - نقل التركيبات إلى PBS معقمة والصورة على الفور على المجهر مضان متحد البؤر. احصل على ثلاث صور مختلفة 100 ميكرومتر z-stack لكل عينة لكل نقطة زمنية وعبر عن الجدوى كمتوسط النسبة المئوية للخلايا الحية (الشكل 4D ، E).
9. تقييم تنشيط الخلايا الليفية
- تحضير 3٪ ث / v ألبومين مصل الأبقار (BSA) و 0.1٪ v / v Tween 20 في PBS. سيشار إلى هذا المحلول باسم محلول التألق المناعي (IF).
- في النقاط الزمنية المطلوبة ، قم بإزالة الوسائط من آبار العينة وشطف التركيبات باستخدام PBS. استبدل PBS ب 4٪ بارافورمالدهيد (PFA) واحتفظ بهذه العينات عند 37 درجة مئوية لمدة 30 دقيقة على الروك. بعد ذلك ، استبدل 4٪ PFA ب 100 mM glycine في PBS واترك هذه العينات على هزاز في درجة حرارة الغرفة (RT) لمدة 15 دقيقة أخرى.
- بعد ذلك ، قم بنقل هذه العينات إلى Tissue-Tek Cryomolds ، وقم بتغطية العينة بالكامل بمحلول درجة حرارة القطع المثلى (OCT) (انظر جدول المواد) ، واسمح ل OCT بالانتشار في العينات لمدة 12-18 ساعة عند 4 درجات مئوية.
- قم بتجميد العينات المنقوعة في OCT في 2-methylbutane باستخدام النيتروجين السائل. املأ صندوق الستايروفوم أو أي حاوية مناسبة أخرى بالنيتروجين السائل ثم ضع حاوية ثانية مملوءة ب 2-ميثيل البيوتان داخل النيتروجين السائل بحيث تكون مغمورة في منتصف الطريق على الأقل. استخدم ملقط للاحتفاظ بكل cryomold يحتوي على عينة مغطاة OCT في النيتروجين السائل المبرد 2-methylbutane حتى يتم تجميده بشكل واضح. يمكن تخزين هذه العينات في -80 درجة مئوية حتى تصبح جاهزة للتشريح بالتبريد.
تنبيه: يجب استخدام معدات الحماية الشخصية (PPE) مثل قفازات الحماية الباردة ، ومئزر الحماية من البرد ، ودرع الوجه المقدم في مجموعة أدوات السلامة المبردة (انظر جدول المواد) أثناء التعامل مع النيتروجين السائل. - قم بتشريح عينات OCT المجمدة عند -22 درجة مئوية وإرفاق شرائح بسمك 10 ميكرومتر بشرائح مجهر زجاجية موجبة الشحنة. قم بإعداد ثلاث شرائح مجهرية مع ما لا يقل عن 3-5 عمليات تجميد لكل شريحة لكل عينة هيدروجيل ثلاثية الأبعاد.
ملاحظة: يمكن تخزين شرائح المجهر عند هذه النقطة عند -80 درجة مئوية إذا لزم الأمر كنقطة توقف. - ثبت عمليات التجميد في الأسيتون المثلج لمدة 15 دقيقة لمساعدة عمليات التبريد على الالتصاق بالشرائح. اشطف المقاطع المبردة برفق بماء RT لإزالة أي OCT متبقي. دع هذه العينات تجف وحدد الخطوط العريضة للعمليات التبريد باستخدام قلم كاره للماء (انظر جدول المواد).
- قم بتخلل العينات في درجة حرارة الغرفة بنسبة 0.2٪ v / v Triton X-100 في PBS لمدة 10 دقائق ثم قم بحظر الأقسام باستخدام 5٪ BSA w / v في PBS لمدة 1 ساعة في RT.
- أضف الجسم المضاد للفأر الأساسي المضاد للعضلات الملساء ألفا (αSMA) (تخفيف 1: 250) (انظر جدول المواد) إلى محلول IF. قم بتخزين هذه العينات المجزأة مع الجسم المضاد الأساسي عليها طوال الليل عند 4 درجات مئوية. شطف العينات 3x مع حل IF.
- احتضان الأقسام في محلول IF الذي يحتوي على الجسم المضاد الثانوي للماعز Alexa Fluor 555 (تخفيف 1: 250) وقطرتين من ActinGreen 488 ReadyProbe (انظر جدول المواد) لكل ملليلتر من محلول IF. قم بتغطية العينات لجميع الخطوات اللاحقة بورق الألمنيوم لحمايتها من الضوء واترك محلول الأجسام المضادة الثانوي يبقى على العينات لمدة 1 ساعة في RT.
- شطف الأقسام 3x بمحلول IF. احتضنهم في 300 نانومتر 4 '، 6-دياميدينو-2-فيليندول (DAPI) في ماء DI لمدة 15 دقيقة في RT. قم بإجراء شطف نهائي للأقسام 3x بماء DI.
- باستخدام 10 ميكرولتر من كاشف مضاد للتلاشي متاح تجاريا (انظر جدول المواد) ، قم بتغطية الأقسام باستخدام الطرق القياسية.
ملاحظة: يمكن تخزين الشرائح المثبتة محمية من الضوء في مجمد -80 درجة مئوية حتى الحاجة للتصوير. - صور عمليات التقطيع بالتبريد باستخدام مجهر مضان (الشكل 3C والشكل 5B). صور ثلاثة أقسام عشوائية لكل شريحة باستخدام هدف 10x.
ملاحظة: يجب التقاط الصور في قنوات DAPI و FITC و TRITC. - قم بتحميل الصور إلى ImageJ (المعاهد الوطنية للصحة). حدد النسبة المئوية للخلايا الإيجابية αSMA كقياس لتنشيط الخلايا الليفية (الشكل 5A) بقسمة العدد الإجمالي للخلايا الإيجابية αSMA على العدد الإجمالي لنوى الخلايا لكل مجال رؤية.
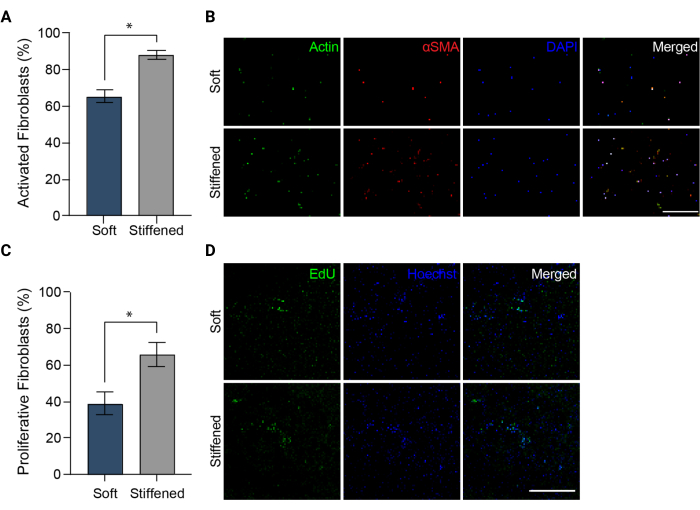
الشكل 5: تنشيط الخلايا الليفية في نماذج ثلاثية الأبعاد مطبوعة بيولوجيا من الارتخاء الشرياني الرئوي . (أ) التنشيط الليفي في الهلاميات المائية ثلاثية الأبعاد اللينة والصلبة التي تقاس بتعبير αSMA. كانت HPAAFs في التركيبات الصلبة أكثر إيجابية بشكل ملحوظ ل αSMA من الخلايا في التركيبات اللينة. تمثل الأعمدة متوسط ± SEM ، n = 3. * ، ص < 0.05 ، اختبار مان ويتني يو. (ب) صور تمثيلية متحدة البؤر للتلطيخ المناعي ل αSMA والأكتين و DAPI في الهلاميات المائية 3D اللينة والصلبة. أظهرت HPAAFs في التركيبات الصلبة تألقا مناعيا ألفا SMA أكثر انتشارا من الخلايا في التركيبات الرخوة. شريط المقياس = 250 ميكرومتر. (C) انتشار الخلايا الليفية في تركيبات 3D المطبوعة بيولوجيا الناعمة والصلبة التي تقاس بإيجابية EdU. كانت HPAAFs في التركيبات الصلبة أكثر إيجابية بشكل ملحوظ ل EdU من الخلايا في التركيبات اللينة. تمثل الأعمدة متوسط ± SEM ، n = 3. * ، ص < 0.05 ، اختبار مان ويتني يو. (د) صور تمثيلية متحدة البؤر للتلطيخ المناعي لصبغة EdU و Hoechst في الهلاميات المائية 3D الناعمة والصلبة. أظهرت HPAAFs في التركيبات الصلبة تألقا مناعيا ل EdU أكثر انتشارا من الخلايا في التركيبات اللينة. شريط المقياس = 300 ميكرومتر. مستنسخة بإذن من Davis-Hall et al.5. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
10. تقييم انتشار الخلايا الليفية
- قبل أربع وعشرين ساعة من النقطة الزمنية المرغوبة للانتشار، قم بإزالة وسائط زراعة الخلايا من كل بئر واستبدلها بوسائط منخفضة المصل مكملة بمحلول 10 ميكرومتر EdU من مجموعة تكاثر الخلايا المتاحة تجاريا (انظر جدول المواد). أعد العينات إلى الحاضنة للحضانة بين عشية وضحاها.
- في النقطة الزمنية المرغوبة للانتشار ، قم بإصلاح العينات المحتضنة باستخدام EdU باستخدام 4٪ PFA عند 37 درجة مئوية لمدة 30 دقيقة على الروك. استبدل محلول PFA 4٪ ب 100 mM glycine في PBS واحتضان العينات عند 37 درجة مئوية لمدة 15 دقيقة على الأقل. أضف Hoechst بتركيز مناسب لمدة 30 دقيقة ثم اشطف التركيبات 2x باستخدام PBS.
ملاحظة: يمكن تخزين العينات محمية من الضوء عند 4 درجات مئوية حتى التصوير. - قم بتصوير جميع عينات EdU الثابتة والمخزنة باستخدام مجهر مضان وإعدادات ومرشحات الشركة المصنعة لمجموعة تكاثر الخلايا المقترحة (الشكل 3C والشكل 5D). احصل على ثلاث صور مختلفة لمكدس z 100 ميكرومتر لكل عينة وقم بإنشاء أقصى إسقاطات من كل من مكدسات z هذه. قم بقياس انتشار HPAAF عن طريق حساب عدد الخلايا الإيجابية ل EdU والقسمة على العدد الإجمالي للخلايا التي حددها Hoechst counterstain ضمن الحد الأقصى لصور الإسقاط (الشكل 5C).
النتائج
يصف هذا البروتوكول كيفية الطباعة الحيوية للهلاميات المائية القابلة للطباعة الضوئية 3D داخل حمام الدعم لإنشاء تركيبات قادرة على التقوية الديناميكية والزمنية لدراسة تنشيط الخلايا الليفية في الأشكال الهندسية التي تحاكي الأنسجة البشرية. أولا ، شرح البروتوكول كيفية تجميع PEGαMA ، العمود الفقر...
Discussion
يمكن لتفاعلات البلمرة ثنائية المرحلة استجابة للتعرض للضوء المتحكم فيه أن تصلب المواد الحيوية بالتحكم المكاني والزماني. سخرت العديد من الدراسات هذه التقنية لتقييم تفاعلات مصفوفة الخلية في منصات مختلفة5،8،9،10،11،21<...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه. أجزاء من هذه المخطوطة مستنسخة بإذن من © https://doi.org/10.1088/1758-5090/aca8cf IOP للنشر. 5 جميع الحقوق محفوظة.
Acknowledgements
يود المؤلفون أن يشكروا الدكتور آدم فاينبرغ (جامعة كارنيجي ميلون) وأولئك الذين استضافوا ورشة عمل 3D Bioprinting مفتوحة المصدر. جعل هؤلاء الأفراد من الممكن تعلم تقنيات الطباعة الحيوية الطازجة وبناء طابعة حيوية 3D المستخدمة في هذه الدراسات. بالإضافة إلى ذلك ، يود المؤلفون الاعتراف Biorender.com ، الذي تم استخدامه لإنتاج أشكال في هذه المخطوطة. تم دعم هذا العمل من قبل مجموعات متعددة أو مصادر تمويل بما في ذلك مؤسسة مجتمع روز (DDH و CMM) ، وجائزة كولورادو لأبحاث أمراض الأوعية الدموية الرئوية (DDH و CMM) ، والمؤسسة الوطنية للعلوم بموجب جائزة 1941401 (CMM) ، وإدارة الجيش بموجب الجائزة W81XWH-20-1-0037 (CMM) ، والمعهد الوطني للسرطان التابع للمعاهد الوطنية للصحة بموجب جائزة R21 CA252172 (CMM) ، مركز عائلة لودمان لأبحاث صحة المرأة في الحرم الجامعي الطبي بجامعة كولورادو أنشوتز (DDH و CMM) ، والمعهد الوطني للقلب والرئة والدم التابع للمعاهد الوطنية للصحة بموجب جوائز R01 HL080396 (CMM) و R01 HL153096 (CMM) و F31 HL151122 (DDH) و T32 HL072738 (DDH و AT).
Materials
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
References
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved