العزل المتزامن لأنواع الخلايا المقيمة في الجهاز العصبي المركزي الرئيسي من الفئران المصابة بالتهاب الدماغ والنخاع المناعي الذاتي للبالغين
* These authors contributed equally
In This Article
Summary
حتى الآن ، تعد بروتوكولات العزل المتزامن لجميع أنواع الخلايا الرئيسية المقيمة في الجهاز العصبي المركزي من نفس الفأر طلبا غير ملباة. يظهر البروتوكول إجراء قابلا للتطبيق في الفئران الساذجة والتجريبية لالتهاب الدماغ والنخاع المناعي الذاتي للتحقيق في الشبكات الخلوية المعقدة أثناء الالتهاب العصبي وتقليل أعداد الفئران المطلوبة في نفس الوقت.
Abstract
التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) هو نموذج الفئران الأكثر شيوعا لمرض التصلب المتعدد (MS) وكثيرا ما يستخدم لزيادة توضيح مسببات مرض التصلب العصبي المتعدد التي لا تزال غير معروفة من أجل تطوير استراتيجيات علاج جديدة. يقوم نموذج EAE للبروتين السكري قليل التغصن المايلين 35-55 (MOG35-55) بإعادة إنتاج مسار مرض أحادي الطور ذاتي الحد مع شلل تصاعدي في غضون 10 أيام بعد التحصين. يتم فحص الفئران يوميا باستخدام نظام التسجيل السريري. يتم تحفيز مرض التصلب العصبي المتعدد من خلال آليات مرضية مختلفة ذات نمط زمني محدد ، وبالتالي فإن التحقيق في دور أنواع الخلايا المقيمة في الجهاز العصبي المركزي (CNS) أثناء تطور المرض له أهمية كبيرة. الميزة الفريدة لهذا البروتوكول هي العزل المتزامن لجميع أنواع الخلايا الرئيسية المقيمة في الجهاز العصبي المركزي (الخلايا الدبقية الصغيرة ، oligodendrocytes ، الخلايا النجمية ، والخلايا العصبية) المطبقة على EAE البالغة والفئران السليمة. يتبع تفكك الدماغ والحبل الشوكي عن الفئران البالغة فرز الخلايا المنشط مغناطيسيا (MACS) لعزل الخلايا الدبقية الصغيرة والخلايا قليلة التغصن والخلايا النجمية والخلايا العصبية. تم استخدام قياس التدفق الخلوي لإجراء تحليلات الجودة للمعلقات أحادية الخلية المنقاة التي تؤكد الصلاحية بعد عزل الخلية وتشير إلى نقاء كل نوع من الخلايا بنسبة 90٪ تقريبا. في الختام ، يقدم هذا البروتوكول طريقة دقيقة وشاملة لتحليل الشبكات الخلوية المعقدة في الفئران السليمة و EAE. علاوة على ذلك ، يمكن تقليل أعداد الفئران المطلوبة بشكل كبير حيث يتم عزل جميع أنواع الخلايا الأربعة من نفس الفئران.
Introduction
التصلب المتعدد (MS) هو مرض مناعي ذاتي التهابي مزمن يصيب الجهاز العصبي المركزي (CNS) يتميز بإزالة الميالين وتلف المحور العصبي والتسمم والتنكس العصبي. على الرغم من العديد من الأساليب البحثية في هذا المجال ، لا تزال الفيزيولوجيا المرضية لمرض التصلب العصبي المتعدد غير مفهومة تماما1،2،3،4. النموذج الحيواني الأكثر شيوعا للتحقيق في مرض التصلب العصبي المتعدد هو ببتيد البروتين السكري قليل التغصن المايلين 35-55 (MOG35-55) - التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) الذي يشترك في العديد من ميزاته السريرية والفيزيولوجيةالمرضية 5،6،7،8،9. يعتمد على استجابة الجهاز المناعي ضد المستضدات الخاصة بالجهاز العصبي المركزي مما يؤدي إلى الالتهاب وإزالة الميالين والتنكس العصبي المحوري. يعد التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) نموذجا مناسبا للتحقيق في مسارات الالتهاب العصبي وشلالات الإشارات الموجودة في مرض التصلب العصبي المتعدد.
خيارات العلاج الحالية لمرض التصلب العصبي المتعدد فعالة جزئيا فقط وتركز في المقام الأول على المرحلة الالتهابية الأولية للمرض. ومع ذلك ، يبدو أن المكون التنكسي العصبي لمرض التصلب العصبي المتعدد هو التحدي الرئيسي للنهج العلاجية طويلة الأجل. لذلك ، هناك حاجة إلى بروتوكولات عزل الخلايا القابلة للتكرار والدقيقة للتحقيق في الآليات الجزيئية والخلوية في أمراض المناعة الذاتية بطريقة شاملة. حتى في حالة وجود بعض البروتوكولات لعزل نوع واحد من الخلايا10،11،12،13،14،15 ، فهناك حاجة غير ملباة للعزل المتزامن للعديد من مجموعات الخلايا المقيمة في الجهاز العصبي المركزي في وقت واحد. تفتقر البروتوكولات السابقة لعزل الخلايا المقيمة في الجهاز العصبي المركزي إلى الحفاظ على الوظائف الخلوية والنقاء ، مما يؤدي إلى الزراعة المشتركة مع الخلايا المجاورة16،17،18 أو عدم ملاءمة التحليلات المعقدة للشبكات داخل الخلايا خارج الجسم الحي19،20،21،22.
كان الهدف من هذا البروتوكول هو إنشاء طريقة قابلة للتكرار وشاملة للعزل المتزامن للمعلقات أحادية الخلية النقية القابلة للحياة لجميع أنواع الخلايا الرئيسية المقيمة في الجهاز العصبي المركزي المطبقة على الفئران البالغة السليمة و EAE. تم عزل أنواع الخلايا المختلفة باستخدام فرز الخلايا المنشط مغناطيسيا (MACS)23. يمكن تحقيق فصل الخلايا إما عن طريق الانتقاء الإيجابي ، أي وضع العلامات المغناطيسية لعلامات السطح الخاصة بنوع الخلية ، أو عن طريق الاختيار السلبي عن طريق البيوتينيل واستنفاد جميع الخلايا غير المرغوب فيها. تم تطبيق قياس التدفق الخلوي لضمان نقاء أعلى من 90٪ وصلاحية 80٪ على الأقل من المعلقات أحادية الخلية المعزولة.
في الختام ، كان الهدف الرئيسي هو إنشاء بروتوكول للعزل المتزامن لجميع أنواع الخلايا الرئيسية المقيمة في الجهاز العصبي المركزي كأداة متعددة الاستخدامات للتحقيق في مسارات الالتهاب العصبي التي تقدم تحليلا شاملا ودقيقا للشبكات الخلوية المعقدة وشلالات الإشارات الكيميائية الحيوية في الفئران السليمة و EAE.
Protocol
تم حث جميع تجارب EAE على إناث الفئران C57BL / 6J في سن 10-12 أسبوعا ووافقت عليها السلطات المحلية (Landesamt für Natur، Umwelt und Verbraucherschutz Nordrhein-Westfalen). كما تم ضمان الامتثال لقانون حماية الألماني والاتحاد الأوروبي في أي وقت من التجارب. تم الاحتفاظ بجميع الفئران تحت أقفاص تهوية فردية لإيواء.
ملاحظة: تشير أحجام الكاشف التالية إلى دماغ فأر بالغ واحد والحبل الشوكي ، والتي تسمى تعليق خلايا الجهاز العصبي المركزي في ما يلي وتزن حوالي 20 مجم إلى 500 مجم. إذا تم التخطيط لتفكك أكثر من معلق خلية CNS ، فيجب زيادة جميع أحجام ومواد الكاشف وفقا لذلك. يوصى بتخزين محلول ملحي مخزن بالفوسفات من Dulbecco (D-PBS ؛ 1x) مع الكالسيوم والمغنيسيوم ، مع استكمال 1 جم / لتر من الجلوكوز و 36 مجم / لتر من بيروفات الصوديوم) بشكل مستمر على الجليد خلال التجربة بأكملها. إذا تم التخطيط لزراعة الخلايا بعد ذلك ، فقم بتنفيذ جميع الخطوات في ظل ظروف معقمة باستخدام الأغطية. خلاف ذلك ، لا يلزم تنفيذ أي من أقسام البروتوكول التالية تحت غطاء محرك السيارة. قم بتخزين المخازن المؤقتة على الجليد. استخدم فقط المحاليل المبردة مسبقا وتجنب الدوامة طوال التجربة بأكملها. انظر الشكل 1 للاطلاع على سير العمل العام.
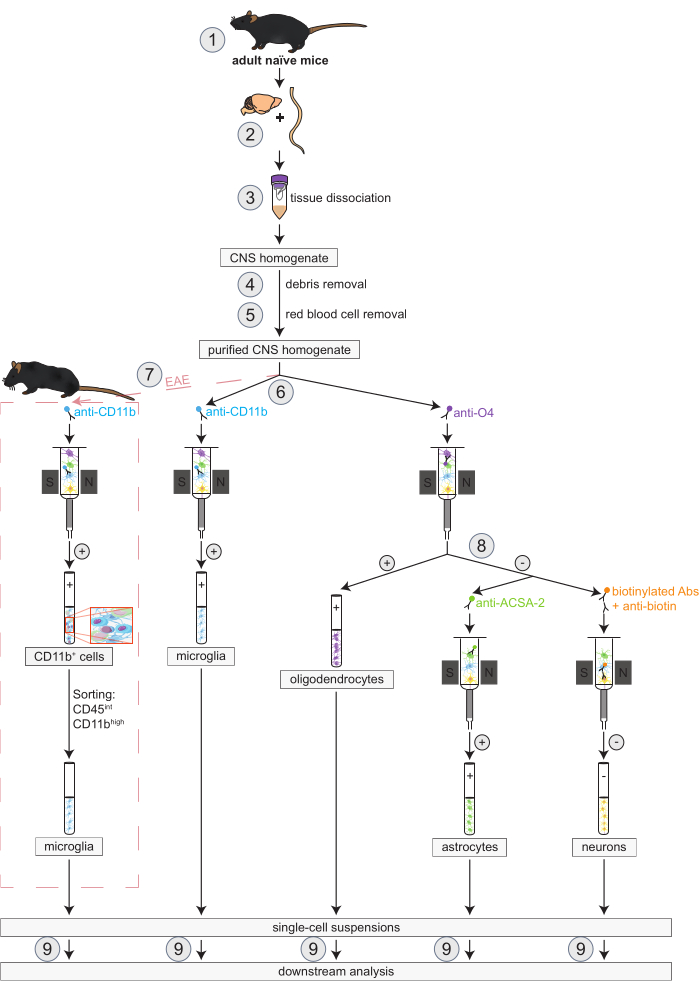
الشكل 1: سير العمل للعزل المتزامن للخلايا قليلة التغصن والخلايا الدبقية الصغيرة والخلايا النجمية والخلايا العصبية في الفئران الساذجة والخلايا EAE. الخطوات الأولى لسير العمل هي نفسها لكل من الفئران الساذجة و EAE. إذا كان العمل مع نسخة متماثلة من EAE مطلوبا ، فيجب إجراء تحريض EAE مسبقا (1). باختصار ، يبدأ البروتوكول بتشريح (2) وتفكك (3) لدماغ الفئران والحبل الشوكي تليها إزالة الحطام (4) وخلايا الدم الحمراء (5). بعد ذلك ، يتم تقسيم تعليق خلية الجهاز العصبي المركزي المنقى الناتج إلى جزأين للعزل المتزامن للخلايا قليلة التغصن والدبقية الصغيرة عبر MACS (6). يتم الكشف عن الخلايا الدبقية الصغيرة عن طريق الخرزات الدقيقة المضادة ل CD11b بينما يتم عزل الخلايا قليلة التغصن باستخدام حبات دقيقة مضادة ل O4 (اختيارات إيجابية). من التدفق السلبي للخلايا قليلة التغصن (8) ، يتم عزل الخلايا النجمية عن طريق حبات ميكروية مضادة ل ACSA-2 (اختيار إيجابي) والخلايا العصبية عن طريق وضع علامات على البيوتين واستنفاد جميع الخلايا غير العصبية (الانتقاء السلبي). في الفئران EAE ، يتبع عزل خلايا CD11b + فرز الخلايا المنشطة بالفلورة للخلاياالعالية CD45intCD11b للقضاء على الخلايا المناعية الأخرى CD11b + مثل الضامة والخلايا المتغصنة والوحيدات والخلايا المحببة والخلايا القاتلة الطبيعية المعروفة بمشاركتها في عمليات الالتهاب العصبي خلال دورة EAE (7) 27،28،48. بعد عزل أنواع الخلايا المختلفة المقيمة في الجهاز العصبي المركزي ، يمكن إجراء تحليلات النقاء (9). الاختصارات: القيمة المطلقة = الأجسام المضادة. ACSA-2 = مستضد سطح الخلية النجمية -2 ؛ CD11b = كيناز 11B المعتمد على السيكلين ؛ CD45 = مستقبلات التيروزين البروتين الفوسفاتيز C ؛ الجهاز العصبي المركزي = الجهاز العصبي المركزي. EAE = التهاب الدماغ والنخاع المناعي الذاتي التجريبي. MACS = فرز الخلايا المنشط مغناطيسيا ؛ O4 = علامة الخلايا قليلة التغصن O4. وقد عدل هذا الرقم من49. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. تحريض EAE النشط
- تحضير الكواشف
- لفصل الخلايا: قم بإعداد المخزن المؤقت PB وتخزينه في 2-8 درجة مئوية لمدة أسبوع واحد كحد أقصى. لتحضير محلول المرق ، أضف 475 مل من 1x PBS بدون مكملات (درجة الحموضة 7.2) + 25 مل من 0.5٪ ألبومين مصل البقر (BSA). استخدم مخففا بنسبة 1:20 معدا في BSA.
- لقياس التدفق الخلوي وفرز الخلايا المنشطة بالتألق (FACS): تحضير المخزن المؤقت FACS ، PBS مع 2٪ مصل عجل الجنين (FCS) و 2 mM EDTA وتخزينه في 2-8 درجة مئوية. للتحضير ، أضف 500 مل من 1x PBS بدون مكملات و 10 مل من FCS + 2 مل EDTA (من 0.5 مليون مخزون EDTA)
- إجراء التحصين وفقا للبروتوكول من Bittner et al. 5. باختصار ، حث EAE عن طريق الحقن تحت الجلد لمستحلب يحتوي على 200 ميكروغرام MOG35-55 ببتيد و 200 ميكرولتر من مساعد فرويد الكامل بما في ذلك 200 ميكروغرام المتفطرة السلية.
- تخدير الماوس مع 2 ٪ إيزوفلوران باستخدام غرفة التخدير مع مبخر isoflurane. استخدم مرهم الطبيب البيطري على عيون لمنع الجفاف أثناء التخدير.
- بعد 2 ساعة ، حقن حقنة داخل الصفاق من 100 نانوغرام من سم السعال الديكي (PTx) المذاب في 100 ميكرولتر من 1x PBS وفقا للبروتوكول من Huntemann et al.24. كرر حقن PTx في اليوم 2 بعد التحصين.
تنبيه: راقب كل حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء القصي. لا يتم إرجاع الفئران التي خضعت لإجراءات الحقن إلى شركة الفئران الأخرى حتى تتعافى تماما. بالنسبة للمتفطرة السلية و PTx: تجنب الاستنشاق والابتلاع والتلامس مع الجلد والعينين. المتفطرة السلية هي منشط للجهاز المناعي الفطري. PTx له العديد من التأثيرات البيولوجية. - راقب تقدم EAE يوميا ، يقوم به اثنان من الباحثين المكفوفين الذين يراقبون الوزن ويفحصون الفئران سريريا.
- لهذا الغرض ، كان استخدام نظام التسجيل التالي هو الدرجة 0 - لا توجد علامات سريرية ل EAE ، شلل جزئي جزئي في الذيل من الدرجة 1 ، شلل جزئي في الذيل من الدرجة 2 ، ضعف الأطراف الخلفية من الدرجة 3 ، ضعف الأطراف الخلفية من الدرجة 4 ، ضعف الأطراف الخلفية الكامل من الدرجة 4 ومشية ترنحية ، خزل جزئي خفيف من الدرجة 5 ، خزل نصفي 6 ، شلل نصفي من الدرجة 7 ، شلل رباعي من الدرجة 8 ، شلل رباعي من الدرجة 8 ، شلل رباعي من الدرجة 9 ، والصف 10 الموت.
- استخدم معايير الاستبعاد التالية لمزيد من المشاركة في التجربة > الدرجة السريرية 7 أو فقدان الوزن الذي يتجاوز 20٪ من وزن الجسم الأولي.
- لتشريح الدماغ والحبل الشوكي ، القتل الرحيم للفئران EAE في اليوم 16 بعد تحريض EAE الذي يمثل الحد الأقصى للمرض.
2. تحضير أنسجة الجهاز العصبي المركزي (المدة: حوالي 10 دقائق لكل فئران)
- بعد التضحية بالفئران بثاني أكسيد الكربون ، ابدأ بالتروية عبر القلب لكل فأر مع 20 مل من 1x PBS. كرر التروية مرة أخرى مع 20 مل من 1x PBS.
- ضع الماوس في وضع ضعيف وأصلح الأطراف بالقنية. ضع 75٪ إيثانول على الجسم الأمامي للحيوان. المزيد من تدابير العقم ليست ضرورية في تلك المرحلة.
- افتح البطن والصدر عن طريق عمل قسم طولي عبر الجلد واللفافة بمساعدة مقص.
- قطع الأضلاع بشكل جانبي وطي الصدر للحصول على حرية الوصول إلى القلب. إصلاح الصدر مطوية لأعلى مع قنية.
- افتح الأذين الأيمن باستخدام المقص. ضع 20 مل من 1x PBS في البطين الأيسر باستخدام قنية لطرد الدم من خلال الأذين الأيمن المقطوع.
- كشف الجمجمة عن طريق قطع الجلد فوق رأس الفئران عبر مقطع طولي وتحريك الجلد حول الرأس باستخدام ملقط. شق الجمجمة بمساعدة مقص على طول الخيط السهمي.
- أدخل طرف ملقط على طول خط الشق لفتح الكالوت. إزالة الأجزاء المتبقية من كالوت بالملقط بحيث يتعرض الدماغ بالكامل.
- قم بإزالة الدماغ بعناية وضعه في مصفوفة دماغ الفئران. قطع الدماغ إلى شرائح سهمية بسمك 1 مم باستخدام شفرة حلاقة.
- قطع العمود الفقري بمساعدة مقص فوق قمة الحرقفي مباشرة بحيث يمكن إدخال المحقنة في القناة الشوكية.
ملاحظة: أسهل طريقة لإزالة الحبل الشوكي هي طرده من القناة الشوكية باستخدام برنامج تلفزيوني. خلاف ذلك ، يجب فتح الأقواس الفقرية بشكل فردي بالمقص ومن ثم يمكن إزالة الحبل الشوكي. - اغسل الحبل الشوكي من القناة الشوكية من الذيلية إلى الجمجمة باستخدام حقنة سعة 20 مل مع إبرة 20 جيجا تحتوي على 1x PBS. قطع الحبل الشوكي إلى شرائح بطول 0.5 سم باستخدام مشرط.
- قم بتخزين كل تعليق خلية في الجهاز العصبي المركزي يتكون من الدماغ والحبل الشوكي المقابل في طبق بتري منفصل لكل فأر مملوء بحوالي 3 مل من D-PBS البارد. تخزين الأطباق على الجليد حتى مزيد من المعالجة.
3. تفكك أنسجة الجهاز العصبي المركزي (المدة: حوالي 1-1.5 ساعة حسب عدد معلقات خلايا الجهاز العصبي المركزي)
ملاحظة: يتم فصل الأنسجة العصبية من الفئران البالغة عن طريق الجمع بين التفكك الميكانيكي والتدهور الأنزيمي للمصفوفة خارج الخلية. وبالتالي ، تظل السلامة الهيكلية قائمة ، ويمكن استخدام تعليق الخلية لمزيد من إجراءات عزل الخلايا.
- تحضير الحجم المناسب من مزيج الإنزيم 1 الذي يتكون من 50 ميكرولتر من الإنزيم P و 1900 ميكرولتر من المخزن المؤقت Z لكل معلق خلية الجهاز العصبي المركزي. ينتمي كلا الكاشفين إلى مجموعة تفكك الدماغ البالغة.
- تحضير الحجم المناسب من مزيج الإنزيم 2 الذي يتكون من 10 ميكرولتر من الإنزيم A و 20 ميكرولتر من المخزن المؤقت Y لكل تعليق خلية الجهاز العصبي المركزي. ينتمي كلا الكاشفين إلى مجموعة تفكك الدماغ البالغة.
- نقل 1950 ميكرولتر من مزيج الإنزيم 1 إلى أنبوب C وإضافة قطع الأنسجة من تعليق خلية الجهاز العصبي المركزي بعد ذلك. استخدم أنبوب C واحد لكل ماوس.
- أضف 30 ميكرولتر من مزيج الإنزيم 2 إلى كل أنبوب C. أغلق الأنابيب C بإحكام وقم بتوصيلها رأسا على عقب على غلاف جهاز فصل الخلية باستخدام السخانات.
- قم بتشغيل البرنامج المناسب المسمى 37C_ABDK_01 (يستغرق 30 دقيقة). راقب أول 5 دقائق على الأقل من البرنامج للتأكد من أن جميع الأنابيب تدور بنفس السرعة. حدوث أخطاء أثناء التشغيل ممكن. ثم انتقل إلى الخطوة 6.
- في آخر 2 دقيقة من البرنامج ، ضع مصفاة واحدة 70 ميكرومتر على أنبوب 50 مل لكل تعليق خلية الجهاز العصبي المركزي المنفصل. قم بترطيب هذه المصافي مسبقا باستخدام 2 مل من D-PBS.
- بعد إنهاء البرنامج ، قم بتوصيل الأنابيب C من جهاز الانفصال ووضعها في جهاز طرد مركزي. طرد مركزي العينات عند 300 × جم و 4 درجات مئوية لمدة 1 دقيقة لجمع العينة في قاع الأنبوب.
- أعد تعليق العينة وضعها على المصفاة المبللة مسبقا. أضف 10 مل من D-PBS البارد إلى أنبوب C الفارغ وأغلقه. رجها برفق وضع التعليق على المصفاة المقابلة.
- تخلص من المصافي وأغلق أنابيب سعة 50 مل. طرد مركزي تعليق الخلية مرة أخرى عند 300 × جم و 4 درجات مئوية لمدة 10 دقائق. بعد ذلك ، استنشق الطافاح كله بعناية فائقة.
4. إزالة الحطام (المدة: حوالي 1.5-2 ساعة حسب عدد معلقات خلايا الجهاز العصبي المركزي)
ملاحظة: غالبا ما يؤدي تفكك الأنسجة إلى المايلين وحطام الخلايا التي يمكن أن تضعف التحليل النهائي. عن طريق إضافة محلول إزالة الحطام ، يمكن إزالة هذا الحطام بكفاءة من تعليق خلية الجهاز العصبي المركزي.
- أعد تعليق حبيبات الخلية بعناية باستخدام 3100 ميكرولتر من D-PBS لكل تعليق خلية في الجهاز العصبي المركزي. لا دوامة.
- في حالة العمل مع أكثر من معلق خلية CNS ، قم بتجميع تعليقين لخلايا الجهاز العصبي المركزي كحد أقصى مشتقين من حالة واحدة أو مجموعة تجريبية في أنبوب واحد سعة 15 مل.
- أضف 900 ميكرولتر من محلول إزالة الحطام من مجموعة تفكك الدماغ البالغة إلى معلق خلية واحد في الجهاز العصبي المركزي أو 1800 ميكرولتر من محلول إزالة الحطام إلى تعليقين مجمعين لخلايا الجهاز العصبي المركزي.
- اقلب الأنبوب وامزج التعليق. بعد ذلك ، قم بتغطيته برفق شديد مع 4 مل من D-PBS البارد. يجب أن يكون التدرج الواضح مرئيا (الشكل 2 أ).
- أجهزة الطرد المركزي الأنابيب لمدة 10 دقائق عند 3000 × جم و 4 درجات مئوية مع تسارع كامل وبدون فرامل.
- إذا حدث الانفصال على النحو المنشود ، يتم تشكيل ثلاث مراحل (الشكل 2C). استنشاق المرحلتين العلويتين تماما (الشكل 2C-1،2) وتجاهلهما. من المهم عدم ترك أي بقايا مايلين (الشكل 2E).
ملاحظة: إذا لم يعمل التدرج وكانت هناك حاجة ماسة إلى الخلايا ، فلا تمتص المرحلتين العلويتين. بدلا من ذلك ، املأ أنبوب 15 مل ب D-PBS بارد يصل إلى 15 مل واقلبه عدة مرات. الطرد المركزي مرة أخرى عند 1000 × جم لمدة 10 دقائق عند 4 درجات مئوية مع تسارع كامل وبدون فرامل. مص الطافع وكرر الخطوات 4.1- 4.4. - املأ الأنبوب ب D-PBS البارد حتى 14 مل وأغلقه. اقلب الأنبوب بقوة على طاولة العمل حتى تنفصل حبيبات الخلية عن قاع الأنبوب. لا دوامة.
- طرد العينة مرة أخرى عند 1000 × جم و 4 درجات مئوية لمدة 10 دقائق. ضبط التسارع الكامل والفرامل الكاملة. نضح الطاف بعناية وبشكل كامل.

الشكل 2: ما يجب فعله وما لا يجب فعله أثناء إزالة الحطام. (أ) مثال إيجابي للتدرج بعد التراكب مع 4 مل من PBS. يمكن تمييز المرحلة العليا التي تتكون من 4 مل من PBS بوضوح عن المرحلة السفلية التي تتكون من تعليق خلية الجهاز العصبي المركزي مع محلول إزالة الحطام. (ب) مثال سلبي للتدرج بعد التراكب مع 4 مل من PBS. يفتقر التدرج إلى فصل واضح بين PBS وتعليق الخلية أدناه. يتم نشر القليل من PBS في تعليق الخلية. (ج) مثال إيجابي للتدرج بعد الطرد المركزي. يمكن تمييز ثلاث مراحل منفصلة بسهولة. لا توجد بقايا مايلين مرئية في المرحلة العليا (1) أو السفلية (3) من التدرج. تحتوي المرحلة الوسطى على كل المايلين (2). تظهر حبيبات الخلية في الجزء السفلي من الأنبوب سعة 15 مل. د: مثال سلبي للتدرج بعد الطرد المركزي. لا يوجد فصل دقيق بين المراحل الثلاث الممكنة. تظهر بعض بقايا المايلين في المرحلة العليا (1) والسفلية (3) من التدرج. ه: مثال إيجابي للتدرج بعد استنشاق المرحلتين العلويتين. تحتوي العينة الناتجة فقط على حبيبات الخلية وطاف واضح أعلاه. لا تترك بقايا المايلين وراءها. (F) مثال سلبي للتدرج بعد استنشاق المرحلتين العلويتين. لا تزال العينة تحتوي على بعض بقايا المايلين (سهم أسود). الاختصارات: الجهاز العصبي المركزي = الجهاز العصبي المركزي. PBS = محلول ملحي مخزن بالفوسفات يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. إزالة خلايا الدم الحمراء (المدة: حوالي 1 ساعة حسب عدد معلقات خلايا الجهاز العصبي المركزي)
ملاحظة: تمنع هذه الخطوة التلوث اللاحق بخلايا الدم الحمراء وتضمن التحلل الأمثل لكريات الدم الحمراء مع الحد الأدنى من التأثير على أنواع الخلايا الأخرى المعزولة من أنسجة الجهاز العصبي المركزي. يشار إلى الأحجام التالية لتعليق الخلايا المشتقة من 100 ملغ إلى 1 غرام من الأنسجة العصبية المقابلة لاثنين من أدمغة الفئران البالغة والحبل الشوكي. إذا كنت تعمل مع أكثر من تعليقين لخلايا الجهاز العصبي المركزي ، فقم بتوسيع نطاق جميع الكواشف والأحجام الإجمالية وفقا لذلك.
- ابدأ بإعداد محلول إزالة خلايا الدم الحمراء (RBCRS): لكل تعليقين مجمعين لخلايا الجهاز العصبي المركزي. قم بتخفيف 100 ميكرولتر من محلول مخزون إزالة خلايا الدم الحمراء (10x) من مجموعة تفكك الدماغ البالغة في 900 ميكرولتر من ddH2O للوصول إلى تخفيف نهائي قدره 1:10.
- قم بتخزين RBCRS في درجة حرارة 2-8 درجة مئوية حتى الاستخدام. تخلص من البقايا غير المستخدمة في نهاية اليوم.
- أعد تعليق حبيبات الخلية لما يصل إلى تعليقين للخلايا في الجهاز العصبي المركزي في 1 مل من RBCRS. تجنب الدوامة. احتضان المحلول لمدة 10 دقائق عند 4 درجات مئوية.
- أضف 10 مل من المخزن المؤقت PB البارد إلى تعليقين للخلايا المجمعة. طرد مركزي للعينة عند 300 × جم و 4 درجات مئوية لمدة 10 دقائق وشفط المادة الطافية تماما بعد ذلك.
- أعد تعليق كل حبيبة خلية من معلق خلية CNS واحد في 80 ميكرولتر من المخزن المؤقت PB عن طريق السحب ببطء لأعلى ولأسفل. وفقا لذلك ، استخدم 160 ميكرولتر لإعادة تعليق كريات الخلايا المشتقة من معلقين لخلايا الجهاز العصبي المركزي.
- عند العمل مع العديد من معلقات خلايا الجهاز العصبي المركزي من نفس الحالة التجريبية ، قم بتجميع كل معلقات الخلايا هذه.
- حدد عدد الخلايا ، على سبيل المثال ، باستخدام غرفة عد محسنة. عادة ما يتم تخفيف معلقات الخلايا بنسبة 1:50 في المخزن المؤقت PB ، يليه تخفيف إضافي بنسبة 1:10 في محلول تريبان الأزرق بنسبة 0.4٪.
6. بروتوكول الخرز المغناطيسي في الفئران الساذجة و EAE (المدة: حوالي 1 ساعة)
- قم بتسمية أنواع خلايا الجهاز العصبي المركزي المختلفة مغناطيسيا باستخدام MicroBeads الخاصة بمستضد سطحها. بعد ذلك ، ضع تعليق الخلية في العمود وافصل مغناطيسيا الخلايا المسماة المحتفظ بها داخل العمود والخلايا غير المسماة التي تمر عبرها.
- بعد إزالة العمود من المجال المغناطيسي ، اغسل الخلايا ذات العلامات المغناطيسية من العمود إلى أنبوب باعتباره جزء الخلية المختار إيجابيا.
ملاحظة: يتم حساب أحجام عملية وضع العلامات المغناطيسية لما يصل إلى 1 × 107 خلايا إجمالية. إذا تم الحصول على المزيد من الخلايا ، فقم بتوسيع نطاق جميع الكواشف والأحجام الإجمالية وفقا لذلك. يوصى بالعمل بسرعة واستخدام المحاليل المبردة مسبقا فقط لمنع تغطية الأجسام المضادة على سطح الخلية ووضع العلامات على الخلايا غير المحددة وكذلك لضمان قابلية عالية لمجموعات الخلايا المعزولة. من المهم أيضا تنفيذ خطوات الغسيل بمجرد أن يكون خزان العمود فارغا عن طريق إضافة المخزن المؤقت PB حتى لا تجف الأعمدة. - قسم معلق خلايا الجهاز العصبي المركزي المنقى غير المخفف إلى جزأين للعزلات التالية للخلايا الدبقية الصغيرة والخلايا قليلة التغصن. تعتمد نسبة كلا الكسرين على عدد الخلايا المطلوب لكل نوع خلية.
ملاحظة: يشار إلى مزيد من التفاصيل (مدة الحضانة ، وخطوات البروتوكول التفصيلية ، والأحجام ، والكواشف ، وطريقة عد الخلايا) في الجدول 1.
الجدول 1: سير العمل لوضع العلامات المغناطيسية في وقت واحد وعزل الخلايا قليلة التغصن والخلايا الدبقية الصغيرة من الفئران الساذجة و EAE. يتم عزل كلا النوعين من الخلايا عن طريق اختيار إيجابي. يشار إلى الخطوات المسردة في نفس الصف ليتم تنفيذها مرة واحدة. الاختصارات: CD11b = كيناز 11B المعتمد على السيكلين ؛ EAE = التهاب الدماغ والنخاع المناعي الذاتي التجريبي. FcR = بروتين شبيه بمستقبلات Fc ؛ O4 = علامة الخلايا قليلة التغصن O4. الرجاء الضغط هنا لتنزيل هذا الجدول.
7. تعديل البروتوكول: فرز إضافي لعزل الخلايا الدبقية الصغيرة في الفئران EAE (المدة: حوالي 1.5-2 ساعة)
ملاحظة: عند العمل مع الفئران EAE ، من الضروري استكمال بروتوكول عزل الخلايا المستند إلى MACS بواسطة FACS لإزالة مجموعات خلايا CD11b + بخلاف الخلايا الدبقية الصغيرة (على سبيل المثال ، الخلايا الوحيدة ، الضامة ، الخلايا القاتلة الطبيعية ، الخلايا المحببة ، أو الخلايا المتغصنة) من جزء خلية CD11b + . خلاف ذلك ، يمكن تجاهل هذه الخطوة.
- قم بإعداد مزيج التلوين الرئيسي الذي يحتوي على 1x PBS المكمل ب CD11b FITC (استنساخ M1 / 70 ، 1:50) و CD45 APC / Cy7 (استنساخ 30-F11 ، 1: 200). استخدم 100 ميكرولتر من مزيج التلوين الرئيسي لكل 5 × 106 خلايا. دوامة جميع الأجسام المضادة قبل الاستخدام.
- طرد مركزي تعليق الخلايا الدبقية الصغيرة عند 300 × جم و 4 درجات مئوية لمدة 10 دقائق ونضح المادة الطافية بعناية.
- أعد تعليق حبيبات الخلية ب 100 ميكرولتر من مزيج التلوين الرئيسي المحضر لكل 5 × 106 خلايا. احتضان لمدة 15 دقيقة في الظلام في درجة حرارة الغرفة (RT).
- أوقف التفاعل بإضافة 500 ميكرولتر من PBS وطرد العينة مرة أخرى عند 300 × جم و 4 درجات مئوية لمدة 10 دقائق.
- نضح المادة الطافية بعناية وأعد تعليق حبيبات الخلية باستخدام 1x PBS تكملها 10 ميكروغرام / مل DNAse للوصول إلى تركيز نهائي قدره 1 × 107 خلايا لكل مل. قم بتخزين الخلايا في درجة حرارة 4 درجات مئوية حتى يبدأ الفرز.
- ضع تعليق الخلية على مصفاة 100 ميكرومتر موضوعة على أنبوب FACS جديد مباشرة قبل البدء في الفرز.
- اضبط معدل التدفق على 1000 حدث في الثانية واستخدم فوهة 100 ميكرومتر. قم بفرز عدد الخلايا المطلوب من الخلاياالعالية CD45intCD11b في أنبوب جديد سعة 15 مل تم إعداده باستخدام 1x PBS في RT.
8. إعداد التدفق السلبي من خلال oligodendrocytes لعزل الخلايا العصبية والخلايا النجمية (المدة: حوالي 1 ساعة)
ملاحظة: يتم جمع التدفق السلبي للخلايا قليلة التغصن من الخطوة 6 لمزيد من عزل الخلايا العصبية والخلايا النجمية. تحقيقا لهذه الغاية ، يتم تقسيم تعليق الخلية إلى قسمين. بسبب العزلة السابقة للخلايا قليلة التغصن من تعليق خلايا الجهاز العصبي المركزي ، يتم تقليل التلوث بخلايا O4 + التي يمكن ملاحظتها بخلاف ذلك.
- الطرد المركزي التدفق السلبي من خلال oligodendrocytes عند 300 × g و 4 °C لمدة 10 دقائق ونضح المادة الطافية بعناية.
- أعد تعليق حبيبات الخلية في 80 ميكرولتر من المخزن المؤقت PB لكل معلق خلية CNS مجمعة كانت تستخدم سابقا لعزل الجزء الإيجابي من oligodendrocyte.
- عد الخلايا. قم بإجراء عد الخلايا التي يفترض أنها O4- باستخدام غرفة عد محسنة بعد تخفيف تعليق الخلية 1:50 في المخزن المؤقت PB متبوعا بتخفيف إضافي 1:10 في 0.4٪ تريبان أزرق.
- قسم معلق الخلية غير المخفف المنقى إلى جزأين للعزل المتزامن التالي للخلايا العصبية والخلايا النجمية. تعتمد نسبة كلا الكسرين على الكمية المفضلة لكل نوع خلية.
ملاحظة: يشار إلى مزيد من التفاصيل (مدة الحضانة ، وخطوات البروتوكول التفصيلية ، والأحجام ، والكواشف ، وطريقة عد الخلايا) في الجدول 2.
الجدول 2: سير العمل لوضع العلامات المغناطيسية في وقت واحد وعزل الخلايا العصبية والخلايا النجمية من الفئران الساذجة و EAE. كلا النوعين من الخلايا معزولان عن التدفق السلبي للخلايا قليلة التغصن. يتم فصل الخلايا النجمية كانتقاء إيجابي عن طريق الخرز الدقيق المضاد ل ACSA-2 بينما يتم تنقية الخلايا العصبية عن طريق البيوتينيل واستنفاد جميع الخلايا غير العصبية كاختيار سلبي. يشار إلى الخطوات المسردة في نفس الصف ليتم تنفيذها مرة واحدة. الاختصارات: Anti-ACSA-2 = مستضد سطح الخلية النجمية -2 ؛ EAE = التهاب الدماغ والنخاع المناعي الذاتي التجريبي. FcR = بروتين شبيه بمستقبلات Fc ؛ MACS = فرز الخلايا المنشط مغناطيسيا. الرجاء الضغط هنا لتنزيل هذا الجدول.
9. تحليلات نقاء أنواع الخلايا المقيمة في الجهاز العصبي المركزي المعزولة (المدة: حوالي 2 ساعة)
ملاحظة: يوصى بإجراء قياس التدفق الخلوي لجميع مجموعات الخلايا الأربعة المعزولة المقيمة في الجهاز العصبي المركزي لقياس ومقارنة نقاوتها وصلاحيتها. لذلك ، من الضروري تلطيخ جميع أنواع الخلايا بجسم مضاد يحمل علامة الفلوروفور. يتم تنفيذ تلطيخ الخلايا الحية / الميتة باستخدام صبغة صلاحية قابلة للتثبيت (1: 10,000).
- لوحة نقاء - بروتوكول تلطيخ خارج الخلية
- استخدم 1 × 105 خلايا مذابة في 50 ميكرولتر من PBS لكل تلطيخ.
- قم بإعداد مزيج التلوين الرئيسي المذاب في PBS مع 2٪ FCS / 2 mM EDTA يتكون من الأجسام المضادة أحادية النسيلة المترافقة بالفلوروكروم التالية التي تستهدف علامات السطح الخاصة بنوع الخلية: CD11b FITC (استنساخ 1/70 ، 1: 100) 25،26،27،28 ، البيوتين-PE (استنساخ Bio3-18E7 ، 1: 200) 29،30،31،32 ، ACSA-2 PE-Vio615 (استنساخ REA-969 ، 1: 200) 33 ،34,35 ، O4 APC (استنساخ REA-576 ، 1: 400) ، و CD45 BV510 (استنساخ 30-F11 ، 1: 150) 36,37. أضف 1 ميكروغرام من مضادات CD16 / 32 لكل 1 × 106 خلايا لمنع مستقبلات Fc3 8,39. دوامة جميع الأجسام المضادة قبل الاستخدام.
- قم بطرد تعليق الخلية لمدة 5 دقائق عند 540 × جم و 4 درجات مئوية واستنشق المادة الطافية بعناية.
- أعد تعليق حبيبات الخلية في 100 ميكرولتر من المزيج الرئيسي المعني واحتضان العينة لمدة 15 دقيقة في RT في الظلام.
- اغسل الخلايا ب 500 ميكرولتر من 1x PBS مع 2٪ FCS / 2 mM EDTA وطرد العينة لمدة 5 دقائق عند 540 × جم و 4 درجات مئوية.
- نضح المادة الطافية وأعد تعليق حبيبات الخلية ب 70 ميكرولتر من 1x PBS مع 2٪ FCS / 2 mM EDTA.
- دوامة العينة لفصل بيليه الخلية تماما. بعد ذلك ، تكون العينة جاهزة لتحليل قياس التدفق الخلوي.
- لوحة نقاء - بروتوكول تلطيخ داخل الخلايا مع NeuN
- استخدم 1 × 105 خلايا من كل خلية تلطيخ داخل الخلايا من NeuN وهي علامة نووية خاصة بالخلايا العصبية 40,41. هذه طريقة إضافية لتلطيخ الخلايا العصبية القابلة للحياة.
- نقل 1 × 105 خلايا من كل مجموعة خلايا إلى أنبوب FACS. أضف 1 مل من PBS مع 2٪ FCS / 2 mM EDTA لكل أنبوب. طرد مركزي الأنابيب عند 540 × جم و 4 درجات مئوية لمدة 5 دقائق.
- في غضون ذلك ، قم بإعداد المزيج الرئيسي المذاب في PBS مع 2٪ FCS / 2 mM EDTA يتكون من الأجسام المضادة أحادية النسيلة المترافقة بالفلوروكروم التالية التي تستهدف علامات السطح الخاصة بنوع الخلية: CD11b FITC (استنساخ M1 / 70 ، 1: 100) 25،26،27،28 ، البيوتين-PE (استنساخ Bio3-18E7 ، 1: 200) 29،30،31،32 ، ACSA-2 PE-Vio615 (استنساخ REA-969 ، 1: 200) 33، 34،35 ، و CD45 BV510 (استنساخ 30-F11 ، 1: 150) 36،37.
- نضح المادة الطافية وإعادة تعليق الخلايا في 100 ميكرولتر من المزيج الرئيسي المحضر واحتضان العينة لمدة 10 دقائق في RT في الظلام.
- اغسل الخلايا ب 100 ميكرولتر من PBS مع 2٪ FCS / 2 mM EDTA وقم بطردها مرة أخرى عند 540 × جم و 4 درجات مئوية لمدة 5 دقائق.
- في غضون ذلك ، قم بإعداد 200 ميكرولتر من محلول التثبيت / النفاذية: أضف 50 ميكرولتر من المخزون المركز من مركز التثبيت / النفاذية إلى 150 ميكرولتر من مخفف التثبيت / النفاذية للوصول إلى تخفيف نهائي بنسبة 1: 4.
- نضح المادة الطافية وإعادة تعليق الخلايا في 100 ميكرولتر من محلول التثبيت / النفاذية 1x. احتضان العينة لمدة 30 دقيقة عند 4 درجات مئوية.
- في غضون ذلك ، قم بإعداد 1 مل من 1x المخزن المؤقت للنفاذية / الغسيل عن طريق إضافة 100 ميكرولتر من مخزون المخزن المؤقت للنفاذية إلى 900 ميكرولتر من ddH2O للوصول إلى تخفيف نهائي قدره 1:10.
- اغسل الخلايا 1x ب 100 ميكرولتر من 1x نفاذية / غسل عازلة وطرد مركزي للعينة عند 540 × جم و 4 درجات مئوية لمدة 5 دقائق.
- في غضون ذلك ، قم بإعداد مزيج رئيسي آخر في 1x نفاذية / عازلة غسيل تتكون فقط من NeuN (NeuN AF647 ، استنساخ EPR12763 ، 1: 200) و 1 ميكروغرام من anti-CD16 / 32 لكل 106 خلايا لمنع مستقبل Fc.
- نضح الطاف. إعادة تعليق الخلايا الثابتة والنفاذية في 50 ميكرولتر من المزيج الرئيسي الثاني واحتضانها لمدة 30 دقيقة عند 4 درجات مئوية.
- اغسل العينة ب 100 ميكرولتر من 1x نفاذية / عازلة غسيل وجهاز طرد مركزي عند 540 × جم و 4 درجات مئوية لمدة 5 دقائق.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 70 ميكرولتر من PBS مع 2٪ FCS / 2 mM EDTA. بعد ذلك ، تكون العينة جاهزة لتحليل التدفق الخلوي.
- بعد إعداد اللوحة على مقياس التدفق الخلوي ، احصل على خلايا لتحليل النقاء باستخدام برنامج تحليل التدفق الخلوي.
10. التحليل الإحصائي
- إجراء التحليلات الإحصائية وتصميم الرسوم البيانية باستخدام برنامج تحليل رسومي. يتم تقديم البيانات كمتوسط ± SEM.
النتائج
يوفر البروتوكول الحالي إمكانية عزل جميع الخلايا الرئيسية المقيمة في الجهاز العصبي المركزي في وقت واحد ، أي الخلايا الدبقية الصغيرة ، والخلايا قليلة التغصن ، والخلايا النجمية ، والخلايا العصبية من نسخة واحدة من الجهاز العصبي المركزي. هذا مهم لتقليل أعداد الفئران اللازمة لهذه الأنواع من التجارب ولضمان إمكانية مقارنة التحليلات الجزيئية والكيميائية الحيوية على المستوى الخلوي. إذا تم عزل أنواع الخلايا الفردية من نسخ مختلفة من الجهاز العصبي المركزي ، فلا يمكن تعيين التفاعلات الخلوية بصدق ويمكن أن تؤدي الانحرافات التقنية المحتملة أثناء عمليات العزل إلى تحيز المزيد من التحليلات النهائية. بالإضافة إلى ذلك ، لن تكون النتائج الجزيئية والكيميائية الحيوية من كل نوع من الخلايا قابلة للمقارنة مع بعضها البعض لأنها ليست مشتقة من نفس سياق EAE. تم تكييف بروتوكول MACS موجود مسبقا باستخدام نظام / مجموعة تجارية لتمكين العزل المتزامن لأنواع الخلايا المذكورة أعلاه.
تم إجراء عزل الخلايا الدبقية الصغيرة باستخدام حبيبات دقيقة مضادة ل CD11b ، وتم عزل الخلايا قليلة التغصن عن طريق حبات دقيقة مضادة ل O4 (الجدول 1) ، وتم استخدام حبيبات دقيقة مضادة ل ACSA-2 لعزل الخلايا النجمية (الجدول 2). في المقابل ، يمثل عزل الخلايا العصبية اختيارا سلبيا وقد تم إنجازه عن طريق البيوتينيل ووضع العلامات المغناطيسية لجميع الخلايا غير العصبية (الجدول 2). يمكن تسمية جميع الخلايا غير العصبية (على سبيل المثال ، oligodendrocytes ، الخلايا الدبقية الصغيرة ، الخلايا النجمية ، الخلايا البطانية ، والخلايا الليفية) باستثناء خلايا الدم مغناطيسيا باستخدام جسم مضاد مقترن بالبيوتين ، موجه بشكل خاص ضد مستضد سطحي معبر عنه على هذه الخلايا غير العصبية (الجدول 2). من خلال استنفاد هذه الخلايا غير العصبية المسماة مغناطيسيا ، يمكن توليد مجموعات خلايا عصبية نقية للغاية وقابلة للحياة30،42،43.
تم تصميم لوحين جديدين لقياس التدفق الخلوي لتحليل نقاء المعلقات أحادية الخلية المتولدة. هنا ، تم استخدام علامات السطح والعلامات النووية الخاصة بنوع الخلية جنبا إلى جنب مع تمييز الخلايا الحية / الميتة.
تم تحليل إنتاجية الخلايا الناتجة لكل فأر ونوع الخلية (الشكل 3 أ) وأدت إلى متوسط 8. 4 × 105 ± 3 × 104 الخلايا الدبقية الصغيرة ، 3.23 × 106 ± 1 × 105 oligodendrocytes ، 8.6 × 105 ± 2 × 104 الخلايا النجمية ، و 4.5 × 105 ± 1 × 104 خلايا عصبية لكل فأر ساذج.
في سياق الهدف المتمثل في التحقيق في نماذج مرض التهاب الأعصاب ، تم تطبيق البروتوكول أيضا على نموذج فأر EAE. تم القتل الرحيم للفئران في اليوم 16 بعد تحريض EAE الذي يمثل الحد الأقصى للمرض. في إعداد EAE هذا ، تم عزل ما يقرب من 2.9 × 106 ± 6.7 × 105 خلايا قليلة التغصن ، 5.2 × 105 ± 9 × 104 خلايا نجمية و 4.4 × 105 ± 4 ×10 4 خلايا عصبية. انخفض إنتاج الخلايا الدبقية الصغيرة إلى ما يقرب من 1.7 × 105 ± 4 × 104 الخلايا الدبقية الصغيرة لكل ماوس EAE بسبب فرز الخلايا الإضافي بعد خطوات MACS (الشكل 3A).
بعد العزل، أثبتت توصيفات النمط الظاهري لمجموعات الخلايا المختلفة عن طريق قياس التدفق الخلوي أنه يمكن تحقيق معلقات أحادية الخلية قابلة للحياة بنقاوة تقارب 90٪ لجميع أنواع الخلايا الرئيسية المقيمة في الجهاز العصبي المركزي (الشكل 3 ب). كانت الخلايا الدبقية الصغيرة مغلقة على أنها CD45intCD11bعالية كما هو محدد في الأدبيات44،45،46،47.
في EAE ، كان لا بد من فرز الخلايا الدبقية الصغيرة من جميع خلايا CD11b + لتمييزها عن الخلايا المناعية الأخرى CD11b + مثل الخلايا الوحيدة ، والعدلات ، والخلايا القاتلة الطبيعية ، والخلايا المحببة ، والبلاعم التي تهاجر إلى الجهاز العصبي المركزي أثناء الالتهاب العصبي27،28،48. لذلك ، تم فرز الخلايا الدبقية الصغيرة على أنها خلاياعالية CD45intCD11 من تعليق خلية CD11b +. يوضح الشكل 4 استراتيجية فرز الخلايا الدبقية الصغيرة بأكملها. في الفئران الساذجة ، كان عدد الخلايا الدبقية الصغيرة 91.16٪ من جميع الخلايا المفردة الحية (96٪ من إجمالي CD11b + السكان) (الشكل 4 أ). في فئران EAE ، كان عدد الخلايا الدبقية الصغيرة 46.85٪ من جميع الخلايا المفردة الحية (55٪ من إجمالي CD11b + السكان) (الشكل 4B). على الرغم من أن كلا من إجراءات MACS و FACS تطبق الإجهاد الميكانيكي على الخلايا المفردة ، إلا أن 75.41٪ ± 8.63٪ من الخلايا الدبقية الصغيرة المنقاة المصنفة كانت قابلة للحياة (الشكل 3B).
أظهرت الخلايا النجمية والخلايا العصبية التي تم عزلها مباشرة من تعليق خلايا الجهاز العصبي المركزي الأولي تلوثا ذا صلة بالخلايا قليلة التغصن مما أدى إلى افتراض أن العزل المتزامن للخلايا العصبية والخلايا النجمية من التدفق السلبي للخلايا قليلة التغصن يمكن أن يمنع هذا التلوث. أكدت تحليلات قياس التدفق الخلوي أن الخلايا النجمية المعزولة من التدفق السلبي للخلايا قليلة التغصن كانت نقاوتها 89.23٪ ± 2.78٪ وأظهرت قابلية للحياة بنسبة 80.56٪ ± 1.41٪. على غرار هذه النتائج ، كان نقاء الخلايا العصبية المعزولة من جزء الخلية O4 81.25٪ ± 3.31٪ وكانت الصلاحية 83.90٪ ± 2.61٪ (الشكل 3B). تؤكد هذه النتائج أيضا أن العزل المتزامن لهذين النوعين من الخلايا فقط بعد عزل الخلايا قليلة التغصن ليس له أي تأثير على كمية الخلايا الوظيفية القابلة للحياة.
كانت النتائج المتعلقة بصلاحية ونقاء المعلقات أحادية الخلية المعزولة متشابهة جدا في الفئران EAE مقارنة بتلك التي تم تلقيها في الفئران الساذجة مما يؤكد أن هذا البروتوكول مناسب للفئران السليمة وكذلك في سياق EAE (الشكل 3B).
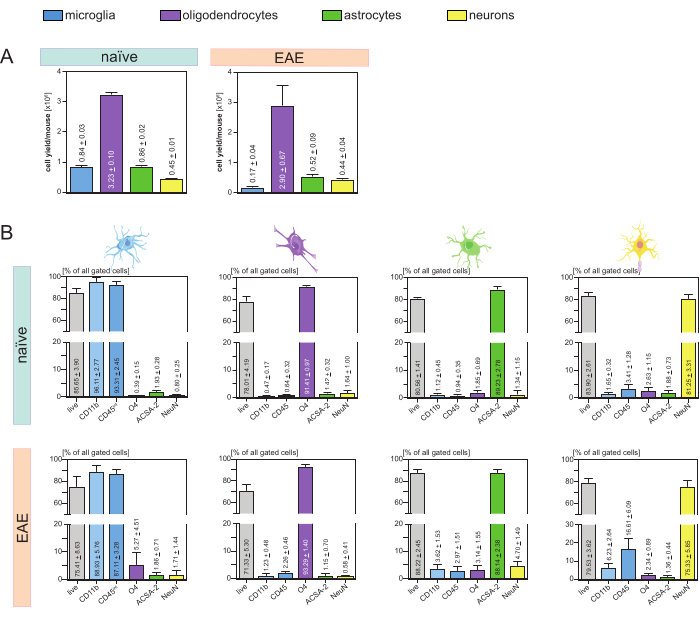
الشكل 3: إنتاجية الخلايا والتحقق القائم على قياس التدفق الخلوي للخلايا المعزولة المقيمة في الجهاز العصبي المركزي. (أ) تنتج الخلية لكل فأر ونوع الخلية بعد عزل الخلايا المقيمة في الجهاز العصبي المركزي في الفئران الساذجة و EAE. تصور الرسوم البيانية الشريطية مقدار إنتاجية الخلية لكل ماوس ونوع الخلية بعد تنفيذ البروتوكول المقدم. تمت معالجة خمسة مكررات بيولوجية للنتائج في الفئران الساذجة ، وتم تحليل أربعة مكررات بيولوجية في فئران EAE. يتم تصوير الوسائل ذات الصلة ± SEMs. (ب) تحليلات النقاء والصلاحية المقابلة لكسور الخلايا المنقاة. تشير الرسوم البيانية الشريطية إلى صلاحية ونقاء المعلقات أحادية الخلية الناتجة بناء على تعبيرها عن العلامات الخاصة بنوع الخلية. تم استخدام NeuN كعلامة نووية محددة لنوع الخلية للخلايا العصبية. تم الحصول على خمس نسخ بيولوجية مكررة ومقارنتها لكل نوع من الخلايا لكل من الفئران السليمة و EAE. يشار إلى الوسائل ذات الصلة ± SEMs. الاختصارات: Anti-ACSA-2 = مستضد سطح الخلية النجمية -2 ؛ CD11b = كيناز 11B المعتمد على السيكلين ؛ CD45 = مستقبلات التيروزين البروتين الفوسفاتيز C ؛ الجهاز العصبي المركزي = الجهاز العصبي المركزي. EAE = التهاب الدماغ والنخاع المناعي الذاتي التجريبي. MACS = فرز الخلايا المنشط مغناطيسيا ؛ NeuN = بروتين ربط الحمض النووي الريبي fox-1 متجانس 3 ؛ O4 = علامة الخلايا قليلة التغصن O4 ؛ SEM = خطأ قياسي للمتوسط. وقد عدل هذا الرقم من49. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
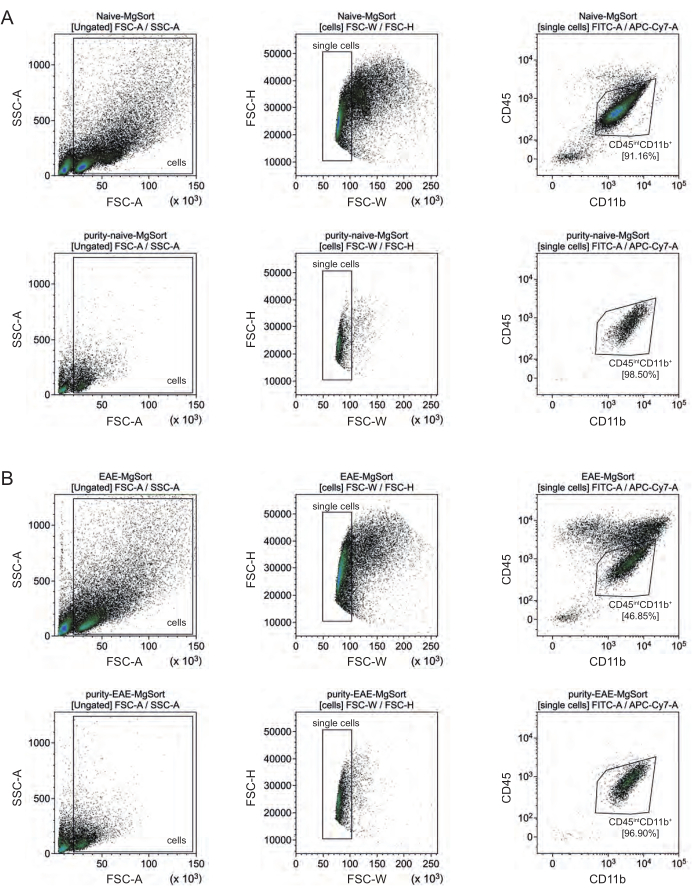
الشكل 4: استراتيجية البوابات لفرز الخلايا الدبقية الصغيرة بعد عزل خلايا CD11b +. (أ) استراتيجية البوابات في الفئران الساذجة و (ب) الفئران EAE. يظهر الصف العلوي من كل لوحة مخططات نقطية قبل الفرز والصف السفلي بعد الفرز. بعد اختيار الخلايا الحية (SSC-A / FSC-A) والخلايا المفردة (FCS-H / FSC-W) ، تم فرز سكان خلايا CD45intCD11b + كمجموعات من الخلايا الدبقية الصغيرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
حتى الآن ، توفر طرق رسم خرائط الخلايا المقيمة في الجهاز العصبي المركزي خارج الجسم الحي من خلال الجمع بين قياس الطيف الكتلي وتسلسل الحمض النووي الريبي تنميطا خلويا دقيقا للغاية في الصحة والمرض ولكنها تتطلب معرفة وخبرة تقنية طموحة في هذا المجال50,51. علاوة على ذلك ، فهي لا تسمح بالتحليلات الوظيفية وهي مكلفة للغاية. إلى جانب ذلك ، توفر أنظمة الموائع الدقيقة على الرقاقة فحصا سريعا وبأسعار معقولة لآليات المرض واختبار الأساليب العلاجية الجديدة مع تقييد نمو الخلايا والهجرة52،53،54،55. يمكن أن تمثل عضويات الجهاز العصبي المركزي أيضا بديلا مكافئا في المستقبل للتحقيق في النمذجة الخلوية ، والاتصالات بين الخلايا ، والتفاعلات أثناء دورات المرض56،57،58،59. ومع ذلك ، فإن فرز الخلايا المنشطة بالفلورة والمغناطيسية هي حاليا أكثر الطرق فعالية لتوليد معلقات خلية واحدة نقية وقابلة للحياة خارج الجسم الحي35،60،61. حتى لو كانت بروتوكولات التصنيع الأخرى المعمول بها لعزل أنواع الخلايا المقيمة في الجهاز العصبي المركزي متشابهة فيما يتعلق بالخطوات الفردية للعزل المغناطيسي وتفكك الخلية السابق ، فمن المفترض أن يتم إجراؤها لكل نوع من أنواع الخلايا على حدة. على النقيض من ذلك ، يدمج البروتوكول الحالي طرق عزل مختلفة لكل نوع خلية مقيمة في الجهاز العصبي المركزي في سياق منطقي بحيث يمكن إجراؤها في وقت واحد في وقت واحد ومن تعليق خلية واحدة في الجهاز العصبي المركزي (الجدول 1 ، الجدول 2). وبالتالي ، فإنه يتيح إجراء تحليلات متعددة الأوميكس من تعليق خلية واحدة في الجهاز العصبي المركزي ، وفي النهاية ، استكشاف الشبكات العصبية المعقدة. حتى لو لم يكن من الضروري تجميع عدة أنسجة من متعددة لتنفيذ هذا البروتوكول ، فإن هذا التجميع يضمن عددا كافيا من الخلايا المعزولة لمزيد من التحليل النهائي. إن استخدام الفئران المختلفة لعزل أنواع الخلايا المفردة من شأنه أن يستبعد إمكانية تحليل التفاعلات الخلوية المحتملة. إلى جانب ذلك ، فإن الجمع بين طرق العزل الفردية لأنواع خلايا الجهاز العصبي المركزي المختلفة ، والتي تتبع جميعها تفككا سابقا للجهاز العصبي المركزي ، يوفر تكاليف المواد باستخدام تعليق خلية CNS منفصل واحد لجميع خطوات العزل المغناطيسي التالية. بالإضافة إلى ذلك ، يتم تقليل التحيز التقني المحتمل الناجم عن استخدام الفئران المختلفة.
يمكن أن يكون أحد قيود البروتوكول هو الاستخدام الحصري تقريبا لإناث الفئران C57BL / 6J. تم تصميم بروتوكول التحصين EAE وتأسيسه لإناث الفئران ، لذلك تم تنفيذ بروتوكول عزل الخلايا هذا في إناث الفئران C57BL / 6J أيضا. ومع ذلك ، تم استخدام الفئران الذكور الساذجة أيضا أثناء تطوير هذا البروتوكول ، دون التعرف على أي تأثير على عدد الخلايا أو النقاء الناتج. يؤثر تقييد آخر على عزل الخلايا المغناطيسية للخلايا العصبية حيث لا توجد حبات دقيقة محددة لعزل الخلايا العصبية من حيث الانتقاء الإيجابي. كان من المفترض أنه يمكن الحصول على معلق نقي أحادي الخلية عن طريق وضع علامات البيوتين واستنفاد جميع الخلايا غير العصبية (الجدول 2). تم التحقق من هذا الافتراض من خلال استخدام NeuN كعلامة نووية محددة للخلايا العصبية ، مدمجة في لوحة نقاء التدفق الخلوي المذكورة. هناك قيد آخر يتعلق بعزل الخلايا الدبقية الصغيرة في فئران EAE. هنا ، يتم تقليل إنتاجية الخلايا الناتجة مقارنة بأنواع الخلايا الأخرى بسبب خطوة الفرز الإضافية بعد بروتوكول MACS. علاوة على ذلك ، يمكن للمرء أن يجادل بأن الفرز يزيد من الضغط الميكانيكي للخلايا الدبقية الصغيرة مقارنة بمجموعات الخلايا الأخرى. قد تؤدي استراتيجيات الفرز الفردية إلى كميات مختلفة من غلة الخلايا. إذا كان رقم الخلية المعزولة أقل من المتوقع أو المطلوب ، يوصى بتعديل إعداد البوابة و / أو تحسين التمييز الحي / الميت.
وتمثل الخطوة الحاسمة في البروتوكول إزالة الحطام. يجب وضع طبقات التدرج ببطء شديد وبلطف لإنشاء المراحل الثلاث المنفصلة المطلوبة (الشكل 2 أ). فقط إذا تمت إزالة المايلين وبقايا الحطام الأخرى في المرحلتين العلويتين تماما (الشكل 2E) ، يمكن توليد معلقات نقية أحادية الخلية ، ويمكن تقليل المزيد من التلوث. إذا كانت معلقات الخلايا الناتجة تفتقر إلى النقاء ، فمن المحتمل أن يكون هذا هو قسم البروتوكول الذي يجب تحسينه أولا بجانب ضمان الاستخدام الصحيح لجميع الخرز الصغير.
قد يكون الحصول على مستويات عالية من النقاء والجدوى أمرا صعبا في هذا النوع من التجارب. بعض التوصيات لاستكشاف الأخطاء وإصلاحها هي:
- العمل تحت ظروف معقمة إلزامي لمنع تلوث الخرز الدقيق المختلفة وتمكين الاستخدام المتكرر ، خاصة للزراعة اللاحقة.
- يوصى بشدة بوضع علامات على كل أنبوب لمنع الاختلاط.
- تجنب استخدام الكواشف / المخازن المؤقتة غير المبردة. قم بتخزين جميع معلقات الخلايا على الجليد أثناء التجربة بأكملها لضمان قابلية عالية للحياة.
- حافظ على الوقت بين خطوات العمل المختلفة قصيرا قدر الإمكان. لا يوجد جزء محدد في البروتوكول حيث يوصى بإيقاف التجربة مؤقتا.
- من المهم للغاية الالتزام بفترات الحضانة المحددة.
في الختام ، يوفر هذا البروتوكول الحالي للعزل المتزامن لجميع أنواع الخلايا الرئيسية المقيمة في الجهاز العصبي المركزي من نسخة متماثلة واحدة من الجهاز العصبي المركزي إمكانية تحليل الشبكات العصبية المعقدة والمسارات الالتهابية العصبية خارج الجسم الحي من تعليق خلية الجهاز العصبي المركزي. وبالتالي ، يمكن فحص الخلايا المقيمة في الجهاز العصبي المركزي خلال مراحل مختلفة من دورات المرض ، على سبيل المثال ، أثناء الالتهاب العصبي و / أو التنكس العصبي و / أو مغفرة في EAE. علاوة على ذلك ، يمكن دراسة تفاعلات الخلايا الخلوية والمسارات الكيميائية الحيوية على المستوى الفردي ويمكن تقليل التباين داخل المجموعات التجريبية. هناك أيضا فرصة لزراعة أجزاء من خلايا الجهاز العصبي المركزي المعزولة في الزراعات الأحادية لمزيد من المقايسات الوظيفية والتحقق من الصحة. الكل في واحد ، يقدم هذا البروتوكول تطورات كبيرة يحتمل أن تؤثر على مناهج البحوث قبل السريرية والسريرية.
Disclosures
يعلن جميع المؤلفين أنه ليس لديهم تضارب في المصالح.
Acknowledgements
تم إنشاء الأشكال باستخدام Adobe Illustrator (إصدار 2023) و Servier Medical Art (https://smart.servier.com). تم دعم أنطونيا هينز من قبل مؤسسة يورغن مانشوت.
Materials
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
References
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved