A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مورين هند نموذج زرع الأطراف لدراسة البيولوجيا الميكانيكية لاصطدام وتر العرقوب
In This Article
Summary
نقدم منصة تجريبية مخصصة وبروتوكول زراعة الأنسجة الذي يعيد إنشاء التغيير الغضروفي الليفي المدفوع بتأثير إدخال وتر العرقوب في نباتات الأطراف الخلفية للفأر مع بقاء الخلية المستدامة ، مما يوفر نموذجا مناسبا لاستكشاف البيولوجيا الميكانيكية لاصطدام الأوتار.
Abstract
يؤدي اصطدام الأوتار بالعظام إلى توليد بيئة إجهاد ميكانيكية متعددة المحاور مع إجهاد ضاغط عرضي مرتفع بشكل ملحوظ ، مما يثير نمطا ظاهريا لغضروفا ليفيا موضعيا يتميز بتراكم المصفوفة الغنية بالجليكوزامينوجليكان (GAG) وإعادة تشكيل شبكة الكولاجين. في حين أن الغضروف الليفي هو سمة طبيعية في المناطق المصابة من الأوتار السليمة ، فإن ترسب GAG الزائد وعدم تنظيم شبكة الكولاجين هي السمات المميزة لاعتلال الأوتار. وفقا لذلك ، يتم التعرف سريريا على الاصطدام كعامل خارجي مهم في بدء وتطور اعتلال الأوتار. ومع ذلك ، فإن البيولوجيا الميكانيكية الكامنة وراء اصطدام الأوتار لا تزال قيد الدراسة. أدت الجهود السابقة لتوضيح الاستجابة الخلوية لاصطدام الأوتار إلى تطبيق ضغط أحادي المحور على الخلايا واستئصال الأوتار في المختبر. ومع ذلك ، تفتقر الخلايا المعزولة إلى بيئة خارج الخلية ثلاثية الأبعاد حاسمة للاستجابة الميكانيكية ، وتفشل كل من الدراسات في المختبر والدراسات المختبرية المستأصلة في تلخيص بيئة الإجهاد متعدد المحاور الناتجة عن اصطدام الأوتار في الجسم الحي ، والذي يعتمد على السمات التشريحية للمنطقة الاصطدامية. علاوة على ذلك ، في الجسم الحي ، تفتقر نماذج اصطدام الأوتار إلى السيطرة على بيئة الإجهاد الميكانيكي. للتغلب على هذه القيود ، نقدم نموذجا جديدا لزرع الأطراف الخلفية للفأر مناسبا لدراسة البيولوجيا الميكانيكية لاصطدام وتر العرقوب. يحافظ هذا النموذج على وتر العرقوب في الموقع للحفاظ على التشريح المحلي ويعيد إنتاج بيئة الإجهاد متعددة المحاور الناتجة عن اصطدام إدخال وتر العرقوب على العقبي أثناء الانثناء الظهري للكاحل المطبق بشكل سلبي مع الاحتفاظ بالخلايا داخل بيئتها الأصلية. نحن نصف بروتوكول زراعة الأنسجة جزءا لا يتجزأ من هذا النموذج ونقدم البيانات التي تثبت استمرارية النبات المستدام على مدار 7 أيام. تظهر النتائج التمثيلية تلطيخا محسنا نسيجيا وانخفاضا في محاذاة ألياف الكولاجين الثانوية للاصطدام ، مما يشير إلى ارتفاع تكوين الغضروف الليفي. يمكن تكييف هذا النموذج بسهولة للتحقيق في أنظمة التحميل الميكانيكية المختلفة ويسمح بمعالجة المسارات الجزيئية ذات الأهمية لتحديد الآليات التي تتوسط تغيير النمط الظاهري في وتر العرقوب استجابة للاصطدام.
Introduction
تعاني العديد من الأوتار ، بما في ذلك وتر العرقوب وأوتار الكفة المدورة ، من اصطدام عظمي بسبب الوضع التشريحي الطبيعي1,2,3,4. يؤدي اصطدام الأوتار إلى توليد إجهاد ضاغط موجه بشكل عرضي إلى محور الألياف الطولي5,6,7. تظهر مناطق اصطدام الأوتار نمطا ظاهريا فريدا للغضروف الليفي يتم فيه تضمين الخلايا المستديرة المنكمشة (الخلايا الليفية الغضروفية) داخل شبكة كولاجين غير منظمة مع زيادة ملحوظة في محتوى الجليكوزامينوجليكان (GAG)2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. تشير الدراسات السابقة إلى أن البيئة الميكانيكية المتباينة الناتجة عن اصطدام الأوتار تحافظ على هذه المصفوفة الغنية ب GAG من خلال دفع ترسب البروتيوغليكان المتجمع الكبير ، وأبرزها aggrecan ، على الرغم من أن الآليات الأساسية غير واضحة.1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. في حين أن الغضروف الليفي هو سمة طبيعية في المناطق المصابة من الأوتار السليمة ، فإن استقلاب البروتيوغليكان الشاذ المرتبط بتكوين الغضروف الليفي المفرط هو سمة مميزة لاعتلال الأوتار ، وهو مرض شائع وموهن يظهر بشكل غير متناسب في الأوتار المصابة بشكل مزمن.1,40,41,42,43,44,45,46,47,48,49. وفقا لذلك ، يتم التعرف سريريا على اصطدام الأوتار كعامل خارجي مهم يقود العديد من اعتلالات الأوتار الأكثر شيوعا ، بما في ذلك مرض الكفة المدورة واعتلال وتر العرقوب (IAT)50,51,52. حاليا ، علاج اعتلال الأوتار غير فعال. على سبيل المثال ، ما يقرب من 47 ٪ من المرضى الذين يعانون من IAT يحتاجون إلى تدخل جراحي بعد فشل الإدارة المحافظة ، مع نتائج متغيرة بعد الجراحة53,54,55,56. على الرغم من العلاقة الواضحة بين الاصطدام واعتلال الأوتار ، فإن الآليات الميكانيكية البيولوجية التي تستشعر بها الخلايا في الأوتار الاصطدامية وتستجيب لبيئتها الميكانيكية موصوفة بشكل سيئ ، مما يحجب فهم التسبب في اعتلال الأوتار ويؤدي إلى علاج غير كاف.
نماذج Explant هي أدوات مفيدة في دراسة علم الأحياء الميكانيكية الأوتار57,58. كخطوة أولى نحو فهم البيولوجيا الميكانيكية لاصطدام الأوتار ، استكشفت العديد من الدراسات السابقة الاستجابة الخلوية بعد تطبيق الضغط البسيط أحادي المحور على الخلايا أو استئصالالأوتار 27،29،30،31،32،33،34،39. ومع ذلك ، تفتقر الخلايا في المختبر إلى مصفوفات خارج الخلية وحول الخلية تسهل نقل الإجهاد ، وتعزل عوامل النمو المهمة والسيتوكينات المنبعثة عن التشوه الميكانيكي ، وتوفر ركيزة لمجمعات الالتصاق البؤري التي تلعب دورا في النقل الميكانيكي57,59. بالإضافة إلى ذلك ، فشلت كل من الدراسات المختبرية والدراسات المزعزلة في تلخيص بيئة الإجهاد الميكانيكي متعدد المحاور الناتجة عن اصطدام الأوتار في الجسم الحي ، والذي يعتمد على السمات التشريحية للمنطقة الاصطدامية 5,6. في سياق إدخال وتر العرقوب الاصطدام ، يشمل ذلك الأنسجة المحيطة مثل الجراب العقبي الخلفي ووسادة الدهونKager 60،61،62،63. على العكس من ذلك ، في الجسم الحي تسمح نماذج اصطدام الأوتار25،28،36،37،38،64،65،66 بالحد الأدنى من التحكم في حجم وتواتر الحمل المطبق مباشرة على الوتر ، وهو قيد معترف به جيدا للنماذج في الجسم الحي لدراسة علم الأحياء الميكانيكي للوتر57,58، 67,68,69,70. نظرا للتحديات في قياس إجهاد الأوتار في الجسم الحي ، فإن بيئة الإجهاد الداخلية المتولدة داخل هذه النماذج غالبا ما تكون سيئة التوصيف بشكل جيد.
في هذه المخطوطة ، نقدم منصة تجريبية مخصصة تعيد إنشاء اصطدام إدخال وتر العرقوب على العقبي داخل نباتات الأطراف الخلفية الكاملة للفئران والتي ، عند إقرانها ببروتوكول زراعة الأنسجة هذا ، تحافظ على صلاحيتها على مدار 7 أيام في زراعة النباتات وتسمح بدراسة العواقب البيولوجية لاصطدام الأوتار. تم بناء المنصة على قاعدة حمض اللبنيك المطبوعة ثلاثية الأبعاد (PLA) التي توفر الأساس لربط المقابض وإدراج تقليل حجم PLA المطبوع ثلاثي الأبعاد. تستخدم المقابض لتثبيت الجزء العلوي من الساق والركبة بالقرب من تقاطع الوتر العضلي للأخيل مع الجانب الذيلي للطرف الخلفي متجها لأعلى ، مما يسمح بتصوير وتر العرقوب من الأعلى باستخدام مسبار الموجات فوق الصوتية أو المجهر المقلوب (الشكل 1 أ). ينزلق إدراج تقليل الحجم على طول مسار على القاعدة ويقلل من الحجم المطلوب لوسائط زراعة الأنسجة. يتم توجيه خط مضفر ملفوف حول مخلب الخلف من المنصة باستخدام التصميم الأساسي ومقطع PLA مطبوع 3D. عن طريق سحب الخيط ، يتم ثني المخلب الخلفي ظهريا ، ويصطدم إدخال وتر العرقوب بالعقبي ، مما يؤدي إلى إجهاد ضغط عرضي مرتفع 5,6 (الشكل 1 أ). تحتوي المنصة داخل حمام أكريليك يحافظ على نباتات الأطراف الخلفية المغمورة في وسائط زراعة الأنسجة. يحافظ تثبيت الخيط المشدود إلى خارج الحمام بشريط لاصق على انثناء ظهر الكاحل لإنتاج اصطدام ثابت بإدخال وتر العرقوب. يتم توفير ملفات CAD للمكونات المطبوعة 3D في أشكال متعددة (ملف تكميلي 1) ، مما يسمح بالاستيراد إلى مجموعة من برامج CAD التجارية والمجانية والمفتوحة المصدر لتعديلها لتناسب الاحتياجات التجريبية. إذا لم يكن الوصول إلى طابعات 3D متاحا للتصنيع ، فيمكن توفير ملفات CAD لخدمات الطباعة ثلاثية الأبعاد عبر الإنترنت التي ستقوم بطباعة الأجزاء وشحنها بتكلفة منخفضة.
الأهم من ذلك ، أن مجمع ثلاثية الرؤوس surae-Achilles العضلي يمتد على مفاصل الركبة والكاحل71،72،73. وبالتالي ، يتأثر إجهاد الشد في وتر العرقوب بثني الركبة. تمديد الركبة يضع وتر العرقوب تحت التوتر ، في حين أن ثني الركبة يقلل من التوتر. من خلال تمديد الركبة أولا ثم ثني الكاحل بشكل سلبي ، يمكن فرض سلالات الضغط عند الإدخال الاصطدام على سلالات الشد. على العكس من ذلك ، من خلال ثني الكاحل بشكل سلبي مع ثني الركبة ، يتم تقليل إجهاد الشد ، ويبقى الإجهاد الضاغط. ويستكشف البروتوكول الحالي ثلاثة شروط من هذا القبيل. 1) بالنسبة للاصطدام الثابت ، يتم ثني القدم ظهريا إلى < 110 درجة فيما يتعلق بالساق لاصطدام الإدخال ، مع ثني الركبة لتقليل التوتر. 2) بالنسبة لمجموعة التوتر الأساسية ، يتم تمديد الكاحل فوق 145 درجة من الانثناء الظهري مع تمديد الركبة ، مما يولد إجهادا للشد في الغالب عند الإدخال. 3) بالنسبة للمجموعة المفرغة ، يتم استزراع النباتات الخارجية في طبق بتري مع الركبة والكاحل في أوضاع محايدة في حالة عدم وجود حمل مطبق خارجيا. يتم قياس الزوايا المشار إليها أعلاه فوتوغرافيا بالنسبة لنظام الإحداثيات حيث تكون القدم والساق متوازيتين بزاوية 180 درجة وعمودية بزاوية 90 درجة.
تشمل الخطوات الرئيسية للبروتوكول 1) تشريح نباتات الأطراف الخلفية والإزالة الدقيقة للجلد والوتر الأخمصي. 2) زراعة النباتات بعد المعالجة المسبقة للديكساميثازون لمدة 48 ساعة ؛ 3) تقسيم الأنسجة وتلطيخ النسيجية. و 4) تحليل الصور الملونة لتقييم تكوين الغضروف الليفي. بعد التشريح ، تتم معالجة كل نبتة طرف خلفي لمدة 48 ساعة في وسط الاستزراع المكمل بديكساميثازون74. يتم تعيين الأطراف المقابلة من كل فأر لمجموعات تجريبية منفصلة للمقارنة الزوجية ، مما يساعد على التحكم في التباين البيولوجي. بعد المعالجة المسبقة ، يتم وضع النباتات في منصات كما هو موضح أعلاه وزراعتها لمدة 7 أيام أخرى (الشكل 1 ب). يتم إجراء مقارنات إضافية مع مجموعة المعالجة مسبقا (اليوم 0) حيث تتم إزالة النباتات مباشرة بعد المعالجة المسبقة لمدة 48 ساعة.
بعد زراعة النباتات ، يتم قطع الأطراف الخلفية ، وتثبيت الفورمالين ، وإزالة الكلس ودمجها في البارافين. يوفر التقسيم التسلسلي في الاتجاه السهمي تصورا لوتر العرقوب من الوصلة العضلية إلى الإدخال العقبي مع السماح بتتبع عمق القسم عبر الوتر بأكمله. يستخدم وضع العلامات الطرفية dUTP X-nick بوساطة dUTP X-nick (TUNEL) لتصور تلف الحمض النووي الثانوي لموت الخلايا المبرمج وتقييم الجدوى. يتم إجراء الأنسجة الزرقاء Toluidine وتحليل الصور الملونة المخصصة لتحديد التغيرات في تلطيخ GAG. ثم يتم استخدام أقسام الأنسجة الملطخة باللون الأزرق Toluidine لتصوير SHG لتوصيف التغيرات في تنظيم ألياف الكولاج (الشكل 1B).
تشير النتائج التمثيلية المقدمة إلى تغير التلوين النسيجي للمصفوفة الغنية ب GAG وعدم تنظيم شبكة الكولاجين خارج الخلية الناتجة عن 7 أيام من الاصطدام الساكن داخل النموذج. يمكن استخدام هذا النموذج لاستكشاف الآليات الجزيئية الكامنة وراء التغير الغضروفي الليفي الناجم عن الاصطدام.
Protocol
تمت الموافقة على جميع الأعمال الحيوانية من قبل لجنة الموارد الحيوانية بجامعة روتشستر.
1. إعداد وسائط زراعة الأنسجة
- استزراع جميع النباتات في وسط النسر المعدل من Dulbecco (1x DMEM) مع 1٪ v / v البنسلين - الستربتومايسين و 200 ميكرومتر حمض الأسكوربيك L في حاضنة عند 37 درجة مئوية و 5٪ CO2. بالنسبة للمعالجة الأولية لمدة 48 ساعة ، استزرع كل نبات في 70 مل من وسائط الاستزراع مع 100 نانومتر ديكساميثازون74. بعد المعالجة المسبقة ، أطراف الثقافة لمدة 7 أيام أخرى دون ديكساميثازون ، وتغيير الوسائط كل 48-72 ساعة.
ملاحظة: لا ينصح بإضافة المصل ، مثل مصل الأبقار الجنيني ، إلى وسائط الاستزراع بما يتفق مع التوصيات المقدمة من Wunderli و Blache و Snedeker57. باختصار ، تمثل الظروف الخالية من المصل بشكل أفضل البيئة الدقيقة الوعائية الفقيرة بالمغذيات الموجودة في الجسم الحي. علاوة على ذلك ، يمكن لمكملات المصل أن تعزز تدهور الأنسجة في ظل ظروف زراعة معينة75 وتحفز تكاثر الخلايا وهجرتها خارج الأنسجة ، وكلاهما من سمات أمراض الأوتار57. - بالنسبة للمجموعة التي تم تفريغها ، قم بزراعة كل نبات في 70 مل من الوسائط. بالنسبة لمجموعات التوتر الأساسي والاصطدام الساكن ، تتطلب كل منصة حوالي 125 مل من وسائط الاستزراع للحفاظ على غمر الطرف. يمكن أن يختلف هذا الحجم اعتمادا على موضع الجزء العلوي من الساق في المقابض ومعلمات الطباعة 3D ، وخاصة كثافة الحشو.
2. تشريح النبات والمعالجة المسبقة لديكساميثازون
- القتل الرحيم للفئران عن طريق استنشاق CO2 وخلع عنق الرحم الثانوي ، أو وفقا للمبادئ التوجيهية المؤسسية. يستخدم هذا البروتوكول الفئران C57BL / 6 أقل من 1 سنة. سيزداد حجم الأطراف الخلفية مع تقدم العمر وقد يصبح من الصعب وضعها في المقابض.
- قبل التشريح ، انقل 70 مل من وسائط الاستزراع المسخنة مسبقا (37 درجة مئوية) إلى طبق بتري 100 مم (قطر) × 25 مم (ارتفاع) في خزانة أمان بيولوجي معقمة (BSC). أضف ديكساميثازون لتحقيق تركيز عمل 100 نانومتر.
- يمكن إجراء التشريح على سطح الطاولة باستخدام وسادات سفلية ماصة ، تعمل بسرعة من خلال التشريح قبل نقل نباتات الأطراف الخلفية إلى BSC. قم بتجميع الأدوات الجراحية اللازمة لهذا التشريح والتي تشمل ملقط ناعم ومستقيم وناعم الأطراف. ملقط مستقيم وطرف ناعم بأسنان مسننة ؛ ومقص مستقيم وحاد وناعم.
- لتشريح نباتات الأطراف الخلفية ، ضع الماوس في وضع ضعيف وحدد مفصل الورك. باستخدام مقص ناعم ، قم بعمل شق صغير (5-10 مم) عبر الجلد الذي يغطي الجانب القريب والأمامي (الجمجمة) من الجزء العلوي من الساق.
- اسحب الشق بعيدا للتوسيع ، واضغط على الجزء العلوي من الساق المكشوف باستخدام الأصابع ، واسحب الجلد بعناية بعيدا لإزالة قفاز الطرف الخلفي إلى مستوى الكاحل. أدخل شفرة مقص واحدة برفق تحت الجلد على طول الجانب الظهري للقدم وقم بعمل شق يمتد إلى أصابع القدم. استمر في سحب الجلد بعيدا لإزالته تماما.
- ضع الماوس لتصور إدخال وتر العرقوب على الجانب الخلفي (الذيلي) من العقبي ، بالقرب من الكاحل. بالقرب من إدخال وتر العرقوب ، يقع وتر أخمصي الأخمص بجوار الحدود الإنسية لوتر العرقوب ويمتد بعيدا نحو الجانب الأخمصي للقدم ، ويمر فوق الجانب الخلفي من العقبي.
- لإزالة الوتر الأخمصي، أدخل بعناية طرفا واحدا من ملقط الطرف الناعم والناعم بين الوترين وقم بتمديد الطرف الإنسي الذي يمر أسفل وتر أخمص المصل. ارسم الطرف عن قرب وقم بتمزيق العضلة الأخمصية. باستخدام طرف رفيع ، ملقط مسنن ، أمسك الطرف القريب المنفصل من وتر أخمصي واسحب بعيدا لإزالته.
- في مفصل الورك ، استخدم مقصا ناعما لقطع الحوض وعزل الطرف الخلفي. استخدم المقص لانتزاع الحوض المتبقي وكشف رأس الفخذ.
- نقل زرع الأطراف الخلفية إلى BSC وإلى الطبق الذي يحتوي على وسائط زراعة الخلايا مع ديكساميثازون. انقل الطبق إلى الحاضنة والمعالجة المسبقة لمدة 48 ساعة.
3. زرع الثقافة ومنصات التحميل
- كما تنتهي المعالجة المسبقة لمدة 48 ساعة ، قم بتسخين كميات كافية من الوسائط الثقافية (القسم 1). من هذه النقطة فصاعدا ، لن تتم إضافة أي ديكساميثازون إلى وسائط الثقافة. في هذا الوقت ، يمكن تثبيت الأطراف من المجموعة المعالجة مسبقا (اليوم 0) وإزالة الكلس وتضمينها في البارافين للتقسيم والتلوين والتحليل في المستقبل.
- بالنسبة للمجموعة التي تم تفريغها ، قم باستنشاق وسائط المعالجة المسبقة ونقل النباتات إلى أطباق بتري الطازجة ، وأضف 70 مل من وسائط الاستزراع لكل منها ، ثم عد إلى الحاضنة.
- بالنسبة لتوتر خط الأساس ومجموعات الاصطدام الساكنة ، قم بإعداد منصات الزرع. قطع قطع من ورق الصنفرة مماثلة في الحجم لألواح القبضة. بالنسبة لمجموعة الاصطدام الثابتة ، قم بقطع قطع من الخط المضفر بطول 18 بوصة تقريبا واربط مسبقا عقدة علوية فضفاضة في منتصف الطريق على طول الخط. قطع المسيل للدموع من رقائق الألومنيوم لتغطية كل حمام أكريليك ورش مع 70 ٪ من الإيثانول (EtOH). نقل الاستعدادات إلى BSC.
- تشتمل كل منصة على حمام أكريليك وقاعدة وملحق لتقليل الحجم ومشبك ومقابض. تشتمل كل قبضة على صفيحتين وثلاثة أنواع مختلفة من البراغي بما في ذلك برغي بطول M5 × 0.8 مم × 10 مم يربط المقابض بالقاعدة ؛ اثنين من مسامير M6 × 1 مم × 20 مم طويلة تمتد الصفائح لتثبيت المقابض ؛ وأربعة مسامير بطول M3 × 0.5 مم × 14 مم ، بالاقتران مع أربعة نوابض ضغط ، تسحب الألواح لفتح المقابض.
- ضع جميع المكونات في حاويات ثانوية قادرة على التقاط جميع وسائط الثقافة في حالة حدوث تسرب. اغمر في محلول مبيض ≥ 10٪ وانقعه لمدة 1 ساعة على الأقل. اشطف محلول التبييض بماء الصنبور (الأوتوكلاف حسب الحاجة) وانتقل إلى BSC.
ملاحظة: لاستكشاف التلوث وإصلاحها ، ضع في اعتبارك تعقيم كل مياه الصنبور أو استخدام المياه النقية. راجع المناقشة للحصول على نصائح إضافية عند معالجة التلوث. - استخدم مسامير M3 ونوابض الضغط لتوصيل الصفائح بالمقابض ، وقم بتثبيت المقابض بالقاعدة باستخدام المسمار M5 ، وأدخل مسامير M6 حتى يتم تعشيق الزجاجات. استخدم شريطا على الوجهين لتوصيل ورق الصنفرة بالأسطوانات، ثم أغلق المقابض لتعزيز التصاق ورق الصنفرة بالأسطوانات. كرر لجميع المنصات.
- عندما تكون جاهزا لتحميل منصة ، افتح المقابض بالكامل واستخدم الملقط ، ضع الجزء العلوي من الساق والركبة بين الصفائح بحيث يكون السطح السطحي لوتر العرقوب متجها لأعلى (الشكل 1 أ). أغلق المقابض بشكل غير محكم لتثبيتها برفق في مكانها.
- استخدم الملقط للإمساك برأس أو قدم عظم الفخذ المكشوف والتعامل مع زاوية ثني الركبة أثناء إغلاق المقابض تدريجيا لتثبيتها في مكانها. بالنسبة لمجموعة الشد الأساسية، قم بتمديد مفصل الركبة كما هو موضح سابقا. مع تشديد المقابض مع تمديد الركبة ، يجب أن يمتد الكاحل بشكل طبيعي. بالنسبة لمجموعة الاصطدام الساكن ، قم بثني مفصل الركبة بين المقابض كما هو موضح سابقا.
- بالنسبة لمجموعة الاصطدام الثابت ، ضع العقدة العلوية للخيط حول المخلب البعيد وشدها. قم بتوجيه الخيط عبر فتحة في القاعدة تقع أسفل الزرع ومن خلال فتحة المشبك. ضع القاعدة في حمام الأكريليك وقم بتثبيت المشبك على الحافة العلوية للحمام (الشكل 1 أ).
- اسحب الخيط لثني القدم إلى 110 درجة على الأقل فيما يتعلق بالساق واستخدم علامة دائمة لتمييز الخيط عند خروجه من المشبك. التقط صورة للزرع في هذا الموضع لتحديد زاوية الانثناء الظهري لاحقا (الشكل 1 أ).
- قم بإزالة القاعدة وإرفاق ملحق تقليل مستوى الصوت عن طريق الانزلاق على طول مسار على القاعدة. ضع القاعدة (متصلة الآن بملحق تقليل مستوى الصوت) مرة أخرى في حمام الأكريليك وأعد وضع المشبك على الحافة العلوية. اسحب الخيط للعودة إلى زاوية الانثناء الظهري الأصلية باستخدام الخيط المحدد كدليل وقم بتثبيت الخيط إلى خارج الحمام بشريط للحفاظ على الانثناء الظهري الثابت.
- بالنسبة لمجموعة التوتر الأساسية ، ما عليك سوى وضع القاعدة مع إدخال تقليل الحجم في حمام الأكريليك بمجرد وضع الزرع بين المقابض والتقاط صورة لتحديد زاوية الانثناء الظهري.
- أضف 125 مل من وسائط الاستزراع الدافئة مسبقا (37 درجة مئوية) إلى كل منصة لغمر النباتات. غطي الجزء العلوي من الحمام بورق الألمنيوم ، وضعه في وعاء ثانوي ، وانتقل إلى الحاضنة. الثقافة لمدة 7 أيام إضافية ، وتغيير الوسائط كل 48-72 ساعة.
ملاحظة: يمكن أن يمنع الشريط اللاصق الموضوع في الجزء العلوي من الحمام أجزاء PLA من الطفو.
4. التثبيت وإزالة الكلس وتضمين البارافين
- بعد زراعة الزرع ، استخدم المقص لتقليم أظافر القدمين / أصابع القدم البعيدة وقطع الجزء العلوي من الساق القريب من تقاطع الوتر العضلي في أخيل. ضع كل مفصل كاحل مشذب في شريط معالجة مبطن بوسادات خزعة رغوية. ادفع الكاحل إلى زاوية الدرج لوضع الكاحل عند انثناء الظهر بزاوية 90 درجة تقريبا وأغلق الكاسيت ليبقى في مكانه.
- ثبت لمدة 3 أيام في 10٪ فورمالين مخزن محايد (NBF) وإزالة الكلس لمدة أسبوعين في 14٪ حمض إيثيلين ديامينيتيتراسيتيك (EDTA) المذاب في الماء المقطر (diH2O) مع تعديل درجة الحموضة إلى 7.4-7.6 مع حمض الخليك الجليدي.
- لإزالة الأملاح، اشطف العينات جيدا ثلاث مرات في كل من محلول ملحي مخزن بالفوسفات 1x (PBS) متبوعا ب diH2O، 5 دقائق لكل منهما. إجراء معالجة روتينية للعينات لأنسجة البارافين: قم بتجفيف من خلال سلسلة متدرجة من EtOH ، واضحة في الزيلين ، وتسلل بشمع البارافين. توجيه العينات وتضمينها في البارافين للحصول على أقسام الأنسجة السهمية من خلال وتر العرقوب في تطور من الإنسي إلى الجانبي كما هو موضح في القسم 5 أدناه (الشكل 1 ب).
5. تقسيم الأنسجة
- باستخدام microtome ، قم بقص العينة بعناية حتى تصبح الأقسام موازية لوجه الكتلة. قم بقص الكاحل بشكل كبير من الجانب الإنسي للمفصل ، وتوقف قبل الوصول إلى الحد الإنسي لإدخال وتر العرقوب.
- انقل العينة إلى كتلة ثلج لضبط درجة الحرارة والترطيب ، وقم بتغيير الشفرات (أو انتقل إلى قسم جديد من الشفرة الحالية). استمر في التقسيم إلى العينة بسمك 10 ميكرومتر وحدد بعناية الدخول إلى إدخال وتر العرقوب باستخدام مجهر برايتفيلد. بمجرد تحديده ، قم بإجراء رقم قسم تتبع المقطع التسلسلي (أي عمق الأنسجة) من خلال إدخال وتر العرقوب بالكامل.
6. إزالة البارافين / الإماهة واختيار الشرائح
- لكل فحص أدناه ، حدد أقسام الأنسجة المتطابقة مع المستوى من كل زوج من الأطراف المقابلة. قبل التلوين ، ضعه على رف منزلق وتحرك خلال 3 تغييرات من الزيلين ، وتغييرين بنسبة 100٪ EtOH ، وتغييرين بنسبة 95٪ EtOH ، وتغيير 1 بنسبة 70٪ EtOH ، 5 دقائق لكل منهما. الانتهاء من إعادة الترطيب في diH2O.
7. TUNEL لتقييم صلاحية وتر العرقوب
- لوضع ملصقات TUNEL ، قم بتلطيخها وفقا لبروتوكول الشركة المصنعة. احتضان في 20 ميكروغرام/مل بروتيناز K لمدة 20 دقيقة في درجة حرارة الغرفة وشطف في diH2O. احتضان في 50 ميكرولتر من محلول TUNEL للبقع (محلول إنزيم 5 ميكرولتر، محلول ملصق 45 ميكرولتر) لمدة 1 ساعة عند 37 درجة مئوية. شطف في diH2O. جبل مع كاشف مضاد للتلاشي يحتوي على DAPI وغطاء الغطاء.
- تخيل إدخال وتر العرقوب باستخدام مجهر مضان بعدسة موضوعية 4x. قم بتضمين قناة DAPI (الأطوال الموجية للإثارة / الانبعاث = 360/460 نانومتر) لتصور جميع النوى ، وقناة TUNEL (TMR Red) (الأطوال الموجية للإثارة / الانبعاث = 540/580 نانومتر) لتصور نوى موت الخلايا المبرمج ، وإذا أمكن ، قناة برايتفيلد.
- لتحليل الصور ، قم باستيراد الصور إلى برنامج تحليل الصور المناسب للمعالجة القائمة على عائد الاستثمار ، مثل FIJI / ImageJ أو MATLAB. حدد منطقة الاهتمام (ROI) التي تحدد وتر العرقوب بأكمله في العرض (الشكل 2 أ) ، باستثناء الخلايا الموجودة في epitenon المعرضة بشدة للموت الناجم عن التشريح والتغير المفاجئ في الظروف البيئية عند وضعها في الثقافة.
- للقيام بذلك ، قم بإجراء تحديد عائد الاستثمار في MATLAB عن طريق استيراد صورة brightfield واستخدام وظيفة drawpolyg() لتتبع حدود الوتر وإرفاقها. ينشئ MATLAB كائن مضلع لعائد الاستثمار ، والذي يمكن تطبيقه بعد ذلك على صور قناة DAPI و TUNEL لإخفاء بيانات كثافة البكسل خارج عائد الاستثمار باستخدام createMask() من أجل تحليل النوى داخل وتر العرقوب فقط.
- استيراد صور قناة DAPI و TUNEL وتحديد عتبة شدة مضان لتحديد نوى موت الخلايا المبرمج (TUNEL +) عن طريق التطبيع إلى أقصى شدة مضان لنوى موت الخلايا المبرمج في الأنسجة غير القابلة للحياة مثل العظام أو العضلات أو الدهون التي يتم التقاطها بالمناسبة في قسم الأنسجة. بمجرد إخفاء الصور ، احسب جزء نوى موت الخلايا المبرمج (TUNEL + nuclei / DAPI nuclei) داخل وتر العرقوب.
8. الأنسجة الزرقاء التولويدين لتوصيف تشكيل الغضروف الليفي
- بمجرد إعادة الترطيب (القسم 6) ، انقل الرف المنزلق مع أقسام الأنسجة المتطابقة المستوى من أزواج من النباتات المقابلة إلى 0.4٪ وزن / وزن Toluidine blue O في محلول أسيتات الصوديوم 0.1 متر مع تعديل درجة الحموضة إلى 4.0 باستخدام حمض الخليك الجليدي. احتضن لمدة 10 دقائق في درجة حرارة الغرفة ، ثم شطف 3x في diH2O لمدة 30 ثانية لكل منهما.
- قم بالجفاف من خلال ثلاثة تغييرات بنسبة 95٪ EtOH وتغييرين بنسبة 100٪ EtOH ، 30 ثانية لكل منهما. مسح من خلال ثلاثة تغييرات من الزيلين ، 1 دقيقة لكل منهما. غطاء مع وسيط تركيب قائم على الزلين.
- احصل على صور ملونة 24 بت باللون الأحمر والأزرق والأخضر (RGB) لإدخال وتر العرقوب. على سبيل المثال ، بالنسبة لهذا البروتوكول ، استخدم محولا لتوصيل كاميرا ملونة رقمية بعدسة مجهر برايت فيلد بسيط بهدف 4x.
- لتحديد الاختلافات في تلطيخ التولويدين الأزرق داخل الغضروف الليفي الوتري الانضغاطي (CTF)16 عند إدخال وتر العرقوب (الشكل 3A ، B) ، قم باستيراد صور RGB إلى برنامج تحليل الصور القادر على تحديد وإدارة عائد استثمار متعدد. تتضمن الخيارات التحديدات وأدوات مدير عائد الاستثمار في FIJI / ImageJ أو مربع أدوات معالجة الصور في MATLAB. ابدأ بتعيين مقياس البكسل / الطول.
ملاحظة: يتم ترك اختيار البرنامج لتقدير الباحث وبالتأكيد لا يقتصر على MATLAB أو FIJI / ImageJ. قدم المؤلفون رمز MATLAB (الملف التكميلي 2) ، والوثائق التي تصف التنفيذ (الملف التكميلي 3) ، وصورة عينة (الملف التكميلي 4). نحن نشجع الباحثين على ترجمة هذا الرمز إلى لغات برمجة بديلة لاستخدامها في برامج أخرى حسب الحاجة أو المفضلة. - مع الصورة المعروضة في البرنامج المختار ، حدد تقاطع حدود الوتر العميق مع العقب. من هنا ، تتبع بالقرب من 800 ميكرومتر على طول حدود الوتر العميق لإنشاء الحدود العميقة ل CTF. على سبيل المثال ، استخدم الدالة drawpolyline () في MATLAB لرسم خط متعدد بشكل تفاعلي فوق صورة RGB. يقوم MATLAB بإنشاء كائن Polyline يحتوي على رؤوس الخط ، والتي يمكن معالجتها وتقليمها بطول 800 ميكرومتر.
- من هذا الموضع ، قم بإنشاء الحدود القريبة ل CTF عن طريق رسم قطعة خطية متصلة بحدود الوتر السطحية المتعامدة مع اتجاه الألياف المحلية.
- عد إلى تقاطع حدود الوتر العميق والعقبي وحدد الحدود البعيدة ل CTF عن طريق رسم قطعة مستقيمة متصلة بحدود الوتر السطحي على طول علامة المد المميزة التي تفصل CTF عن الغضروف الليفي لمنطقة التعلق (AZF) 16 (الشكل 3 أ ، ب). أخيرا ، قم بإنشاء الحدود السطحية ل CTF عن طريق تتبع حدود الوتر السطحية لإحاطتها.
- لوصف الاختلافات المكانية في تلطيخ GAG عبر الإدراج ، قسم إجمالي CTF إلى 4 أرباع (الشكل 3 أ ، ب). قم بتوصيل نقطة المنتصف لحدود CTF العميقة والسطحية بقطعة مستقيمة لإنشاء حد بعيد / قريب. بالمرور عبر نقطة منتصف هذه الحدود ، قم بتوصيل نقاط المنتصف لحدود CTF البعيدة والقريبة على طول اتجاه الألياف لإنشاء حدود سطحية / عميقة.
- توفر حدود 6 هذه معلومات يمكن استخدامها لتحديد عائد الاستثمار الذي يمثل CTF بالكامل ، ولكن أيضا 4 أرباع تقسم CTF. في MATLAB ، على سبيل المثال ، قم بتجميع الرؤوس التي تحدد حدود كل عائد استثمار فردي (CTF ، الأرباع 1-4) في متجهات واستخدم images.roi.Polygon() لإنشاء كائنات مضلعة مغلقة لكل عائد استثمار.
- مع تحديد عائد الاستثمار ، قم بتحويل بيانات بكسل RGB إلى مساحة ألوان Hue-Saturation-Value (HSV) باستخدام المكون الإضافي لمحول الألوان في FIJI ، أو وظيفة rgb2hsv () في MATLAB ، أو أي برنامج آخر يطبق معادلات التحويل المناسبة76. يمكن بعد ذلك عرض بيانات HSV في مساحة تشبع الصبغة ثنائية الأبعاد ، حيث تقوم كل مجموعة من تدرج اللون والتشبع بتشفير لون فريد (الشكل 3C).
- ضمن كل عائد استثمار ، احسب متوسط تدرج اللون والتشبع الذي يصف متوسط لون البقعة في عائد الاستثمار. يمكن تحقيق ذلك في MATLAB ، على سبيل المثال ، باستخدام كائنات Polygon التي تحدد كل عائد استثمار لإخفاء الصورة باستخدام createMask() من أجل تحليل بيانات بكسل تشبع تدرج اللون على وجه التحديد داخل كل عائد استثمار.
- حدد عائد استثمار صغير آخر داخل الغضروف الليفي السمحاق (PF)16 (الشكل 3 أ ، ب) واحسب متوسط تدرج اللون والتشبع. بعد ذلك ، احسب المسافة الإقليدية التي تفصل متوسط اللون في كل عائد استثمار ل CTF إلى لون PF (الشكل 3C).
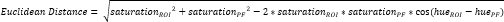
ملاحظة: يصف حساب المسافة الإقليدية درجة التشابه بين متوسط لون عائد الاستثمار ولون PF ، وهو نسيج ليفي غضروفي مثالي16،17،77. تشير المسافة الإقليدية الأصغر إلى لون عائد استثمار أكثر مظهرا ليفيا. - استخدم هذه المسافة لحساب درجة الغضروف الليفي ، والتي تفترض قيمة قصوى تبلغ 1 إذا كان لون عائد الاستثمار مطابقا للون PF وقيمة دنيا -1 إذا وصل لون ROI و PF إلى أقصى فصل داخل مساحة لون تشبع تدرج اللون.
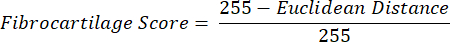
- متوسط البيانات عن درجة تدرج اللون والتشبع والغضروف الليفي داخل كل عائد استثمار عبر أقسام الأنسجة من كل طرف. إجراء مقارنات إحصائية مزدوجة بين مجموعات الأطراف المقابلة.
9. تصوير SHG للتحقيق في التغيير في تنظيم شبكة الكولاجين
- قم بإجراء تصوير SHG للأقسام الملطخة باللون الأزرق Toluidine باستخدام نظام مجهر قادر مع عدسة كائن 20x. احصل على مداخن z من خلال سمك القسم وقم بإجراء مسح للبلاط حسب الحاجة لالتقاط إدخال وتر العرقوب بالكامل.
- استيراد صور SHG إلى برنامج تحليل الصور المفضل وتحديد عائد الاستثمار الذي يشمل ويقسم CTF عند إدخال وتر العرقوب كما هو موضح لتحليل الصورة الزرقاء Toluidine في القسم 8 (الشكل 4A ، B).
- إذا تم استيراد صور SHG إلى MATLAB ، فاستخدم النهج لتحديد عائد استثمار CTF في MATLAB كما هو موضح في القسم 8. بعد تحديد عائد الاستثمار ، انقل إحداثيات عائد الاستثمار إلى FIJI عن طريق تصدير رؤوس عائد الاستثمار من MATLAB كملفات .txt والاستيراد إلى FIJI باستخدام إحداثيات استيراد > XY للملف >. تراكب التحديد وإرساله إلى مدير عائد الاستثمار لتحليله.
- لتحديد تنظيم الكولاجين ، استخدم المكون الإضافي Directionality في FIJI ، والذي يقوم بإجراء تحليل طيف فورييه لحساب توزيعات اتجاهات الألياف عبر النوافذ الصغيرة التي تمتد على عائد استثمار. يرتبط انتشار هذا التوزيع ، المشار إليه باسم التشتت ، عكسيا بمحاذاة الألياف.
ملاحظة: قد تتخذ ألياف الكولاجين اتجاهات متغيرة في نوافذ مختلفة عبر CTF بسبب الانحناء الإجمالي للوتر بدلا من غياب المحاذاة / التنظيم. لتمييز التغيرات في تنظيم الكولاجين بشكل أفضل عن الانحناء الإجمالي للوتر عند الإدخال ، من الضروري تحديد عائد استثمار أصغر. - استيراد صور SHG إلى فيجي وتعيين مقياس البكسل / الطول. عرض بيانات كثافة البكسل القصوى في صورة مركبة 2D وإضافة عائد استثمار إلى مدير عائد الاستثمار. تراكب كل عائد استثمار CTF بالتتابع على الصورة وارسم 10 عائد استثمار فرعي صغير بحجم ثابت داخل عائد الاستثمار ، مع إضافة عائد الاستثمار الفرعي إلى مدير عائد الاستثمار.
- ضمن كل عائد استثمار فرعي ، قم بتشغيل المكون الإضافي للاتجاه في FIJI لحساب تشتت الألياف. متوسط بيانات التشتت عبر عائد الاستثمار الفرعي داخل كل عائد استثمار CTF ، ومتوسط بيانات التشتت داخل كل عائد استثمار CTF عبر الأقسام من كل مصنع خارجي. إجراء مقارنات إحصائية مزدوجة بين مجموعات الأطراف المقابلة.
النتائج
تظهر الصور التمثيلية لأقسام الأنسجة الملطخة TUNEL الحد الأدنى من نوى موت الخلايا المبرمج داخل جسم وتر العرقوب بعد 7 أيام من زراعة النباتات عبر المجموعات التجريبية (الشكل 2 أ). يوفر القياس الكمي لهذه الصور دليلا على أن بروتوكول زراعة الأنسجة يحافظ على ما يصل إلى 78٪ من الصلاحية ?...
Discussion
توفر منصة زرع الأطراف الخلفية التجريبية للفأر المقترنة ببروتوكول زراعة الأنسجة الموصوف في هذه الدراسة نموذجا مناسبا لدراسة البيولوجيا الميكانيكية لتشكيل الغضروف الليفي الناجم عن الاصطدام عند إدخال وتر العرقوب. تتجلى فائدة هذا النموذج الخارجي من خلال النتائج التمثيلية ، والتي تشير إلى ...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يشعر المؤلفون بالامتنان للدعم والمساعدة التي قدمها جيف فوكس وفيديا فينكاتراماني من مركز أبحاث الأنسجة والكيمياء الحيوية والتصوير الجزيئي (HBMI) التابع لمركز أبحاث الجهاز العضلي الهيكلي بجامعة روتشستر ، بتمويل جزئي من P30AR06965. بالإضافة إلى ذلك ، يود المؤلفون أن يشكروا مركز الفحص المجهري الضوئي والنانوي (CALMN) في المركز الطبي بجامعة روتشستر للمساعدة في الفحص المجهري متعدد الفوتونات. تم تمويل هذه الدراسة من قبل R01 AR070765 و R01 AR070765-04S1 ، وكذلك 1R35GM147054 و 1R01AR082349.
Materials
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
References
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved