A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصور في الجسم الحي للنشاط التلقائي في القشرة الحسية للفأر الوليدي بدقة خلية عصبية واحدة
* These authors contributed equally
In This Article
Summary
تظهر المناطق الحسية الأولية في القشرة المخية الحديثة أنشطة عفوية فريدة أثناء النمو. توضح هذه المقالة كيفية تصور أنشطة الخلايا العصبية الفردية والمناطق الحسية الأولية لتحليل الأنشطة المتزامنة الخاصة بالمنطقة في الفئران الوليدية في الجسم الحي.
Abstract
يخضع دماغ الثدييات لتغيرات تنموية ديناميكية على المستويين الخلوي والدوري طوال فترات ما قبل الولادة وما بعدها. بعد اكتشاف العديد من الجينات التي تساهم في هذه التغيرات التنموية ، من المعروف الآن أن النشاط العصبي يعدل هذه العمليات بشكل كبير. في القشرة الدماغية النامية ، تظهر الخلايا العصبية أنماط نشاط متزامنة متخصصة في كل منطقة حسية أولية. تختلف هذه الأنماط بشكل ملحوظ عن تلك التي لوحظت في القشرة الناضجة ، مما يؤكد دورها في تنظيم العمليات التنموية الخاصة بالمنطقة. يمكن أن يؤدي نقص النشاط العصبي أثناء التطور إلى أمراض دماغية مختلفة. تسلط هذه النتائج الضوء على الحاجة إلى فحص الآليات التنظيمية الكامنة وراء أنماط النشاط في تطور الخلايا العصبية. تلخص هذه الورقة سلسلة من البروتوكولات لتصور المناطق الحسية الأولية والنشاط العصبي في الفئران الوليدية ، لتصوير نشاط الخلايا العصبية الفردية داخل الحقول الفرعية القشرية باستخدام المجهر ثنائي الفوتون في الجسم الحي ، ولتحليل ارتباطات النشاط المتعلقة بالحقول الفرعية. نعرض نتائج تمثيلية للنشاط المتزامن الشبيه بالترقيع داخل البراميل الفردية في القشرة الحسية الجسدية. نناقش أيضا العديد من التطبيقات المحتملة وبعض القيود على هذا البروتوكول.
Introduction
تحتوي القشرة الدماغية على العديد من المناطق الحسية ذات الوظائف المتميزة. تتلقى المناطق مدخلات تنشأ من أعضائها الحسية المقابلة ، ويتم نقلها في الغالب عبر الحبل الشوكي أو جذع الدماغ ويتم نقلها عبر المهاد 1,2. والجدير بالذكر أن الخلايا العصبية في كل منطقة حسية أولية تظهر نشاطا متزامنا بشكل فريد خلال مراحل النمو المبكرة ، والتي تنشأ أيضا من الأعضاء الحسية أو المراكز العصبية السفلية ، ولكنها تختلف اختلافا جوهريا عن الأنشطة التي لوحظت في القشرةالناضجة 3.
في القوارض الوليدية ، على سبيل المثال ، تعرض المنطقة البصرية الأولية (V1) نشاطا يشبه الموجة ، والذي ينشأ في شبكية العين (موجة الشبكية) وينتشر عبر المسار البصري بأكمله مع الحفاظ على الشبكية4. تظهر المنطقة السمعية الأولية (A1) نشاطا متزامنا منظما في مناطق فرعية على شكل نطاق تتوافق مع نطاقات متساوي التردد في الدماغ الناضج. ينبع النشاط من خلايا الشعر الداخلية للقوقعة 5,6. تظهر القشرة البرميلية في المنطقة الحسية الجسدية الأولية (S1) نمط نشاط يشبه الترقيع يتم فيه تنشيط الخلايا العصبية للطبقة 4 داخل البراميل الفردية ، أي الخلايا العصبية المستجيبة للشعيرات الفردية ، بشكل متزامن7. على الرغم من أنه يقترح أن تنشأ من العقدة الثلاثية التوائم ، إلا أن مصدر النشاط لا يزال غير معروف7. وبالتالي ، فإن أنماط نشاط حديثي الولادة متخصصة داخل كل منطقة حسية أولية وداخل الحقول الفرعية داخل المساحة. قد يسهل التصور المتزامن للنشاط العصبي وهيكل المناطق الحسية الأولية التحقيق في مساهمة أنماط النشاط هذه في تطوير الأنظمة الحسية.
في هذه المقالة ، قمنا بتلخيص سلسلة من البروتوكولات: (1) لتصور الأنشطة العصبية الفردية باستخدام وضع العلامات المتناثرة ل GCaMP والمناطق الحسية الأولية باستخدام فئران TCA-RFP التي تعبر عن بروتين الفلورسنت الأحمر في محاور المهادالقشرية 7 ، (2) لتصوير النشاط على مستوى الخلية المفردة في الفئران حديثي الولادة باستخدام المجهر ثنائي الفوتون في الجسم الحي، و (3) لتحليل ارتباطات النشاط داخل قشرة البرميل S1. تظهر النتائج التمثيلية نشاطا متزامنا يشبه الترقيع داخل براميل فردية من فأر يوم ما بعد الولادة (P) 6. على الرغم من بعض القيود ، يمكن استخدام هذه التقنية للتصوير المزمن ، والتصوير واسع المجال عبر مناطق حسية متعددة ، وتجارب التلاعب المختلفة. التحليل متعدد الأوجه للنشاط العصبي أثناء التطور سيثري فهمنا لآليات تشكيل دائرة الدماغ.
Access restricted. Please log in or start a trial to view this content.
Protocol
أجريت جميع التجارب وفقا للمبادئ التوجيهية للتجارب على في جامعة كوماموتو والمعهد الوطني لعلم الوراثة ووافقت عليها لجان التجارب على.
1. في التثقيب الكهربائي في الرحم (IUE)
- رفيق ذكور الفئران TCA-RFP من خلفية ICR مع إناث الفئران من النوع البري ICR. راقب السدادة المهبلية للتحقق من التزاوج في الصباح الباكر من اليوم التالي. مراقبة البطن للتحقق من الحمل 2 أسابيع في وقت لاحق.
- تحضير محلول البلازميد الذي يحتوي على 5 نانوغرام / ميكرولتر TRE-nCre ، 1 ميكروغرام / ميكرولتر CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE ، و 0.02٪ تريبان بلو في ddH2O لتسمية الخلايا العصبية بشكل ضئيل بواسطة GCaMP باستخدام نظام المستعر الأعظم8.
- تحضير محلول مسكن يحتوي على 0.5 ملغ / مل كاربروفين و 0.01 ملغ / مل من البوبرينورفين. احفظه من الضوء واحتفظ به في درجة حرارة الغرفة.
- في اليوم الجنيني (E) 14 ، قم بإجراء IUE على النحو التالي. طرق IUE هي في الأساس نفس التقارير السابقة9،10،11.
- امسح مقعد المختبر بنسبة 70٪ من الإيثانول أو محلول الجلوتارالدهيد. تعقيم جميع الأدوات الجراحية عن طريق التعقيم. ارتد قناعا ومعطفا مختبريا لتقليل خطر إصابة الفأر بالعدوى.
- تحضير الماصات الزجاجية الدقيقة باستخدام مجتذب ماصة دقيقة. خذ محلول خليط البلازميد في الماصة الزجاجية الدقيقة باستخدام أنبوب شفاط.
- حث التخدير للفئران الحوامل في E14 باستخدام الأيزوفلوران (2.0٪ في الهواء). الحفاظ على الفئران مخدر أثناء العملية مع isoflurane (1.2 ٪ في الهواء). اضغط على إصبع القدم للتأكد من أن التخدير عميق بما فيه الكفاية. استخدم مرهم العيون لمنع جفاف العين.
- تطهير منطقة البطن ثلاث مرات على الأقل مع جولات بالتناوب من فرك القائم على اليود و 70 ٪ من الإيثانول. ضع ستارة معقمة لتغطية منطقة الجراحة. قم بعمل شق في خط الوسط وفضح الرحم على الستارة.
- كرري تقطير محلول ملحي دافئ على الرحم لمنعه من الجفاف أو التبريد حتى إغلاق البطن (الخطوة 1.4.8).
- حقن محلول البلازميد في جانب واحد من البطين الجانبي للأجنة واحدا تلو الآخر باستخدام ماصة دقيقة وأنبوب شفاط.
- استخدم قطبا كهربائيا من نوع الملقط لقرص رؤوس الجنين وتوصيل نبضات كهربائية مربعة (40 فولت ، 50 مللي ثانية) خمس مرات على فترات 1 ثانية باستخدام جهاز كهربائي.
- أعد الرحم إلى تجويف البطن. ضع ~ 3 مل من المحلول الملحي الدافئ في التجويف. خياطة الغشاء البريتوني وجلد البطن. تطبيق المحلول المسكن بوزن 10 ميكرولتر/غرام (كاربروفين بوزن 5 ميكروغرام/غرام والبوبرينورفين بوزن 0.1 ميكروغرام/غرام) تحت الجلد في الجزء الخلفي من الرقبة.
- ضع الماوس في قفص استرداد على وسادة تدفئة (37 درجة مئوية) للتعافي من التخدير. ضع الفأر على بطنه لمنع لسانه ولعابه من خنق الحلق. احتفظ بالماوس بعيدا عن الفئران الأخرى وراقبه حتى يتعافى ليتحرك بشكل طبيعي. أعد الماوس إلى القفص.
- بعد الولادة ، قم بإجراء التنميط الجيني للتحقق من أليل RFP ، والقتل الرحيم للجراء بدون الأليل. يوصى بهذه الخطوة ، خاصة إذا تم إجراء التصوير خلال الأسبوع الثاني بعد الولادة عندما تكون إشارة TCA-RFP ضعيفة ويصعب التحقق منها في الخطوة 2.2.7.
2. جراحة نافذة الجمجمة
- قم بإعداد المخزن المؤقت للقشرة الذي يحتوي على 125 مللي مول كلوريد الصوديوم ، و 5 مللي مول KCl ، و 10 مللي مول من الجلوكوز ، و 10 مللي مول HEPES ، و 2 mM CaCl2 ، و 2 mM MgSO4 في ddH2O (يتم تعديل درجة الحموضة إلى 7.4 مع 1 M NaOH) 12 قبل يوم الجراحة. تعقيم المخزن المؤقت باستخدام مرشح فراغ.
ملاحظة: يمكن الاحتفاظ بالمخزن المؤقت عند 4 درجات مئوية لمدة تصل إلى 3 أشهر. الحجم المطلوب هو 5-10 مل لكل جرو. - قم بتنفيذ الخطوات التالية في P3-12. انظر أيضا التقارير السابقة التي وصفت هذا الإجراء13,14.
- مزيج 50 ملغ من agarose مع 5 مل من العازلة القشرة وحل تماما agarose عن طريق التدفئة. خذ بعض المحلول في أنبوب سعة 1.5 مل واحتفظ به عند 42 درجة مئوية.
- خذ بعض المخزن المؤقت للقشرة في أنبوب مخروطي سعة 50 مل واحتفظ به في درجة حرارة الغرفة. خذ بعض المحلول الملحي في وعاء (على سبيل المثال ، غطاء أنبوب مخروطي سعة 50 مل) واحتفظ به في درجة حرارة الغرفة.
- تحضير محلول مسكن يحتوي على 0.01 ملغ/مل من البوبرينورفين. احفظه من الضوء واحتفظ به في درجة حرارة الغرفة.
- تعقيم جميع الأدوات الجراحية عن طريق التعقيم. تطهير المجهر ستيريو مضان مع 70 ٪ من الإيثانول.
- استخدم مبخر إيزوفلوران للحث على التخدير في الجرو مع إيزوفلوران (2.0٪ في الهواء). انتبه إلى الجرو وأخرجه عندما يتباطأ تنفسه قليلا.
ملاحظة: إذا طال التخدير ، فقد يتوقف تنفس الجرو لبضع ثوان. حتى إذا تم استئناف تنفس الجرو ، فإن التخدير المطول قد يقلل من تدفق الدم الدماغي للجرو ويسبب تلفا في الدماغ لا رجعة فيه. - تطهير رأس الجرو ثلاث مرات على الأقل مع جولات متناوبة من فرك القائم على اليود و 70 ٪ من الإيثانول. ضع الجرو على وسادة التدفئة (35 درجة مئوية) تحت مجهر ستيريو مضان. احتفظ دائما بتخدير الجرو بالإيزوفلوران (1.5٪ -2.5٪ في الهواء).
- حدد الجراء التي تعبر عن TCA-RFP و GCaMP من خلال مراقبة التألق من خلال الجمجمة. القتل الرحيم للجراء التي لا تعبر عن كليهما.
- قم بإزالة فروة الرأس فوق نصفي الكرة المخية على أوسع نطاق ممكن بعناية حتى لا تسبب النزيف. افركي الجمجمة بقطعة قطن معقمة مبللة بالمحلول الملحي لإزالة النسيج الضام.
- بعد أن تجف الجمجمة ، قم بلصق سطح فروة الرأس المحفور بالجمجمة باستخدام مادة لاصقة للأنسجة.
- انقل الجرو إلى وسادة تسخين 37 درجة مئوية للتعافي من التخدير. انتظر لمدة 15 دقيقة على الأقل حتى تتجمد المادة اللاصقة.
ملاحظة: توقف مؤقتا لمدة تصل إلى 1 ساعة قبل الانتقال إلى الخطوة التالية. قم بإعداد الجراء الأخرى بطريقة مماثلة إذا لزم الأمر خلال هذا الوقت. - تخدير الجرو مع إيزوفلوران. ضع الجرو على وسادة التدفئة (37 درجة مئوية) تحت مجهر ستيريو مضان أثناء التخدير (1.5٪ -2.5٪ إيزوفلوران في الهواء).
ملاحظة: إذا طال التخدير أكثر من وقت نقطة النهاية (60 دقيقة) ، فقم بالقتل الرحيم للجرو عن طريق قطع الرأس أثناء التخدير باستخدام الأيزوفلوران. - ضع علامة على موقع GCaMP المعرب على الجمجمة بعلامة دائمة معقمة. ضع المخزن المؤقت للقشرة على الموقع.
- أدخل زاوية شفرة الحلاقة في الجمجمة. ادفع الشفرة ببطء لحلق الجمجمة وعمل ثقب. قرصة من الجمجمة المتشققة مع ملاقط وإزالته.
- تأكد من أن ثقب الجمجمة يتم بنجاح من خلال مراقبة الأوعية الدموية في الحفرة. في حالة حدوث نزيف ، شطف الحفرة بسرعة مع عازلة القشرة باستخدام micropipette. كرر الشطف حتى يتوقف النزيف تماما.
- ضع قطرة من المخزن المؤقت للقشرة على فتحة الجمجمة وضعها في غطاء زجاجي دائري معقم بقطر 3 مم فوق الفتحة. امسح المخزن المؤقت الزائد بقماش غير منسوج. انتظر حتى تجف المنطقة المحيطة بالزجاج.
- ضع محلول الأغاروز الدافئ حول الحافة الزجاجية باستخدام ماصة دقيقة. نظرا لأن الكثير من الأغاروز قد يقلل من إشارات الفلورسنت ، قم بإزالة المحلول الزائد تحت الزجاج عن طريق دفع الزجاج برفق من الأعلى.
- قم بإزالة الأغاروز على الزجاج أو بعيدا عن الحافة الزجاجية باستخدام الملقط. اترك agarose فقط حول محيط الزجاج الخارجي.
- انتظر حتى يصلب الأغاروز. إذا كان انكماش الأغاروز يصنع مساحة تحت الزجاج ، أضف محلول الأغاروز من الجانب لتغطية الحافة الزجاجية بالكامل. قم بإزالة أي سائل من سطح الجمجمة بقماش غير منسوج.
- اخلطي مسحوق راتنج الأكريليك والسائل في وعاء مطاطي. نضح الخليط مع micropipette وصبه لتغطية agarose المحيطة بالحافة الزجاجية مع الراتنج.
ملاحظة: نظرا لأن الراتنج يتصلب بعد وقت قصير من خلط المسحوق والسائل ، فيجب خلطهما بشكل متكرر قبل التقديم. الكميات المطلوبة في كل خلط هي ~ 500 ميكرولتر للسائل و ~ 0.15 جم للمسحوق. - إصلاح شريط التيتانيوم مع الراتنج على نصف الكرة المقابلة. حافظ على زاوية الشريط موازية لزجاج الغطاء. إصلاح سطح الجمجمة بالكامل مع الراتنج.
- يتم تطبيق المحلول المسكن بوزن 10 ميكرولتر/غرام (البوبرينورفين بوزن 0.1 ميكروغرام/غرام) تحت الجلد في الجزء الخلفي من الرقبة. أعد الجرو إلى وسادة تدفئة 37 درجة مئوية لاستعادة التخدير. انتظر لمدة >60 دقيقة لتصلب الراتنج قبل التصوير.
ملاحظة: توقف لمدة 1-5 ساعات قبل التصوير. إجراء عملية جراحية على الجراء الأخرى بطريقة مماثلة خلال هذا الوقت.
3. تصوير الكالسيوم ثنائي الفوتون
- قم بتوصيل مقياس الزوايا ثنائي المحور بلوحة من التيتانيوم بلوحة مرحلة مع وضع XY أسفل المجهر. قم بإعداد وسادة تدفئة (35 درجة مئوية) على المسرح.
- قم بتشغيل برنامج المسح الضوئي بالشروط التالية: بكسل ، 512 × 512 ؛ ثنائي الاتجاه ، ON ؛ المتوسط ، لا شيء ؛ منطقة التصوير ، 600 × 600 ميكرومتر مع هدف 20x. اضبط الإعدادات بحيث يكون معدل المسح أسرع من 1 هرتز.
- ضع الجرو على وسادة التدفئة ، وقم بتثبيت قضيب التيتانيوم المثبت على الرأس على لوحة التيتانيوم بمسامير. حافظ على تخدير الجرو عن طريق وضع منفذ أنبوب للأيزوفلوران (1.5-2.0٪ في الهواء).
- اضبط زاوية النافذة أفقيا بواسطة مقياس الزوايا . قم بتشغيل الإضاءة الخلفية ومراقبة سطح الدماغ باستخدام عدسة موضوعية 5x ، وحدد منطقة التصوير حسب موضع XY.
- ضع قطرات العين على نافذة الجمجمة. قم بتبديل الهدف إلى عدسة غمر بالماء 20x. راقب السطح القشري للتأكد من أن تدفق الدم يظهر على سطح الدماغ.
- قم بإيقاف تشغيل الإضاءة الخلفية ومسح سطح الدماغ باستخدام وضع الفوتون الواحد. زيادة قوة الليزر لجعل التألق الذاتي الأخضر للزجاج وسطح الدماغ مرئيا.
- خفض تركيز الأيزوفلوران إلى 1.0٪ -1.5٪. قم بتغطية المجهر لتجنب تسرب الضوء. قم بتبديل برنامج المسح الضوئي إلى وضع الفوتونين.
- اضبط طاقة الليزر وكسب الكاشف المناسب لمسح إشارات GCaMP و RFP. ابحث عن العمق حيث تظهر إشارات TCA-RFP. تأكد من أن العمق هو الطبقة 4 ، ~ 300 ميكرومتر أقل من سطح الدماغ في P6. حدد منطقة التصوير حيث يتم رؤية العديد من الخلايا العصبية المعبرة عن GCaMP.
- بدء التصوير بفاصل زمني لإشارات GCaMP وRFP. إذا كان المسح الضوئي المتزامن ثنائي القناة غير قابل للتطبيق ، فالتقط صور GCaMP و TCA-RFP قبل التصوير.
- وقف isoflurane لإضعاف التخدير ومراقبة الأنشطة التلقائية لمدة ~ 20 دقيقة. راقب حركات الجرو أثناء التصوير باستخدام كاميرا الأشعة تحت الحمراء. استأنف تخدير الأيزوفلوران (2٪ في الهواء) على الفور إذا لوحظت أي استجابة تشير إلى الضيق.
- بعد توقف الجرو عن الحركة ، كرر التصوير من الخطوة 3.9. قم بتغيير منطقة التصوير إذا لزم الأمر.
- القتل الرحيم للجرو بجرعة زائدة من الأيزوفلوران. إصلاح الدماغ عن طريق التروية عبر القلب من المياه المالحة و 4 ٪ PFA ، تليها بعد التثبيت في 4 ٪ PFA بين عشية وضحاها لإعداد شرائح عرضية وإجراء الكيمياء المناعية. خلاف ذلك ، القتل الرحيم الجرو مع جرعة زائدة من مخدر تليها قطع الرأس.
- إذا لم يكن للسد جراء أخرى ، فقم بالقتل الرحيم للفأر الأم بجرعة زائدة من التخدير متبوعة بخلع عنق الرحم.
4. التحليل
- بدء تشغيل MATLAB وتشغيل EZcalcium toolbox15 لفتح واجهة مستخدم رسومية (GUI) 'واجهة المستخدم الرسومية الأولية'.
- تعويض انحرافات إطار الصورة بسبب حركات الماوس أو لأسباب أخرى.
- انقر فوق تصحيح الحركة في واجهة المستخدم الرسومية الأولية لفتح واجهة المستخدم الرسومية لتصحيح الحركة. انقر فوق "إضافة ملفات ..." لتحميل ملف TIF لبيانات التصوير.
- اضبط الإعدادات على النحو التالي: تصحيح الحركة غير الجامد ، فارغ ؛ عامل أخذ العينات ، 50 ؛ ماكس شيفت ، 15 ؛ حجم الدفعة الأولية ، 200 ؛ عرض الصندوق ، 200. انقر فوق "تشغيل تصحيح الحركة" لتنفيذ التصحيح. سيتم حفظ بيانات التصوير المصححة للحركة تلقائيا.
ملاحظة: يجب ضبط الإعدادات وفقا لخصائص بيانات التصوير. إذا لم يتم تعويض انحرافات بعض الإطارات بسبب تشوهات الإطار غير الخطية أو حركة القشرة في اتجاه العمق ، فافتح بيانات التصوير الأصلية دون تصحيح في ImageJ Fiji وقم بإزالة الإطارات ، وأعد تشغيل الخطوة 4.2.
- الكشف عن الخلايا العصبية ورسم مناطق الاهتمام (ROIs).
- انقر فوق الكشف التلقائي عن عائد الاستثمار في واجهة المستخدم الرسومية الأولية لفتح واجهة المستخدم الرسومية لاكتشاف عائد الاستثمار. انقر فوق إضافة ملفات... لتحميل بيانات التصوير المصححة للحركة.
- اضبط الإعدادات على النحو التالي: التهيئة ، الجشع ؛ طريقة البحث ، القطع الناقص ؛ الالتفاف ، مقيد FOOPSI-SPGL1 ؛ الانحدار الذاتي ، الاضمحلال ؛ # المقدرة من عائد الاستثمار ، 60 (يوصى بأكثر من ضعف العدد المكتشف بصريا) ؛ عرض عائد الاستثمار المقدر ، 17 (~ 20 ميكرومتر) ؛ عتبة الدمج ، 0.95 ؛ عامل الهراء ، 0.95 ؛ الاختزال المكاني ، 1 ؛ درجة الحرارة. اختزال العينات ، 1 ؛ التكرارات المؤقتة ، 5.
ملاحظة: يجب ضبط الإعدادات وفقا لخصائص بيانات التصوير. - انقر فوق تشغيل اكتشاف عائد الاستثمار لتنفيذ الكشف. سيتم حفظ بيانات عائد الاستثمار تلقائيا.
- انقر فوق تحسين عائد الاستثمار في واجهة المستخدم الرسومية الأولية لفتح واجهة المستخدم الرسومية لتحسين عائد الاستثمار. انقر فوق تحميل البيانات لتحميل بيانات عائد الاستثمار. حدد عائد الاستثمار الذي كان له تردد نشاط منخفض (<1 هرتز) ، أو يقع تحت الجمجمة ، أو يحتوي على أعصاب الخلايا العصبية الأخرى. انقر على استبعاد عائد الاستثمار لاستبعاد عائد الاستثمار من التحليل.
- حدد تنسيق تصدير البيانات إلى XLSX وانقر فوق تصدير البيانات للحصول على ملف Excel بقيم dF / F الأولية. يستخدم dF / F المعادلة (1) ، حيث F هو متوسط كثافة البكسل في كل إطار ، و F0 هو شدة إشارة خط الأساس ، و Fb هو مضان الخلفية.
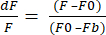 (1)
(1)
- احسب معامل ارتباط بيرسون ل dF / F بين عائد الاستثمار وقم بعمل مصفوفة معامل الارتباط. استخدم dF / F فقط بعد أن يضعف التخدير ويبدأ النشاط التلقائي في الحدوث (~ 10 دقائق بعد إيقاف الأيزوفلوران).
- حدد حواف الأسطوانة من صورة TCA-RFP باستخدام فيجي. صنف عائد الاستثمار إلى البراميل أو الحاجز الخاص بها. قارن الارتباط الزوجي داخل نفس البرميل وبين البراميل المختلفة.
- قم بإنشاء 1,000 إلى 10,000 بيانات بديلة عن طريق خلط المراسلات بشكل عشوائي بين ROI و Ca2+ traces. حساب متوسط معامل الارتباط داخل البراميل الفردية في كل بيانات بديلة ، وتقييم الدلالة الإحصائية للارتباط في البيانات الحقيقية.
ملاحظة: إذا كان أحد بدائل 10,000 له قيمة أعلى من القيمة الحقيقية ، فإن الدلالة الإحصائية هي 0.0001. يمكن إجراء التحليلات الموصوفة في الخطوتين 4.5 و 4.6 للبيانات المجمعة من متعددة ، كما تم إجراؤها في أماكن أخرى7،16.
Access restricted. Please log in or start a trial to view this content.
النتائج
يوضح الشكل 1 النتائج التمثيلية لأنشطة الخلايا العصبية من الطبقة 4 في القشرة البرميلية لجرو P6 المتصور باستخدام البروتوكول الحالي. تم حساب متوسط الصور ثنائية الفوتون للقناة الخضراء (GCaMP) والقناة الحمراء (TCA-RFP) مؤقتا والموضحة في الشكل 1A. نظرا ...
Access restricted. Please log in or start a trial to view this content.
Discussion
بالنظر إلى أن الأنشطة التلقائية تنشأ من العضو الحسي أو الجهاز العصبي السفلي وتنتقل إلى المنطقة الحسية الأولية من خلال مسار مكافئ لمسار الجهاز العصبي الناضج3 ، فمن الأهمية بمكان تحديد المنطقة الحسية الأولية وموقع الخلايا العصبية المصورة داخل المنطقة. في هذ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين مصالح مالية متنافسة يعلنونها.
Acknowledgements
تم دعم هذا العمل من قبل الجمعية اليابانية لتعزيز المنح العلمية في المعونة لمجالات البحث التحويلية (B) (22H05092 ، 22H05094) ومنح البحث العلمي 20K06876 ، AMED بموجب رقم المنحة 21wm0525015 ، مؤسسة تاكيدا للعلوم ، مؤسسة نايتو ، مؤسسة كاتو التذكارية للعلوم البيولوجية ، مؤسسة كوا لعلوم الحياة ، NIG-JOINT (24A2021) (إلى HM) ؛ والجمعية اليابانية لتعزيز المنح العلمية في المعونة لمنح البحث العلمي 19K06887 و 22K06446 ، وصندوق كوداما التذكاري للبحوث الطبية ، ومؤسسة أوهارا التذكارية ، ومؤسسة كاتو التذكارية للعلوم البيولوجية ، ومؤسسة تاكيدا للعلوم (إلى N.N-T.). نشكر الدكتور تاكوجي إيواساتو على فئران TCA-RFP.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
References
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340(2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245(2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679(2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173(2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1(2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942(2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143(2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106(2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved