توليد نظام استزراع أحادي الطبقة ثنائي الأبعاد مشتق من الإنتيرويد البقري للتطبيقات في البحوث الطبية الحيوية الانتقالية
In This Article
Summary
تظهر Enteroids كنموذج جديد لدراسة فسيولوجيا الأنسجة والفيزيولوجيا المرضية ، وتطوير الأدوية ، والطب التجديدي. هنا ، نصف نظام الثقافة المشتقة من الخلايا الأولية 2D المشتقة من الخلايا الأولية التي تسمح بالزراعة المشتركة مع أنواع خلايا الأنسجة ذات الصلة. يقدم هذا النموذج ميزة انتقالية لنمذجة أبحاث الجهاز الهضمي.
Abstract
يمكن لأنظمة زراعة الخلايا العضوية تلخيص التعقيد الذي لوحظ في الأنسجة ، مما يجعلها مفيدة في دراسة التفاعلات بين المضيف والممرض ، وتقييم فعالية الدواء وسميته ، والهندسة الحيوية للأنسجة. ومع ذلك ، قد يكون تطبيق هذه النماذج للأسباب الموضحة محدودا بسبب الطبيعة ثلاثية الأبعاد (3D) لهذه النماذج. على سبيل المثال ، يعد استخدام أنظمة الثقافة المعوية 3D لدراسة أمراض الجهاز الهضمي أمرا صعبا بسبب عدم إمكانية الوصول إلى تجويف الأمعاء ومواده المفرزة. في الواقع ، يتطلب تحفيز المواد العضوية ثلاثية الأبعاد بمسببات الأمراض إما الحقن المجهري اللمعي ، أو الاضطراب الميكانيكي للهيكل ثلاثي الأبعاد ، أو توليد المعوية القمية. علاوة على ذلك ، لا يمكن زراعة هذه الكائنات العضوية مع الخلايا المناعية واللحمية ، مما يحد من التحليل الميكانيكي المتعمق في الديناميات الفيزيولوجية المرضية. للتحايل على هذا ، قمنا بتحسين نظام زراعة أحادي الطبقة مشتق من الخلايا الأولية البقرية ثنائية الأبعاد (2D) ، مما يسمح بالزراعة المشتركة مع أنواع الخلايا الأخرى ذات الصلة. تم استزراع الخبايا اللفائفية المعزولة من الماشية البالغة السليمة لتوليد عضويات 3D تم حفظها بالتبريد للاستخدام في المستقبل. تم إنشاء طبقة أحادية 2D باستخدام المعوية ثلاثية الأبعاد التي تم إحياؤها والتي تم تمريرها وتعطيلها لإنتاج خلايا مفردة ، والتي تم زرعها على إدخالات زراعة خلايا transwell المغلفة بمستخلص الغشاء القاعدي ، وبالتالي فضح سطحها القمي. تم توصيف قطبية الطبقة الأحادية المعوية والتمايز الخلوي ووظيفة الحاجز باستخدام الفحص المجهري المناعي وقياس المقاومة الكهربائية عبر الظهارة. كشف تحفيز السطح القمي للطبقة الأحادية عن الوظيفة المتوقعة للطبقة الأحادية ، كما يتضح من إفراز السيتوكين من كل من المقصورات القمية والقاعدية. يحمل نموذج الطبقة الأحادية المشتقة من 2D المعوي الموصوف وعدا كبيرا في التحقيق في تفاعلات المضيف الممرض وعلم وظائف الأعضاء المعوي ، وتطوير الأدوية ، والطب التجديدي.
Introduction
تلعب النماذج الحيوانية في البحث دورا حاسما في تعزيز فهمنا للفيزيولوجيا المرضية للمرض وديناميكيات الاستجابة المناعية للمضيف أثناء العدوى ودعم تطوير استراتيجيات وقائية وعلاجية جديدة1،2،3،4. تدعم هذه النماذج اكتشاف الأبحاث والتقدم في وهي أساسية لتقدم أبحاث صحة الإنسان. لعقود من الزمان ، دعمت نماذج القوارض التقدم في آليات المناعة وأبحاث البيولوجيا الأساسية للأمراض البشرية3،5،6،7. في حين أن نماذج القوارض مهمة في الفحص وأبحاث التطوير المبكر ، تقدم النماذج الحيوانية الكبيرة مقارنة أكثر صلة في البحث عن الأمراض البشرية في كل من الاكتشاف المبكر ودراسات التطوير اللاحقة ، بما في ذلك الفعالية العلاجية واختبار السلامة1،3،4،5. تقدم الثروة الحيوانية مزايا واضحة مقارنة بنماذج القوارض لترجمة أكثر كفاءة للتطبيقات البشرية لبعض الأمراض ، بما في ذلك داء الكريبتوسبوريديوسيس ، السالمونيلا ، السل ، الفيروس المخلوي التنفسي ، وداء البروسيلات1،7،8. في الواقع ، تتطور هذه الأمراض وغيرها تلقائيا في الماشية ، والتي تشترك في العديد من الأمراض المماثلة والعمليات المناعية للبشر ، وكمجموعة مهجنة ، تحاكي الماشية عدم التجانس الجيني والبيئي الذي يؤثر على الاستجابات المناعية البشرية5،8،9،10. يمكن تعظيم فوائد نماذج الأبقار لأبحاث الأمراض المعدية من خلال استخدام نظام استزراع متطور أولا ثم تنفيذ الدراسات في الجسم الحي تدريجيا. يمكن أن يؤدي الاستخدام الأولي لنظام الاستزراع المشتق من الأبقار شديد التعقيد إلى تقليل عدد الدراسات على الحية بشكل كبير مع تحسين فرص نجاح البحوث الانتقالية والتطبيقية. يجب أن تلخص نماذج الاستزراع عمليات المرض على مستوى الأعضاء من أجل الصلاحية التنبؤية المثلى ، مع الاحتفاظ بالبيئة المكروية للأنسجة الأصلية مكانيا ووظيفيا.
الاستجابة المناعية المخاطية هي نظام متعدد الأوجه يتكون من حاجز عالي الكفاءة يتكون من الخلايا المعوية المعدية المعوية ومجموعات متنوعة من الخلايا المناعية الموجودة تحت سطح الغشاء المخاطي11. هذا النظام المعقد للغاية أمر بالغ الأهمية أثناء العدوى في الحفاظ على توازن الجهاز الهضمي وبدء الدفاعات المناعية ضد مسببات الأمراض المعوية11. التواصل بين الخلايا المعوية والخلايا المناعية الفطرية الكامنة يبدأ تطوير الاستجابات المناعية الوقائية ضد الكائنات الحية الدقيقة المسببة للأمراض. على هذا النحو ، فإن أنظمة الاستزراع المقارنة في مستوى تعقيدها ضرورية لإجراء تحقيق مثالي في تفاعلات مسببات الأمراض المعوية المضيفة وهي فعالة للغاية في فهم علم وظائف الأعضاء المعوي واكتشاف الأدوية وتطويرها12،13. المواد العضوية هي نظام استزراع قوي يشبه بنية ووظيفة نسيج المنشأ14,15. تسمح تعدد الخلايا لهذه النماذج بالتحقيق في دور مجموعات الخلايا المتنوعة والتفاعلات الخلوية المشاركة في الصحة المعوية والمرض12,14. ومع ذلك ، فإن النماذج العضوية المشتقة من الإنسان في البحث محدودة حاليا بسبب صعوبة الحصول على كمية كافية ونوعية متسقة من الخلايا الظهارية المعوية البشرية ومحدودية صلاحية الخلية في الثقافة. يمكن استخدام خطوط الخلايا الخالدة للحصول على غلات عالية من الثقافات المتماثلة في هذه النماذج باستمرار. ومع ذلك ، تفتقر الخلايا المحولة بطبيعتها إلى التنوع والتعقيد الوظيفي للخلايا الظهارية غير المحولة 16,17. تشمل مزايا استخدام المزارع المشتقة من أنسجة الأبقار كنموذج للتحقيق في أمراض الجهاز الهضمي وعلم وظائف الأعضاء السهولة التي يمكن بها الحصول على عينات الأنسجة باستمرار من المتبرعين الأصحاء ، وتحسين صلاحية الخلايا ، وزيادة التنوع الخلوي الذي لا يمكن تحقيقه إلا مع الأنسجة غير الخالدة. تكشف ترانسكريبتوميات الأنسجة المقارنة وتوصيف الكائنات العضوية المعوية عن أوجه تشابه في الجينات المتعامدة المحفوظة والإمكانات الخلوية بين البشر والماشية18. لذلك ، قد يكون نظام الاستزراع العضوي البقري المشتق مفيدا في التحقيق في الأمراض المعوية البشرية ، مع ترجمة النتائج بسهولة إلى الطب البشري.
يفصل البروتوكول الموصوف هنا منصة فعالة لتقييم استجابات المضيف لمسببات الأمراض المعوية أو المركبات وعلم وظائف الأعضاء المعوية باستخدام نظام زراعة الخلايا الأولية 2D المشتق من الأمعاء البقرية. على عكس المواد العضوية 3D ، تسمح أنظمة الثقافة 2D المتولدة على إدخالات transwell بزراعة مزدوجة للخلايا المعوية ذات الخلايا المناعية أو اللحمية ، مما يسمح بدراسة ديناميكيات مستوى الأنسجة. مع التطبيقات في البحوث الطبية الحيوية ، وتطوير الأدوية ، واختبار الفعالية ، يمكن لهذا النموذج ذي الصلة من الناحية الفسيولوجية أن يفيد صحة وتقدم كل من الماشية والناس على حد سواء.
Protocol
تم تنفيذ جميع البروتوكولات وفقا للمبادئ التوجيهية واللوائح المؤسسية والوطنية لرعاية.
1. إعداد الكاشف
ملاحظة: يسرد الجدول 1 المخزون والتركيزات النهائية للكواشف المستخدمة في هذه الدراسة.
- تحضير مخزن مؤقت لجمع العينات: امزج 1 لتر من محلول ملحي مخزن بالفوسفات المثلج البارد (PBS) يحتوي على البنسلين (100 وحدة / مل) ، والستربتومايسين (100 ميكروغرام / مل) ، والجنتاميسين (25 ميكروغرام / مل) ، والكاسبوفونجين (2.5 ميكروغرام / مل). قم بتخزين محلول المخزون عند 4 درجات مئوية.
- تحضير كاشف التفكك # 1: امزج 18.55 مل من المخزن المؤقت لجمع العينات (كما هو موضح في الخطوة 1.1) ، 1.422 مل من حمض الإيثيلين ديامينيتتراسيتيك (EDTA ، 0.422 م / درجة الحموضة 7.4) ، 20 ميكرولتر من محلول 1 M 1،4-Dithiothreitol (DTT) ، 4 ميكرولتر من محلول Y-27632 (5000x / 50 mM). يخزن المحلول في درجة حرارة 4 درجات مئوية.
- تحضير كاشف التفكك # 2: امزج 18.57 مل من مخزن التجميع المؤقت (كما هو موضح في الخطوة 1.1) ، 1.422 مل من EDTA (0.422 م / درجة الحموضة 7.4) ، 4 ميكرولتر من محلول Y-27632 (5000x / 50 mM). قم بتخزين المحلول في درجة حرارة 37 درجة مئوية.
- تحضير مخزون وسائط النمو المعوي: امزج 9.875 مل من وسط النمو العضوي بالإضافة إلى مكمل ، و 100 ميكرولتر من البنسلين (100 وحدة / مل) ، والستربتومايسين (100 ميكروغرام / مل) ، و 5 ميكرولتر من الجنتاميسين (25 ميكروغرام / مل) ، و 20 ميكرولتر من الكاسبوفونجين (2.5 ميكروغرام / مل). يخزن المحلول في درجة حرارة 4 درجات مئوية.
- تحضير مخزون وسائط التمايز المعوي: امزج 10 مل من وسط التمايز العضوي بالإضافة إلى الملحق ، و 100 ميكرولتر من البنسلين (100 وحدة / مل) ، والستربتومايسين (100 ميكروغرام / مل) ، و 5 ميكرولتر من الجنتاميسين (25 ميكروغرام / مل) ، و 20 ميكرولتر من كاسبوفونجين (2.5 ميكروغرام / مل). يخزن المحلول في درجة حرارة -20 درجة مئوية.
- تحضير وسائط الغسيل: امزج 48.45 مل من DMEM / F-12 1.1 متوسط (مع L-glutamine ، بدون HEPES) ، 1 مل من مكمل B-27 بدون فيتامين A (مخزون 50x) ، 500 ميكرولتر من البنسلين (100 وحدة / مل) ، ستربتومايسين (100 ميكروغرام / مل) ، 25 ميكرولتر من الجنتاميسين (مخزون 50 مجم / مل) ، و 25 ميكرولتر من caspofungin (مخزون 5 مجم / مل). يخزن المحلول في درجة حرارة 4 درجات مئوية.
- تحضير عازلة الطلاء: امزج 25 مل من DMEM: F12 وسائط كاملة بدون مثبطات و 25 مجم من ألبومين مصل الأبقار (BSA). يخزن المحلول في درجة حرارة 4 درجات مئوية.
2. عزل الخبايا المعوية من الأنسجة الكاملة (الشكل 1)
ملاحظة: تم إنشاء الأمعاء المعوية الدقيقة البقرية من الأنسجة اللفائفية التي تم الحصول عليها من هولشتاين البالغ الأصحاء (>2 سنة من العمر) من مصنع محلي لمعالجة لحوم البقر. تم استخدام متبرع واحد لهذه السلسلة من التجارب.
- تحضير عينات الأنسجة المعوية
- ضع عينات الأنسجة المعوية المحصودة ~ 10 بوصة (25 سم) في ~ 400 مل من مخزن جمع الثلج البارد (PBS + المضادات الحيوية / مضادات الفطريات) وعلى الثلج لنقله إلى المختبر.
- باستخدام المقص الجراحي (على سبيل المثال ، مقص المايونيز) والملقط (على سبيل المثال ، ملقط الملحق) ، قم بإزالة الدهون الزائدة والمساريق من عينة الأنسجة المعوية.
- قطع الأنسجة إلى قطعتين متساوية.
- افتح الأنسجة طوليا بالمقص الجراحي وشطف الأنسجة في برنامج تلفزيوني معقم.
- قم بإزالة الطبقة المخاطية للعينة المعوية برفق باستخدام جانب شريحة مجهر زجاجية معقمة وشطف الأنسجة باستخدام برنامج تلفزيوني جديد.
ملاحظة: تساعد هذه الخطوة على إزالة الزغابات وتساعد على زيادة نقاء كسور القبو في الخطوات اللاحقة. - لكل قطعة مقاس 5 بوصات (13 سم) ، قم بتقطيع الأنسجة إلى قطعتين مقاس 2.5 بوصة (6.5 سم) ثم قطع كل قطعة إلى 4 قطع صغيرة متساوية تقريبا لتسهيل تفكك الأنسجة.
- تفكك الأنسجة المعوية
- قم بإعداد حجم 20 مل من كاشف تفكك الأنسجة # 1 في أنبوب مخروطي معقم سعة 50 مل وقم بإيداع عينات الأنسجة الصغيرة في الأنبوب المخروطي حتى يؤدي إزاحة الحجم إلى تحريك الغضروف المفصلي من علامة 20 مل إلى علامة 35 مل على الأنبوب المخروطي.
- كرر الخطوة أعلاه لقطع عينة أنسجة الأمعاء الدقيقة المتبقية.
- ختم الأنابيب المخروطية مع parafilm ويهز يدويا الأنبوب المخروطي 10 مرات.
ملاحظة: طوال البروتوكول ، يجب أن يتم الاهتزاز اليدوي بطريقة متعمدة ولكن لطيفة. - ضع الأنابيب المخروطية أفقيا على الجليد في وعاء على منصة اهتزاز مدارية.
- هز الأنابيب المخروطية على الجليد في الحاوية لمدة 30 دقيقة بسرعة 80 دورة في الدقيقة (دورة في الدقيقة). كل 10 دقائق ، يهز الأنبوب المخروطي يدويا.
- قم بإعداد حجم 20 مل من كاشف تفكك الأنسجة المسخن مسبقا (37 درجة مئوية) # 2 (تمت صياغته على النحو الوارد أعلاه ، ولكن بدون DTT) في أنبوب مخروطي سعة 50 مل. قم بإيداع عينات الأنسجة من الأنابيب المخروطية التي تحتوي على كاشف التفكك # 1 في الأنابيب المخروطية التي تحتوي على كاشف التفكك # 2.
- ختم الأنابيب المخروطية مع parafilm ويهز يدويا الأنابيب المخروطية 10 مرات.
- ضع الأنابيب المخروطية في حمام مائي مهتز تم تسخينه مسبقا (37 درجة مئوية) ، مائلا بزاوية 60 درجة مئوية تقريبا ، ورجها عند 150 دورة في الدقيقة لمدة 10 دقائق ، مع الاهتزاز اليدوي بعد 5 دقائق ومرة أخرى بعد الحضانة الإجمالية لمدة 10 دقائق.
- عزل شظايا القبو
- تسمية 10 أنابيب مخروطية معقمة # 1 - # 10. أضف 20 مل من برنامج تلفزيوني معقم بارد إلى كل أنبوب مخروطي مسمى.
- انقل قطع الأنسجة من الأنابيب المخروطية التي تحتوي على كاشف التفكك # 2 إلى أنبوب مخروطي معقم جديد سعة 50 مل يحتوي على برنامج تلفزيوني بارد #1.
- هز الأنابيب المخروطية يدويا 10 مرات.
- أغلق الأنابيب المخروطية بالبارافيلم وضعها أفقيا على الجليد. هز الأنابيب المخروطية على شاكر مداري لمدة 10 دقائق عند 80 دورة في الدقيقة. بعد 10 دقائق ، يهز الأنبوب المخروطي # 1 يدويا 10 مرات. يعتبر هذا غسل # 1.
- انقل عينات الأنسجة برفق باستخدام زوج من الملقط الجراحي إلى الأنبوب المخروطي # 2.
- كرر الخطوات 2.3.2 - 2.3.4 ، وهذا يعتبر غسل # 2.
- كرر الغسيل حتى يغسل # 10.
- تحتوي المواد الطافية من كل غسلة على الخبايا التي سيتم استخدامها لتوليد المعوي. احتفظ بالأنابيب التي تحتوي على المواد الطافية عند 4 درجات مئوية حتى تكتمل جميع الغسلات ال 10.
- بعداكتمال الغسيل العاشر والتخلص من قسم الأنسجة ، قم بطرد طافات الأنابيب المخروطية # 6- # 10 عند 400 × جم لمدة 2 دقيقة عند 4 درجات مئوية لحبيبات الخبايا المعزولة.
ملاحظة: تحتوي الغسالات 6-10 على أنظف أجزاء من الخبايا السليمة ذات الحطام المحدود والخلايا المفردة. على هذا النحو ، يوصى باستخدام هذه الكسور فقط لتوليد المعوي ، ويتم التخلص من الغسلات السابقة (# 2- # 5)) - تخلص من المادة الطافية وأضف 4 مل من برنامج تلفزيوني طازج وبارد إلى الخبايا دون تعليق (وهذا يساعد على الحفاظ على الشظايا سليمة حتى الفحص المجهري).
- تقييم نقاء الخبايا المنفصلة لكل أنابيب مخروطية # 6- # 10 عن طريق الفحص المجهري.
- أضف 50 ميكرولتر من PBS إلى لوحة 384 بئر.
- أضف 10 ميكرولتر من تعليق القبو إلى PBS واستخدم عدسة هدف تكبير 40x لتحديد نقاء القبو وسلامته وعدده.
ملاحظة: رسم صليب على الجزء السفلي من اللوحة جيدا يجعل العد أسهل.
3. توليد خارج الجسم الحي ومرور الأمعاء اللفائفية البقرية (الشكل 2)
ملاحظة: سيتم استخدام الخبايا من الأنابيب المخروطية ذات الخبايا المعوية الأكثر نقاء وسليمة في المقايسات النهائية. بالنسبة لجميع الخطوات التي تتضمن الخبايا والمعوية ، يجب أن تكون أطراف الماصة وكاشطات الخلايا والأنابيب مغلفة مسبقا بمحلول الطلاء ، ويجب تجنب الفقاعات لمنع فقدان الخبايا. ما لم ينص على خلاف ذلك ، يجب استخدام طرف ماصة 1000 ميكرولتر لمنع تفتيت شظايا القبو.
- توليد المعوية من شظايا القبو
- اجمع بين أنقى كسور القبو (عادة # 6 - # 10) في أنبوب مخروطي واحد.
- جهاز طرد مركزي الأنبوب المخروطي الذي يحتوي على الخبايا عند 400 × جم لمدة 2 دقيقة عند 4 درجات مئوية.
- تخلص من المادة الطافية عن طريق شفطها باستخدام ماصة وإعادة تعليق حبيبات القبو في وسائط الغسيل.
- أجهزة الطرد المركزي كما في الخطوة 3.1.2. صب المادة الطافية وإضافة 2 مل من وسائط الغسيل إلى حبيبات القبو.
- احسب عدد الخبايا كما هو موضح في الخطوة 2.3.11.1.
- أجهزة الطرد المركزي كما في الخطوة 3.1.2 لتكسير الخبايا ، والتخلص من المواد الطافية ، وإعادة التعليق في مصفوفة خارج الخلية للغشاء القاعدي المثلج البارد بنسبة 100٪ لتحقيق تركيز يبلغ حوالي 400 سرداب / 100 ميكرولتر.
ملاحظة: من المهم إذابة BME بشكل صحيح عند 4 درجات مئوية لأن التغيرات في درجة الحرارة تغير اتساقها. يمكن منع BME من التصلب قبل الأوان باستخدام كتلة التبريد وأطراف الماصة المبردة مسبقا.- قد يتطلب استخدام تركيبة مصفوفة غشاء قاعدي أخرى تخفيف BME عند إنشاء القباب. راجع تعليمات الشركة المصنعة الخاصة ب BME المستخدمة.
- ماصة صعودا وهبوطا لتعليق الخبايا تماما في BME.
- اصنع قباب crypt-BME عن طريق سحب 50 ميكرولتر من تعليق crypt-BME ببطء على لوحة زراعة أنسجة ذات 6 آبار على صفيحة تسخين مضبوطة على 37 درجة مئوية مع ما يصل إلى 8 قباب / بئر.
ملاحظة: يجب تسخين اللوحة المكونة من 6 آبار مسبقا في حاضنة عند 37 درجة مئوية طوال الليل قبل طلاء القباب. - احتفظ بلوحة 6 آبار على لوحة التسخين لمدة 1 دقيقة قبل تحريك اللوحة بعناية إلى حاضنة 37 °C ، 5٪ CO2 .
- بعد 2 دقيقة ، اقلب اللوحة المكونة من 6 آبار بحيث يكون الغطاء متجها لأسفل واحتضانها لمدة 30 دقيقة إضافية للسماح للقباب بالبلمرة.
- بعد 30 دقيقة ، أضف بعناية 3 مل من وسائط النمو المعوي بدرجة حرارة الغرفة (RT) المكملة ب 10 ميكرومتر SB202190 و 0.5 ميكرومتر LY2157299 و 10 ميكرومتر Y-27632 إلى الآبار التي تحتوي على قباب.
- احتضان في 37 درجة مئوية ، 5 ٪ CO2.
- قم بإزالة الوسائط واستبدلها بوسائط نمو معوي جديدة تستكمل بمثبطات كل 2-3 أيام.
- مرور المعوية
- بعد 7-10 أيام ، تأكد من أن الخبايا قد شكلت معويات ثلاثية الأبعاد مع العديد من الهياكل الناشئة ، كما في الشكل 2E ، وجاهزة للمرور.
- تخلص من الوسائط من الآبار التي تحتوي على قباب.
- لكل 4 قباب لكل بئر ، أضف 1 مل من محلول تفكك الخلايا غير الأنزيمية المثلج المكمل ب 10 ميكرومتر Y-27632 إلى كل قباب تحتوي على بئر.
- باستخدام مكشطة الخلايا المطلية مسبقا ، افصل القبة برفق عن لوحة زراعة الأنسجة.
- اجمع المعوية في أنبوب مخروطي سعة 15 مل وسحنها عن طريق السحب لأعلى ولأسفل 10 مرات.
- احتضان الأنبوب المخروطي الذي يحتوي على المعوية المجزأة في RT على شاكر مداري عند 80 دورة في الدقيقة لمدة 10 دقائق.
- أضف 10 مل من وسائط الغسيل المثلجة مع 10 ميكرومتر Y -27632 إلى المعوية.
- جهاز طرد مركزي الأنبوب المخروطي عند 300 × جم لمدة 5 دقائق في RT.
- تخلص من المادة الطافية وأعد تعليق الحبيبات في 10 مل من وسائط الغسيل الطازجة وانقلها إلى أنبوب مخروطي جديد سعة 15 مل.
- جهاز طرد مركزي الأنبوب المخروطي عند 300 × جم لمدة 5 دقائق في RT.
- تخلص من المادة الطافية وأعد تعليق الحبيبات في 1 مل من وسائط النمو المعوي في أنبوب طرد مركزي دقيق سعة 1.5 مل.
- جهاز طرد مركزي أنبوب الطرد المركزي الدقيق عند 300 × جم لمدة 5 دقائق في RT وتخلص من المادة الطافية.
- أعد تعليق الحبيبات المعوية في BME المثلج 100٪ واتبع الخطوات 3.1.6-3.1.13.
- إعادة مرور المعوية كل 7 أيام. قد تختلف أوقات التمدد بسبب الكثافة والجدوى ومدى التبرعم. تشير الهياكل الناشئة المتعددة التي تخلق هياكل معوية كبيرة إلى الحاجة إلى المرور المعوية.
- الحفظ بالتبريد للمعوية
- للحفظ بالتبريد ، تأكد من أن المعوية لا تمر أكثر من خمس مرات في الثقافة.
ملاحظة: لم يتم اختبار هذا تجريبيا ويستند إلى ملاحظة المؤلفين بأن المقاطع اللاحقة قد قللت من الجدوى وأسفرت عن نتائج متغيرة. - لحصاد المعوية ، استخدم المخزن المؤقت للتفكك كما هو موضح في الخطوات 3.2.2-3.2.9.
ملاحظة: فصل المعوية ميكانيكيا باستخدام ماصة 5 مل. - احسب عدد شظايا المعوي كما هو موضح في الخطوة 2.3.11.1.
- جهاز طرد مركزي الأنبوب المخروطي عند 300 × جم لمدة 5 دقائق في RT.
- تخلص من المادة الطافية وأعد تعليق شظايا المعوي في وسائط الحفظ بالتبريد المكملة ب 10 ميكرومتر Y-27632 لتحقيق تركيز ~ 2000 شظية معوية / مل و aliquot 1 مل في cryovials المسمى مسبقا.
- ضع الكريوفيال في حاوية تجميد خاضعة للرقابة واحفظها في درجة حرارة -80 درجة مئوية طوال الليل.
- نقل cryovials إلى النيتروجين السائل في مرحلة البخار للتخزين على المدى الطويل.
- للحفظ بالتبريد ، تأكد من أن المعوية لا تمر أكثر من خمس مرات في الثقافة.
- إنعاش شظايا الخبايا المعوية
- ضع صفيحة 6 بئر طوال الليل داخل الحاضنة.
- قم بطلاء أنبوب سعة 5 مل مسبقا ب 5 مل من وسائط الطلاء.
- قم بإزالة الكريوفيال من تخزين النيتروجين السائل.
- على الفور ، بمجرد إذابتها ، انقل الخبايا من cryovial إلى أنبوب 5 مل المطلي مسبقا. اشطف المبرد باستخدام وسائط الغسيل وأضفه إلى أنبوب سعة 5 مل. تجنب الفقاعات.
- ارفع مستوى الصوت إلى 5 مل باستخدام وسائط الغسيل وأجهزة الطرد المركزي عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أثناء الطرد المركزي ، قم بطلاء أنبوب سعة 1.5 مل مسبقا بوسائط طلاء.
- بعد الطرد المركزي ، اسكب المادة الطافية ، وأعد تعليق الحبيبات في الوسائط المتبقية في الأنبوب ، وانقلها إلى أنبوب 1.5 مل المطلي مسبقا. اغسل الأنبوب سعة 5 مل بوسائط الغسيل وانقله إلى أنبوب سعة 1.5 مل. أجهزة الطرد المركزي عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- ارفع مستوى الصوت إلى 1.5 مل باستخدام وسائط النمو المعوية.
- أجهزة الطرد المركزي على النحو الوارد أعلاه (الخطوة 3.4.7) ، ونضح بعناية.
- خذ BME من 4 درجات مئوية وضعه على كتلة الثلج / الجليد.
- أعد تعليق الحبيبات المعوية في BME المثلج 100٪ واتبع الخطوات 3.1.6- 3.1.12.
- قم بتغيير الوسائط كل 2-3 أيام.
4. توليد وتقييم أحاديات الطبقات 2D من المعوية 3D
ملاحظة: كما هو مذكور أعلاه ، بالنسبة لجميع الخطوات التي تتضمن الخبايا والمعوية ، يجب طلاء أطراف الماصة وكاشطات الخلايا والأنابيب مسبقا بمخزن الطلاء المؤقت ، ويجب تجنب الفقاعات لمنع فقدان الخبايا.
- إعداد إدراج transwell لتشكيل أحادي الطبقة 2D
- ضع الحشوات في لوحة محول زراعة الأنسجة المكونة من 24 بئرا وقم بتغطية الجانب القمي مسبقا من إدخالات زراعة الخلايا PET 24-well 1 ميكرومتر مع 100 ميكرولتر من تخفيف 1:15 من BME في وسائط النمو المعوي. قم دائما بتغطية ملحق إضافي سيتم استخدامه كعنصر تحكم عند أخذ قياسات سلامة الحاجز.
- ضع الملحق المطلي في لوحة محول زراعة الأنسجة 24 بئرا في الحاضنة.
ملاحظة: يجب استخدام محول معين أو لوحة زراعة الأنسجة المصاحبة مع إدخالات البئر. - احتضان حشوات الاستزراع عند 37 درجة مئوية ، 5٪ CO2 لمدة 1 ساعة للسماح بالبلمرة.
ملاحظة: يمكن ختم الآبار المغلفة ب BME باستخدام parafilm وتخزينها في 4 °C لمدة تصل إلى 1 أسبوع إذا لم يتم استخدامها على الفور. - في نهاية الحضانة ، نضح وسط الثقافة المعوية 3D.
- تفكك المعوية 3D
- قم بإنشاء طبقات أحادية معوية ثنائية الأبعاد من شظايا معوية محفوظة بالتبريد تم إنعاشها وطلائها وزراعتها كما هو موضح أعلاه في القسم 3.1 لتشكيل معوية ثلاثية الأبعاد. قم بتمرير المعوية المذابة مرتين على الأقل ، مع استزراع الممر الأخير لمدة لا تقل عن 5 أيام قبل المعالجة لتوليد ثقافات أحادية الطبقة 2D.
- حصاد المعوية عن طريق إضافة وسائط الغسيل الجليدية الباردة المكملة ب 10 ميكرومتر Y-27632 إلى القباب المعوية (استخدم حوالي 1 مل من مخزن التفكك المؤقت ل 4 قباب)
- افصل القباب بمكشطة خلوية واجمعها في أنبوب مخروطي سعة 15 مل.
- سحن 30 مرة باستخدام طرف ماصة 1 مل لتوليد شظايا معوية.
- سحن 40 مرة بطرف ماصة 200 ميكرولتر لمزيد من تفتيت الشظايا المعوية.
- ارفع حجم الأنبوب المخروطي سعة 15 مل مع شظايا معوية إلى 10 مل باستخدام وسائط الغسيل الباردة الثلجية.
- جهاز طرد مركزي الأنبوب المخروطي عند 300 × جم لمدة 5 دقائق في RT.
- نضح المادة الطافية ، بما في ذلك طبقة BME ، مع الحرص على عدم إزعاج الحبيبات المعوية.
ملاحظة: ستظهر طبقة BME كطبقة جيلاتينية غائمة فوق الحبيبات مباشرة. - لكل 4 قباب ، أعد تعليق الحبيبات في 1 مل من إنزيم TrypLE Express الذي تم تسخينه مسبقا والمكمل ب 10 ميكرومتر من Y-27632.
- يضاف خليط enteroid-TrypLE إلى طبق من 24 بئرا ويحتضن عند 37 درجة مئوية ، 5٪ CO2 لمدة 10 دقائق.
- بعد 10 دقائق ، قم بسحب خليط enteroid-TrypLE 40 مرة باستخدام ماصة 1 مل لمزيد من تجزئة الأمعاء.
- بعد ذلك ، يتم شظايا الماصة 40 مرة باستخدام ماصة 200 ميكرولتر لتقسيم الأجزاء إلى خلايا مفردة.
- باستخدام حقنة 3 مل أو 5 مل مع إبرة معقمة 22-G متصلة ، قم بنضح وتوزيع تعليق الخلية 4 مرات لتحقيق تعليق خلية واحدة.
- راقب تفكك الخلايا عن طريق الفحص المجهري كما هو موضح في الخطوة 2.3.11.1 ، حتى يتم تقسيم 80٪ من المعوية إلى خلايا مفردة.
- اجمع معلق الخلية في أنبوب مخروطي سعة 15 مل وقم بإخماد التفاعل الأنزيمي عن طريق إضافة حجم 4x من وسائط الغسيل المكملة ب 10٪ FBS.
- قم بتصفية المعوية من خلال مصفاة خلية 40 ميكرومتر مغلفة مسبقا مرتين في أنبوب مخروطي سعة 50 مل.
- بيليه الخلايا المفردة عن طريق الطرد المركزي للأنبوب المخروطي عند 300 × جم لمدة 5 دقائق.
- 2D البذر أحادي الطبقة على إدراج transwell.
- صب المادة الطافية وإعادة تعليق الحبيبات في حجم صغير (~ 600 ميكرولتر) من وسائط النمو العضوية المكملة بمصل بقري جنيني بنسبة 20٪ (FBS) في RT.
- حدد كثافة الخلايا المعوية وصلاحيتها باستخدام طريقة استبعاد صبغة Trypan Blue أو مقياس الدم أو عداد الخلايا الآلي. ومن المتوقع أن يبلغ متوسط الجدوى 75٪.
- قم بإزالة محلول الطلاء الزائد المطبق في الخطوة 1.3 بعناية من ملحق زراعة الخلية قبل بذر الخلايا مباشرة.
- قم بزرع الخلايا المفردة عند 1 × 105 خلايا بحجم 200 ميكرولتر لكل إدراج على السطح القمي لإدراج زراعة الخلايا المطلي مسبقا.
- أضف 700 ميكرولتر من الوسائط الكاملة المكملة ب 20٪ FBS إلى الجانب القاعدي من ملحق زراعة الخلايا.
- قم بمناورة اللوحة 10 مرات على شكل الرقم 8 للسماح للخلايا بالانتشار بالتساوي فوق الإدخال.
- احتفظ بالطبق على الطبق أكثر دفئا لمدة 10 دقائق في خزانة السلامة البيولوجية.
- احتضان اللوحة عند 37 درجة مئوية و 5٪ CO2.
- بعد 48 ساعة ، استبدل الوسائط الموجودة على المقصورات القمية والقاعدية بوسائط نمو معوية جديدة مكملة ب 20٪ FBS ومثبطات.
- في اليوم الثالث ، قم بإزالة الوسائط من المقصورات القمية والقاعدية ، واغسل الملحق بعناية باستخدام 1x PBS ، واستبدله بوسائط التمايز المعوي المكملة بالمثبطات فقط.
- قم بتغيير الوسائط في كلا المقصورتين كل 2-3 أيام.
- القياس الكمي لسلامة الحاجز الظهاري والتقاء الطبقة الواحدة
ملاحظة: يمكن تقييم سلامة الحاجز باستخدام مقياس الفولتوم الظهاري لقياس المقاومة الكهربائية عبر الظهارة (TEER).- قم بإزالة لوحة ثقافة البئر من الحاضنة واتركها تتوازن عند RT لبضع دقائق في خزانة السلامة الحيوية.
- تأكد من تكييف أقطاب STX2 مسبقا ومعايرة مقياس الفولتوم إلى 1000Ω وفقا لتعليمات الشركة المصنعة.
- أدخل العصا الطويلة للمسبار في المقصورة القاعدية والنهاية القصيرة في المقصورة القمية لثقافة الخلايا الظهارية المتنقلة. احرص على عدم تعطيل الطبقة الأحادية أو إتلاف الملحق.
- بمجرد الاستقرار ، سجل 3 قياسات TEER لكل إدخال transwell ، بما في ذلك الإدراج بدون خلايا. خذ متوسط القياسات لكل إدراج.
- احسب قيمة TEER المصححة عن طريق طرح متوسط قياس البئر الفارغ من متوسط قياسات الآبار التجريبية ثم ضربها في مساحة سطح الملحق لتحديد مقاومة الحاجز الظهاري (TEER [Ω.cm2] = [طبقة Rcell - Rblank] × المساحة).
النتائج
تتمثل الخطوة الأولى في توليد طبقات أحادية مشتقة من الأمعاء ثنائية الأبعاد في تحضير قسم الأنسجة المعوية التي يتم حصادها (الشكل 1 أ) لتفكك الأنسجة. يتم ذلك عن طريق إزالة الدهون المرفقة والمساريق من الأنسجة (الشكل 1 ب) ، متبوعا بقطع الأنسجة طوليا لكشف سطح التجويف بحيث يمكن إزالة الطبقة المخاطية للأمعاء عن طريق الكشط اللطيف باستخدام شريحة زجاجية. ثم يتم قطع الجزء المعوي المحصود إلى أقسام أنسجة أصغر تدريجيا (الشكل 1 ج) لزيادة سهولة التفكك. ثم يتم فصل الخبايا عن الأنسجة تحت المخاطية الأساسية باستخدام سلسلة من الغسلات التي تتكون من مخازن الاستخلاب (الشكل 1D ، E) و PBS. ثم يتم تضمين الخبايا المعوية المعزولة (الشكل 1F) في قباب مصفوفة الغشاء القاعدي (الشكل 2A) ويتم استزراعها لعدة أيام لتوليد معوية ثلاثية الأبعاد. من قسم 10 بوصة من الدقاق البقري ، يمكن عزل ما يقرب من 900000 سرداب واستخدامها لتشكيل المعوي. بعد بضع ساعات فقط في الثقافة ، تبدأ الخبايا المطلية في الاستطالة وتتطور إلى طبقات معوية (الشكل 2 ب). بعد يومين ، يمكن ملاحظة تجويف محدد جيدا (الشكل 2C) ، مع ملاحظة الهياكل الناشئة في وقت مبكر من اليوم 4 في الثقافة (الشكل 2D). بحلول اليوم 7 ، تطورت المعوية الناضجة (الشكل 2E). يوضح تلطيخ التألق المناعي ل 3D المعوي البالغ من العمر 7 أيام وجود سلالات خلايا مختلفة. يوضح الفحص المجهري البؤري للمعوية توطين صبغة DAPI النووية ، وبروتين E-cadherin عند تقاطع adherens ، وتلطيخ Chromogranin-A (Chr-A) الذي يظهر وجود خلايا الغدد الصماء المعوية ، والليزوزيم (LYZ) الذي يوضح خلايا Paneth ، و Cytokeratin-18 (CK-18) الذي يمثل خلايا الخلايا المعوية في الشكل 3. بعد 7-10 أيام في الثقافة ، يجب تمرير المعوية للسماح بمزيد من التوسع ومنع الاكتظاظ. تم تحديد الوقت الأمثل لمرور المعوية ليكون 7-10 أيام بعد عزل القبو الأولي الأولي ويعتمد في النهاية على صحة ومعدل نمو المعوية في الثقافة. كثافة البذر المثلى لتحقيق مورفولوجيا المعوي المطلوب وصلاحيته ، كما هو موضح في الشكل 2E ، هي 400 سرداب لكل قبة. يمكن بسهولة حفظ المعويدات بالتبريد ، وتتعافى شظايا الأمعاء المذابة تماما للاستخدام التجريبي بعد مرورين بعد الذوبان. والجدير بالذكر أنه يوصى بمرورين على الأقل من ثقافة القبو الأولية قبل الحفظ بالتبريد.
من أجل إنتاج طبقة أحادية مشتقة من 2D المعوي ، يتم حصاد المعوية ثلاثية الأبعاد وعلى مدى سلسلة من الخطوات ، يتم سحنها ميكانيكيا في وجود محلول تفكك (الشكل 4 أ) في خلايا مفردة. يمكن بعد ذلك زرع هذه الخلايا المفردة على ملحق ترانسويل تم طلاءه مسبقا بمحلول وسائط مصفوفة الغشاء القاعدي. في المتوسط ، يمكن زرع أربعة transwells من أربع قباب معوية 3D. وبالتالي فإن عدد المعويدات المعوية 3D المعالجة يعتمد على عدد عمليات النقل اللازمة للتجربة. يمكن أن يؤدي طلاء الخلايا المفردة بكثافة بذر تبلغ 1 × 105 واستزراعها في البداية بوجود 20٪ FBS (الشكل 4B-D) إلى توليد طبقة أحادية متقاربة في أقل من أسبوع واحد. يمكن مراقبة الالتقاء التدريجي للطبقة الأحادية ثنائية الأبعاد في الثقافة بمرور الوقت باستخدام المجهر الضوئي (الشكل 4E ، F). يمكن أن تؤكد قياسات المقاومة الكهربائية عبر الظهارة (TEER) التقاء وتوصيف سلامة الحاجز الظهاري بمرور الوقت واستجابة للتحفيز التجريبي (الشكل 5 أ). في المتوسط ، بعد سبعة أيام في الثقافة ، سيكون للطبقة الأحادية المتقاربة بنسبة 100٪ تقريبا قيمة TEER المقابلة ~ 1500 Ω · سم2. يوضح التقييم الطولي لقيم TEER أحادية الطبقة المعوية ثنائية الأبعاد زيادة مطردة في قيم TEER على مدار سبعة أيام ، حيث وصلت إلى متوسط قيمة قصوى يبلغ 1546 Ω سم2 قبل أن تنخفض بأقل قيمة تبلغ 11.5 Ω سم2 تم الحصول عليها في اليوم الثاني عشر (الشكل 5B). يشير وضع العلامات المناعية للطبقات الأحادية المتمايزة إلى أن صفائح ظهارية معوية سليمة ومنظمة ومستقطبة تتشكل باستخدام هذا البروتوكول (الشكل 6). يوضح الفحص المجهري متحد البؤر للطبقة الأحادية 2D الملطخة توطين صبغة DAPI النووية ، و E-cadherin ، وتلطيخ F-actin (الشكل 6A-D). يظهر الفحص المجهري الفلوري للطبقة الأحادية 2D السمات المميزة للخلايا الظهارية المعوية المتمايزة مع تلطيخ Chromogranin-A (Chr-A) الذي يظهر وجود خلايا الغدد الصم المعوية ، والليزوزيم (LYZ) الذي يوضح خلايا Paneth ، و Cytokeratin-18 (CK-18) يشير إلى سلالات الخلايا المعوية (الشكل 6E-L). تظهر نمذجة Z-stack الاستقطاب المتوقع لثقافة 2D أحادية الطبقة مع ترسب مميز ل F-actin الموجود في الزغابات الدقيقة التي تغطي الجانب القمي للخلايا المعوية المتمايزة و E-cadherin ، وهو بروتين يقع عند تقاطعات adherens المتباعدة بين الخلايا الظهارية (الشكل 6M).
يمكن تقييم وظيفة الطبقة الأحادية عن طريق التحفيز القمي بمكونات مختلفة ، بما في ذلك روابط أو مسببات الأمراض المستقبلات الشبيهة بالحصيلة (TLR) ، تليها كمية السيتوكين لطاف مزارع الخلايا التي يتم حصادها من المقصورات القمية والقاعدية. في الواقع ، عندما يتم تحفيز الجانب القمي للطبقة الأحادية لمدة 24 ساعة باستخدام ناهض TLR 1/2 Pam3csk4 في اليوم الرابع من الثقافة ، لوحظ زيادة إنتاج السيتوكين في كلا الجزأين مقارنة بالطبقات الأحادية غير المعالجة (الشكل 7 أ ، ب).
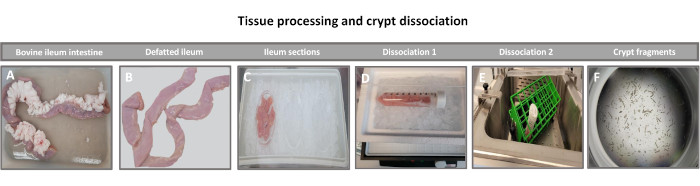
الشكل 1: عزل سرداب الأمعاء البقرية عن الماشية البالغة السليمة. صور توضح معالجة الأنسجة ل (أ) دقاق الماشية البالغ الكامل ، (ب) الدقاق منزوع الدهن ، (ج) الدقاق مقسم إلى قطع 2.5 بوصة (6.3 سم) في PBS على الجليد ، (د) أقسام الأنسجة اللفائفية في مخزن التفكك # 1 عند 4 درجات مئوية ، و (ه) في مخزن التفكك 2 في حمام مائي مهتز عند 37 درجة مئوية ، و (F) شظايا سرداب لفائفي معزولة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
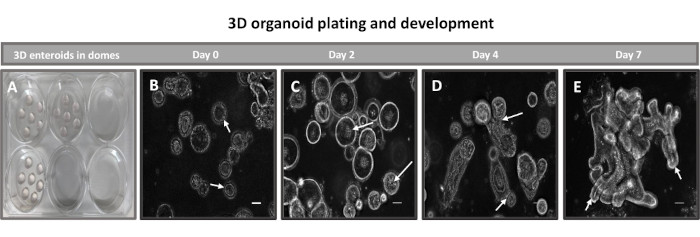
الشكل 2: تطور الأمعاء اللفائفي 3D البقري الأساسي في مصفوفة الغشاء القاعدي. صور تمثيلية للقباب المعوية ثلاثية الأبعاد (A) التي تم إنشاؤها في لوحة زراعة الأنسجة المكونة من 6 آبار وتطور المعوي ثلاثي الأبعاد (B-E) من الأيام 0 و 2 و 4 و 7 في الثقافة. شريط المقياس = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
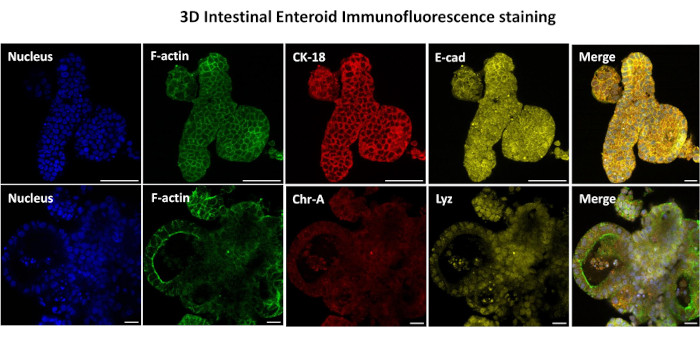
الشكل 3: تظهر الحلقات المعوية ثلاثية الأبعاد تلطيخ نسب الخلايا الطلائية. تظهر الصور التمثيلية للمعوية ثلاثية الأبعاد بعد 7 أيام في الثقافة وجود صبغة نووية ، F-actin ، cytokeratin-18 (CK-18) ، Chromogranin-A (Chr-A) ، Ecadherin (E-cad) ، Lysozyme (Lyz) وتراكب الصور (Merge). شريط مقياس 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
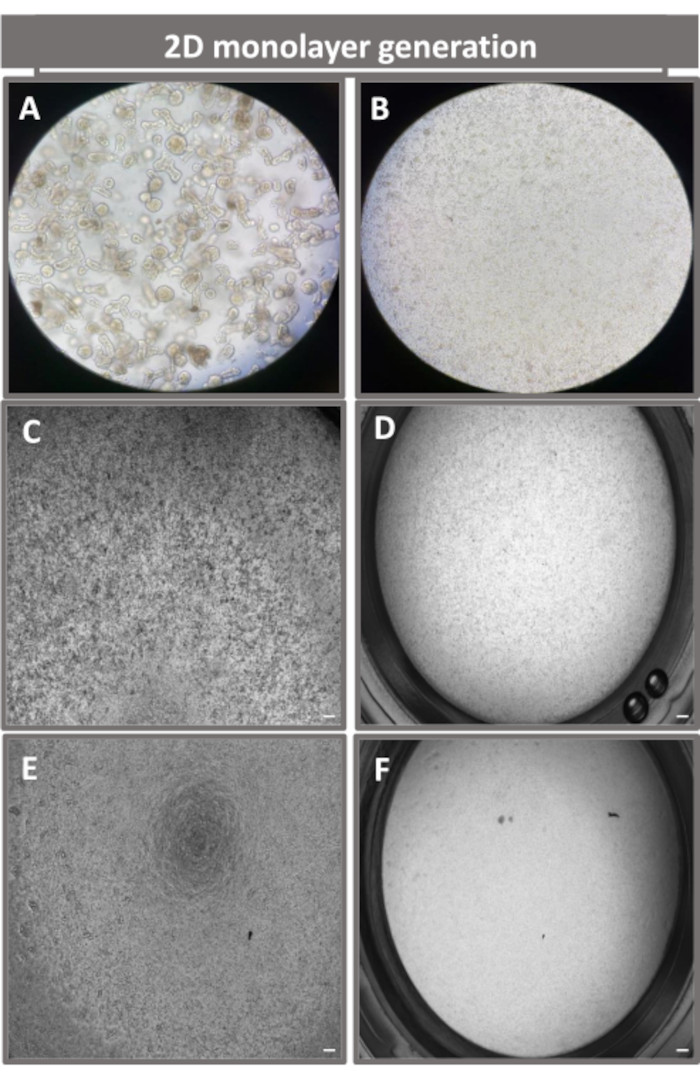
الشكل 4: إنشاء طبقة أحادية مشتقة من الأمعاء 2D من الأمعاء اللفائفية. صور تمثيلية ل (A) شظايا معوية ثلاثية الأبعاد في محلول التفكك استعدادا للبذر أحادي الطبقة ، وخلايا مفردة مطلية على ملحق transwell بكثافة بذر 1 × 105 تم تصويرها في اليوم 0 باستخدام (B) الضوء ، و (C) تباين الطور ، و (D) المجهر الميداني الساطع ، وتطوير أحادي الطبقة على إدخالات transwell التي تم تصويرها في اليوم الخامس باستخدام تباين الطور (E) و (F) المجهر المجال الساطع. 40x التكبير وشريط المقياس = 50 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
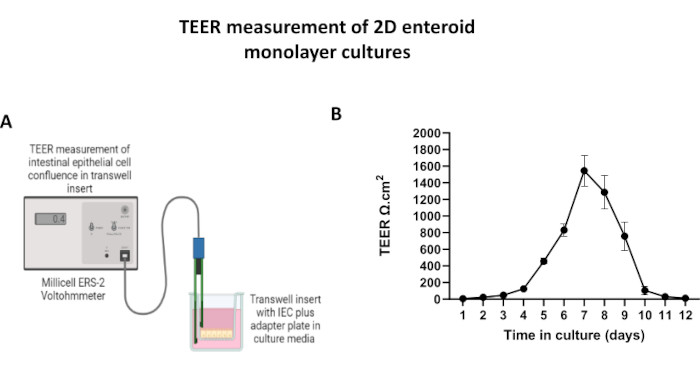
الشكل 5: قياسات المقاومة الكهربائية عبر الظهارة (TEER) للطبقة الأحادية المشتقة من 2D المعوي على إدخالات البئر . (أ) رسم تخطيطي لكيفية الحصول على قياسات TEER للطبقة الأحادية للخلية الظهارية المعوية ثنائية الأبعاد (IEC) باستخدام أقطاب عود تناول الطعام STX2 لمقياس الفولتومتر ، (ب) المراقبة الطولية لقياسات TEER أحادية الطبقة ثنائية الأبعاد على مدار 12 يوما في زراعة الخلايا. تمثل كل نقطة بيانات متوسط قيمة TEER والخطأ المعياري للمتوسط (SEM) الذي تم الحصول عليه من نسختين تقنيتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
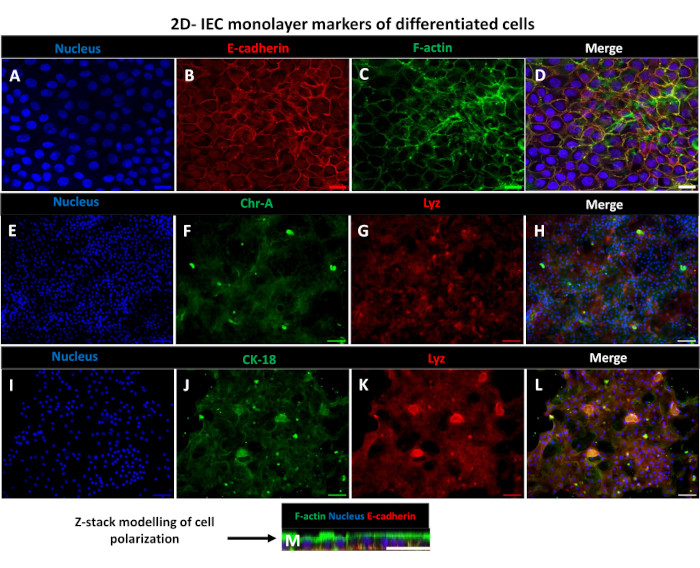
الشكل 6: تتطور الطبقات الأحادية المتمايزة المشتقة من 2D المعوي على إدخالات transwell إلى صفائح ظهارية معوية مستقطبة. (أ-م) صور مناعية تمثيلية لطبقة أحادية مشتقة من 2D معوي على إدراج transwell بعد 5 أيام في الثقافة تظهر (A) النواة (الأزرق) ، (B) E-cadherin (الأحمر) ، (C) F-actin (الأخضر) و (D) تراكب الصور 3 (دمج) ، (E ، I) صبغة نووية ، (F) Chromogranin-A ، (J) Cytokeratin-18 ، (G ، K) الليزوزيم ، و (H ، L) دمج الصور. (M) نمذجة Z-stack توضح توزيع نفس بروتينات علامة الخلية الظهارية للورقة أحادية الطبقة 2D. تم الحصول على الصور من 2 النسخ المتماثلة البيولوجية. شريط المقياس = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
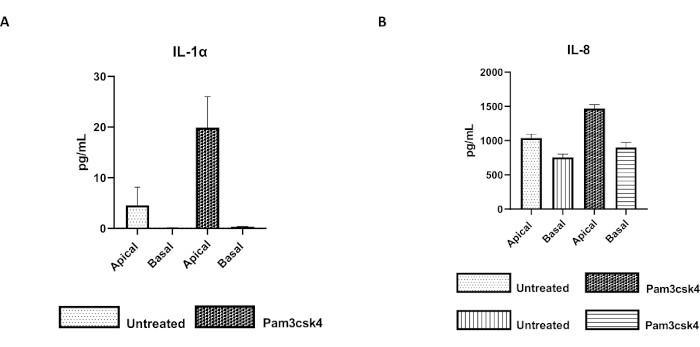
الشكل 7: الطبقات الأحادية المشتقة من الأمعاء 2D الأولية البقرية على إدخالات البئر نشطة وظيفيا. إفراز السيتوكين الطافي لثقافة الخلايا القمية والقاعدية ل (A) IL-1α ، و (B) IL-8 بواسطة 2D أحادي الطبقات على إدخالات البئر بعد 5 أيام في المزرعة التي لم يتم علاجها أو تحفيزها باستخدام Pam3csk4 لمدة 24 ساعة. تمثل البيانات متوسط مستويات السيتوكين و SEM من الطبقات الأحادية المشتقة من المخزونات المجمدة من الخبايا من واحد وثلاث تجارب مستقلة. تم قياس كمية السيتوكينات باستخدام مقايسة تعدد الإرسال القائمة على الخرز (جدول المواد) وفقا لتعليمات الشركة الصانعة وتحليلها على وحدة تعدد إرسال مدمجة (جدول المواد) وبرنامج تركيب منحنى المقايسة المناعية (جدول المواد). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: المخزون والتركيزات النهائية للكواشف. الرجاء الضغط هنا لتنزيل الجدول.
Discussion
يصف البروتوكول المقدم هنا نموذجا ذا صلة من الناحية الفسيولوجية للتحقيق في فسيولوجيا الأمعاء والاضطرابات المعوية. وصفت العديد من المجموعات البحثية جيل الثقافات المعوية البقرية ، بما في ذلك 2D monolayers16،19،20،21،22،23،24. في حين أن التوليد أحادي الطبقة لا يمثل تحديا تقنيا بشكل علني ، إلا أن الخطوات التي تستغرق عدة دقائق ضرورية في تطوير ثقافات ناجحة باستمرار. على هذا النحو ، فإن استنساخ أحادي الطبقات 2D باستخدام الأساليب الموصوفة بإيجاز في الأدبيات المنشورة يمكن أن يكون تحديا للباحث المبتدئ في مجال المواد العضوية. تم تكييف البروتوكول الموصوف هنا من هذه البروتوكولات وتلك المنشورة في الأنواع الأخرى ، مما يوفر دليلا خطوة بخطوة لتوليد أحادي الطبقة على إدخالات البئر التبادلية القابلة للتكرار بشكل كبير.
يمكن بسهولة تعديل البروتوكول المبين هنا ليناسب الأهداف المحددة للتصميم التجريبي أو توافر الكواشف. في الواقع ، باتباع هذا البروتوكول ، يمكن تحقيق الثقافات الناجحة عن طريق زرع طبقة أحادية بكثافة خلية أقل (على سبيل المثال ، 2.5 × 104) أو في حالة عدم وجود FBS ، كما هو موضح في منشورات أخرى24. ومع ذلك ، قد يتطلب تغيير هذه المعلمات زيادة الثقافة لإنشاء طبقة أحادية متقاربة. على هذا النحو ، إذا كانت هناك عوامل أخرى جزء لا يتجزأ من تصميم الدراسة ، بما في ذلك الثقافة المشتركة مع الخلايا المناعية ، تملي مسارا زمنيا محددا للتجربة ، فيمكن تغيير كثافة البذر حسب الحاجة. في حين يمكن استبدال تركيبات الغشاء القاعدي الأخرى بدلا من تلك المستخدمة في هذا البروتوكول لتوليد 3D enteroids و 2D monolayers ، فإن هذه ستتطلب بعض التحسين لتحديد النسبة المثلى للغشاء القاعدي إلى الوسائط.
تطبيق إدراج transwell في المنهجية الموصوفة له العديد من الفوائد على نمو أحادي الطبقة على الأواني البلاستيكية التقليدية والثقافات المعوية 3D. بالمقارنة مع لوحات زراعة الأنسجة القياسية ، فإن استخدام transwells للثقافات أحادية الطبقة يعزز التمايز الخلوي والتنظيم بطريقة تحتفظ بما يشبه الخبايا المعوية14,25. الحاجز الظهاري المعوي أمر حيوي في منع انتقال السموم والكائنات الحية الدقيقة إلى الجسم مع تسهيل امتصاص العناصر الغذائية في نفس الوقت. على هذا النحو ، من الأهمية بمكان أن نفهم كيف تعمل سلامة حاجز الأمعاء بشكل صحي ويتم تغييرها أثناء الاضطرابات المعوية أو استجابة للمركبات. على عكس الثقافات المعوية ثلاثية الأبعاد ، يمكن إجراء تقييم موضوعي لسلامة الحاجز المعوي عند الجمع بين الطبقات الأحادية على transwells وقياس TEER ، كما هو موضح هنا14،25. توليد 2D أحادي الطبقات على transwells يسمح أيضا ثقافة مزدوجة مع أنواع الخلايا ذات الصلة مثل الخلايا المناعية أو اللحمية. وهذا يسمح بتداخل مهم للغاية بين الخلايا المعوية وخلايا البيئة الدقيقة للأنسجة ، والتي لا يمكن تحقيقها مع ثقافات 3D. إن تعرض السطح القمي للطبقة الأحادية لا يسمح فقط بالتعرض التجريبي لمسببات الأمراض والمركبات وجمع المنتجات اللمعية ولكنه يتيح أيضا إجراء دراسات في جوانب أخرى من فسيولوجيا الأمعاء والأمراض ، بما في ذلك التحقيق في الجراثيم المعوية والامتصاص الجزيئي أو فسيولوجيا النقل13. السيطرة المستقلة على الأسطح المعوية القمية والقاعدية هي ميزة واضحة على نماذج المعوية 3D.
من خلال العديد من التجارب التجريبية، حددنا الخطوات الرئيسية التي ساهمت في نجاح البروتوكول. بينما يمكن تبريد عينات الأنسجة المعوية الكاملة طوال الليل ومعالجتها في اليوم التالي ، يجب إجراء تفكك الأنسجة وعزل خطوات شظية القبو على الفور لمنع تفكك أجزاء القبو المعزولة. بعد الانتهاء من عمليات غسل PBS ، يمكن أن يساعد الطرد المركزي للخبايا في Wash Media في منع انهيار التشفير ، كما هو مفصل في الخطوة 2.3.10. عند تمرير المعوية أو حصادها لتشكيل طبقة واحدة ، من الضروري فصل المعوية عن قباب BME. يجب أن تكون وسائط الغسيل باردة جليدية للمساعدة في إذابة BME. في المقابل ، يمكن أن يساعد استخدام TrypLE المسخن مسبقا وتصفية تعليق الخلية مرتين في تكوين الخلايا المفردة اللازمة لتوليد الطبقة الأحادية. أخيرا ، يمكن أن تساعد المناورة اليدوية للوحة على شكل الرقم 8 في تشتيت الخلايا المفردة بالتساوي فوق ملحق البئر.
أحد القيود المهمة لهذا البروتوكول هو أن الطبقة الأحادية ثنائية الأبعاد تم إنتاجها من مخزون معوي تم إنشاؤه من توجيه هولشتاين ناضج (> 2 سنة من العمر). قد يتطلب الجهاز الهضمي الناضج في العجول تعديلات طفيفة على البروتوكول الموصوف لتحقيق أفضل النتائج. تم وصف الاختلافات الخاصة بالسلالة في فسيولوجيا الأمعاء لسلالات الماشية في الأدبيات26. في حين أنه من غير المعروف ما إذا كانت هذه الاختلافات يمكن أن تؤثر على توليد الطبقة المعوية وأحادية الطبقة اللاحقة ، فإننا نشك في أن أي اختلافات ستؤدي فقط إلى تغييرات طفيفة في بروتوكولنا. بالإضافة إلى ذلك ، فإن نموذج ثقافة 2D له بعض العيوب المتأصلة. بالمقارنة مع نماذج 3D المعوية ، قد تفتقر الثقافات ثنائية الأبعاد إلى بعض جوانب بنية الأنسجة المعوية والتنوع الخلوي وتخلق قيودا وتحديات مرتبطة بنشر ثقافة 2D13. ومع ذلك ، تظهر الدراسات أن بعض الطبقات الأحادية يمكنها محاكاة تنظيم التشفير المتوقع27 ، ويمكن التغلب على بعض هذه القيود من خلال إنشاء ثقافات ثنائية الأبعاد بواجهة هواء سائلة. ومع ذلك ، ينبغي النظر بشكل كامل في قيود هذا النموذج لتحديد ما إذا كان تطبيقه مناسبا للسؤال التجريبي المطروح.
يصف هذا البروتوكول نظام استزراع محسن يقوم بنمذجة الجهاز الهضمي البقري باستخدام المعوية المشتقة من الدقاق البقري لتشكيل طبقات أحادية على إدخالات البئر. مع مجموعة واسعة من التطبيقات من أبحاث الأمراض المعدية إلى اكتشاف الأدوية والطب التجديدي ، يمكن أن يؤدي نظام الاستزراع عالي الإنتاجية هذا إلى تطوير غير مسبوق للاستراتيجيات الوقائية والعلاجية التي يمكن أن تكون مفيدة للطرفين لصحة والإنسان.
Disclosures
يعلن المؤلفون أن البحث قد أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
نحن نقر باستخدام المرفق الخلوي والجزيئي الأساسي في جامعة ميدويسترن.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
References
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved