القياس الكمي السريع للأشكال المؤكسدة والمخفضة من الجلوتاثيون باستخدام أورثو فثالدهيد في خلايا الثدييات المستزرعة في المختبر
In This Article
Summary
تم تحقيق القياس الكمي لكل من الأشكال المؤكسدة والمخفضة من الجلوتاثيون (GSSG و GSH ، على التوالي) من خلال استخدام أورثو فثالدهيد (OPA). يصبح OPA شديد الفلورسنت بمجرد اقترانه ب GSH ولكنه غير قادر على اقتران GSSG حتى يتم تقليله. هنا ، نصف مقايسة متعددة المعلمات لتحديد كليهما باستخدام القياس الكمي للبروتين للتطبيع.
Abstract
منذ فترة طويلة يعتبر الجلوتاثيون علامة حيوية رئيسية لتحديد استجابة مضادات الأكسدة للخلية. وبالتالي ، فهي علامة أساسية لدراسات أنواع الأكسجين التفاعلية. تستخدم الطريقة أورثو فثالدهيد (OPA) لتحديد التركيز الخلوي للجلوتاثيون (ق). يترافق OPA مع الجلوتاثيون المختزل (GSH) عبر ارتباط سلفهيدريل لتشكيل إيزوإندول لاحقا ، مما ينتج عنه اقتران شديد الفلورسنت. للحصول على نتيجة دقيقة لكل من الجلوتاثيون المؤكسد (GSSG) و GSH ، يلزم الجمع بين عوامل التقنيع وعوامل الاختزال ، والتي تم تنفيذها في هذا البروتوكول. قد تؤثر العلاجات أيضا على الصلاحية الخلوية. ومن ثم ، يتم تقديم التطبيع عن طريق مقايسة البروتين في هذا الفحص متعدد المعلمات. يوضح الفحص نطاق الكشف الخطي الزائف من 0.234 - 30μM (R2 = 0.9932±0.007 (N = 12)) خاص ب GSH. يسمح الفحص المقترح أيضا بتحديد الجلوتاثيون المؤكسد مع إضافة عامل التقنيع N-ethylmaleimide لربط الجلوتاثيون المختزل ، ويتم إدخال عامل الاختزال tris (2-carboxyethyl) الفوسفين لشق رابطة ثاني كبريتيد في GSSG لإنتاج جزيئين من GSH. يتم استخدام الفحص مع مقايسة حمض bicinchoninic التي تم التحقق من صحتها لقياس كمية البروتين ومقايسة كيناز أدينيلات لتقييم السمية الخلوية.
Introduction
أنواع الأكسجين التفاعلية (ROS) هي محفز أساسي للإجهاد التأكسدي. تم تأسيس الإجهاد التأكسدي بشكل جيد في توليد طفرات الحمض النووي ، والشيخوخة الخلوية / الموت ، والسرطانات المختلفة ، والسكري ، والأمراض العصبية (مثل باركنسون والزهايمر) ، والعديد من الحالات الأخرى المنهكة للحياة1،2،3،4،5. الدفاع الرئيسي ضد أنواع الأكسجين التفاعلية هو مضادات الأكسدة غير الأنزيمية ، والتي هي قادرة على الحد من المؤكسدات أو الجذور من خلال العمل كمتبرعين للبروتون 6,7. الجلوتاثيون (GSH) والسيستين هما الثيول الأكثر انتشارا الموجود في الثدييات8 ، في حين توجد العديد من الثيول منخفض الوزن الجزيئي (مثل الإرغوثيونين) ، GSH والسيستين هما أكثر مضادات الأكسدة غير الأنزيمية شيوعا الموجودة في الأدبيات9،10،11 ولهما أهمية أكبر لمكافحة أنواع الأكسجين التفاعلية8،12،13،14.
عند استخدام GSH كمضاد للأكسدة ، يتم ربط جزيئين من GSH تساهميا معا عبر رابطة ثاني كبريتيد لصنع ثاني كبريتيد الجلوتاثيون (GSSG). غالبا ما يستخدم استنفاد GSH كمؤشر للإجهاد التأكسدي 15,16. يمكن أيضا الجمع بين هذا التقييم والكشف عن GSSG ، على الرغم من أن الزيادات في GSSG في الخلايا غالبا ما تكون محدودة بسبب عمليات التصدير النشطة لأن GSSG يمكن أن يكون تفاعليا نسبيا في الخلايا ، مما يؤدي إلى تكوين رابطة ثاني كبريتيد مع ثيول البروتينالآخر 16.
الطرق التقليدية لقياس GSH و GSSG ليست عمليات بسيطة وتتطلب خطوات عديدة ، بما في ذلك الاستخراج الخلوي باستخدام الكواشف lytic17,18. يبسط البروتوكول الموضح هنا هذه الطرق ويسمح بالقياس الدقيق للثيولات غير الأنزيمية والتطبيع باستخدام محتوى البروتين الخلوي أو إطلاق كيناز أدينيلات. بالإضافة إلى ذلك ، من الممكن قياس الجدوى الخلوية قبل استخراج GSH / GSSG. حاولت عدة طرق سابقا استهداف وقياس الثيولات غير الأنزيمية المختزلة والمؤكسدة بكفاءة. طرق تشمل استخدام HPLC19،20،21 ، مقايسة الألواح (الكيمياء الحيوية) 22،23،24،25 ، والتي تستخدم الكواشف الشائعة لاقتران الثيول ، مثل 5،5-ديثيو مكرر (2-حمض النيتروبنزويك) (DTNB / كاشف إيلمان) 19 ، أحادي كلوروبيمان (mBCI) 26،27،28. كما أعدت عدة شركات مجموعات مسجلة الملكية للكشف عن الجلوتاثيون. ومع ذلك ، فإنها لا تنشر عدم توافق الكاشف ، مما يمثل مشكلات تعتمد على العلاجات المستخدمة29.
يحدد هذا البروتوكول مقايسة متعددة المعلمات تكتشف الثيول المختزل (مثل GSH) عبر اقتران أورثو فثالدهيد (OPA) لإنتاج إشارة فلورية يمكن اكتشافها عند 340/450 Ex / Em ، على التوالي. يسهل هذا الفحص الكشف عن كل من GSH و GSSG في وقت واحد (في الصفيحة) ، من خلال استخدام عوامل التقنيع (N-ethylmaleimide) وعوامل اختزال GSSG (tris (2-carboxyethyl) phosphine). يوفر بروتوكول العلامات الحيوية المتعددة هذا أيضا فرصة خلال مرحلة التحلل الخلوي لتحديد البروتينات عبر مقايسة حمض bicinchoninic لتطبيع العينات عند الانتهاء من القياس النهائي أو عن طريق مقايسة كيناز أدينيلات من وسائط الخلية. يمكن إجراء هذا الفحص باستخدام العديد من الكواشف المتوفرة بسهولة في معظم المختبرات ولا يتطلب سوى عدد قليل من المواد الكيميائية الإضافية غير الشائعة لأداءها. العملية بسيطة ويمكن الوصول إليها ويمكن إجراؤها دون مراحل شاقة في أقل من 2 ساعة.
في هذا البروتوكول ، تم اختيار العديد من المواد النانوية التي ثبت سابقا أنها تحفز أنواع الأكسجين التفاعلية أو يشتبه في أنها تحفز الإجهاد التأكسدي30,31. تم استكشاف نطاق التركيز لمعرفة آثار التعرض لهذه المواد النانوية على خطوط الخلايا المختلفة وفعالية الفحص في تحديد كمية الثيول المضاد للأكسدة.
Protocol
ملاحظة: تم تصميم البروتوكول التالي مع القدرة على استخدامه جنبا إلى جنب مع مقايسة بروتين حمض البيسينتشونينيك (BCA) ومقايسة أدينيلات كيناز (AK) لتطبيع العينات للعلاجات. تأكد من أن المشغل يرتدي الملابس المناسبة ومعدات السلامة اللازمة ، مثل معطف مختبر Howie وقفازات النتريل ونظارات السلامة من الفئة الأولى ، طوال فترة إعداد المواد واستخدامها. ينقسم البروتوكول إلى عدة مراحل.
1. الاستعدادات للمخزون وحلول العمل
- تحضير محاليل مخزون من معيار 100 mM GSH في 1 mM HCl (محضر من 37٪ HCl في ماء مقطر مزدوج (ddH2O)).
ملاحظة: في حالة التخفيف من حمض عالي التركيز ، مثل 37٪ حمض الهيدروكلوريك ، تأكد من العملية الصحيحة لإضافة الحمض إلى الماء في غطاء دخان من الفئة الأولى. - إعداد مخزون من 22.35 mM OPA في الإيثانول المطلق. نفذ هذه الخطوة في غطاء دخان من الدرجة الأولى. تحضير 25 mM N-ethylmaleimide (NEM) في ddH2O. نفذ هذه الخطوة في غطاء دخان من الفئة الأولى.
ملاحظة: يمكن تخزين هذه الحلول الثلاثة في -20 درجة مئوية لمدة تصل إلى 3 أشهر. - تحضير 0.01 م تريس (2-كربوكسي إيثيل) فوسفين (TCEP) إلى حجم إجمالي قدره 500 ميكرولتر ، مطلوب ل 100 بئر. تحضير 100 ميكرولتر من معيار 1 mM GSH ، مخفف من مخزون 100 mM باستخدام ddH2O.
- إما استخدام محلول تحلل الترسيب المناعي (IP) أو الصيغة التالية: 394 ملغ من Tris-HCl (التركيز النهائي 25 ملليمول) ، 877 ملغ من كلوريد الصوديوم (التركيز النهائي 150 ملليمول) ، 29 ملغ من EDTA (التركيز النهائي 1 ملليمول) ، إما 1 مل من 100٪ NP-40 أو IGEPAL CA-630 (التركيز النهائي 1٪ V / V) ، 5 مل من الجلسرين (التركيز النهائي 5٪ V / V) ، 84 مل من ddH2O. امزج المكونات عن طريق التحريك اللطيف واضبط درجة الحموضة على 7.4. صب في دورق حجمي 100 mL وأضف الحجم المتبقي من ddH2O للوصول إلى الحجم النهائي 100 mL. مرشح معقم من خلال مرشح 0.22 ميكرومتر وتخزينه في درجة حرارة 2-8 درجة مئوية لمدة تصل إلى 6 أشهر.
ملاحظة: تعمل محاليل التحلل كملوث / متداخل في هذا الفحص ؛ ومن ثم ، يتم تحديد الصيغ المذكورة أعلاه. - تحضير 1 لتر من محلول ملحي مخزن بالفوسفات 0.1 M مكمل بحمض رباعي الخليك الإيثيلين ديامين (PBS-EDTA) عند 3 قيم أس هيدروجيني مختلفة ، وتحديدا 7.2 و 8.5 و 9.0. استخدم مخزن مؤقت تجاري 0.1 M PBS مكمل ب 1 mM EDTA (292.24 مجم / لتر) أو التركيبة التالية 10x (1 لتر): 80 جم كلوريد الصوديوم ، 2.0 جم KCl ، 14.4 جم Na2HPO4 ، 2.4 جم KH2PO4 ، 800 مل من ddH2O. أضف واخلط. أعلى ما يصل إلى 1 لتر. الأوتوكلاف الحل للعقم وتخزينه لمدة 12 شهرا في درجة حرارة الغرفة. من حل مخزون 10x ، قم بعمل حل عملي ل PBS واستكمله ب EDTA (التركيز كما هو مذكور سابقا).
ملاحظة: الرقم الهيدروجيني له أهمية حاسمة. تأكد من دقة الأس الهيدروجيني قبل بدء البروتوكول. - قم بإجراء تخفيف تسلسلي 1: 2 ل 1 mM GSH باستخدام ddH2O (1 mM ، 500 μM ، 250 μM ، 125 μM ، 62.5 μM ، 31.25 μM ، 15.625 μM ، و 7.8125 μM). أضف 10 ميكرولتر من كل تركيز إلى الآبار القياسية (يتم إجراؤها في نسختين). سيتم تخفيف العينات بشكل أكبر في المخزن المؤقت للتحلل ؛ ومن ثم ، ستكون التركيزات 1/5من تركيزها الأصلي بعد ذلك (200 ، 100 ، 50 ، 25 ، 12.5 ، 6.25 ، 3.125 ، 1.5625 ميكرومتر).
ملاحظة: ستكون التركيزات النهائية للمعايرة 30 ميكرومتر و 15 ميكرومتر و 7.5 ميكرومتر و 3.75 ميكرومتر و 1.875 ميكرومتر و 937.5 نانومتر و 468.8 نانومتر و 234.4 نانومتر.
2. إعداد الفحص
ملاحظة: يستخدم هذا البروتوكول خطوط الخلايا البشرية HepG2 و A549 و J774 ، والتي تم شراؤها تجاريا من ATCC. تم استخدام خطوط الخلايا هذه بموجب المبادئ التوجيهية المعتمدة التي حددتها قوانين ولوائح زراعة والأنسجة في الجامعة.
- في 24 ساعة قبل بدء الفحص ، خلايا البذور بتركيزات موضحة في الجدول 1 ؛ ومع ذلك ، اعتمادا على خط / نوع الخلية والعلاج المستخدم ، اضبط الكثافة حسب الحاجة. تنمو الخلايا في وسط نمو كامل (وسط إيجلز المعدل (EMEM) مع 10٪ مصل عجل الجنين المعطل حراريا (HIFS) ، 1٪ Penstrep (10000 وحدة / مل بنسلين / 10 مجم / مل ستربتومايسين) ، و 1٪ أحماض أمينية غير أساسية.
- خلايا البذور باستخدام طرق بذر الخلايا التقليدية32. خلايا البذور في لوحات سوداء بالكامل إذا لم تستخدم الفحص المجهري بعد الفحص. تقييم الخلايا من أجل الالتقاء والصحة العامة في قارورة T75 قبل استخدامها عن طريق الفحص المجهري.
- في خزانة أمان بيولوجي نظيفة ومعقمة من الفئة الثانية وباتباع تقنية تعقيم صارمة ، تخلص من وسائط الخلايا ، واغسل الخلايا برفق باستخدام ~ 15 مل من درجة حرارة الغرفة المعقمة (RT) PBS ، وتخلص منها.
- إلى قارورة الخلية ، أضف 5 مل من التربسين المعقم 1x ، واهزه برفق لضمان تغطية الطبقة الأحادية للخلية ، وضعه في حاضنة عند 37 درجة مئوية لمدة 5 دقائق لتسهيل انفصال الخلايا.
- إيقاف التربسين عن طريق إضافة وسط نمو يحتوي على مصل عجل الجنين المعطل بالحرارة (10٪) ، حوالي 10 مل.
- نقل الخلايا إلى أنبوب طرد مركزي 50 مل وحبيبات عند 200 × جم لمدة 5 دقائق. تخلص من الوسائط واستبدلها ب 5 مل من نفس الوسائط. أعد تعليق الخلايا في الأنبوب حتى تصبح متجانسة ولا يمكن ملاحظة أي تكتل.
- إزالة 20 ميكرولتر من تعليق الخلية ووضعها في مقياس الدم للعد. بمجرد حساب عدد الخلايا المطلوبة ، قم بإجراء تخفيف لعمل محلول بكثافة الخلية الصحيحة.
- تحتوي وسائط الماصة على خلايا في ألواح 96 بئرا (سعة 350 ميكرولتر) ، بحد أقصى 200 ميكرولتر لكل بئر. ضع الخلايا في حاضنة 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة للالتصاق بسطح اللوحة.
- لتقييم كل من الجلوتاثيون الكلي و GSSG ، عالج العينات لكلتا الحالتين. قم ببذر ومعالجة 6 آبار لتوفير مجموعتين لكل من GSH و GSSG مع 3 تكرارات فنية (يوضح الشكل 1 التخطيط).
- تأكد من إعداد جميع الكواشف بشكل مناسب قبل بدء الفحص ؛ تأكد من أن جميع المكونات والكواشف العازلة في RT قبل البدء في بناء المخازن المؤقتة أو استخدامها في الفحص ، باستثناء الرقم الهيدروجيني 7.4 PBS (بدون EDTA) ، والتي يجب الاحتفاظ بها على الثلج / المبردة حتى الاستخدام.
ملاحظة: من الأهمية بمكان أن يقتصر تكوين الفقاعات على الحد الأدنى للسماح بحدوث التفاعلات المرغوبة داخل الفحص والسماح بالقياس الكمي الدقيق عبر قارئ اللوحة.
| خط الخلية | كثافة البذر (لوحة 96 بئر) |
| HepG2 | 10000 خلية / بئر |
| أ 549 | 5000 خلية / بئر |
| جي 774 | 10000 خلية / بئر |
الجدول 1: كثافات البذر المقترحة لخطوط الخلايا المختارة. تم توضيح كثافات بذر مختلفة لثلاثة خطوط خلايا مختلفة مستخدمة في البيانات الممثلة ، وتحديدا A549 و J774 و HepG2.
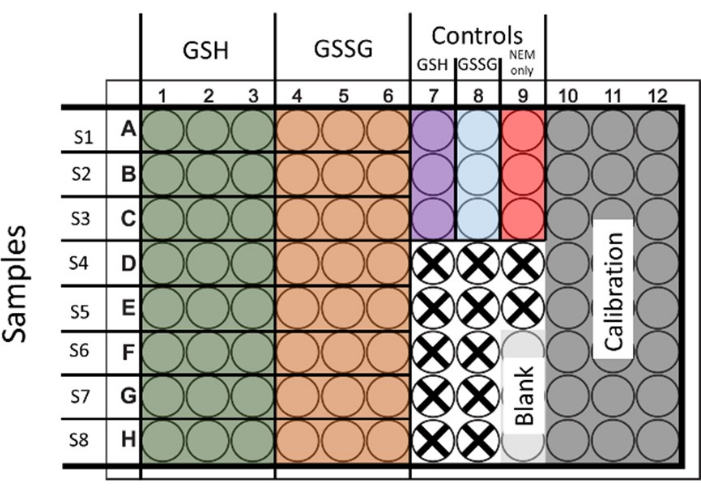
الشكل 1: التخطيط المقترح لبذر 96 لوحة بئر للتحديد المتزامن لإجمالي الجلوتاثيون وثاني كبريتيد الجلوتاثيون. كما يتم عرض آبار للمعايرة والضوابط. يتم تمثيل الآبار غير المستخدمة بصليب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. معالجة المواد النانوية
- وزن المواد النانوية (على وجه التحديد ZnO و TiO2 و CuO و Ag) في مقياس وزن قادر على ميكروغرام. قم بإجراء عملية حسابية لتحقيق تركيز أولي قدره 1 مجم / مل لكل مادة نانوية.
- نقل حلول المواد النانوية إلى صوتنة وصوتنة لمدة 16 دقيقة باستخدام حمام صوتنة (38 واط) لإنتاج محلول متجانس. قم بعمل سلسلة من التخفيفات لكل مادة نانوية عند 125 ، 62.5 ، 31.25 ، 15.625 ميكروغرام / مل.
- إزالة الخلايا من الحاضنة وغسل بخفة مع RT PBS. بعد التأكد من إزالة جميع PBS ، أضف 100 ميكرولتر من العلاجات إلى اللوحة ، مع عناصر التحكم (وسائط الاستزراع بدون HIFS). بعد تطبيق العلاج على الخلايا ، احتضان المواد النانوية في حاضنة 37 درجة مئوية (5 ٪ CO2) لمدة 4 ساعات ؛ بعد ذلك ، استخدم البروتوكول أدناه لتحديد GSH: GSSG ، وتركيز البروتين ، وإطلاق AK.
4. بروتوكول الفحص
- بعد التعرض للعلاج (الشكل 2 أ) ، قم بتقييم الجدوى عن طريق نشاط أدينيلات كيناز (AK) (اختياري). استخدم مجموعة تجارية لهذا الفحص باتباع تعليمات الشركة المصنعة.
- قم بتدوير الألواح في جهاز طرد مركزي عند 200 × جم لمدة 5 دقائق لمعالجة الحبيبات الخفيفة وحطام الخلايا (الشكل 2 ب).
- قم بإزالة 20 ميكرولتر من طاف الوسائط برفق من كل عينة وتحكم جيدا (كما هو محدد أعلاه) والماصة في لوحة بيضاء مجاورة ذات 96 بئرا بنفس تنسيق التخطيط (الشكل 2C).
- أضف 100 ميكرولتر من محلول العمل من مجموعة AK إلى كل بئر ، واحم اللوحة من الضوء ، واتركها لتتطور لمدة 10 دقائق في درجة حرارة الغرفة. سجل التلألؤ باستخدام قارئ لوحة بمعدل 1000 عدد / ثانية.
- بالنسبة لمعايير GSH ، أضف 40 ميكرولتر من إجمالي محلول الجلوتاثيون إلى كل بئر (الشكل 2D ؛ اختياري ، مطلوب للقياس الكمي).
- قم بشفط الوسائط المتبقية من اللوحة واغسلها 3x باستخدام الثلج البارد 0.1 M PBS ، درجة الحموضة 7.2 ، وتجاهل كل غسلة (الشكل 2E) باستثناء المعايير. اترك الغسيل النهائي في اللوحة حتى يتم تحميل معايرة GSH في اللوحة.
- أضف 10 ميكرولتر من كل تركيز الجلوتاثيون وفراغ (ddH2O) في الآبار في ثلاث نسخ.
- قم بإزالة غسل PBS النهائي وإضافة المخاليط إلى كل بئر كما هو موضح في الجدول 2 للقياس الكمي المستهدف المطلوب (الشكل 2E). احسب الأحجام المطلوبة قبل البدء في هذه الخطوة بسبب فقدان النشاط الحساس للوقت مع المخازن المؤقتة الكاملة. تأكد من إجراء خلطات الكاشف هذه قبل بدء عملية الفحص ، ولكن لا تسمح لها بالجلوس لأكثر من 30 دقيقة قبل الاستخدام.
- ضعها على شاكر لوحة مدارية واترك اللوحة تهتز عند 300 دورة في الدقيقة لمدة دقيقتين (الشكل 2F).
- أخرجه من الخلاط وأضف 5 ميكرولتر من محلول 0.01M TCEP إلى كل بئر ، باستثناء بئر التحكم في NEM. أعد الطبق إلى شاكر واحتضانه لمدة 10 دقائق (الشكل 2F).
- نقل لوحة إلى جهاز الطرد المركزي وتدور في 200 × غرام لمدة 5 دقائق. نقل 25 ميكرولتر من كل بئر عينة إلى لوحة أخرى ذات 96 بئرا (شفافة) ؛ سيتم استخدام هذا لتركيز البروتين (انظر الخطوة 4.15 ; الشكل 2G). لا تقم بنقل المعايير أو ضوابط الفحص.
- تأكد من أن الحجم النهائي لكل بئر هو 30 ميكرولتر ؛ إزالة مستوى الصوت من عناصر التحكم والمعايير لتلبية هذا المطلب (الشكل 2H).
- أضف 170 ميكرولتر من محلول OPA العامل إلى كل بئر ، ولوحة الدرع من الضوء وضعها على شاكر لمدة 15 دقيقة (الشكل 2I).
- اقرأ التألق باستخدام قارئ الألواح في Ex340 / Em450 (الشكل 2J). تأكد من عدم وجود فقاعات أثناء مرحلة القياس ؛ سيكون لها تأثير ضار على كل من التفاعل والقياس الكمي عبر قارئ اللوحة.
- لتحديد محتوى البروتين في الخلايا المحللة ، استخدم مجموعة مقايسة BCA التجارية. نقل العينات المأخوذة من الخطوة 4.12 إلى صفيحة جديدة من 96 بئرا (شفافة) عند 25 ميكرولتر لكل بئر.
- استخدم معيار ألبومين مصل الأبقار (BSA) المخفف في محلول تحلل IP وأضفه إلى اللوحة في ثلاث نسخ بمعدل 25 ميكرولتر لكل بئر. يتم تحديد التركيزات الدقيقة في بروتوكول مجموعة BCA.
- قم بإعداد حل عملي يتكون من نسبة 50: 1 من الكواشف A و B من مجموعة BCA وأضف 200 ميكرولتر إلى كل بئر يحتوي على عينة ومعيار وتحكم. تحمي الألواح من الضوء وتحتضن عند 37 درجة مئوية لمدة 30 دقيقة (الشكل 2K).
- قم بإزالة العينات من الحاضنة ، واتركها تتوازن في درجة حرارة الغرفة لمدة 5 دقائق ، ثم اقرأ الامتصاص عبر قارئ الألواح عند 562 نانومتر (الشكل 2 لتر).
| إجمالي مزيج كاشف تحلل تركيز الجلوتاثيون | |
| مكون | حجم |
| التحلل العازلة | 50 ميكرولتر |
| الحجم الكلي / البئر | 50 ميكرولتر |
| مزيج كاشف تحلل تركيز الجلوتاثيون المؤكسد | |
| مكون | حجم |
| التحلل العازلة | 49.5 ميكرولتر |
| نيم (25 مللي مول) | 0.5 ميكرولتر |
| الحجم الكلي / البئر | 50 ميكرولتر |
| استخدم كلا المحلولين في غضون 30 دقيقة من تكوين الخليط | |
| مكون حل الكشف عن OPA | حجم |
| OPA 3 ملغ / مل | 5 ميكرولتر |
| برنامج تلفزيوني (درجة الحموضة 9.0) | 165 ميكرولتر |
| الحجم الكلي / البئر | 170 ميكرولتر |
الجدول 2: الكميات اللازمة من الكواشف لتنفيذ البروتوكول. الأحجام المطلوبة لكل بئر لتحديد إجمالي الجلوتاثيون وثاني كبريتيد الجلوتاثيون وكاشف العمل المطلوب. تأكد من حساب الأحجام المطلوبة ، ويتم تضمين فائض لحساب فقدان الحجم من خلال النقل.
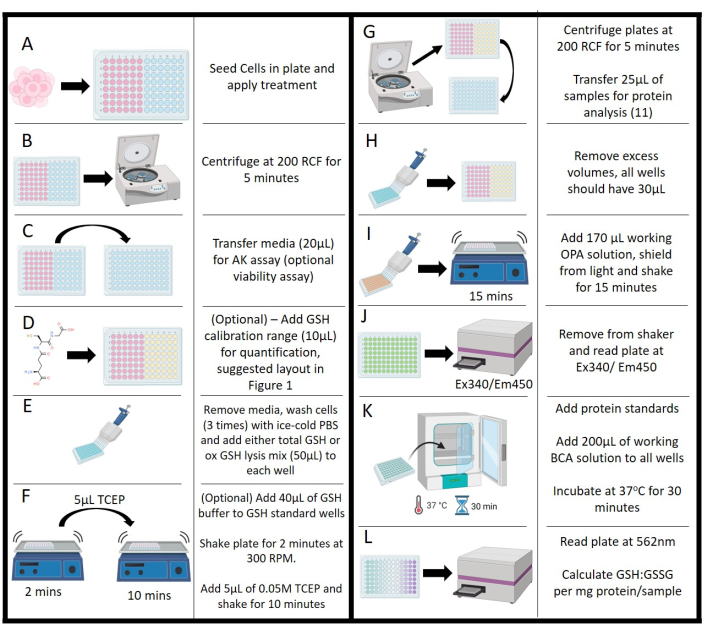
الشكل 2: تمثيل تخطيطي للبروتوكول. أ: البذر الأولي للخلايا وتحضينها ومعالجتها. (ب) الطرد المركزي لفصل الوسائط عن المواد الصلبة العالقة. (ج) نقل الوسائط لمقايسة كيناز أدينيلات. د: إضافة تركيزات الجلوتاثيون لنطاق المعايرة. ه: مراحل الغسيل وإضافة كاشف التحلل. (F) إضافة العازلة وإضافة الفوسفين tris (2-carboxyethyl) مع خطوة الاهتزاز. (ز) الطرد المركزي للخلايا المحللة لإزالة الوسائط لتحليل البروتين. ( H) إزالة الوسائط لمعادلة مستوى الصوت عبر اللوحة. (I) إضافة محلول عمل أورثو فثالدهيد مع حضانة اهتزازية. (ي) قياس مضان أورثو-فثالدهيد عبر قارئ الصفائح. (ك) مراحل الحضانة لمقايسة حمض البيسينشونينيك لتحديد البروتين. (L) قياس تركيز البروتين ، مما يسمح بتطبيع الجلوتاثيون: قيم ثاني كبريتيد الجلوتاثيون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
باتباع هذا البروتوكول ، تم زرع خطوط الخلايا A549 و J774 بكثافة 5000 خلية / بئر و 10000 خلية / بئر ، على التوالي واستزراعها عند 37 درجة مئوية في 5٪ CO2 لمدة 48 ساعة. يظهر تحليل AK بعد معالجة المواد النانوية في الجدول التكميلي 1 ، ويبين تركيز البروتين في الجدول التكميلي 2.
الرسم البياني للمعايرة
يظهر في الشكل 3 ثلاث معايرات باستخدام نطاق التركيز المذكور (0.234 - 30 ميكرومتر التركيز النهائي) من ثلاث لوحات منفصلة من ثلاثة أنواع مختلفة من الخلايا (على الرغم من أنه لا ينبغي أن يؤثر على المعايرة) في ثلاثة أيام مختلفة غير متتالية. بينما تم عرض 3 عينات ، لوحظ N من 12 ، وأظهر انحدارات خطية مماثلة بمتوسط قيمة R2 يبلغ 0.9932 ± 0.007.
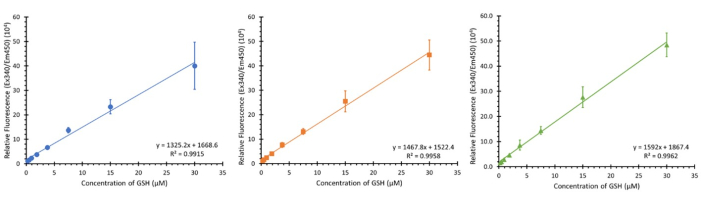
الشكل 3: الرسوم البيانية لمعايرة الجلوتاثيون للفحص. ثلاثة رسوم بيانية للمعايرة من نطاقات معايرة الجلوتاثيون المنفصلة داخل اللوحة ، يتم تنفيذ كل منها على حدة لمدة أسبوع ؛ أشرطة الخطأ ± SD (n = 3 ، N = 12) n = النسخ المتماثلة التقنية ، N = النسخ المتماثلة البيولوجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
نتائج العينة
تم استخدام خلايا HepG2 و A549 و J774 في تقييم المواد النانوية المختلفة المشتبه في إحداث تغييرات في الآليات الخلوية عن طريق الإجهاد التأكسدي. تم استخدام بروتوكول الكشف والقياس الكمي الموصوف.
تم التعامل مع البيانات الواردة من 3 قياسات (AK و BCA و GSSH / GSSG) على النحو التالي. تم تنفيذ اختبار AK و BCA للتطبيع. سيعطي فحص AK ، باستخدام المجموعة الموصى بها ، أسرع وأبسط البيانات لكمية AK التي تم إطلاقها في وسائط الخلية. من المتوقع زيادة قيم AK لزيادة موت الخلايا. وبالتالي ، يلزم التحكم -ve (حي) و + ve (ميت). سيسمح هذا بالتطبيع على أساس النسبة المئوية.
اختبار BCA هو عملية أطول ولكنه سيسمح بالحصول على نتائج قابلة للقياس الكمي عن طريق القياس الكمي للبروتين (mg / mL). هذا لا يتطلب التحكم -ve أو + ve كما هو الحال في AK ولكنه سيظل يتطلب تحكما عاما -ve (خلايا غير معالجة) للسماح بتحقيق تطبيع القيم.
في قسم النتائج التمثيلية هذا ، وجد أن المعالجة (المواد النانوية) لديها القدرة على إحداث تداخل مع اختبار AK. ومن ثم ، تم إجراء جميع عمليات التطبيع باستخدام بيانات BCA. لذلك ، يتم تقديم المعلومات على أنها تركيز الأنواع المكتشفة (GSH أو GSH + GSSG (ومع ذلك ، يتم إجراء طرح تركيز GSH من إجمالي تركيز GSH + GSSG للحصول على تركيز GSSG) لكل ملغ / مل من البروتين (عبر مقايسة BCA). إذا رغبت في ذلك ، يمكن بعد ذلك تحويل هذا إلى نسبة لتقييم التغيير في GSH: GSSG من العلاج المطلوب.
يظهر في الشكل 4 بيانات نسبة GSH: GSSG من ثلاثة خطوط خلايا مختلفة (A549 و J774 و HepG2) تم الحصول عليها باستخدام بروتوكول OPA وتم تطبيعها إلى تعبير البروتين عبر BCA (μg / mL) ، ويمكن العثور على مزيد من البيانات التي تحدد قيم GSH و GSSG الإضافية في الشكل التكميلي 1.
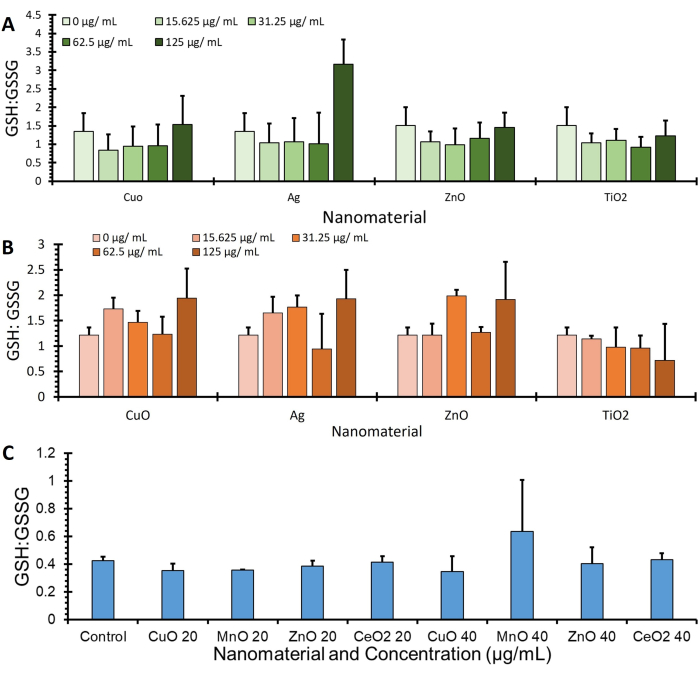
الشكل 4: الجلوتاثيون: نسبة ثاني كبريتيد الجلوتاثيون من إجراء الفحص. يظهر الجلوتاثيون: نسب ثاني كبريتيد الجلوتاثيون ل 3 خطوط خلوية، وهي (A) A549 و (B) J774 و (C) HepG2. تم تحضين الخلايا بعلاجات (مواد نانوية مختلفة في وسائط خالية من المصل) لمدة 4 ساعات. تمت معالجة الخلايا باستخدام هذا البروتوكول لتحديد التغيرات في ثاني كبريتيد الجلوتاثيون والجلوتاثيون وتطبيعها عن طريق تحديد كمية البروتين ، وأشرطة الخطأ ± SE (ن = 3 ، ن = 3) الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحتوي اللوحة أيضا على سلسلة من عناصر التحكم لضمان تشغيل الفحص بشكل صحيح. تمت إضافة NEM كمكون فردي لإثبات عدم التفاعل مع وسائط الكشف عن OPA. يوضح معيار المعايرة زيادة خطية مع تركيز GSH ، مما يدل على القدرة الفعالة لكاشف الكشف OPA على الارتباط بشكل فعال بتركيزات متزايدة من GSH.
وتجدر الإشارة إلى أن هذا الفحص يستهدف على وجه التحديد مجموعات سلفهيدريل الحرة الموجودة عادة في الثيول (مثل GSH ، والتي تعتبر عادة مضادات الأكسدة). أحد التفاعلات المحتملة هو ارتباط OPA بثيول البروتين ، مما قد يؤدي إلى جمع بيانات غير دقيقة. وبالتالي ، فإن اختبار BCA هو مرحلة حاسمة لتطبيع البيانات إلى البروتين والسماح بانعكاس دقيق ل GSH الحر.
الشكل التكميلي 1: الأرقام التي توضح الجلوتاثيون ، ثاني كبريتيد الجلوتاثيون ، والجلوتاثيون: نسبة ثاني كبريتيد الجلوتاثيون من 3 خطوط خلايا ، وهي (A) A549 و (B) J774 و (C) HepG2. تم تحضين الخلايا بعلاجات (مواد نانوية مختلفة في وسائط خالية من المصل) لمدة 4 ساعات. تمت معالجة الخلايا باستخدام هذا البروتوكول لتحديد التغيرات في ثاني كبريتيد الجلوتاثيون والجلوتاثيون وتطبيعها عن طريق تحديد كمية البروتين ، وأشرطة الخطأ ± SE (ن = 3 ، ن = 3) الرجاء النقر هنا لتنزيل هذا الملف.
الجدول التكميلي 1: البيانات الوصفية لقيم أدينيلات كيناز لخلايا A549 و J774. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 2: البيانات الوصفية لقيم حمض Bicinchoninic مع معايرة لخلايا A549 و J774 و HepG2. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
كما ذكرنا ، فإن الحاجة إلى فهم الأكسدة والاختزال الخلوي ، ومراقبة حالات الإجهاد التأكسدي ، والاستجابة المضادة للأكسدة كانت دائما حاسمة في فهم ومنع عدد لا يحصى من الأمراض ، مثل السرطانات والتنكس العصبي33,34. يوضح هنا وسيلة لتحسين المشهد الانتقالي من خلال زيادة إمكانية الوصول إلى GSH: كشف GSSG الدقيق مع إعداد سريع وبأقل قدر ممكن.
يوضح هذا البروتوكول تسلسلا متعدد المعلمات من المقايسات لتحديد أنواع الجلوتاثيون / الثيول داخل الخلايا (المختزلة والمؤكسدة) ، مع 2 وسيلة للتطبيع عبر مقايسة بروتين BCA و / أو مقايسة AK. يمكن أيضا تعديل هذا الفحص للكشف عن العديد من العلامات الأخرى من خلال خطوة استخراج الوسيط الأولية ويمكن تبسيطه بطريقة تعطي ببساطة نسبة ثيول مؤكسدة / مخفضة مع استبعاد نطاق المعايرة.
عند النظر في تقييم التحليلات ، تم استكشاف كل من mBCI و OPA ومقارنتهما للاستخدام. بينما أظهر mBCl في البداية إمكانات إشارة جيدة ، تم اكتشاف قيود كبيرة في الاستخدام. في المقام الأول ، يوضح استخدام الخلايا الحية أفضل استخدام ل mBCl. ومع ذلك ، بعد تحلل الخلية ، وجد أن الإشارة قد تم إخمادها وتتضاءل بشكل عام بتنسيق متعدد الآبار مقارنة ب OPA35. هناك مشكلة أخرى تتمثل في قياس GSSG عبر mBCl ، والأدبيات قليلة فيما يتعلق بهذا الأمر ، ومن خلال تحسين / استكشاف البروتوكول ، لم يتم تحقيق الكشف الدقيق عن GSSG من خلال mBCl.
لقد أثبتنا أن مقايسة OPA تقدم نطاقات معايرة موثوقة بشكل كبير ، بمتوسط R2 من 0.9932 ± 0.007 (N = 12) عبر نطاق تركيز 0.234 - 30 μM GSH. تم اختيار هذا النطاق بسبب النطاقات المرجعية السابقة الموجودة في الأدبيات35. من الممكن نظريا اكتشاف الجلوتاثيون خارج هذه النطاقات ولكنه سيتطلب تعديلا لتركيز الكواشف ووقت الحضانة وربما المعدات المستخدمة في الكشف. وتجدر الإشارة إلى أن كل لوحة تتطلب نطاقها القياسي الخاص للقياس الكمي ؛ يمكن أن يكون لأدنى تباين في الوقت بين اللوحات التي يتم إجراؤها في أيام مختلفة تأثير كبير على القيم التي تم الحصول عليها أثناء القياس.
يعتمد الحصول على بيانات دقيقة وموثوقة من هذا البروتوكول على عدة خطوات حاسمة يتم الالتزام بها بدقة. عند إنشاء المخازن المؤقتة المختلفة المطلوبة في البروتوكول ، من الأهمية بمكان أن يكون الرقم الهيدروجيني دقيقا. وبالتالي ، يجب ألا يكون للمخازن المؤقتة التي تتطلب درجة حموضة 9 أي انحراف يتجاوز ± 0.1 من هذه القيمة. ويرجع ذلك إلى احتمال أن تترسب المكونات العازلة من المحلول في الرقم الهيدروجيني الخاطئ ؛ سيؤدي اتباع هذا البروتوكول بالضبط إلى منع هذه المشكلة.
تعد الإزالة الكاملة للمعالجة والغسيل الدقيق قبل التحلل أمرا بالغ الأهمية أيضا لمنع القطع الأثرية والحصول على البيانات غير الدقيقة أثناء مرحلة قراءة اللوحة. بمجرد تحليل الخلايا (الخطوة 4.8) ، لا يمكن إزالة العلاج ، ولن تكون اللوحة قابلة للإنقاذ. نظرا لأحجام المخازن المؤقتة / الكواشف التي تتم إضافتها في جميع أنحاء البروتوكول والتي تختلف بين العينات والمعايير ، فمن الأهمية بمكان أن يكون المستخدم على دراية بالأحجام المتنوعة ، في الخطوة 4.12 و 4.13. يتم أيضا إطلاع مشغل الفحص على هذه الأحجام المتنوعة ويطلب منه التأكد من أن جميع الأحجام هي نفسها للسماح بتحقيق قياس دقيق. نظرا لأن الأحجام بين العينات والمعايير ليست ذات أهمية واضحة ، فقد يكون من السهل ارتكاب خطأ فيما يتعلق بوجود محلول زائد في بئر العينة.
هناك قيود على هذا البروتوكول تعتمد على خطوات حاسمة ، والتي تعتبر ضرورية للحصول على بيانات دقيقة وموثوقة. يحتاج المستخدمون الذين يقومون بإجراء هذا الفحص إلى امتلاك مستوى معقول من المهارات المختبرية لمنع المشاكل غير المرغوب فيها ، مثل تكوين الفقاعة. تكوين الفقاعات له تأثير جذري على كل من القدرة على حدوث التفاعلات داخل الصفيحة الدقيقة وقياس التألق. يحتوي عامل التحلل المستخدم في هذا البروتوكول على منظف ، مما يمثل صعوبة للباحث المبتدئ الذي قد يكافح لمنع تكوين الفقاعة. قد ينقذ الطرد المركزي الفوري هذا الخطأ. من المحتمل أيضا أن يكون البروتوكول محدودا فيما يتعلق بنوع الخلية. تم استخدام خطوط الخلايا A549 و J774 و HepG2 لتحسين وإنتاج البيانات لهذا البروتوكول. قد تتطلب خطوط الخلايا الأخرى كثافات بذر مختلفة وتحسين البروتوكول للحصول على بيانات دقيقة.
يوفر هذا البروتوكول العديد من المزايا مقارنة بالعديد من المقايسات الحالية. في حين أن الكشف عن الثيول باستخدام الفثالدهيد ليس مفهوما جديدا ، فإن الاستخدام في شكل فحص مشترك مثل هذا ، في صفيحة دقيقة ، مع مواد ومعدات محدودة مطلوبة ، يوفر إمكانات كبيرة لجميع المختبرات للوصول إلى هذا البروتوكول. لا تكشف معظم مجموعات Thiol / GSH من الموردين التجاريين عن تكوين الكواشف الخاصة بهم. وبالتالي ، قد يكون من الصعب التنبؤ باحتمال عدم التوافق / التداخل. هنا ، نقدم كل مكون من جميع الكواشف المستخدمة للحد من هذه الإمكانات.
يتم تنفيذ هذا البروتوكول أيضا بسرعة كبيرة عند الانتهاء من فترة العلاج الأولية. عند حساب معالجة المستخدم بين مراحل الحضانة ، يمكن إجراء جانب القياس الكمي للثيول لهذا البروتوكول في أقل من 1 ساعة. يتم تحليل العينات وربطها في وقت واحد لمنع الأكسدة الذاتية للعينات ، وهو الأمثل لهذه الأنواع من التفاعلات. على الرغم من عدم تحديد ذلك في البروتوكول ، يمكن تحليل العينات تقنيا في لوحة وإغلاقها ، مما يسمح بتجميدها لتحليلها في المستقبل. ومع ذلك ، لم يتم استكشاف هذا التغيير في البروتوكول.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذا البحث من قبل المشاريع الأوروبية GRACIOUS (GA760840) و SUNSHINE (GA952924). ويود المؤلفون أيضا أن يعربوا عن تقديرهم للجهود التي بذلها جميع الذين ساعدوا، بطريقة ما، في وضع هذا البروتوكول.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22µm filter (optional-For lysis buffer) | Fisher scientific | 12561259 | |
| 100mL volumetric flask | Fisher scientific | 15290866 | |
| 1L Volumetric flask | Fisher scientific | 15230876 | |
| 250mL beaker (optional-For lysis buffer) | Fisher scientific | 15409083 | |
| 8-Channel micropipette (20-200µL) | SLS | FA10011D2 | |
| 8-Channel micropipette (2-20µL) | SLS | B2B06492 | |
| 96 well plates - black with clear bottom, TC treated | Fisher scientific | 10000631 | Preferred plate for seeding and fluoresence, use TC treated clear if unavailable |
| 96 well plates - clear (TC treated and untreated) | Fisher scientific | 10141161 | If black plates with clear bottom is not available/ suitable use TC treated clear |
| 96 well plates - white, Not TC treated | Fisher scientific | 11457009 | |
| A549 (lung carcinoma) cell line | ATCC | CCL-185 | |
| Absolute ethanol | Merck (Sigma-Aldrich) | 1.08543 | |
| Aluminium foil | Fisher scientific | 11779408 | For protecting plates from light |
| BCA Assay Kit | Thermo | 23225 | |
| Benchtop Centrifuge (with 96 plate rotor) | Eppendorf | 5804 | |
| Ethylenediaminetetraacetic acid (EDTA) | Merck (Sigma-Aldrich) | E9884 | |
| Glutathione (GSH) | Merck (Sigma-Aldrich) | G6013 | |
| Glutathione disulfide (GSSG) | Merck (Sigma-Aldrich) | G4501 | |
| Glycerol | Merck (Sigma-Aldrich) | G5516 | |
| HCl, 37% | Merck (Sigma-Aldrich) | 258148 | Dilute to 1mM for GSH stock, pH adjustment also |
| HepG2 (Hepatocarcinoma) cell line | ATCC | HB-8065 | |
| IGEPAL CA-630 | Merck (Sigma-Aldrich) | 18896 | Use either IGEPAL CA-630 or NP-40 for solution, not both |
| IP lysis buffer | Fisher scientific | 11825135 | |
| J774 (monocyte, macrophage) cell line | ATCC | TIB-67 | |
| KCl | Merck (Sigma-Aldrich) | P3911 | |
| KH2PO4 | Merck (Sigma-Aldrich) | P0662 | |
| Micropipette (20-200µL) | SLS | B2B06482 | |
| Micropipette (2-20µL) | SLS | B2B06478 | |
| Microplate shaker | VWR | 444-0041 | |
| Na2HPO4 | Merck (Sigma-Aldrich) | S9763 | |
| NaCl | Merck (Sigma-Aldrich) | S9888 | |
| NaOH, 10M | Merck (Sigma-Aldrich) | 72068 | For pH adjustment only |
| N-Ethylmaleimide (NEM) | Merck (Sigma-Aldrich) | E3876 | |
| NP-40 | Merck (Sigma-Aldrich) | 492016 | Use either IGEPAL CA-630 or NP-40 for solution, not both. NP-40 alternative suggested |
| Ortho -Phthaldialdehyde (OPA) | Merck (Sigma-Aldrich) | P1378 | |
| PBS 0.1M | Merck (Sigma-Aldrich) | P2272 | PBS can either be acquired pre-made or made in house, see notes |
| Plate reader (with fluoresence capacity) | Tecan | SPARK | |
| Stir bar (optional-For lysis buffer) | Fisher scientific | 16265731 | |
| Toxilight bioassay kit (AK assay) | Lonza | LT17-217 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) 0.5M in H2O | Alfa Aesar | H51864 | Can also be purchased crystalised and suspended |
| TRIS-HCl | Merck (Sigma-Aldrich) | 93363 | |
| X100 phosphatase and protease cocktail | Fisher scientific | 10025743 |
References
- Barnham, K. J., Masters, C. L., Bush, A. I. Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov. 3 (3), 205-214 (2004).
- Arfin, S., et al. Oxidative stress in cancer cell metabolism. Antioxidants. 10 (5), 642 (2021).
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Ghezzi, P., Jaquet, V., Marcucci, F., Schmidt, H. H. H. W. The oxidative stress theory of disease: levels of evidence and epistemological aspects. Br J Pharmacol. 174 (12), 1784-1796 (2017).
- Bhattacharyya, A., Chattopadhyay, R., Mitra, S., Crowe, S. E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 94 (2), 329-354 (2014).
- Yin, F., Sancheti, H., Cadenas, E. Mitochondrial thiols in the regulation of cell death pathways. Antioxi Redox Sig. 17 (12), 1714-1727 (2012).
- Balcerczyk, A., Bartosz, G. Thiols are main determinants of total antioxidant capacity of cellular homogenates. Free Rad Res. 37 (5), 537-541 (2003).
- McBean, G. J. Cysteine, glutathione, and thiol redox balance in astrocytes. Antioxidants. 6 (3), 62 (2017).
- Nimse, S. B., Pal, D. Free radicals, natural antioxidants, and their reaction mechanisms. RSC Adv. 5 (35), 27986-28006 (2015).
- Nordberg, J., Arnér, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system1. Free Rad Biol Med. 31 (11), 1287-1312 (2001).
- Pham-Huy, L. A., He, H., Pham-Huy, C. Free radicals, antioxidants in disease and health. Int J Biomed Sci. 4 (2), 89 (2008).
- Harris, I. S., DeNicola, G. M. The complex interplay between antioxidants and ROS in cancer. Trend Cell Biol. 30 (6), 440-451 (2020).
- Traverso, N., et al. Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev. 2013, 972913 (2013).
- Day, R. M., Suzuki, Y. J. Cell proliferation, reactive oxygen and cellular glutathione. Dose-Resp. 3 (3), 425-442 (2005).
- Aquilano, K., Baldelli, S., Ciriolo, M. R. Glutathione: new roles in redox signaling for an old antioxidant. Front Pharmacol. 5, 196 (2014).
- Zitka, O., et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in paediatric tumour patients. Onco Lett. 4 (6), 1247-1253 (2012).
- Childs, S., Haroune, N., Williams, L., Gronow, M. Determination of cellular glutathione: glutathione disulfide ratio in prostate cancer cells by high performance liquid chromatography with electrochemical detection. J Chrom A. 1437, 67-73 (2016).
- Giustarini, D., et al. glutathione disulfide, and S-glutathionylated proteins in cell cultures. Free Rad Biol Med. 89, 972-981 (2015).
- Özyürek, M., et al. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, L., Lu, B., Lu, C., Lin, J. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 37 (1-2), 30-36 (2014).
- Tsiasioti, A., Georgiadou, E., Zacharis, C. K., Tzanavaras, P. D. Development and validation of a direct HPLC method for the determination of salivary glutathione disulphide using a core shell column and post column derivatization with o-phthalaldehyde. J Chromat B. 1197, 123216 (2022).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. J Agri Food Chem. 53 (6), 1841-1856 (2005).
- Berker, K. I., Güçlü, K., Tor, &. #. 3. 0. 4. ;., Demirata, B., Apak, R. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method. Food Anal Meth. 3 (3), 154-168 (2010).
- Rahman, I., Kode, A., Biswas, S. K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Prot. 1 (6), 3159-3165 (2007).
- Kampa, M., et al. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay. BMC Clin Pathol. 2 (1), 3 (2002).
- Fernández-Checa, J. C., Kaplowitz, N. The use of monochlorobimane to determine hepatic GSH levels and synthesis. Anal Biochem. 190 (2), 212-219 (1990).
- Nauen, R., Stumpf, N. Fluorometric microplate assay to measure glutathione S-transferase activity in insects and mites using monochlorobimane. Anal Biochem. 303 (2), 194-198 (2002).
- Stevenson, D., Wokosin, D., Girkin, J., Grant, M. H. Measurement of the intracellular distribution of reduced glutathione in cultured rat hepatocytes using monochlorobimane and confocal laser scanning microscopy. Toxicol in vitro. 16 (5), 609-619 (2002).
- McBeth, C., Stott-Marshall, R. J. Interference of reversible redox compounds in enzyme catalysed assays–Electrochemical limitations. Anal Biochem. 662, 114972 (2023).
- Yu, Z., et al. Reactive oxygen species-related nanoparticle toxicity in the biomedical field. Nanoscale Res Lett. 15 (1), 115 (2020).
- Boyles, M., et al. Development of a standard operating procedure for the DCFH2-DA acellular assessment of reactive oxygen species produced by nanomaterials. Toxicol Mech Meth. 32 (6), 439-452 (2022).
- Segeritz, C. P., Vallier, L. Cell culture: Growing cells as model systems in vitro. Basic Sci Meth Clin Res. , 151-172 (2017).
- Ma, Q. Role of nrf2 in oxidative stress and toxicity. Ann Rev Pharmacol Toxicol. 53, 401-426 (2013).
- Calabrese, V., Cornelius, C., Dinkova-Kostova, A. T., Calabrese, E. J., Mattson, M. P. Cellular stress responses, the hormesis paradigm, and vitagenes: novel targets for therapeutic intervention in neurodegenerative disorders. Antioxid redox Signal. 13 (11), 1763-1811 (2010).
- Ishkaeva, R. A., Zoughaib, M., Laikov, A. V., Angelova, P. R., Abdullin, T. I. Probing cell redox state and glutathione-modulating factors using a monochlorobimane-based microplate assay. Antioxidants. 11 (2), 391 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved