Method Article
طريقة معدلة للقسطرة داخل القراب في الفئران
In This Article
Summary
هنا ، نقدم طريقة معدلة للقسطرة داخل القراب في الفئران تمثل نهجا بسيطا ومريحا وموثوقا به لإدارة الأدوية داخل القراب المتكررة.
Abstract
تم تطبيق القسطرة داخل القراب على نطاق واسع في التجارب على ، خاصة تلك المتعلقة بألم الأعصاب. ومع ذلك ، لا تزال الطرق التقليدية لها العديد من القيود. على الرغم من أن بعض الباحثين حاولوا تحسين الأساليب التقليدية ، إلا أن الطرق المتاحة لا تزال بحاجة إلى تعديل. هنا ، نقدم طريقة معدلة للقسطرة داخل القراب في الفئران.
تستخدم هذه الطريقة سلكا من الفولاذ المقاوم للصدأ بطول 20 سم (قطره 0.2 مم) ، وأنبوب PE10 بلاستيكي بطول 15 سم ، وغطاء مانع للتسرب عصامي ، وشريط مضاد للحساسية بطول 0.3 سم × 0.5 سم. طريقتنا المعدلة للقسطرة داخل القراب لها العديد من المزايا. أولا ، يؤدي إدخال سلك من الفولاذ المقاوم للصدأ إلى أنبوب PE10 إلى زيادة مرونة الأنبوب ، وتحسين معدل نجاح القسطرة داخل القراب ، وتقليل مقدار المساحة المطلوبة للعملية ، وتقليل الضرر الذي يلحق بالأنسجة حول العمود الفقري القطني. ثانيا ، يتم تحديد طول أنبوب PE10 قبل الجراحة ، ويمكن أن يكون وقت سكون القسطرة أطول من أسبوع واحد. ثالثا ، يتم تثبيت أنبوب PE10 بواسطة خياطة الشكل 8 ، 4 مرات ، مما يمنع حركة الأنبوب والتراجع عندما يتحرك. رابعا ، يتم استخدام غطاء مانع للتسرب عصامي الصنع لإغلاق أنبوب PE10 ، والذي لا يمنع تسرب السائل النخاعي فحسب ، بل يقلل أيضا من الحاجة إلى القطع المتكرر لأنبوب PE10. أخيرا ، يتم ربط الطرف خارج الجسم لأنبوب PE10 بشريط ، مما يمنع تراجع الأنبوب عندما يتحرك.
يمكن أن تزيد هذه الطريقة من معدل نجاح القسطرة في الفئران ، حيث بقيت ما يقرب من 80٪ من أنابيب PE10 في مكانها حتى بعد 28 يوما من الجراحة. وبالتالي ، قد تمثل هذه الطريقة المعدلة نهجا بسيطا ومريحا وموثوقا به لإدارة الأدوية المتكررة داخل القراب.
Introduction
القسطرة داخل القراب (المعروفة أيضا باسم القسطرة تحت العنكبوتية) في الفئران هي طريقة تتضمن إدخال قسطرة في الفضاء تحت العنكبوتية من خلال الفضاء الفقري1. يتم حقن الأدوية مباشرة في الفضاء تحت العنكبوتية من خلال القسطرة ، مما يساعد الباحثين على التحقيق في آثار الأدوية على النخاع الشوكي دون النظر في آثار الأدوية التي تخترق الحاجز الدموي الدماغي2،3. علاوة على ذلك ، يمكن جمع السائل الدماغي النخاعي بعد القسطرة داخل القراب للتحقيق في البيئة المكروية للجهاز العصبي المركزي4،5. تم إنشاء الطريقة المستخدمة حاليا للقسطرة داخل القراب لأول مرة بواسطة Yaksh و Rudy6 في عام 1976 ، ومنذ ذلك الحين ، تم تطبيقها على نطاق واسع في التجارب على في مجالات علم الأعصاب ، والتخدير والتسكين ، وتنظيم القلب والأوعية الدموية بوساطة الحبل الشوكي ، وخاصة آلام الأعصاب2،7. ومع ذلك ، لا تزال هذه الطريقة لها العديد من القيود ، مثل ارتفاع معدل تلف الحبل الشوكي ، والنزيف تحت العنكبوتية ، والخلل الحسي والحركي بعد الجراحة ، وارتفاع معدل الوفيات بعد الجراحة ، وارتفاع خطر الإصابة بضعف عصبي4،5،8،9،10. في محاولة للتغلب على هذه القيود ، اقترح Størkson et al. في عام 199611 ، وتم الإبلاغ عن معدل نجاح أعلى بعد الجراحة. والجدير بالذكر أن تثبيت القسطرة الساكنة لا يزال يمثل تحديا في هذه الطريقة ، كما أن تراجع القسطرة شائع بسبب حركة ، مما يجعل إعطاء الدواء داخل القراب غير مريح.
بسبب القيود المذكورة أعلاه ، حاول بعض الباحثين12،13،14،15 تحسين أدوات الثقب ، وطرق القسطرة ، وطرق تثبيت القسطرة ، ولكن لا تزال الطرق المتاحة بحاجة إلى تعديل بسبب صعوبة تحديد قطر الخرزات المستخدمة ، والحاجة إلى الثقوب المتكررة وقصر طول القسطرة ، إلخ.11
وفقا لنهج أسفل الظهر للقسطرة داخل القراب1 وتقنية Seldinger لقسطرة الوريد المركزي ،16 قمنا بتطوير طريقة للقسطرة داخل القراب في الفئران تستخدم سلكا من الفولاذ المقاوم للصدأ ، وغطاء مانع للتسرب عصامي الصنع ، وشريط مضاد للحساسية لتبسيط الطريقة الحالية. من خلال هذه الطريقة ، يمكن إدخال القسطرة بسهولة في الفضاء تحت العنكبوتية وتثبيتها بثبات على الجزء الخلفي من الفئران ، ويتم تجنب الحاجة إلى ثقوب متكررة لإعطاء الدواء داخل القراب المتكرر.
هنا ، نقدم طريقة معدلة قد تحسن معدل نجاح القسطرة داخل القراب في الفئران وتمثل نهجا بسيطا ومريحا وموثوقا به للإعطاء المتكرر للأدوية داخل القراب.
Protocol
تم إجراء القسطرة داخل القراب بما يتفق تماما مع التوصيات الواردة في المبادئ التوجيهية لرعاية واستخدام المختبر التابعة للمعاهد الوطنية للصحة ، وتمت الموافقة على البروتوكول من قبل لجنة أخلاقيات التجارب ، الصين (No. TJBH15523201). تم استخدام ذكور فئران Sprague-Dawley (SD) في التجربة. تم الحرص على تقليل الألم وعدم الراحة للحيوانات.
1. إعداد المواد والأدوات
ملاحظة: يعد تحضير المواد والأدوات أمرا مهما جدا للقسطرة داخل القراب بنجاح.
- قم بإعداد أنبوب PE10 بطول 15 سم (يتم تحديد الطول وفقا للمسافة بين رأس الفئران ونهاية الذيل) ، وأدخل سلكا من الفولاذ المقاوم للصدأ بطول 20 سم (قطره 0.2 مم) مع طرفين مصقولين في أنبوب PE10 كدعم ، وقم بتمييز الأنبوب 2 سم من أحد طرفيه للإشارة إلى عمق الإدراج (كما هو موضح بالصلبان السوداء في الشكل 1 أ ، ب).
- اقطع الطرف الحاد لإبرة 22 جم وأغلق الطرف البعيد (الشكل 1 ج).
- قطع قسطرة فوق الجافية (1.0 مم في القطر الخارجي) إلى شظايا 1 سم. بعد ذلك ، أدخل جزءا في إبرة 22 جم خالية من الأطراف الحادة (الشكل 1 د) ، وأغلق الطرف البعيد للجزء بزوج من الملقط المستقيم الساخن. يسمى هذا الجهاز غطاء ختم الأنبوب (الشكل 1E).
- قم بإعداد شريط مضاد للحساسية بطول 0.3 سم × 0.5 سم عن طريق قطع شريط حريري (1.25 سم × 9.1 م) بمقص (الشكل 1F).
2. التحضير للجراحة
- جهز الأدوات للقسطرة داخل القراب عن طريق تعقيمها قبل الجراحة. الأدوات المستخدمة في الجراحة هي ملقط مسنن ، مقص ، جهاز تزقيم ، مقبض مشرط وشفرات # 10. (الشكل 2).
- اغمر أنبوب PE10 وسلك التوجيه في 75٪ من الإيثانول للتعقيم لمدة 2 ساعة تقريبا.
3. الجراحة
- تخدير الفئران بنسبة 3٪ أيزوفلوران بمعدل تدفق 3 لتر / دقيقة.
- ضع الجرذ على طاولة العمليات ولاحظ منعكس الانسحاب عند الضغط على المخلب الخلفي بالملقط. أكد غياب حركة المخلب الخلفي استجابة للتحفيز نجاح التخدير. يجب تطبيق تسكين الألم الكافي عن طريق الحقن العضلي بمقدار 1 ملغ/كغ من ميلوكسيكام قبل القسطرة داخل القراب.
- قم بإزالة الشعر من منطقة العمود الفقري القطني في الظهر والمنطقة الواقعة بين الأذنين باستخدام ماكينة حلاقة.
- ضع أنبوب طرد مركزي (قطره 3 سم) تحت بطن الجرذ عند تقاطع الخصر والورك لزيادة الانثناء في العمود الفقري القطني ، مما يوفر مساحة أكبر للإبرة والقسطرة لتمريرها.
- تعقيم المواقع الجراحية (المنطقة الواقعة فوق منطقة العمود الفقري القطني والمنطقة الواقعة بين الأذنين) بمحلول بوفيدون اليود ثم بمحلول الإيثانول ثلاث مرات. قم بتغطية الجرذ بضمادة معقمة ، وفضح المواقع الجراحية. ثم اغسل أنبوب PE10 وسلك التوجيه بمحلول ملحي عادي قبل الجراحة.
ملاحظة: لم يتم تغطية الذيل بحيث يمكن ملاحظة حركة الذيل أثناء القسطرة داخل القراب. - حدد موقع الفراغ الفقري بين L5 و L6 عن طريق تحديد موقع العملية الشائكة ل L6 عند نقطة المنتصف بين القمم الحرقفية الثنائية اليمنى واليسرى. ثبت الجلد بالإبهام الأيسر والسبابة اليسرى للمشغل ، ثم قم بعمل شق خط الوسط بطول 3-4 سم فوق العملية الشائكة بين L4 و S1.
- افصل الأنسجة تحت الجلد بصراحة باستخدام مقص. حدد موقع الفراغ الفقري بين L5 و L6 مرة أخرى وقم بعمل شق صغير (0.3 - 0.5 سم) على جانبي العمليات الظهرية L5 و L6.
- قم بتثبيت ورفع العملية الظهرية L5 باستخدام زوج من الملقط المسنن لتوسيع المساحة الفقرية. بعد ذلك ، افصل بصراحة العضلات حول الجسم الفقري باستخدام مقص حتى ينكشف الجزء العلوي من العملية الظهرية L6 تماما.
ملاحظة: يجب تجنب إزالة أي جزء من الجسم الفقري والعضلات ، بهدف تقليل الضرر الذي يلحق بالأنسجة المحيطة. - عندما يتم رفع العملية الظهرية L5 بزوج من الملقط المسنن ويتم توسيع المساحة الفقرية بزوج آخر من الملقط ، قم بتنظيف المساحة الفقرية L5-6 بكرة قطنية حتى تنكشف المنطقة "V" المقلوبة تماما.
- ثقب العمود الفقري بإبرة 23 جم في المنطقة المقلوبة "V" أسفل الجزء العلوي من العملية الظهرية L6.
ملاحظة: لوحظ نفض الغبار عن الذيل ، و / أو يتدفق السائل الشفاف عديم اللون من الفضاء تحت العنكبوتية ، مما يشير إلى ثقب ناجح في الفضاء تحت العنكبوتية. - أدخل أنبوب PE10 الذي يحتوي على سلك من الفولاذ المقاوم للصدأ بعناية في القناة الشوكية في موقع البزل ، مع إمالته بزاوية 30 درجة باتجاه الذيل. اضبط زاوية الإدراج حتى يمكن إدخال أنبوب PE10 بنجاح دون مقاومة (لوحظ نقرة الذيل أثناء هذه العملية).
- عندما تصل المنطقة المحددة من أنبوب PE10 إلى العضلات الخلفية ، يتم إيقاف القسطرة.
- قم بإزالة السلك المقاوم للصدأ ببطء من أنبوب PE10. يمكن ملاحظة نفض الغبار عن الذيل.
ملاحظة: يمكن ملاحظة نفض الغبار عن الذيل ، وبعد إزالة السلك ، قد يتدفق السائل الشفاف (أو السائل الأحمر الفاتح) من الأنبوب. - بعد ذلك ، قم بتوصيل أنبوب PE10 بحقنة سعة 1 مل ، يتم من خلالها حقن 20 ميكرولتر من المحلول الملحي العادي. بعد إزالة المحقنة ، سوف يتدفق المحلول الملحي باستمرار من أنبوب PE10 ، مما يشير إلى أنه تم إدخاله بنجاح في الفضاء تحت العنكبوتية.
- بمجرد التأكد من أن أنبوب PE10 غير عائق ، قم بخياطة العضلات الموجودة على جانب واحد من الجسم الفقري بخياطة 4-0 وقم بعمل عقدة. ثم اربط الخيط حول أنبوب PE10 وقم بعمل عقدة أخرى. لا تقطع خياطة. خياطة العضلات على الجانب الآخر. اربط الخيط بأنبوب PE10 مرة أخرى ، وقم بعمل عقدة ثالثة ، وقطع الخياطة.
ملاحظة: تعمل هذه العملية على إصلاح أنبوب PE10 بخيط الشكل 8 لتقليل احتمالية إزاحة الأنبوب وتراجع عنه. - قم بعمل شق بطول 0.5 سم 1 سم تحت نقطة المنتصف بين الأذنين. افصل الأنسجة تحت الجلد بصراحة بالمقص ، وأدخل أنبوب تزقيم معدني باتجاه الذيل حتى يصبح الطرف مرئيا في شق أسفل الظهر.
- أدخل الطرف البعيد لأنبوب PE10 في أنبوب التزقيم حتى يخرج أنبوب PE10 من الطرف الآخر من أنبوب التزقيم ؛ ثم اسحب التزقيم برفق.
- عندما يتم التأكد من أن أنبوب PE10 غير عائق مرة أخرى ، قم بخياطة العضلات المتبقية حول الشق القطني بخياطة 4-0 ، واربط الخيط حول أنبوب PE10 ، وقم بعمل عقدة أخرى لإصلاح أنبوب PE10 مرة أخرى.
- خياطة الجلد ، وتجنب تلف أنبوب PE10. بعد ذلك ، قم بخياطة جلد الرقبة بخياطة 4-0 ، واربط الخيط حول أنبوب PE10 ، وقم بعمل عقدة لإصلاح أنبوب PE10.
- عندما يتم التأكد من أن أنبوب PE10 غير عائق مرة أخرى ، قم بإغلاق الطرف خارج الجسم لأنبوب PE10 بغطاء مانع للتسرب.
- جفف أنبوب PE10 بقطعة من الأنسجة ثم اربط الشريط المضاد للحساسية حول أنبوب PE10 عدة مرات لمنع تراجع أنبوب PE10 أثناء حركة الفئران.
4. تجربة التحقق من صحة الليدوكائين
- بعد الجراحة ، أعد الجرذ إلى قفصه (واحد لكل قفص) وراقبه عن كثب أثناء التعافي من التخدير حتى يستوعي الفئران.
- بعد أن يستيقظ الجرذ تماما ، قم بإزالة غطاء مانع التسرب وحقن 20 ميكرولتر من 2٪ ليدوكائين في أنبوب PE10 بمعدل 0.02 مل / ثانية عبر حقنة هاميلتون ، متبوعا بحقن 10 ميكرولتر من المحلول الملحي العادي.
- أغلق أنبوب PE10 بغطاء الختم.
- ضع الجرذ على طاولة وراقب بعناية. يشير وجود شلل في الأطراف الخلفية بعد الحقن داخل القراب من الليدوكائين (من أنبوب PE10) إلى نجاح القسطرة (الشكل 3). عادة ما يستمر شلل الأطراف الخلفية حوالي 30 دقيقةو 10.
ملاحظة: اسمح للفأر بالتعافي لمدة 5-7 أيام قبل التجارب التالية. - راقب الجرذ عن كثب خلال فترة التعافي حتى الشفاء التام لوظيفة الأطراف.
النتائج
بالنسبة للحقن داخل القراب ، تم قطع الطرف خارج الجسم لأنبوب PE10 ، وتم إغلاق أنبوب PE10 بغطاء مانع للتسرب بين حقنتين للدواء. في دراستنا التجريبية ، كان معدل نجاح القسطرة داخل القراب حوالي 95٪ (19 من أصل 20 فأرا). تمت الإشارة إلى النجاح من خلال نفض الغبار عن الذيل و / أو إطلاق سائل شفاف عديم اللون أثناء العملية. ظل ما يقرب من 85٪ من الأنابيب في مكانها بعد 7 أيام من الجراحة ، وظل ما يقرب من 80٪ في مكانها بعد 28 يوما من الجراحة. تعافت الفئران بعد فترة وجيزة من العملية ، ولم يلاحظ أي مضاعفات في غضون 7 أيام بعد الجراحة. كانت الحركة اليومية طبيعية ، ولم يلاحظ شذوذ سلوكي. تشير هذه النتائج إلى أن طريقتنا متفوقة على تلك التي تم الإبلاغ عنها سابقا من حيث معدل النجاح ومعدل الإقامة الطويلة.
يشير الشلل الكامل للأطراف السفلية عند حقن الليدوكائين عن طريق القسطرة إلى نجاح القسطرةداخل القراب 15. يتم حساب معدل نجاح القسطرة داخل القراب بقسمة العدد الإجمالي للفئران على عدد الفئران ذات القسطرة الناجحة. باستخدام طريقتنا المعدلة ، كان معدل النجاح 95٪ ، وهو أكبر من المعدل الذي تم تحقيقه بالطريقة التي أبلغ عنها Hou et al. (88٪) 15. يظهر هذا في الشكل 4.
تمت مراقبة الأنبوب داخل القراب بعد 2 و 5 و 7 أيام من القسطرة داخل القراب وتم حساب معدل القسطرة الناجحة للسكان على أنه عدد الفئران ذات القسطرة الناجحة / العدد الإجمالي للفئران × 100٪. في 2 و 5 و 7 أيام بعد القسطرة داخل القراب ، كان معدل القسطرة الناجحة الساكنة 94٪ و 81٪ و 65٪ على التوالي ، في دراسة StØrkson et al.11. كان معدل القسطرة الناجحة في 2 و 5 و 7 أيام بعد القسطرة داخل القراب 95٪ و 90٪ و 85٪ على التوالي ، باستخدام تقنيتنا (الشكل 5).

الشكل 1. المواد والأدوات المستخدمة في القسطرة داخل القراب. (أ) تم إعداد أنبوب PE10 بطول 15 سم ، وتم تمييز الأنبوب بمقدار 2 سم من أحد طرفيه للإشارة إلى عمق الإدخال. (ب) تم إدخال سلك من الفولاذ المقاوم للصدأ بطول 20 سم مع طرفين مصقولين في أنبوب PE10 كدعم. (ج) تم قطع الطرف الحاد لإبرة 22G بمقص ، وتم إغلاق الطرف البعيد بزوج من الملقط. (د) تم تقطيع قسطرة فوق الجافية (1.0 مم في القطر الخارجي) إلى شظايا بطول 1 سم ، ثم تم إدخالها في إبرة 22G الخالية من الأطراف الحادة. (ه) تم إغلاق الطرف البعيد للقسطرة فوق الجافية بزوج من الملقط المستقيم المسخن؛ كان هذا الجهاز يسمى غطاء ختم الأنبوب. (F) تم تحضير شريط مضاد للحساسية مقاس 0.3 سم × 0.5 سم (شريط حريري ، 1.25 سم × 9.1 م) بمقص. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
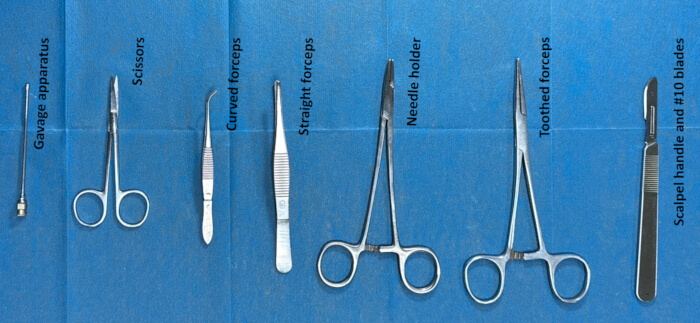
الشكل 2. تحضير أدوات القسطرة داخل القراب. تم تعقيم الأدوات (مثل الملقط المسنن والمقص وجهاز التزقيم ومقبض المشرط والشفرات # 10) بالإيثانول لمدة ساعتين تقريبا ثم غسلها بمحلول ملحي عادي قبل 30 دقيقة تقريبا من الجراحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
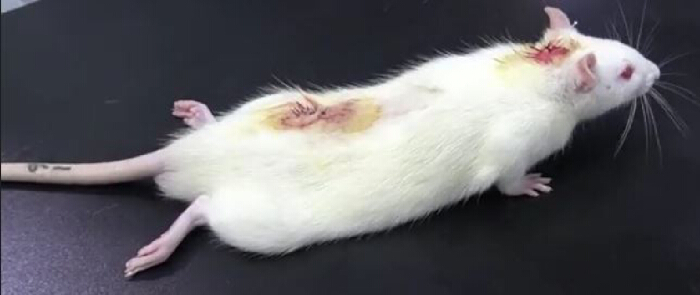
الشكل 3. نتائج تجربة التحقق من صحة الليدوكائين بعد القسطرة داخل القراب. بعد الحقن داخل القراب من 20 ميكرولتر من الليدوكائين 2٪ متبوعا بحقن 10 ميكرولتر من المحلول الملحي العادي ، أصيب الجرذ بالشلل مؤقتا: حدث شلل في الأطراف السفلية في غضون 30 ثانية واختفى بعد 30 دقيقة ، مما يشير إلى نجاح القسطرة داخل القراب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
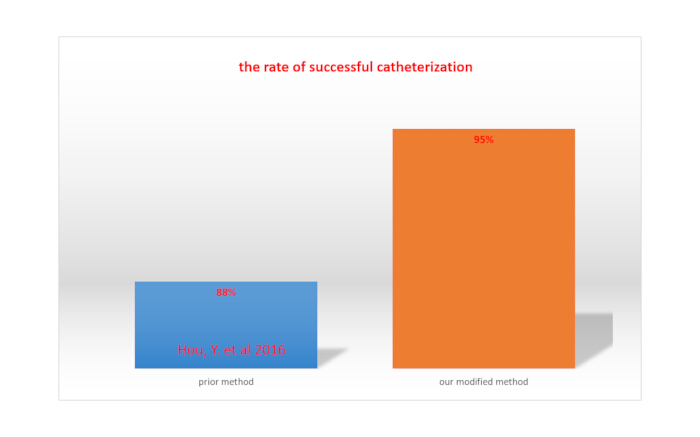
الشكل 4. مقارنة بين معدل القسطرة الناجحة بين طريقتنا المعدلة والطريقة التي تم الإبلاغ عنها سابقا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
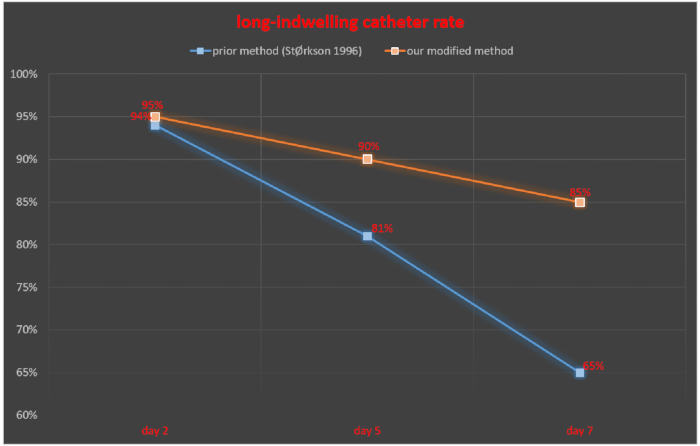
الشكل 5. مقارنة بين معدل القسطرة طويلة الأمد بين طريقتنا المعدلة والطريقة التي تم الإبلاغ عنها سابقا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| طريقة معدلة | الطريقة السابقة | مزايا الطريقة المعدلة | عيوب الطريقة السابقة | |
| طريقة إرشادية للإدخال | سلك من الفولاذ المقاوم للصدأ | دليل القناء (20 جم 0.9× 38 مم) | يزيد من مرونة الأنبوب ، | يصعب الشعور بالمقاومة ، مما يزيد من صعوبة التشغيل |
| يحسن معدل نجاح القسطرة داخل القراب | تلف الأنسجة بسبب البزل المتكرر | |||
| يقلل من متطلبات مساحة التشغيل | يتم تمديد أحد طرفي الأنبوب إلى 1.5 مرة من الطول الأصلي ، مما يجعل قطر كلا الطرفين مختلفا | |||
| يقلل من تلف الأنسجة حول العمود الفقري القطني | القابلية لتسرب السائل النخاعي لأن قطر القنية التوجيهية 20G هو 2 مرات أو أكثر من أنبوب PE10 الممتد | |||
| طول أنبوب PE10 | 15 سم | 14 أو 28 سم | من السهل تحديد طول أنبوب PE10 بغض النظر عن مدة سكن القسطرة | مدة سكن القسطرة أقصر لأنبوب PE10 أقصر. القابلية للسقوط من الجسم لأنبوب PE10 الطويل |
| طريقة التثبيت | خياطة "8" و 4 مرات | 1 أو 2 حبة | يتجنب حركة الأنبوب والتراجع أثناء أنشطة | الاختلاف في قطر الأنبوب في كلا الطرفين ، والقابلية لإزاحة أنبوب PE10 أثناء صنع الخرز |
| طريقة لختم الأنبوب | غطاء عصامي | لا | يمنع تسرب السائل الدماغي النخاعي | متطلبات القطع المتكرر لأنبوب PE10 |
| يتجنب القطع المتكرر لأنبوب PE10 | ||||
| طريقة لمنع التراجع | شريط مضاد للحساسية | 1 أو 2 حبة | يمنع الأنبوب من التراجع أثناء الأنشطة الحيوانية | القابلية للتراجع |
الجدول 1. مزايا وعيوب الطريقة المعدلة والطريقة التي تم الإبلاغ عنها مسبقا.
Discussion
هناك العديد من النصائح الهامة لهذه الطريقة المعدلة لزيادة معدل نجاح القسطرة داخل القراب. أولا ، يجب تحضير سلك من الفولاذ المقاوم للصدأ بطول 20 سم مع طرفين مصقولين وإدخاله في أنبوب PE10 كدعم. ثانيا ، يجب على المشغل كشف المنطقة المقلوبة "V" تماما بعد تنظيف المساحة الفقرية L5-6 بكرة قطنية ، ويجب توسيع المساحة الفقرية بملقط آخر أثناء رفع العملية الظهرية L5 باستخدام ملقط مسنن. ثالثا ، يجب تثبيت أنبوب PE10 بخيط الشكل 8 أربع مرات. أخيرا ، يجب ربط الطرف خارج الجسم لأنبوب PE10 بشريط ومختومه بغطاء عصامي.
قد يؤثر معدل نجاح القسطرة داخل القراب وتلف الأنسجة حول الأجسام الفقرية بشكل كبير على موثوقية النتائج التجريبية15. وبالتالي ، فإن تحسين معدل النجاح قدر الإمكان وتقليل الضرر الذي يلحق بالأنسجة المحيطة أمر بالغ الأهمية في إنشاء نماذج حيوانية وتجارب ذات صلة1. في هذه الطريقة المعدلة ، يتم إدخال سلك من الفولاذ المقاوم للصدأ في أنبوب PE10 للتوجيه ، مما يزيد من مرونة الأنبوب ويحسن معدل نجاح القسطرة داخل القراب. علاوة على ذلك ، يتم تقليل مقدار المساحة اللازمة للتشغيل بهذه الطريقة المعدلة ، ويتم تقليل الضرر الذي يلحق بالأنسجة حول العمود الفقري القطني لأن الأنسجة المحيطة منفصلة بشكل صريح ، ولكن لا يتم قطعها. بالمقارنة ، في الطريقة11 التي تم الإبلاغ عنها سابقا ، يتم استخدام قنية توجيه 20 جم لتقليل المقاومة أثناء الثقب ، وغالبا ما تكون هناك حاجة إلى ثقب متكرر ، مما قد يؤدي إلى إصابة الأنسجة. بالإضافة إلى ذلك ، في الطريقة التي تم الإبلاغ عنها سابقا ، لتقليل قطر أنبوب PE10 ، يتم غمره في ماء دافئ (60 درجة مئوية) ثم يتم تمديده في أحد طرفيه إلى ما يقرب من 150٪ من الطول الأصلي ، مما قد لا يضمن تناسق قطر الأنبوب وبالتالي قد يتسبب في تسرب السائل النخاعي لأن قطر قنية التوجيه 20G أكبر أو يساوي قطر أنبوب PE10 الممتد مرتين. علاوة على ذلك ، في طريقتنا ، يتم الحفاظ على وظيفة أسفل الظهر إلى أقصى حد ، مما يتجنب تأثير الجراحة على نتائج التجارب اللاحقة. تتوافق هذه النتائج مع تلك التي أبلغ عنها Xu etal 2.
في الطريقة11 التي تم الإبلاغ عنها سابقا ، يبلغ طول أنبوب PE10 حوالي 14 سم إذا تم تثبيت الأنبوب في الموقع المحيط بموقع البزل ، ولكن غالبا ما يكون وقت سكون القسطرة أقصر من 7 أيام في ظل هذه الظروف (أو يتم إزالة الأنبوب من الجسم بواسطة الفئران). يبلغ طول أنبوب PE10 حوالي 28 سم إذا تم تثبيت الأنبوب في مؤخرة العنق ، وهو أطول بكثير من أنبوب PE10 المستخدم في طريقتنا (15 سم). على الرغم من أن الخرزات تشكلت وفقا للبروتوكول الذي أبلغ عنه Størkson et al.11 ، فقد تمت إزالة بعض الأنابيب من الجسم ، ولم يتم تثبيت ما يقرب من 65٪ فقط من الأنابيب في مكانها بعد 7 أيام من الجراحة ، مما أثر بشكل كبير على نتائج التجارب اللاحقة. في طريقتنا ، يتم تثبيت أنبوب PE10 بخياطة الشكل 8 4 مرات ، ويتم ربط الطرف خارج الجسم لأنبوب PE10 بشريط لتقليل احتمالية الإزاحة والتراجع. باتباع طريقتنا ، ظل ما يقرب من 85٪ من الأنابيب في مكانها بعد 7 أيام من الجراحة ، وبقيت ما يقرب من 80٪ من الأنابيب في مكانها بعد 28 يوما من الجراحة.
في الطريقة11 التي تم الإبلاغ عنها سابقا ، يجب قطع الطرف خارج الجسم للقسطرة داخل القراب لكل إعطاء دواء. ومع ذلك ، فإن الإعطاء المتكرر للأدوية داخل القراب قد يقصر وقت سكون القسطرة ، مما يجعل إعطاء الأدوية داخل القراب غير مريح. لذلك ، في طريقتنا ، يتم استخدام غطاء عصامي لإغلاق أنبوب PE10 ، والذي يتم تعقيمه بالإيثانول مرة واحدة يوميا. هذا لا يمنع تسرب السائل الدماغي النخاعي فحسب ، بل يقلل أيضا من الحاجة إلى القطع المتكرر لأنبوب PE10 لإعطاء الأدوية داخل القراب ، مما يضمن التوصيل الفعال للأدوية.
يتم تلخيص مزايا وعيوب الطريقة المعدلة والطريقة المبلغ عنها سابقا في الجدول 1. أولا ، بالنسبة للطريقة المعدلة ، فإن استخدام الأسلاك المصنوعة من الفولاذ المقاوم للصدأ في أنبوب PE10 يزيد من مرونة الأنبوب ويحسن معدل نجاح القسطرة داخل القراب ، ويتم تقليل مقدار المساحة اللازمة للعملية ، وتقليل الضرر الذي يلحق بالأنسجة حول العمود الفقري القطني. في الطريقة التي تم الإبلاغ عنها سابقا ، يتم إدخال قنية توجيه 20G حتى تشعر بالمقاومة ، وغالبا ما تكون هناك حاجة إلى ثقب متكرر ، مما قد يؤدي إلى تلف الأنسجة. بالإضافة إلى ذلك ، يتم شد أنبوب PE10 في أحد طرفيه حتى يصل طوله إلى حوالي 150٪ من الطول الأصلي ، مما قد يتسبب في تسرب السائل النخاعي لأن قطر قنية التوجيه 20G أكبر أو يساوي قطر أنبوب PE10 الممتد. ثانيا ، في الطريقة المعدلة ، يتم تحديد طول أنبوب PE10 قبل الجراحة ، ويمكن أن يكون وقت سكون القسطرة أطول من أسبوع واحد. في الطريقة التي تم الإبلاغ عنها سابقا ، يبلغ طول أنبوب PE10 حوالي 14 سم إذا تم تثبيته في موقع البزل ، ولكن غالبا ما يكون وقت سكون القسطرة أقصر من 7 أيام لأن الأنبوب عرضة للخروج من الجسم بواسطة الفئران. يبلغ طول أنبوب PE10 حوالي 28 سم إذا تم تثبيته في مؤخرة العنق ، وهو أطول بكثير من طول الأنبوب المستخدم في طريقتنا. ثالثا ، في الطريقة المعدلة ، يتم تثبيت أنبوب PE10 بخياطة الشكل 8 4 مرات لمنع حركة الأنبوب وتراجع ؛ يتم استخدام غطاء عصامي الصنع لإغلاق أنبوب PE10 ، والذي لا يمنع تسرب السائل النخاعي فحسب ، بل يمنع أيضا الحاجة إلى القطع المتكرر لأنبوب PE10. في الطريقة التي تم الإبلاغ عنها سابقا ، من الصعب الحصول على خرز بقطر ثابت ، ويكون إزاحة أنبوب PE10 أمرا شائعا عند تشكيل الخرز ، وغالبا ما تكون هناك حاجة إلى قطع متكرر لأنبوب PE10. أخيرا ، في الطريقة المعدلة ، يتم ربط الطرف خارج الجسم لأنبوب PE10 بشريط ، مما يمنع الأنبوب من التراجع أثناء الحركة. ومع ذلك ، في الطريقة السابقة ، لا يمكن للحبات أن تمنع بشكل موثوق تراجع أنبوب PE10 لأنه من الصعب الحصول على حبات بقطر ثابت.
بشكل عام ، تتمتع هذه الطريقة المعدلة للقسطرة داخل القراب بالمزايا التالية. أولا ، يؤدي استخدام الأسلاك المصنوعة من الفولاذ المقاوم للصدأ في أنبوب PE10 إلى زيادة مرونة الأنبوب وتحسين معدل نجاح القسطرة داخل القراب ، ويتم تقليل مقدار المساحة اللازمة للعملية ، وتقليل تلف الأنسجة حول العمود الفقري القطني ، مما يحافظ على وظيفة أسفل الظهر إلى أقصى حد ممكن ويتجنب تأثير الجراحة على نتائج التجارب اللاحقة. ثانيا ، يتم تثبيت أنبوب PE10 بخياطة الشكل 8 4 مرات ، مما يمنع حركة الأنبوب والتراجع أثناء الحركة. ثالثا ، يتم استخدام غطاء مانع للتسرب عصامي الصنع لإغلاق أنبوب PE10 ، والذي لا يمنع تسرب السائل النخاعي فحسب ، بل يمنع أيضا الحاجة إلى القطع المتكرر لأنبوب PE10. قد يؤدي القطع المتكرر للقسطرة إلى تقصير القسطرة ، مما يجعل توصيل الأدوية غير مريح. أخيرا ، يتم ربط الطرف خارج الجسم لأنبوب PE10 بشريط مضاد للحساسية ، مما يمنع الأنبوب من التراجع أثناء الحركة.
ومع ذلك ، هناك العديد من القيود في تقنية القسطرة داخل القراب المعدلة. أولا ، بعد الجراحة ، يجب إيواء الفئران بشكل منفصل (واحد لكل قفص) لتجنب تلف الطرف خارج الجسم لأنبوب PE10. ثانيا ، هناك حاجة إلى التعافي لمدة 5-7 أيام بعد حقن الليدوكائين داخل القراب قبل التجارب اللاحقة.
في الختام ، قد تكون هذه الطريقة المعدلة للقسطرة داخل القراب بمثابة أداة مفيدة للإعطاء المتكرر للأدوية داخل القراب وتمثل طريقة بسيطة ومريحة وموثوقة لتقصير مدة التجارب.
Disclosures
يعلن مؤلفو هذه المخطوطة أنه لا يوجد تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية (رقم 81971042) ومشاريع الدعم المتخصصة الرئيسية التابعة للجنة الصحة في مقاطعة شنغهاي هونغكو (رقم 10). HKZK2020A06).
Materials
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
References
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved