نهج الموائع الدقيقة لحل إفراز السيتوكين المتزامن والمتسلسل للخلايا الفردية متعددة الوظائف
* These authors contributed equally
In This Article
Summary
يصف البروتوكول منصة الموائع الدقيقة المتقدمة لقياس ديناميكيات إفراز السيتوكين لخلايا الدم أحادية النواة المحيطية البشرية الفردية. تقيس المنصة ما يصل إلى ثلاثة سيتوكينات بالتوازي (IL-6 و TNFα و IL-1β) لكل خلية فردية يتم تحفيزها باستخدام عديد السكاريد الدهني كمثال.
Abstract
يمكن أن تؤدي العدوى وأمراض المناعة الذاتية والاستجابات المناعية المرغوبة والسلبية للعلاج إلى استجابة معقدة وديناميكية للسيتوكين في الجسم الحي. تتضمن هذه الاستجابة العديد من الخلايا المناعية التي تفرز العديد من السيتوكينات لتنظيم التفاعل المناعي. ومع ذلك ، فإن ديناميكيات الإفراز والكميات والحدوث المشترك للسيتوكينات المختلفة حسب الأنواع الفرعية المختلفة للخلايا لا تزال غير مفهومة بشكل جيد بسبب نقص الأدوات المناسبة لدراستها. هنا ، نصف بروتوكولا باستخدام منصة قطرات الموائع الدقيقة التي تسمح بالقياس الكمي الذي تم حله زمنيا لديناميكيات الإفراز للعديد من السيتوكينات بالتوازي على مستوى الخلية الواحدة. يتم تمكين ذلك من خلال تغليف الخلايا الفردية في قطرات الموائع الدقيقة جنبا إلى جنب مع مقايسة مناعية متعددة الإرسال للقياس الكمي المتوازي لتركيزات السيتوكين ، وتجميدها للتصوير الفلوري الديناميكي ، وتحليل الصور المعنية لاشتقاق الكميات والديناميكيات المفرزة. يصف البروتوكول تحضير الجسيمات النانوية المغناطيسية الوظيفية ، وتجارب المعايرة ، وإعداد الخلايا ، وتغليف الخلايا والجسيمات النانوية في قطرات للتصوير الفلوري وتحليل الصور والبيانات اللاحقة باستخدام مثال خلايا الدم البشرية أحادية النواة المحفزة عديد السكاريد الشحمي. حددت المنصة المقدمة سلوك إفراز السيتوكين المتميز للخلايا المفردة والمشتركة ، مما يميز عدم التجانس الظاهري المتوقع في عينة الخلية المقاسة. علاوة على ذلك ، تسمح الطبيعة المعيارية للفحص بتكييفه وتطبيقه لدراسة مجموعة متنوعة من البروتينات والسيتوكينات وعينات الخلايا ، مما قد يؤدي إلى فهم أعمق للتفاعل بين أنواع الخلايا المناعية المختلفة ودور السيتوكينات المختلفة التي تفرز ديناميكيا لتشكيل الاستجابة المناعية المنظمة بإحكام. يمكن أن تكون هذه الأفكار الجديدة مثيرة للاهتمام بشكل خاص في دراسات عدم التنظيم المناعي أو في تحديد السكان المستهدفين في العلاج وتطوير الأدوية.
Introduction
غالبا ما تسبب العدوى تفاعلات مضيفة معقدة تشمل جهاز المناعة الفطري والتكيفي 1,2. عند الإصابة أو التعرف على العوامل المعدية ، يمكن للخلايا المضيفة إنتاج مجموعة متنوعة من الكيماويات والسيتوكينات ، وهي بروتينات صغيرة تعرف باسم الاتصالات الحرجة وتعديل الجهاز المناعي3. يتم إطلاق السيتوكينات المؤيدة للالتهابات في وقت مبكر من الإصابة لبدء الاستجابة المناعية ، تليها لاحقا السيتوكينات المضادة للالتهابات ، والتي تعتبر ضرورية لمنع تلف الأنسجة والأمراض المزمنة أو الالتهابية الذاتية اللاحقة. يتجلى هذا التوازن بين القضاء على التهديد وحماية الأنسجة كذخيرة واسعة من السيتوكينات التي تمارس وظائف مختلفة أثناء العدوى ، مما يسمح بضبط الاستجابة 4,5. داخل هذا الخليط، يمكن ملاحظة التوقيعات الفريدة اعتمادا على مسبب المرض والإشارات التي يحفزها، وموقع الأنسجة، والخلايا المناعية التي تنشأ منها. ومع ذلك ، يبدو أن إطلاق السيتوكين يشكل أيضا عملية بيولوجية متعددة الوظائف فريدة من نوعها لكل مجموعة من الخلايا ، ومتنوعة في ديناميكيات الإفراز والاستجابة الفردية. تم وصف عدم التجانس هذا في الأدبيات لسنوات عديدة ، على سبيل المثال ، بين المجموعات السكانية الفرعيةللخلايا التائية 6,7 ، حيث أظهرت التحقيقات في الأمراض الالتهابية الذاتية والتهابات COVID-19 الشديدة تنوعا وظيفيا كبيرا لعلامات الالتهاب داخل وبين المرضى 8,9. في الآونة الأخيرة ، سلط ظهور تسلسل الخلية الواحدة الضوء على اللدونة العالية والحديث المتبادل بين المجموعات السكانية الفرعية داخل البيئات الدقيقة المناعية التي لم تكن واضحة من قبل ، مما يشير إلى أن طرق الخلية الواحدة ضرورية لالتقاط هذا عدم التجانس10,11. بينما يتم تطوير طرق جديدة لتحليل النسخ ، لا يزال تحليل النمط الظاهري يمثل تحديا ، لأن هذا يتطلب قياسات متزامنة وكمية وزمنية لإفراز البروتين على مستوى خلية واحدة. تسمح لنا هذه القياسات بالتحقيق في هويات الخلايا المفرزة وديناميكياتها وأنماط الإفراز (بطيئة / سريعة ، مبكرة / متأخرة ، متزامنة / متسلسلة) لذخيرة أو لوحة من السيتوكينات. من خلال تمكين دراسة ديناميكيات إطلاق السيتوكين أثناء الاستجابة المناعية كميا وبدقة زمنية ، قد تسمح الأفكار الناتجة بفهم المجموعة الخلوية والاستجابة المستحثة.
في البروتوكولات القياسية ، عادة ما يتم الكشف عن السيتوكينات في طاف معلقات الخلايا والمصل باستخدام مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) ، مما ينتج عنه كميات مفرزة بكميات كبيرة. لا تسمح القياسات السائبة بالقياس الكمي لكميات السيتوكين التي تنتجها كل خلية ، وهي مشكلة تم تسليط الضوء عليها بشكل خاص في عينات الخلايا غير المتجانسة. تكتشف الطرق البديلة مثل تلطيخ السيتوكين داخل الخلايا أو مقايسة البقعة المناعية المرتبطة بالإنزيم (ELISpot) أو المقايسات المحفورة الدقيقة (على سبيل المثال ، Isoplexis) السيتوكينات التي تعبر عنها الخلايا الفردية ولكنها توفر قياسات نقطة النهاية فقط12,13. هذا يعني تجاهل ديناميكيات الإفراز والتغيرات التي قد تحدث في نمط الإفراز الخلوي خلال فترة الحضانة. بالإضافة إلى ذلك ، لا يمكن لقياسات نقطة النهاية التمييز بين إفراز السيتوكين المتزامن والمتسلسل ، لذلك يظل المدى الحقيقي لتعدد الوظائف المتزامنة للخلايا المناعية في إفراز السيتوكين غير واضح باستخدام هذه الطرق.
يمكن تحقيق دقة الخلية الواحدة باستخدام الموائع الدقيقة القطيرية لتوليد ومعالجة مقصورات مادية بحجم بيكولتر من أجل دراسة الخلايا المناعية على الأنماط الظاهرية الفريدة لإفراز السيتوكين على مستوى الخليةالواحدة 14,15. تتكون هذه المقصورات من مستحلبات الماء في الزيت ويمكن توليدها باستخدام رقائق الموائع الدقيقة16,17. في الواقع ، أظهرت مقايسات الموائع الدقيقة القائمة على القطيرات تنوعا شديدا في تمكين تحليل العينات والذخيرة البيولوجية المختلفة على مستوى الخلية الواحدة وتكاملها مع المنبع (معالجة الخلايا والكواشف) وعمليات المصب (فرز الخلية الواحدة أو البروتينات أو التسلسل)18،19،20،21،22. على وجه الخصوص ، تسمح الإعدادات التي تسمح بتثبيت القطيرات بقياس وظيفة الخلية الواحدة بمرور الوقت ، وهو أمر مهم لتحليل إفراز البروتين18. علاوة على ذلك ، فإن دمج المقايسات الكمية متعددة الإرسال يسهل إجراء تحقيقات إضافية في أبعاد لم يكن من الممكن الوصول إليها سابقا ، في عمليات مثل الإفراز المشترك وتحديد الخلايا المناعية متعددة الوظائف23,24.
في هذا البروتوكول ، نصف سير عمل أحادي الخلية قائم على القطيرات الثابتة لاكتشاف وقياس وقياس إفراز ما يصل إلى ثلاثة سيتوكينات بالتوازي من الخلايا الفردية17,23. توفر هذه التقنية القدرة على مراقبة استجابات السيتوكين من أكثر من 20000 خلية بالتوازي.
يتكون سير العمل المقدم من تغليف الموائع الدقيقة للخلايا المناعية المفردة والجسيمات النانوية الوظيفية في قطرات ماء في زيت 60 pL. يسمح تجميد >100000 قطرة في غرفة المراقبة والفحص المجهري الفلوري الذي تم حله بمرور الوقت بقياس ديناميكيات إفراز السيتوكين داخل كل قطرة وكل سيتوكين (الشكل 1 أ). لكل خلية فردية داخل قطرة ، يتم قياس إفراز السيتوكين بواسطة مقايسة مناعية شطيرة ، حيث تربط الجسيمات النانوية المغناطيسية التي تعمل بجسم مضاد التقاط محدد السيتوكين المفرز ، مما يؤدي إلى النقل اللاحق وربط الأجسام المضادة للكشف الموسومة بالفلورسنت (الشكل 1B ، C). يتم تشكيل خط الخرز عن طريق محاذاة الجسيمات النانوية المغناطيسية ، والتي يمكن تحديد انتقال التألق إليها في وجود السيتوكين. هنا ، يتم تعريف نقل التألق على أنه متوسط شدة التألق الموجود على خط الخرز مقسوما على متوسط شدة التألق للقطرة المتبقية. يمكن مضاعفة هذا الفحص للعديد من السيتوكينات عن طريق خلط دفعات الجسيمات النانوية ذات الوظائف المختلفة والأجسام المضادة للكشف ذات الصلة الموسومة في قنوات مضان مختلفة23 ، مما يؤدي إلى عمليات نقل مضان محددة في القنوات المختلفة. بمساعدة برنامج نصي مخصص للتحليل ، يمكن استخراج قيم نقل التألق ، ويمكن تحويل الصور إلى ملفات تعريف ديناميكية إفرازية لكل خلية فردية وسيتوكين. لذلك ، فإن مجموعات البيانات الناتجة تنتج العديد من القراءات ، مثل قياس الإفراز الكمي بمرور الوقت ، وتحديد المجموعات السكانية الفرعية المشتركة ، وتوزيعات الخلايا وفقا للكميات المفرزة ، والمعدلات ، ومجموعات السيتوكينات.
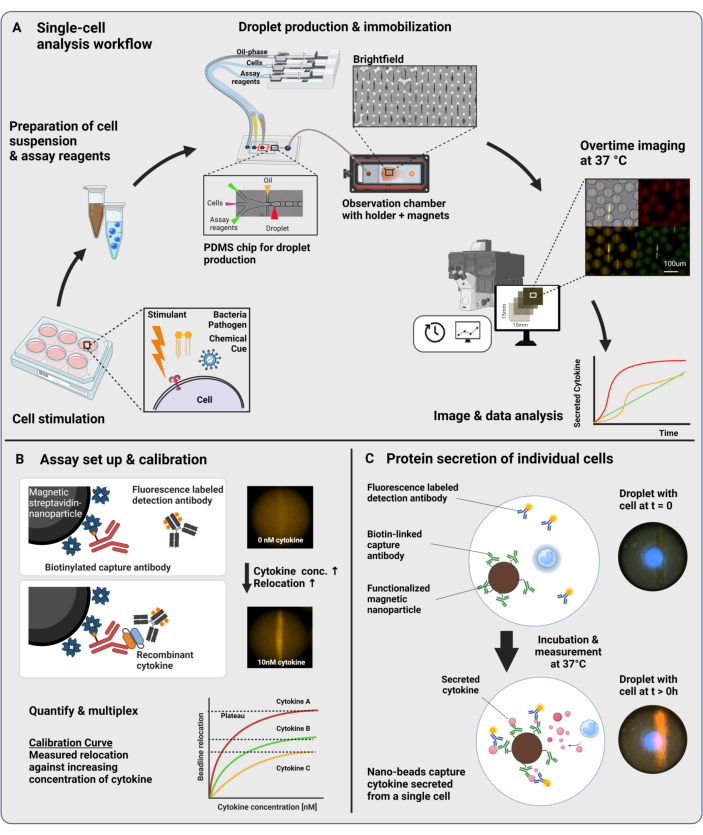
الشكل 1: سير العمل ومبدأ الفحص. أ: نظرة عامة على سير العمل لتحليل الخلايا المفرزة للسيتوكينات بعد التحفيز. يتم تحضير معلقات أحادية الخلية وجسيمات نانوية مغناطيسية وتغليفها في 60 مل في مستحلبات الزيت / الماء الحجمية (قطرات). يتم تثبيت القطرات ومحاذاة الجسيمات النانوية داخل مجال مغناطيسي قبل القياس لمدة تصل إلى 4 ساعات كل 30 دقيقة. أخيرا ، يتم تحليل الصور ، ويتم استخراج المعلمات لكل قطرة ونقطة زمنية وقناة فلورسنت. وقد عدل هذا الرقم من17. (ب) مبدأ المقايسة الحيوية لشطيرة القطيرات. تربط الجسيمات النانوية الوظيفية السيتوكينات المفرزة ، مما يؤدي إلى النقل اللاحق للأجسام المضادة للكشف ذات العلامات الفلورية إلى الجسيمات النانوية. يتم تحديد هذا النقل للتألق والتحقق من صحته من خلال تجارب المعايرة التي أجريت باستخدام السيتوكينات المؤتلفة. يسمح خلط الجسيمات النانوية الوظيفية المختلفة بإجراء قياسات متعددة لما يصل إلى ثلاثة سيتوكينات في وقت واحد. (ج) في التجارب القائمة على الخلايا، تتبع القطرات خلال زمن القياس، ويتم تحديد الخلايا المفرزة من خلال زيادة الوقت الإضافي في انتقال التألق إلى الجسيمات النانوية. المخططات ليست على نطاق واسع. تم إنشاء الشكل باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تم إجراء جميع التجارب بموجب اتفاقية الأخلاقيات EK202-N-56 ووافقت عليها لجنة الأخلاقيات في ETH Zurich. تم إجراء مناولة الخلايا البشرية في خزانة تدفق رقائقي موجودة في مختبر السلامة البيولوجية من المستوى 2.
ملاحظة: توضح الأقسام التالية بالتفصيل بروتوكول قياس إفراز السيتوكين الذي تم حله زمنيا على مستوى خلية واحدة. يتم تطبيق الإجراء الموضح هنا على تحفيز خلايا الدم أحادية النواة المحيطية (PBMC) باستخدام عديد السكاريد الدهني (LPS) والقياس المتوازي للسيتوكينات IL-6 و TNFα و IL-1β. ومع ذلك ، إذا لزم الأمر ، يمكن تكييف البروتوكول مع أنواع الخلايا والمنشطات والسيتوكينات الأخرى.
1. تصنيع غرفة المراقبة
ملاحظة: لتجنب حركة القطرات أثناء التصوير ، يتم تحضير غرفة مراقبة بارتفاع أصغر بحوالي 10٪ من قطر القطرة.
- تحضير شريط القطع على الوجهين والشريحة الزجاجية العلوية
- ارسم أو قم بتحميل التصميم المطلوب لفتحة الغرفة في علامة التبويب "تصميم" في برنامج القطع. للاطلاع على الأبعاد المحددة المستخدمة هنا، انظر الشكل 2E.
- ثبت الشريط اللاصق على الوجهين بسمك 32 ميكرومتر على حصيرة القطع اللاصقة باستخدام الشريط وضع حصيرة القطع في آلة القطع الأوتوماتيكية.
- قم بقص تصميم الغرفة من الشريط ، مع الانتباه إلى قطع الحواف الطويلة للغرفة في نفس الاتجاه لتسهيل الانفصال في الخطوة 1.3.
- قم بتخزين قواطع الشريط في درجة حرارة الغرفة للتخزين طويل الأجل. للتخزين قصير الأجل ، قم بتخزينها في -20 درجة مئوية وقم بإزالتها قبل وقت قصير من الخطوة 1.3. لتسهيل التعامل.
- احفر فتحتين يبلغ قطرهما حوالي 1 مم في منتصف شريحة مجهر قياسية واحدة (76 مم × 26 مم × 1 مم) ، مع مسافة بين الفتحتين تبلغ حوالي 3.5 سم.
- تنظيف وتفعيل البلازما من الشرائح الزجاجية
- نظف شريحة زجاجية واحدة بها ثقوب وواحدة بدون ثقوب باستخدام الصابون. اشطفها جيدا بالماء المقطر وجففها باستخدام مناديل دقيقة خالية من النسالة.
- ضع الشرائح الزجاجية في منظف البلازما وعالج الأسطح العلوية بالبلازما عند 55 واط لمدة 10 دقائق. قم بإزالة الشرائح الزجاجية وانتقل إلى الخطوة 1.3.
- جمعية الغرفة
- ضع الشريحة الزجاجية ذات الثقوب على سطح نظيف بحيث يكون الجانب المنشط بالبلازما متجها لأعلى ، دون لمس السطح المنشط.
- قم بإزالة الطبقة الواقية من جانب واحد من الشريط اللاصق على الوجهين ، في نفس اتجاه القطع. دون لمس محاذاة قطع الشريط مع حواف الشريحة الزجاجية والثقوب المحفورة ، ووضع الشريط ببطء في اتصال مع الشريحة الزجاجية بدءا من الحافة القصيرة.
ملاحظة: انتبه إلى عدم إنشاء أي امتدادات أو طيات في الشريط لأن ذلك سيؤدي إلى ارتفاعات غير صحيحة للحجرة. نظرا لأن هذه الخطوة عرضة للخطأ وتحتاج إلى بعض الخبرة العملية ، فمن المستحسن إعداد عدة شرائح زجاجية بالتوازي. - قم بإزالة الطبقة الواقية الثانية من الشريط ، مرة أخرى في اتجاه القطع ، وضع الشريحة الزجاجية الثانية بدون ثقوب مع توجيه السطح المنشط لأسفل. اضغط على سطح الشريحتين الزجاجيتين معا عن طريق وضع لوح مسطح في الأعلى والضغط لأسفل بقوة الجزء العلوي من الجسم لمدة 10 ثوان تقريبا.
- بعد تجميع الشريحتين الزجاجيتين ، اقلب الحجرة بحيث تكون الفتحتان مواجهتين. قم بلصق المنافذ النانوية على الفتحتين عن طريق وضع كمية صغيرة من الغراء القابل للمعالجة بالأشعة فوق البنفسجية في الحلقة أسفل المنفذ ووضع المنفذ أعلى الفتحة في الشريحة الزجاجية. أضف حلقة من الغراء القابل للشفاء بالأشعة فوق البنفسجية حول المنفذ وقم بمعالجة الغراء باستخدام مصباح الأشعة فوق البنفسجية. يجب أن تبدو الغرفة الآن كما هو موضح في الشكل 2E. انتقل فورا إلى الخطوة 1.4.
ملاحظة: الأشعة فوق البنفسجية يمكن أن تلحق الضرر بالعينين والجلد. ارتداء معدات الحماية المناسبة.
- طلاء فلوروفيلي لسطح الغرفة
ملاحظة: يجب أن تتم هذه الخطوة في غضون ساعة واحدة بعد معالجة البلازما للشرائح الزجاجية (الخطوة 1.2.2) لضمان كفاءة طلاء جيدة.- قم بإعداد 1 مل من محلول الفلوروسيلان 1٪ (1H ، 1H ، 2H ، 2H-perfluorodecyltrichlorosilane) في الزيت المفلور (HFE-7500) واملأه في حقنة. ادفع محلول الطلاء من خلال مرشح حقنة PTFE وإبرة 27G × 0.75 بوصة متصلة بأنابيب دقيقة PTFE مقاس 0.3 مم × 0.76 مم ، إلى غرفة المراقبة.
- بعد 1 دقيقة الحضانة ، اغسل محلول الطلاء خارج الغرفة باستخدام ضغط النيتروجين تحت غطاء الدخان. اشطف الحجرة بالزيت المفلور (HFE-7500 فقط) باستخدام مجموعة حقنة أخرى.
- قم بتخزين الحجرة المملوءة بالزيت المفلور مع مداخل مغلقة في درجة حرارة الغرفة (RT). بعد كل تجربة ، اغسل الخلايا والقطرات مباشرة لضمان الحفاظ الجيد على الطلاء.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا ، ويمكن تخزين الغرف وإعادة استخدامها لعدة أشهر.
- حامل غرفة مع مغناطيس
- لمحاذاة الجسيمات النانوية المغناطيسية ، قم بتطبيق مجال مغناطيسي ثابت على غرفة المراقبة أثناء تغليف القطيرات والتصوير. لهذا ، ضع الغرفة في حامل مجهري مخصص مطبوع ثلاثي الأبعاد (انظر الشكل 2D ، والملف الموجود في Bounab et al.17 Complementary Data 4) الذي يحمل مغناطيسين من النيوديميوم على طول الجوانب الطويلة للغرفة.
2. وظيفية الجسيمات النانوية
ملاحظة: تتشابه عملية وظيفة الجسيمات النانوية لكل سيتوكين ، والفرق الوحيد هو إضافة الأجسام المضادة الخاصة بالسيتوكين. يتم تنفيذ الوظائف لكل سيتوكين في أنابيب تفاعل فردية مختلفة بالتوازي. قبل هذا البروتوكول ، تم تصنيف الجسم المضاد لالتقاط TNFα والجسم المضاد للكشف IL-1β داخليا مع البيوتين و Alexa Fluor 647 ، على التوالي. تم إجراء الاقتران وفقا لبروتوكول الشركة المصنعة الموجود على موقع البائع (انظر الروابط في جدول المواد) وتم نقل الأجسام المضادة وتخزينها عند -20 درجة مئوية.
- أضف 50 ميكرولتر من الجسيمات النانوية الوظيفية للستربتافيدين (قطرها (Ø) 300 نانومتر) في الأنبوب المخصص للكشف عن TNFα ، و 50 ميكرولتر ل IL-1β ، و 100 ميكرولتر ل IL-6. تمييع محلول الجسيمات النانوية 1: 1 (v / v) في محلول ملحي مخزن بالفوسفات (PBS).
- أضف إلى كل أنبوب 1/20 (v / v) من الحجم المعني للأجسام المضادة لالتقاط البيوتينيلات (تركيزات المخزون عند 0.5 مجم / مل) واحتضانها لمدة 30 دقيقة في RT.
ملاحظة: عند إضافة كميات صغيرة إلى محلول الجسيمات النانوية ، قم بإيداع الحجم في الجزء العلوي من الأنبوب واغسله عدة مرات بالجزء الأكبر من المحلول. هذا يضمن الخلط السليم ويمنع تكوين الركام. - أضف 1/100 (v / v) من 1 mM D-biotin Solution إلى الأنبوب واحتضانها لمدة 5 دقائق في RT. ينتج عن هذا تركيز البيوتين النهائي 10 ميكرومتر.
ملاحظة: يمنع البيوتين الزائد جوانب الارتباط الحرة على الجسيمات النانوية ويقلل من تكوين الركام غير المرغوب فيه. - اجمع الجسيمات عن طريق وضع مغناطيس نيوديميوم بالقرب من الأنبوب. انتظر حتى يصبح الطافع واضحا وتخلص من المادة الطافية.
ملاحظة: تظهر المغناطيسات المستخدمة في جميع أنحاء الفحص قوى جذب قوية جدا ، والتي يمكن أن تسبب ضررا جسديا إذا انفصل مغناطيسان معا عن طريق الخطأ. - لتقليل الامتزاز غير المحدد لسطح الجسيمات النانوية ، أعد تعليق الجسيمات النانوية على الفور في 0.5x الحجم النهائي للخطوة 2.1 من Pluronic F-127 (10٪) و 0.5x حجم PBS. احتضان الحل لمدة 30 دقيقة في RT.
- اجمع الجسيمات باستخدام المغناطيس ، وتخلص من المادة الطافية ، وأعد تعليق حجم المخزن المؤقت للتخزين بمقدار 1 أضعاف (RPMI 1640 ، استبدال مصل الضربة القاضية بنسبة 5٪ ، 1٪ قلم / بكتيريا ، 1٪ ألبومين مصل بشري مؤتلف (HSA) ، 25 مللي متر HEPES ، 0.1٪ Pluronic F-127). احتضان الحل لمدة 30 دقيقة في RT.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا ، ويمكن الآن تخزين الجسيمات لمدة تصل إلى 1 أسبوع عند 4 °C. - مباشرة قبل التغليف ، أعد تعليق الجسيمات عن طريق سحب وخلط الجسيمات النانوية المترافقة بنسبة 2: 1: 1 (v / v) ل IL-6: TNFα: IL-1β ، على التوالي.
ملاحظة: تعتمد النسب المختلفة للجسيمات النانوية الوظيفية على زوج الأجسام المضادة المستخدم لكل سيتوكين وقد تم تحديدها تجريبيا من خلال عينات المعايرة للحصول على نطاق ديناميكي مثالي. - اغسل بوسائط كاملة (RPMI 1640 ، 10٪ FBS ، 1٪ قلم / بكتيريا ، 25 مللي متر HEPES) عن طريق جمع الجسيمات بالمغناطيس ، والتخلص من المادة الطافية وإعادة التعليق. كرر هذه الخطوة ولكن أعد التعليق فقط في 0.5x من حجم الوسائط الكاملة من الخطوة 2.7.
- أضف الأجسام المضادة للكشف عن IL-6 و TNFα و IL-1β ذات العلامات المختلفة إلى المحلول للوصول إلى تركيز نهائي يبلغ 10 نانومتر لكل منها. الحل جاهز الآن للاستخدام في تجارب القطيرات.
3. إعداد الخلية
ملاحظة: تم عزل PBMC من معطف بافي تم استلامه من بنك الدم في زيورخ. تم تجميد الخلايا وتخزينها في cryovials (1 × 107 خلايا / قارورة) في النيتروجين السائل لعدة أشهر.
- ذوبان الخلايا
- في 1 ساعة قبل بدء التجربة ، اترك الوسائط الكاملة والمخزن المؤقت MACS (2 mM EDTA ، 0.5٪ BSA في DPBS ، مرشح معقم) للإحماء في RT. قم بإعداد الأنبوب الذي يحتوي على الخلايا عن طريق إضافة 9 مل من الوسائط الكاملة إلى أنبوب سعة 15 مل والاحتفاظ بها في حمام مائي عند 37 درجة مئوية.
- استرجع برود PBMC (يحتوي على ~ 1 × 107 خلايا) من تخزينه في النيتروجين السائل. قم بتدوير أنبوب التبريد في حمام مائي عند 37 درجة مئوية حتى تبقى كمية صغيرة فقط من الثلج.
- امسح الأنبوب بنسبة 70٪ EtOH وانقله إلى خزانة التدفق الصفحي. أضف 1 مل من الوسائط الكاملة التي تم تسخينها مسبقا إلى cryovial ، واخلطها برفق وانقل جميع الخلايا إلى الأنبوب الذي يحتوي على وسائط كاملة دافئة. يمكن غسل cryovial مع 1 مل من الوسائط الكاملة الدافئة لاستعادة أكبر عدد ممكن من الخلايا.
- أدر الخلايا عند 500 × جم لمدة 5 دقائق في RT ، وتخلص من المادة الطافية وأعد تعليقها برفق باستخدام ماصة بيليه الخلية مع 1 مل من الوسائط الكاملة. أضف 9 مل من الوسائط الكاملة.
- أدر الخلايا عند 500 × جم لمدة 5 دقائق في RT. تخلص من المادة الطافية وأعد تعليقها كما كان سابقا في 1 مل من الوسائط الكاملة.
- عد الخلايا باستخدام عداد الخلايا المتوفر. في هذه الحالة ، تم استخدام عداد خلية آلي. تم عد الخلايا عن طريق خلط 10 ميكرولتر من معلق الخلية مع 10 ميكرولتر من أزرق تريبان ونقل 10 ميكرولتر من الخليط إلى شريحة عد الخلايا.
- تلطيخ وحجب FCR
- احسب العدد الإجمالي للخلايا والحجم المطلوب لإعادة تعليق الخلايا عند 2 × 106 خلايا حية / مل. تحضير محلول تلطيخ الخلايا (CellTrace Violet) عن طريق تخفيف المخزون (5mM) 1000x في PBS (تركيز العمل 5 ميكرومتر).
- قم بتدوير الخلايا عند 500 × جم لمدة 5 دقائق في RT. تخلص من المادة الطافية وأعد تعليق الخلايا في الحجم المحسوب لمحلول تلطيخ الخلايا المحضر في الخطوة 3.2.1. احتضان الخلايا على حرارة 37 درجة مئوية لمدة 5 دقائق.
- في نهاية الحضانة ، قم بإخماد الصبغة المتبقية في المحلول عن طريق إضافة وسائط كاملة (على الأقل 2x حجم محلول الصبغة). أدر الخلايا عند 500 × جم لمدة 5 دقائق في RT.
- تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في 60 ميكرولتر من المخزن المؤقت MACS وأضف 20 ميكرولتر من كتلة FcR البشرية لكل 1 × 107 خلايا. احتضان الخلايا لمدة 10 دقائق في RT.
- املأ الأنبوب إلى 10 مل باستخدام MACS Buffer وقم بتدوير الخلايا عند 500 × جم لمدة 5 دقائق في RT.
- تخلص من المادة الطافية وأعد تعليق الخلايا في 1 مل من الوسائط الكاملة عد الخلايا كما هو موضح في الخطوة 3.1.6.
- تحفيز الخلايا مع LPS
- باستخدام عدد الخلايا ، قم بتخفيف الخلايا عند 1 × 106 خلايا / مل ونقل 2 مل من الخلايا إلى كل بئر في لوحة ربط منخفضة للغاية من 6 آبار.
- تمييع LPS في وسائط كاملة وإضافته إلى البئر التي تحتوي على الخلايا للحصول على تركيز نهائي من LPS من 1 ميكروغرام / مل. احتضان الخلايا لمدة 6 ساعات عند 37 درجة مئوية.
- التحضير للتغليف
- في نهاية وقت التحفيز ، انقل تعليق الخلية إلى أنبوب جديد سعة 15 مل.
- أضف 1 مل من الوسائط الكاملة إلى البئر الفارغة. باستخدام مكشطة الخلايا ، افصل الخلايا المتبقية. انقل الخلايا إلى أنبوب جديد سعة 15 مل. اغسل البئر ب 1 مل من الوسائط الكاملة وانقلها إلى أنبوب 15 مل آخر.
- قم بتدوير الأنبوبين عند 500 × جم لمدة 5 دقائق عند RT وانقل 1 مل من محلول الطافية غير المخفف (من الأنبوب الأول الذي يحتوي على الخلايا غير المغسولة) إلى أنبوب جديد لمزيد من التحليل إذا لزم الأمر (على سبيل المثال ، ELISA).
- تخلص من بقية المواد الطافية.
- أعد تعليق الكريات في 0.5 مل من الوسائط الكاملة ، وادمج الخلايا من نفس البئر ، وانقلها إلى أنبوب طرد مركزي. عد الخلايا كما هو موضح في الخطوة 3.1.6.
- قم بتدوير الخلايا عند 500 × جم لمدة 5 دقائق عند RT وتخلص من معظم المادة الطافية (اترك حوالي 100 ميكرولتر). بدون تعليق الحبيبات ، أضف بعناية فائقة 200 ميكرولتر من الوسائط الكاملة.
- تخلص من المادة الطافية. أعد تعليق الخلايا في وسائط كاملة بتركيز 6.6 إلى 13.3 × 106 خلايا / مل لتحقيق متوسط عدد الخلايا لكل قطرة λ = 0.2-0.4 للتغليف ، كما هو محدد في الخطوة 8.6.
ملاحظة: يجب تنفيذ الخطوتين 3.4.6 و 3.4.7 مباشرة قبل التغليف لتجنب إفراز السيتوكين في المادة الطافية. يتبع عدد الخلايا لكل قطرة توزيع بواسون: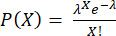 ، حيث يظهر P جزء القطرات التي تحتوي على خلايا X و λ هو متوسط عدد الخلايا لكل قطرة.
، حيث يظهر P جزء القطرات التي تحتوي على خلايا X و λ هو متوسط عدد الخلايا لكل قطرة.
4. التغليف وإنتاج القطيرات
ملاحظة: يتم تمكين تغليف الخلايا في قطرات بواسطة شريحة مولد قطرات الموائع الدقيقة ، والتي يتم وصف تصنيعها بتفصيل كبير في مكان آخر17. البدائل متاحة تجاريا (انظر المثال في جدول المواد). يحتوي تصميم رقاقة مولد القطيرات المناسب على مدخلين للمراحل المائية ، ومدخل واحد لمرحلة الزيت ، ومخرج واحد للقطرات المتولدة. علاوة على ذلك ، يجب أن تمكن رقاقة مولد القطيرات التجارية المناسبة من إنتاج الماء في قطرات الزيت المفلورة بحجم 40-60 pL. ينتج عن البروتوكول الموصوف هنا مستحلبات ماء / زيت (قطرات) بقطر 50 ميكرومتر. يمكن أن يؤدي استخدام خيارات مختلفة لتغيير البروتوكول إلى قطرات أكبر أو أصغر.
- تحضير مضخة الحقن (الشكل 2 أ)
- املأ حقنة سعة 1 مل ب 500 ميكرولتر من الطور المستمر الذي يتكون من 2٪ 008-فلورو خافض للتوتر السطحي في زيت مفلور HFE-7500. قم بتوصيل إبرة 27G × 0.75 بوصة بالأنابيب الدقيقة PTFE مقاس 0.30 مم × 0.76 مم وقم بتركيب التجميع على المحقنة وبعد ذلك على مضخة المحقنة.
ملاحظة: تأكد من عدم بقاء هواء في المحقنة أو القنية لأن هذا يمنع معدلات التدفق الثابتة. - قم بإعداد موصلين مخصصين لطرف الماصة للمراحل المائية (الشكل 2 ب): قم بثقب ثقب بكمية خزعة Ø0.75 مم في منتصف فتحة PDMS بارتفاع ~ 5 مم بقطر 6 مم. اسحب ~ 3 سم من أنابيب PTFE (القطر الداخلي 0.56 مم ، القطر الخارجي 1.07 مم) من خلال الفتحة الموجودة في فتحة PDMS وادفع التجميع إلى الجزء العلوي من طرف ماصة 200 ميكرولتر. قم بتوصيل الجانب الآخر من الأنبوب بإبرة 23Gx 1.25 بوصة. أغلق الموصل عن طريق نشر الغراء القابل للمعالجة بالأشعة فوق البنفسجية أعلى الماصة ومعالجته بضوء الأشعة فوق البنفسجية.
ملاحظة: نظرا لأن ضوء الأشعة فوق البنفسجية ضار بالعين ، ارتد نظارات واقية من الأشعة فوق البنفسجية للحماية. - املأ حقنتين سعة 1 مل ب 500 ميكرولتر من الزيت المعدني الخفيف ، وقم بتوصيل إبرتين 23G بالمرفقات المصنوعة خصيصا ، وقم بتركيبهما على مضخة المحقنة.
- نضح 30 ميكرولتر من الجسيمات النانوية و 30 ميكرولتر من محلول الخلية في أطراف الماصة للمراحل المائية باستخدام برنامج التحكم في مضخة المحقنة.
- قم بإعداد غرفة مراقبة عن طريق تنظيف السطح بالماء لإزالة الأوساخ والغبار وتجفيفه بمناديل دقيقة. ثبت الحجرة في حامل الحجرة المطبوعة المجهز بمغناطيسين من النيوديميوم.
ملاحظة: تأكد من أن المغناطيس يشير في الاتجاه الصحيح (يجذب بعضه البعض) لتشكيل ركام ممدود. - زاوية الغرفة قليلا (30 درجة). افتح كلا المنفذين وقم بتوصيل منشفة ورقية في المنفذ العلوي لامتصاص المرحلة الخارجية الزائدة أثناء التعبئة.
- املأ حقنة سعة 1 مل ب 500 ميكرولتر من الطور المستمر الذي يتكون من 2٪ 008-فلورو خافض للتوتر السطحي في زيت مفلور HFE-7500. قم بتوصيل إبرة 27G × 0.75 بوصة بالأنابيب الدقيقة PTFE مقاس 0.30 مم × 0.76 مم وقم بتركيب التجميع على المحقنة وبعد ذلك على مضخة المحقنة.
- إنتاج القطيرات وملء الغرفة
- قم بتوصيل المرحلة المستمرة عبر الأنبوب بالمدخل العلوي لرقاقة الموائع الدقيقة (الشكل 2A ، C ، F). اغسل الرقاقة لمدة 30 ثانية تقريبا بمرحلة مستمرة باستخدام معدل تدفق يبلغ 1800 ميكرولتر / ساعة.
- قم بتوصيل أطراف الماصة للمحاليل المائية بالمدخلين الأوسطين (الشكل 2A ، C ، F).
- ابدأ تدفق المحلول المائي ب 200 ميكرولتر / ساعة لكل منهما واترك القنوات والمخرج يمتلئان بالسائل. عند استخدام الجسيمات النانوية المغناطيسية ، يجب أن يتدفق محلول متجانس بلون بني-أحمر من مخرج الرقاقة.
- بمجرد ظهور السائل عند المخرج ، ابدأ تدفق طور الزيت المفلور عند 800 ميكرولتر / ساعة وانتظر حتى يتم إنشاء إنتاج قطرات مستقر ، يؤكده تدفق محلول متجانس ورمادي ولامع عند المخرج.
- بمجرد إنشاء إنتاج مستقر للقطرات ، اجمع القطرات المنتجة عن طريق توصيل الأنابيب الدقيقة PTFE (القطر الداخلي 0.3 مم × القطر الخارجي 0.76 مم) بمنفذ المخرج وتوجيهها إلى غرفة المراقبة عن طريق تمرير الأنابيب الدقيقة عبر وحدة الطويق لتركيب قطعة واحدة محكمة الإصبع (الشكل 2 أ).
- في حالة حدوث إنتاج مناسب للقطرات ، يجب أن يملأ سائل متجانس ولامع الغرفة بجبهة مستقيمة من الأسفل إلى الأعلى.
- بمجرد ملء الحجرة ، أوقف التدفق وأغلق المنافذ باستخدام مقابس المنفذ باستخدام ضغط محكم الإصبع.
ملاحظة: انتبه إلى عدم إغلاق الحجرة بإحكام شديد. يمكن أن يؤدي محاصرة الهواء أو تدفقه إلى حركات القطرات وبالتالي الإضرار بالتتبع أثناء القياس. - بعد إنتاج القطيرات ، اغسل الشريحة بالزيت المفلور وفجر أي تذكير بالسوائل بالنيتروجين للحفاظ على وظيفتها. يمكن إعادة استخدام الرقائق عدة مرات وتخزينها لعدة أشهر طالما أنها غير مسدودة.
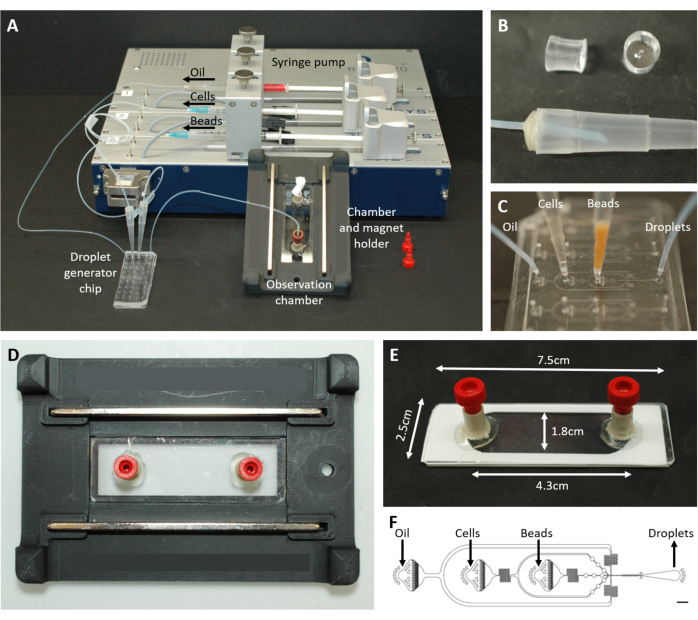
الشكل 2: نظرة عامة على إعداد الموائع الدقيقة. (أ) إعداد تغليف القطيرات باستخدام مضخة المحقنة ، ورقاقة توليد القطيرات ، وغرفة المراقبة وحامل المجهر. (B) صورة لقابس PDMS المثقوب (أعلى) لتشكيل موصل بطرف ماصة 200 ميكرولتر (أسفل) ، كما هو موضح في خطوة البروتوكول 4.1.2. (ج) صور لتوصيل أطراف الأنابيب والماصة بشريحة توليد القطيرات. (د) صورة للغرفة الموضوعة داخل حامل المجهر المطبوع 3D المخصص مع مغناطيسين في الأعلى والأسفل. (ه) صورة لغرفة المراقبة (مع شريط أبيض للتوضيح). (F) تخطيط رقاقة الموائع الدقيقة لإنشاء القطيرات (شريط المقياس: 750 ميكرومتر). وقد عدل هذا الرقم من17. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. الحصول على الصور وقياسها
ملاحظة: يتم الحصول على الصور على مجهر مضان مقلوب قياسي محاط بحاضنة ، مما يسمح بإجراء قياسات عند 37 درجة مئوية. الإعدادات الموصوفة هنا خاصة بمجهر Nikon Eclipse Ti2 الذي يعمل ببرنامج NIS Elements (V. 5.30.04) المجهز بكاميرا Orca Fusion ولكنها قابلة للتكيف بشكل عام مع أي مجاهر وكاميرات مضان أخرى.
- تحديد معلمات القياس
- لتعيين حجم الصورة، حدد حجم صفيف 10 × 10 صور. ستحتوي هذه المصفوفة على ما يقرب من 50,000-70,000 قطرة. استخدم التداخل بنسبة 1٪ وقم بتنشيط المزج لخياطة الصورة.
- لتعيين عدد القنوات المقاسة ، حدد قناة DAPI لاكتشاف الخلايا ، وقنوات FITC ، و TRITC ، و Cy5 للكشف عن السيتوكين (خطوط الخرز) وقناة BF للكشف عن القطيرات. استخدم تجميع وحدات البكسل 2 × 2 و 16 بت لعمق البت. قم بتكييف إعدادات الكاميرا لتحقيق قيم بكسل كثافة داخل القطرات التي لا تصل إلى الحد الأقصى للكاميرا لكل قناة مضانة.
ملاحظة: تعتمد أوقات التعرض الدقيقة وشدة المصباح لكل قناة على الطراز والكواشف المستخدمة ويتم تحديدها قبل إنشاء منحنيات المعايرة (الخطوة 7). يعد استخدام نفس إعدادات الاكتساب في المعايرة وقياسات الخلايا أمرا مهما للقياس الكمي الدقيق. - لإعداد القياس الذي تم حله بالوقت، حدد قياسا كل 30 دقيقة لإجمالي 9 قياسات.
ملاحظة: قد تختلف معلمات القياس للخلايا المستخدمة والمنشطات والكواشف والسيتوكينات المقاسة ودرجة حرارة الحضانة ونماذج المجهر.
- بدء القياس
- قم بتركيب حامل الحجرة على المجهر باستخدام مرحلة تنسيق لوحة جيدة (الشكل 2D) وانتقل إلى قناة برايت فيلد (BF) باستخدام هدف 10x.
- ركز على القطرات الثابتة في BF وتأكد من تركيب التجميع في مستوى مثالي عن طريق التحريك والتعديل إذا لزم الأمر. انتقل إلى منتصف الغرفة للخطوات اللاحقة.
- قم بتنشيط نظام التركيز الآلي (PFS) واضبطه على مستوى القياس الأمثل على قناة BF بحيث تظهر حواف القطيرات كدوائر سوداء حادة يمكن تمييزها بسهولة عن مرحلة الزيت والخلفية.
ملاحظة: القياسات ممكنة أيضا بدون نظام تركيز آلي ، ولكن إذا كان المجهر مزودا بنظام ، فإننا نوصي بشدة باستخدامه. يعمل هذا على تحسين جودة القياس للصور الكبيرة والمخيطة بشدة. - انتقل من خلال جميع القنوات الفلورية وتعيين مستوى القياس الأمثل لكل منها. بالنسبة لقياسات النقل على قنوات FITC و TRITC و Cy5 ، تأكد من أن مجموع الجسيمات النانوية في تركيز مثالي ، بالنسبة لقناة DAPI ، تأكد من تركيز الخلايا.
ملاحظة: قد تختلف المستويات البؤرية المثلى وقيم z لجميع القنوات المقاسة. تأكد من حفظ إزاحات PFS الفردية لكل قناة. - قبل البدء في القياس ، انتقل عبر جميع القنوات للتحقق مرة أخرى من البؤر الفردية وانتظر 5 دقائق للتوازن لأن الحركة قد تحدث في البداية أثناء تسخين الحلول.
- ابدأ القياس. بعد إنشاء الصورة الأولى ، تحقق من وجود أي مخالفات (التركيز ، القطرات المتحركة ، القنوات الخاطئة ، إلخ). أعد تشغيل عملية الاستحواذ إذا لزم الأمر ، أو في حالة الهواء ، أعد ملء الغرفة (ابدأ من الخطوة 4.1.4). اترك التجميع لتصوير القطرات التي تزيد عن 4 ساعات.
6. تحليل الصور
- قم بتثبيت برنامج تحليل الصور (DropMap Analyzer App v 4.023) في MatLab (https://github.com/ESPCI-LCMD/MiMB) ونقل ملف .nd2 الذي تم إنشاؤه من التجربة إلى كمبيوتر تحليل.
- افتح التطبيق. حدد الإعدادات المحددة ، وإلا اترك القيمة الافتراضية: CH1: DAPI ، WD (قطرة كاملة) محددة ؛ CH2: تم اختيار FITC ، BL (خط الخرز) ؛ CH3: TRITC ، BL المحدد ؛ CH4: تم اختيار Cy5 ، BL ؛ أقصى قطر قطرة (ميكرومتر): 70 ؛ كشف السقوط: كامل. التتبع: نعم. اضغط على زر ابدأ (رمز الفاكهة) لتحديد موقع ملف .nd2 وبدء التحليل.
- بعد بضع دقائق ، سيعرض البرنامج مثالا على الصورة (الشكل 3 أ). اضغط على مفتاح المسافة حتى تجد واحدا مناسبا لاكتشاف القطيرات، ثم اضغط على مفتاح الإدخال Enter. في نفس قسم الصورة ، ارسم مستطيلا في منطقة تمثيلية للعثور على معلمات العتبة لاكتشاف القطرات.
- بعد بضع دقائق ، سيتم فتح نافذة أخرى تعرض توزيع كثافة قناة DAPI. اسحب شريط التمرير وأفلته لاكتشاف الإشارة فقط من الخلايا الملطخة وانقر فوق تم في الزاوية اليمنى العليا.
- بعد تقسيم الصورة إلى قطرات مفردة بأقطار أصغر من الحد الأقصى لقطر السقوط (ميكرومتر) ، سيقوم البرنامج الآن بتنفيذ الخطوات التالية لكل قطرة ونقطة زمنية وقناة مضان دون مزيد من مدخلات المستخدم (انظر الشكل 3).
- يقوم البرنامج بحساب وحدات البكسل المنقولة للقطرات بين النقاط الزمنية (يتم استبعاد القطرات التي تتحرك أكثر من 40 بكسل تلقائيا).
- يقيس البرنامج متوسط قيمة التألق للقطرة بأكملها ، ويكتشف ويقيس متوسط كثافة خط الخرز من خلال العثور على ألمع بكسل على خط أفقي ومتوسط جميع كثافة البكسل على خط عمودي من أعلى إلى أسفل القطرة. يتم ذلك تلقائيا ويستخدم لحساب متوسط قيم نقل خط الخرز (الشكل 3 ب) وفقا للمعادلة:
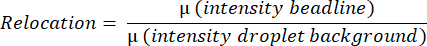
- يقوم البرنامج بحساب النسبة المئوية لإجمالي وحدات البكسل في منطقة القطرة فوق العتبة المحددة على قناة DAPI.
- سيحتوي ملف .xslx الناتج على الأعمدة التالية ذات الأهمية لمزيد من التحليل: DropIdX (معرف القطرة التي تم تتبعها بمرور الوقت) ، TrueCentroid_ t * 2-1 و t + 2 (إحداثيات x و y ، على التوالي ، لمركز القطرة للنقطة الزمنية t) ، القطرميكرون (قطر القطرة بالميكرومتر) ، TrackingMove (عدد وحدات البكسل التي تم نقلها خلال وقت القياس بأكمله) ، FluoChannel_BL_Ratio_t (قيمة النقل ل FluoChannel عند النقطة الزمنية t) ، DAPI_WD_PosPxlCount_t (عدد وحدات البكسل فوق العتبة في القطرة بأكملها في قناة DAPI عند النقطة الزمنية t).
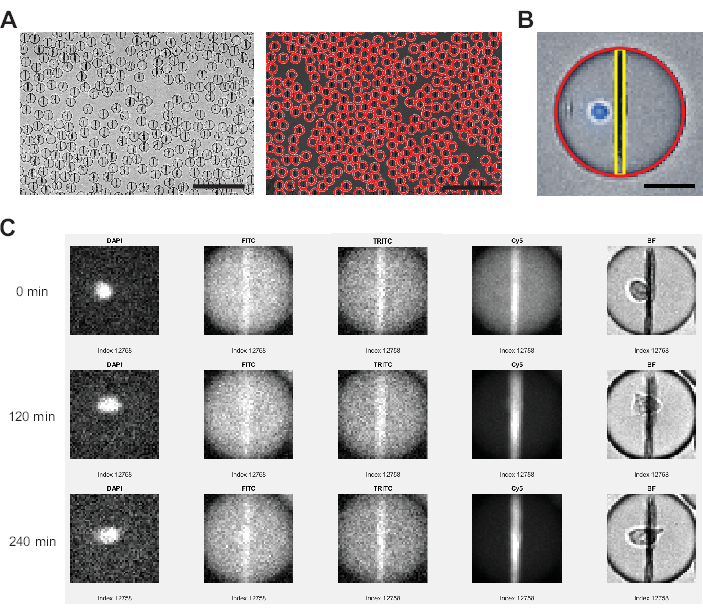
الشكل 3: تحليل الصور الذي يقوم به برنامج تحليل الصور. (أ) يتم الكشف عن القطرات في قناة برايت فيلد (BF) باستخدام تحويل Hough ، مع تمييز كل قطرة بدائرة حمراء. قضبان المقياس: 200 ميكرومتر. (ب) داخل كل قطرة ، يتم تحديد حبة الجسيمات النانوية من خلال ألمع وحدات البكسل في المستوى الأفقي ومتوسط شدة التألق لجميع وحدات البكسل الممتدة من أعلى القطرة إلى أسفلها. بالإضافة إلى ذلك ، يتم تحديد الخلية من خلال نسبة البكسل >0 أعلى من الحد لمنطقة القطرة بأكملها. شريط المقياس: 20 ميكرومتر. (ج) يقارن برنامج المحلل شدة التألق على الجسيمات النانوية بخلفية القطيرات لقنوات FITC و TRITC و Cy5 على جميع النقاط الزمنية المقاسة لكل قطرة فردية. تظهر النقاط الزمنية 0 و4 (120 دقيقة) و9 (240 دقيقة). للتحقق يدويا من اكتشاف القطيرات والخلايا بشكل صحيح ، يتم عرض قنوات DAPI و BF أيضا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. المعايرة
ملاحظة: للحصول على قراءة كمية ، يجب إجراء معايرة تركيزات السيتوكين لقيم نقل التألق مرة واحدة ، حيث يمكن أن تحدث اختلافات بين الإعدادات التجريبية المختلفة. يتم تفصيل جميع الخطوات المطلوبة في أقسام البروتوكول السابقة كما هو مشار إليه.
- تحضير الجسيمات النانوية كما هو موضح في الخطوة 2.
- إعادة تكوين البروتينات المؤتلفة البشرية IL-6 و TNFα و IL-1β وفقا لتعليمات الشركة الصانعة.
ملاحظة: تأكد من إذابة الحصص المجمدة مرة واحدة فقط واستخدامها على الفور. - قم بإعداد سلسلة تخفيف ثنائية الطي لجميع البروتينات الثلاثة معا باستخدام وسائط كاملة (10٪ FBS ، 1٪ قلم / بكتيريا ، 25 مللي متر HEPES) بتركيز أولي يبلغ 80 نانومتر وصولا إلى 0.625 نانومتر.
- قم بإجراء التغليف كما هو موضح في الخطوة 4 مع الجسيمات النانوية الوظيفية في المرحلة الأولى و RPMI فقط في المرحلة المائية الثانية. يعمل هذا القياس كفراغ ويتم استخدام الانحراف المعياري المقاس لتحليل البيانات لاحقا.
- انتظر 5 دقائق وقم بتصوير القطرات كما هو موضح في الخطوة 5. التقط 3 صور بحجم صفيف 2 × 2 في القنوات الفلورية المعنية.
- كرر الخطوتين 7.4 و7.5 مع جميع محاليل المعايرة المعدة ، بدءا من الأقل وتنتهي بأعلى تركيز.
- تحليل الصور كما هو موضح في الخطوة 6. لا تستخدم خيار WD لقناة DAPI واضبط التتبع على لا.
- ينتج التحليل قيم نقل التألق لكل قطرة مقاسة في صورة واحدة. استخراج الوسيط والانحراف المعياري لكل قناة مضان. متوسط المتوسط والانحراف المعياري لكل صورة مقاسة لكل تركيز.
- قم بإنشاء منحنى معايرة عن طريق رسم متوسط الانتقال المتوسط مقابل التركيزات المقاسة لكل بروتين مؤتلف.
- تناسب المنحنيات باستخدام اقتران أحادي الطور:
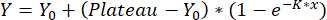 ،
،
مع Y = الانتقال عند x ، Y0 = نقل القياس الفارغ و x التركيز المستخدم. يتم استخدام منحنى المعايرة الذي تم الحصول عليه لتحديد قيم النقل كما هو موضح في الخطوة 8.
ملاحظة: تناسب فقط القيم التي تصل إلى أعلى عملية نقل تم قياسها واستبعد القيم من التركيزات الأعلى مع النقل الأقل قياسا. من المتوقع حدوث انخفاض في قيم النقل المقاسة بتركيزات أعلى ويحدث بسبب تأثير الخطاف وقدرة الربط المحدودة للجسيمات النانوية.
8. تحليل البيانات
- استبعاد القطرات ذات قيمة TrackingMove أعلى من 10 ، أي التي تحركت أكثر من 10 بكسل خلال فترة القياس.
- حدد القطرات التي تحتوي على خلايا ملطخة (قناة DAPI) في النقطة الزمنية الأولى عن طريق فرز القطرات ذات القيم الأعلى من 0 في العمود DAPI_WD_PosPxlPercent_1.
- حدد القطرات التي تحتوي على خلايا مفرزة من خلال تطبيق معايير 3 التالية على نقل التألق لكل قناة مضان (أعمدة FluoChannel_BL_Ratio_t).
- تحديد القطرات ذات قيم النقل المتزايدة ، عن طريق الفرز للحصول على منحدر موجب خلال وقت القياس.
- تحديد القطرات ذات قيم النقل التي تصل إلى حد الكشف (LOD). يتم اختيار قطرة عندما يكون الحد الأقصى لنقل التألق خلال وقت القياس أعلى من LOD ، محسوبا كما هو موضح في مكان آخر25:
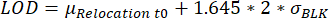 ، حيث μRelocation t0 هو متوسط جميع قيم النقل عند النقطة الزمنية 0 و σBLK الانحراف المعياري للفراغ المقاس أثناء المعايرة ، كل منها خاص بالسيتوكين.
، حيث μRelocation t0 هو متوسط جميع قيم النقل عند النقطة الزمنية 0 و σBLK الانحراف المعياري للفراغ المقاس أثناء المعايرة ، كل منها خاص بالسيتوكين. - التحقق من أن الزيادة في قيمة النقل مهمة عن طريق التحقق من أن التغيير بين الحد الأقصى والحد الأدنى لنقل التألق المقاس خلال وقت القياس يتفوق على:
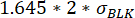 .
.
- حدد خلايا الإفراز المشترك من خلال تلبية المعايير الموضحة في الخطوة 8.3. لأكثر من قناة مضان واحدة في وقت واحد.
- كرر الخطوة 8.3. لجميع القطرات التي لا تحتوي على خلية (DAPI_WD_PosPxlPercent_1 = 0). استخدم هذه القطرات لحساب النسبة المئوية الإيجابية الخاطئة.
- حدد القيمة الدقيقة λ للقياس عن طريق اختيار 200 - 500 قطرة عشوائيا وفحصها باستخدام وظيفة التحقق والفرز لبرنامج تحليل الصور. احسب عدد الخلايا في هذه القطرات واحسب:
λ = عدد الخلايا المحسوبة / عدد القطرات التي تم تحليلها - احسب العدد الإجمالي للخلايا المغلفة للقياس عن طريق:
إجمالي عدد الخلايا = λ × عدد القطرات التي تم تحليلها - احسب النسبة المئوية لإفراز الخلايا باستخدام عدد الخلايا المحدد. بالإضافة إلى ذلك ، احسب النسبة المئوية الإيجابية الكاذبة لكل سيتوكين (عادة أقل من 3٪ -5٪ بالنسبة لعدد الإيجابيات الحقيقية لكل قناة) واستخدمها كعنصر تحكم داخلي للاتساق التجريبي وقابلية التكاثر.
- لحساب تركيزات السيتوكين المفرزة، قم بتحويل قيم الانتقال إلى تركيز باستخدام معادلات المعايرة المحددة من الخطوة 7.10.
- احسب معدل الإفراز (SR) بين النقاط الزمنية باستخدام المعادلة التالية.
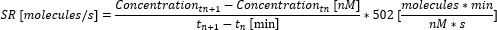
- احسب متوسط معدل الإفراز على القياس عن طريق حساب متوسط معدلات الإفراز الفردية بين النقاط الزمنية. إذا تم الوصول إلى الحد الأقصى للانتقال القابل للقياس قبل نهاية القياس ، فاضبط التركيز على الحد الأقصى للتركيز القابل للقياس (هذه القيمة خاصة بالسيتوكين وتتوافق مع الحد الأقصى للتركيز الذي تم قياسه واستخدامه في منحنى المعايرة في الخطوة 6.10) ، ولا تحسب المزيد من التركيز. احسب معدل الإفراز والمتوسط فقط حتى هذه النقطة الزمنية.
ملاحظة: إذا تم اكتشاف أقل من 50 خلية إفرازية في قناة مضان واحدة ، فيجب فحص القطرات بصريا من خلال وظيفة التحقق والفرز ويمكن استبعاد القطرات التي تحتوي على مجاميع مضان أو جسيمات نانوية من التحليل. - لاستخراج المزيد من المعلمات من منحنى إفراز كل خلية مفردة ، قم بإجراء أقل ملاءمة مربعة لمنحنى تركيز الوقت لكل خلية وسيتوكين باستخدام برنامج نصي Python مخصص (متوفر عند الطلب). الوظيفة المجهزة هي منحنى سيني يتبع الصيغة الموضحة أدناه (يتم استبعاد Fits with R2<0.95 من الخطوات التالية):
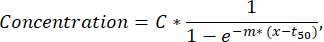
حيث تتوافق C مع هضبة التركيز [nM] ، و t50 إلى إزاحة نصف الحد الأقصى [s] ، و m إلى منحدر Hill [min-1]. من هذه المعلمات ، يتم استخراج واصفات المنحنى التالية كما هو موضح أدناه.- Cmax [nM]: الحد الأقصى للتركيز المقاس.
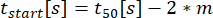 وقت بدء الإفراز ، حيث تصل النوبة إلى 10٪ من درجة مئوية.:
وقت بدء الإفراز ، حيث تصل النوبة إلى 10٪ من درجة مئوية.: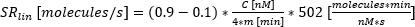 معدل الإفراز كميل خطي تقريبي للمنحنى بين 10٪ و 90٪ من منحنى تركيز الوقت.:
معدل الإفراز كميل خطي تقريبي للمنحنى بين 10٪ و 90٪ من منحنى تركيز الوقت.:
النتائج
سمحت المنصة الوظيفية أحادية الخلية المقدمة بقياس العديد من المعلمات. أولا ، وعلى غرار التقنيات القياسية ، يتم تصوير تواتر الخلايا المفرزة في نهاية القياس (الشكل 4 أ). بعد التحفيز باستخدام 1 ميكروغرام / مل من عديد السكاريد الدهني (LPS) لمدة 6 ساعات من خلايا الدم أحادية النواة المحيطية (PBMC) ، 5.81٪ من الخلايا تفرز IL-6 (ن = 1270) ، 4.55٪ TNFα (ن = 995) و 6.06٪ IL-1β (ن = 1326).
لتحديد إفراز السيتوكين ، تم إنشاء منحنيات معايرة بتركيزات معروفة من السيتوكينات المؤتلفة (الشكل 4 ب). تسمح منحنيات المعايرة هذه بالقياس الكمي لتركيزات السيتوكين داخل القطيرات بمرور الوقت. على سبيل المثال ، وصل متوسط تركيز IL-6 في القطرة إلى هضبة بعد 90 دقيقة ل PBMC المحفز LPS ، في حين زاد متوسط IL-1β داخل القطرة بسرعة أكبر من 90 دقيقة ، مما يعرض الدقة الديناميكية للمنصة وإمكانية استخراج مجموعات فرعية من الخلايا تفرز سيتوكينات معينة (الشكل 4C). مع تغير التركيز بين نقاط القياس ، يمكن حساب معدلات الإفراز الديناميكية لكل سيتوكين. بالنظر إلى متوسط معدل الإفراز لكل سيتوكين (الشكل 4 د) ، أظهرت الخلايا المفرزة IL-6 انخفاضا ثابتا في متوسط معدل الإفراز ، بينما أظهرت كل من الخلايا المفرزة TNFα و IL-1β زيادة في معدل الإفراز بعد 90 دقيقة من وقت القياس وانخفاض ثان بعد 150 دقيقة.
علاوة على ذلك ، من الممكن تجميع الخلايا في مجموعات فرعية اعتمادا على السيتوكينات المفرزة والمفرزة (الشكل 4E). هنا ، يتم إفراز IL-6 و TNFα بشكل فردي بنسبة 30.2٪ و 26.4٪ من الخلايا التي تفرز IL-6 أو TNFα ، على التوالي ، بينما تشكل خلايا IL-1β أحادية الإفراز 68.8٪ من جميع الخلايا المفرزة IL-1β. بالإضافة إلى ذلك ، يمكن حل آثار الإفراز المشترك على التركيزات المفرزة ومعدلات الإفراز (الشكل 4F). من خلال النظر إلى الخلايا التي تفرز IL-6 ، تم إفراز كميات مختلفة من IL-6 إذا أنتجت الخلايا بالإضافة إلى TNFα أو IL-1β. وبالمثل ، اختلف توزيع متوسط معدلات الإفراز على القياس إحصائيا بين الخلايا التي تفرز IL-6 أو IL-6 فقط جنبا إلى جنب مع TNFα (معدلات إفراز أعلى) و IL-1β (معدلات إفراز IL-6 أقل).
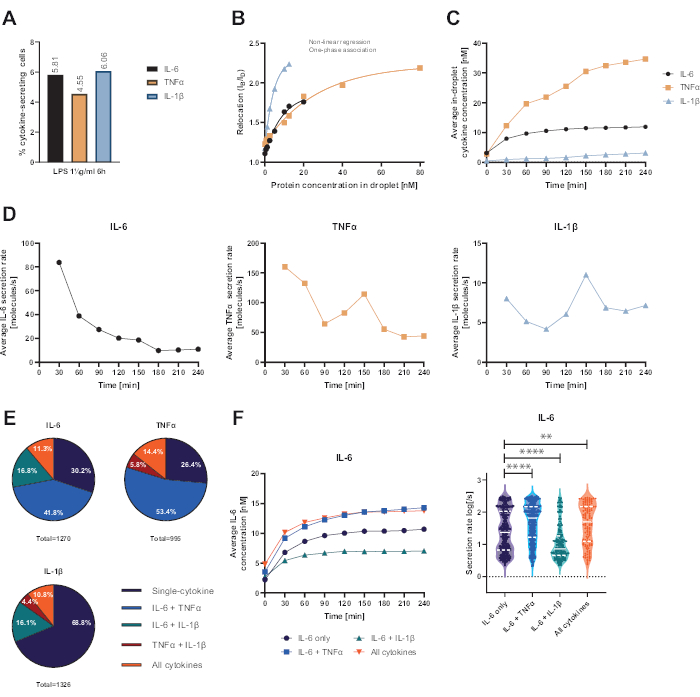
الشكل 4: النتائج التمثيلية لإفراز IL-6 و TNFα و IL-1β PBMC بعد تحفيز لمدة 6 ساعات باستخدام 1 ميكروغرام / مل LPS. (أ) النسبة المئوية لإفراز PBMC IL-6 و TNFα و IL-1β في نهاية القياس لمدة 4 ساعات. (ب) تتولد منحنيات معايرة السيتوكينات المتعددة بتركيزات معروفة من السيتوكينات المعاد الاتحاد. وهذا يسمح بالقياس الكمي لتجارب الخلية عن طريق الحوسبة من قيمة النقل تركيز السيتوكين داخل القطرة. تم تركيب النقاط باستخدام ملاءمة منحنى ارتباط أحادي الطور غير خطي ، r2 = 0.9926 (IL-6) ، 0.9901 (TNFα) ، 0.9990 (IL-1β). (ج) متوسط التركيزات المفرزة من IL-6 و TNFα و IL-1β المنبعثة عن طريق إفراز PBMC خلال وقت القياس 4 ساعات. (د) متوسط معدلات إفراز IL-6 و TNFα و IL-1β خلال وقت القياس 4 ساعات. ه: النسبة المئوية النسبية لخلايا الإفراز المشترك التي تفرز IL-6 أو TNFα أو IL-1β وتوليفاتها. تطبيع لجميع الخلايا المفرزة المكتشفة لكل سيتوكين. (F) متوسط تركيزات IL-6 خلال وقت القياس ومتوسط توزيعات معدل الإفراز (اللوغاريتم) للخلايا المفرزة IL-6 ذات استبانة الإفراز المشترك (ن = 383 ل IL-6 فقط ، ن = 531 ل IL-6 + TNFα ، ن = 213 ل IL-6 + IL-1β و ن = 143 ل IL-6 + TNFα + IL-1β). تم تقييم الاختلافات الإحصائية في توزيعات معدل الإفراز باستخدام اختبارات Kolmogorov-Smirnov ذات الوجهين ، غير المتزاوجة ، غير المعلمية بثقة 95٪ ، ويتم تمثيل القيمة الاحتمالية. ** (ص <0.002) و **** (ص <0.0001). يمثل الخط الكامل الوسيط والخط المنقط الأرباع. nمجموع الخلايا = 21 866. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لاستخراج معلومات إضافية عن مستوى الخلية الواحدة ، يمكن تركيب وظيفة السيني على نقاط تركيز الوقت لكل خلية وسيتوكين (الشكل 5). تم تصوير تركيز مثالي بمرور الوقت لمجموعة بيانات لخلية واحدة والملاءمة السينية المقابلة في الشكل 5A. هنا ، ينتج عن إجراء تركيب المربعات الصغرى المعلمات التالية: C ، المقابلة لقيمة الهضبة العليا للمنحنى ، t50 تحديد التحول الزمني للمنحنى من الصفر ، ومنحدر Hill m ، الذي يصف انحدار الجزء الصاعد من منحنى السيني مع قيم تركيز 10٪ و 90٪ تم الوصول إليها طوال القياس. من معلمات الملاءمة هذه ، يمكن استخراج بعض واصفات المنحنى كما هو موضح في الخطوة 7.12. ينتج Cmax ، أعلى قيمة تركيز للبيانات ،t start ، وقت بدء الإفراز ، الذي يعرف بأنه الوصول إلى 10٪ من قيمة تركيز الهضبة العليا ، و SRlin ، معدل الإفراز خلال الجزء الصاعد من المنحنى.
لتصنيف المجموعات السكانية الفرعية للخلايا ، تم تصنيف واصفات المنحنى التي تم الحصول عليها من جميع نوبات الخلية المفردة إلى ثلاث فئات لكل منها: تم تجميع قيمC القصوى في منخفضة ومتوسطة وعاليةلتبدأ t في وقت مبكر ومتوسط ومتأخر منخط SR إلى إفرازات بطيئة ومتوسطة وسريعة. لتوضيح هذا التصنيف ، يتم عرض أربعة منحنيات إفراز أحادية الخلية نموذجية وواصفات المنحنى المقابلة لها (الشكل 5A-D) ، حيث يعرض المنحنى A خصائص إفراز منخفض مبكر بمعدل متوسط ، والمنحنى B هو إفراز مبكر وبطيء ومرتفع ، والمنحنى C إفرازا مرتفعا سريعا مبكرا ، ويظهر المنحنى D إفرازا منخفضا متأخرا. من المهم ملاحظة أن القطع لهذه المعايير هي خاصة بالخلية والسيتوكين ومعلمة الفحص ، وتحتاج إلى تكييفها لكل سؤال بحثي. علاوة على ذلك ، تم النظر هنا فقط في إفراز IL-6 ل PBMC بعد تحفيز 1 ميكروغرام / مل LPS لمدة 6 ساعات ، مما يعني أن معظم الخلايا كانت إفرازات مبكرة وعالية بنسبة 80٪ و 79٪ على التوالي (الشكل 5E-F). فيما يتعلق بمعدل الإفراز ، لوحظت استجابة ثنائية القطب مع 55٪ من الخلايا المفرزة IL-6 هي إفرازات بطيئة و 39٪ كمفرزات سريعة (الشكل 5G).
لمزيد من توصيف سلوك الإفراز ، تم رسم واصفات المنحنى لكل خلية مقابل بعضها البعض وتم استخراج مجموعات مختلفة (الشكل 5H-J). لم يتم إعطاء ارتباط واضح بين tstart و Cmax (الشكل 5H): كان أكبر مجموعتين من الإفرازات المنخفضة المبكرة والإفرازات العالية مستقلة عن بداية الإفراز. بالنظر إلى العلاقة بين tstart و SRlin (الشكل 5I) ، كانت معظم الخلايا عبارة عن إفرازات بطيئة مبكرة مع مجموعة واضحة من الإفرازات العالية المبكرة وعدد قليل من الإفرازات البطيئة / المتوسطة إلى المتأخرة. فيما يتعلق بارتباطات SRlin و Cmax (الشكل 5J) ، لم تكن هناك إفرازات سريعة منخفضة إلى متوسطة تقريبا ، مع وجود عدد أكبر فقط من الإفرازات المنخفضة السريعة. علاوة على ذلك ، كان هناك عدد كبير من الإفرازات السريعة التي لا تعتمد على الحد الأقصى للتركيز المقاس ، ومجموعتان من الإفرازات العالية تفرز إما بطيئة أو سريعة. باختصار ، يمكن الاستنتاج أن التحقيق في العلاقة بين واصفات المنحنى للخلايا الفردية ينتج عنه تحليل أكثر تفصيلا ويمكن أن يستخرج نتائج بيولوجية جديدة من قياسات إفراز الخلية الواحدة.
من خلال التحليل المقدم أعلاه ، استخلصنا ديناميكيات إفراز خلايا الإفراز المشترك (الشكل 6). يظهر مثالان منحنيان ديناميكيات مختلفة للإفراز المشترك ل IL-6 و TNFα من خليتين مفردتين مع بداية متزامنة لكلا السيتوكينات (الشكل 6A) ، أو بداية إفراز متسلسلة ، مع إفراز IL-6 أولا (الشكل 6B). لتصنيف جميع خلايا الإفراز المشترك ، تم تحديد تأخير إفراز مدته 60 دقيقة ، حيث تعتبر جميع الخلايا التي تبدأ الإفراز ضمن هذا النطاق إفرازات متزامنة وجميع الخلايا ذات التأخيرات الأطول تعتبر إفرازات متسلسلة. سمح هذا التحليل أيضا بإمكانية ملاحظة السيتوكين الذي تم إفرازه أولا. بالنسبة ل IL-6 و TNFα ، لوحظ إفراز مشترك متزامن بشكل أساسي في 76٪ من الخلايا (الشكل 6C) ، بينما بالنسبة ل IL-6 و IL-1β ، لوحظ إفراز مشترك متسلسل في 86٪ من الخلايا مع كون IL-6 أول سيتوكين يتم إفرازه في معظم الحالات (الشكل 6D).
بالنظر إلى وقت بدء إفراز السيتوكينات المختلفة لجميع الخلايا الفردية التي تفرز بشكل مشترك، لم يلاحظ وجود ارتباط واضح بين أوقات بدء الإفراز في التجارب التي أجريت. بالنسبة للإفراز المشترك IL-6 و TNFα (الشكل 6E) ، كانت هناك مجموعة رأسية أكبر حوالي 0 دقيقة ، تتوافق مع خلايا الإفراز المشترك بشكل أكثر انتشارا بدءا من IL-6. بالنسبة للإفراز المشترك IL-6 و IL-1β (الشكل 6F) ، بدأت معظم الخلايا في إفراز IL-6 في بداية القياس ، بينما تم إفراز IL-1β بشكل أساسي لاحقا. باختصار ، مكن التحليل المقدم هنا من تحديد مجموعات فرعية مختلفة من الإفرازات وديناميكيات إفراز السيتوكين المشترك المعقدة.
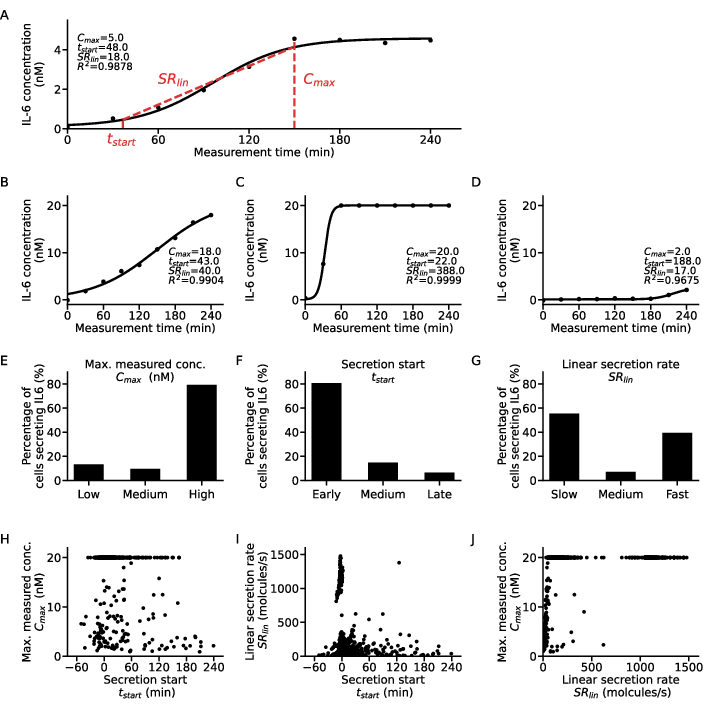
الشكل 5: تحليل مفصل لأنماط ديناميكية إفراز مختلفة لمنحنيات الخلايا المفرزة أحادية IL-6. (أ) بيانات تركيز السيتوكين أحادية الخلية التمثيلية خلال وقت القياس مع منحنى السيني المجهز والمعلمات المستخرجة. (ب-د) ثلاثة منحنيات نموذجية لتركيز السيتوكين أحادي الخلية لأنواع إفراز السيتوكين المختلفة الموجودة لإفراز IL-6 بعد تحفيز LPS. (E-G) النسب المئوية لخلايا إفراز IL-6 المصنفة إلى أنواع إفراز مختلفة بالمعايير التالية (ن = 633):الحد الأقصى ل EC: منخفض <5 نانومتر ، مرتفع > 19.5 نانومتر ، F. tالبداية: في وقت مبكر <30 دقيقة ، أواخر > 120 دقيقة ، G.SR lin: بطيء <250 جزيء / ثانية ، سريع >750 جزيء / ثانية. (H-J) العلاقة بين واصفات منحنى الإفراز الثلاثة Cكحد أقصى ، tstart و SRlin لكل خلية فردية (n = 633). ينتج عدد السكان الكبير عند Cmax = 20nM عن الوصول إلى الحد الأعلى للكشف عن الفحص. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
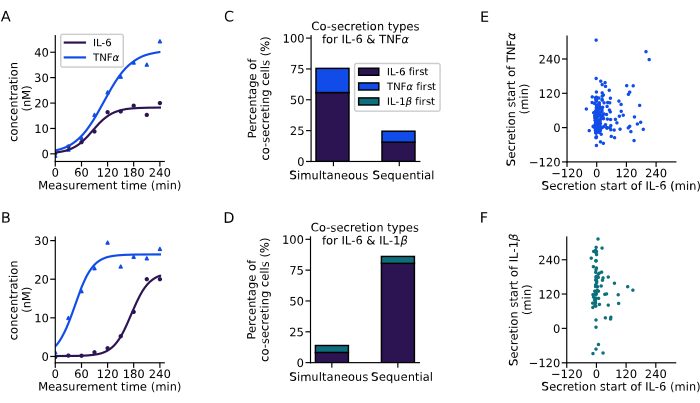
الشكل 6: استخلاص أنماط الإفراز المشترك من منحنيات تركيز الخلية الواحدة. (A-B) منحنيات التركيز التمثيلية للخلايا المفردة التي تفرز IL-6 و TNFα (A) في وقت واحد و (B) بالتتابع ، على التوالي. (ج-د) النسبة المئوية للخلايا التي تظهر إفرازا متزامنا ومتسلسلا ل IL-6 و TNFα (n = 249) ، أو IL-6 و IL-1β (n = 72) ، على التوالي. يتم تعريف الإفراز المتسلسل من خلال التأخير بين بدء إفراز السيتوكين لأكثر من 60 دقيقة. تشير الألوان إلى أي من السيتوكينات بدأ الإفراز أولا. (إ-و) العلاقة بين أوقات بدء الإفراز للسيتوكينات المختلفة لكل خلية إفرازية (nIL6-TNFα = 249 ، nIL6-IL1β = 72). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
كثيرا ما يتم التحقيق في إطلاق السيتوكين وإفرازه في علم المناعة والطب السريري3. يمكن أن يؤدي إفراز السيتوكين غير المتوازن إلى آثار ضارة للمرضى الذين يعانون من الالتهابات ولكن أيضا في الأمراض العصبية أو الالتهاب أو السرطان26،27،28. على الرغم من أن أهميتها في الصحة والمرض راسخة ، إلا أن دراسة السيتوكينات وخلاياها المفرزة لا تزال صعبة لأن المنهجيات الحالية غير قادرة على الكشف بدقة عن السيتوكينات الناشئة من خلية واحدة وقياسها بطريقة تم حلها بمرور الوقت. بالنسبة لسير العمل المقدم هنا ، تم استخدام بروتوكول تحفيز ثابت مع PBMC وتم قياس إفرازها من IL-6 و TNF-α و IL-1β. نشأ اختيار استخدام PBMCs بدلا من المجموعات السكانية الفرعية الفردية المنقاة من التطبيق السابق للتحقيق في متلازمات إطلاق السيتوكين (CRS)23 ، وهي حالة تتميز بتركيزات بلازمية مرتفعة للغاية من السيتوكينات المؤيدة للالتهابات ، بما في ذلك IL-6 و TNF-α و IL-1β29. نظرا لأن CRS لا يرتبط عادة بمجموعة سكانية واحدة فقط ، فقد استخدمنا PBMCs لأنها ستكون موجودة في الجسم الحي. ومع ذلك ، يمكن تنقية المجموعات الفرعية الخلوية وتقييمها بشكل فردي ، إذا كان السؤال العلمي يتطلب هذه الخطوة. تم تحسين وقت الحضانة وظروف التحفيز ونطاقات الفحص الديناميكي لقياس إفراز السيتوكينات الثلاثة ذات الأهمية. يوضح سير العمل والبيانات المعروضة هنا كيفية إعداد ومعايرة وقياس وقياس وتحليل إفراز الخلية الواحدة الذي تم حله بمرور الوقت لسيتوكينات متعددة. يوفر هذا البروتوكول مخططا حول كيف يمكن للتحليل متعدد الوظائف لإفراز السيتوكين أن يتيح التنوع الوظيفي والديناميكي الكبير للسيتوكين الذي يفرز في المرضى.
تتيح العديد من الجوانب الحاسمة لبروتوكول الفحص الموصوف قراءات بيولوجية فريدة. أولا ، سمح تغليف الخلية الواحدة في قطرات الموائع الدقيقة باستخراج البيانات لكل خلية على حدة. يمكن الكشف عن أحداث تغليف الخلايا المتعددة وفرزها داخل أو خارج عن طريق تحليل الصور ، اعتمادا على سؤال البحث. ثانيا ، سمح إدراج العديد من المقايسات المناعية الفلورية المستقلة في القطيرات ومحاذاة الجسيمات النانوية الوظيفية بالقياس الكمي لما يصل إلى ثلاثة تركيزات من السيتوكين بالتوازي. مكن هذا الإرسال المتعدد من تحليل أنماط إفراز السيتوكين المشترك على مستوى خلية واحدة. ثالثا ، سمح تجميد القطرات بالقياس الزمني وارتباط إفراز السيتوكين لكل خلية إفرازية وسمح بالتمييز بين الإفراز المشترك والإفراز المتسلسل. قدمت دقة الوقت بشكل فريد بيانات عن أنماط الإفراز والمجموعات السكانية الفرعية لأنواع الإفرازات المختلفة. وأخيرا، مكن تحليل الصور المتوازي من استخراج وتتبع كميات كبيرة من البيانات بكفاءة من القياسات مع أكثر من 20000 خلية فردية. سمح الاستخراج من منحنيات الإفراز الفردي باكتشاف مجموعات فرعية من النمط الظاهري ووظائفه.
بجانب قراءته الفريدة ، يتمتع الفحص أيضا بمزايا تقنية مقارنة بتحليل السيتوكين القياسي. بفضل الحجم الصغير لحجرات التغليف التي تبلغ حوالي 60 مل ، يمكن اكتشاف كميات مطلقة من السيتوكينات المفرزة مباشرة من المصدر البيولوجي مع حدود الكشف التي تناسب إفراز الخلية. يستخدم تصغير الفحص أيضا كميات أقل من الكواشف الحيوية باهظة الثمن. علاوة على ذلك ، يتطلب الإعداد القليل جدا من المعدات المتخصصة ، والتي غالبا ما تكون متاحة بالفعل في مختبرات البيولوجيا والهندسة الحيوية. تتوفر المجاهر الفلورية على نطاق واسع ، وكثيرا ما تستخدم مضخات الحقن في مختبرات الهندسة الحيوية أو يمكن شراؤها بتكلفة منخفضة نسبيا. في حالة وجود مزرعة خلوية ، تبلغ تكلفة المعدات الكاملة اللازمة لإجراء التجارب حوالي 148000 يورو ، مع مساهمة الغالبية بواسطة المجهر الفلوري الآلي (130000 يورو). ومع ذلك ، يمكن العثور على مثل هذه الأداة في كثير من الأحيان في المختبرات البيولوجية ، ويتم توزيع بقية التكلفة على مضخة الحقنة (13000 يورو ، ولكن تتوفر بدائل أرخص) ومعدات أصغر. تم وصف تصنيع رقاقة القطيرات وغرفة المراقبة بشكل جيد للغاية17 ويمكن إجراؤها خارج بيئة غرف الأبحاث مع البنية التحتية اللازمة ، مثل الأفران ومنظفات البلازما الموجودة في معظم مختبرات الهندسة الحيوية. بدلا من ذلك ، يتوفر موردون مختلفون لتزويد المختبرات المهتمة برقائق مولد القطيرات. نظرا للأحجام الصغيرة المطلوبة ، فإن الفحص فعال من حيث التكلفة وسهل الإعداد.
لضمان أعلى درجة من التكرار ، حددنا بعض الخطوات الحاسمة لنجاح البروتوكول. مشكلة شائعة للمستخدمين لأول مرة هي حركة القطيرات أثناء القياس. في حين أن برنامج التحليل يمكنه تتبع القطرات الفردية إلى حد ما ، فإن الحركة المفرطة تؤدي إلى فقدان دقة الخلية الواحدة والنتائج غير الدقيقة. يمكن تجنب الحركة باستخدام غرف قياس محكمة الإغلاق بشكل صحيح ، وحجم القطرات الصحيح وأحجام الغرف ، وفترة توازن قصيرة قبل بدء القياس ، وتركيز الفاعل بالسطح المناسب. خطوة أخرى حاسمة هي التركيز الدقيق قبل بدء القياس. يؤدي التركيز غير السليم إلى انخفاض كبير في قيم نقل التألق والتقليل من كمية السيتوكين المفرز. أخيرا ، اعتمادا على السؤال والبروتوكول المطروح ، يعد التوقيت الصحيح بين الخطوات المختلفة ذا أهمية قصوى لقابلية التكاثر. يجب أن يكون وقت الانتظار بين ملء الغرفة وبدء القياس متسقا ، وإلا فقد يتم تفويت نافذة قياس السيتوكينات المفرزة.
تشمل قيود التكنولوجيا المقدمة القدرة المحدودة على زيادة التلاعب بالخلايا بعد التغليف. لذلك لا يمكن حاليا إضافة أو إزالة المنشطات أو الأجسام المضادة أو الكواشف الإضافية. بالإضافة إلى ذلك ، نظرا لأن الخلايا مغلفة في مفاعلها الحيوي المعزول ، فلا يمكن إجراء تفاعلات بين الخلايا (الإشارات القائمة على الاتصال أو paracrine) أثناء القياس. يمكن التغلب على هذا القيد جزئيا من خلال الحضانة السائبة مسبقا. إلى جانب ذلك ، من الممكن أيضا تعزيز تأثيرات autocrine من السيتوكينات المفرزة ولا يمكن تحديد هذه التأثيرات أو استبعادها على وجه اليقين ، حيث يتم قياس السيتوكينات المفرزة المكتشفة بالأجسام المضادة فقط. لذلك ، يجب دائما وصف وجهة النظر المعزولة حول إفراز السيتوكين في سياق السؤال والتطبيق المقابلين. ومع ذلك ، يمكن أيضا استخدام هذا القيد للدراسة التفصيلية للمضاعفات المغلفة والمزدوجة والثلاثية إذا كانت ذات أهمية. سيوفر هذا إعدادا مثيرا للاهتمام مفيدا للتحقيق في الاتصال بالخلية أو الأسئلة القائمة على paracrine. أخيرا ، النطاق الديناميكي للفحص محدود ويحتاج إلى التكيف مع التطبيق المحدد. هنا ، قمنا بتكييف النطاق الديناميكي للفحص مع الكمية المفرزة المتوقعة من السيتوكينات المقاسة.
ولزيادة تعزيز قدرات الفحص وإمكانية تطبيقه، يمكن معالجة العديد من التطورات في المستقبل، في الجوانب البيولوجية والتقنية وتحليل البيانات. على الجانب البيولوجي ، يمكن دمج قياس السيتوكينات الإضافية أو البروتينات المفرزة الأخرى أو علامات التمثيل الغذائي أو سطح الخلية عن طريق تكييف الفحص. علاوة على ذلك ، يمكن دمج هذا الفحص في سير العمل جنبا إلى جنب مع المقايسات الأخرى القائمة على الخلايا لتوسيع القراءات (على سبيل المثال ، تلطيخ التدفق الخلوي أو التسلسل). بالإضافة إلى ذلك ، يمكن تبسيط قابلية استخدام الفحص ، على سبيل المثال ، عن طريق إنشاء شريحة موائع دقيقة متكاملة لإنشاء القطيرات ومراقبتها ، مما قد يتيح تطبيقا أوسع خارج مختبرات الهندسة الحيوية في بيئة سريرية. فيما يتعلق بتحليل البيانات ، يمكن توسيع استخراج وتتبع المعلومات من الصور من خلال تعزيز الأتمتة واستخدام نهج التعلم الآلي ، على سبيل المثال ، للكشف عن وجود وموضع الخلية (الخلايا) وخط الخرز في كل قطرة دون وضع علامات على الفلورسنت. سيؤدي القيام بذلك إلى فتح قنوات فلورية إضافية يمكن استخدامها للمقايسات المناعية ، مما يؤدي إلى قياس المزيد من السيتوكينات بالتوازي.
يمكن تطبيق الفحص المقدم والبروتوكولات والتحليلات المرتبطة به على حالات الاستخدام المحتملة المتنوعة المتعلقة بديناميكيات إفراز السيتوكينات. وبشكل أكثر تحديدا ، يمكن أن يعالج الفحص الأسئلة المناعية الأساسية مثل تحديد نوع الخلية وملفات إفراز السيتوكين الخاصة بالتنشيط ، أو تعدد وظائف الخلايا المفرزة للسيتوكين ، أو الآليات الزمنية والصيانة لأرصدة السيتوكينات. علاوة على ذلك ، في التطبيقات السريرية ، قد تمكن المنصة من كشف دور السيتوكينات أثناء الاستجابات الالتهابية النشطة أو المزمنة ، كما لوحظ في COVID-1930 ، أو توفر أداة لتقسيم المرضى إلى طبقات وتخصيص العلاجات بناء على توقيعات فريدة كما هو الحال في الالتهاب الذاتي31. في الختام ، يعد التقييم الكمي الذي تم حله زمنيا لإفراز السيتوكين من الخلايا المفردة طريقة مطلوبة بشدة لأنه يوضح كيف يؤدي دواء معين أو عدوى أو تغيير جيني أو تحفيز خارج الجسم الحي إلى استجابة معينة.
Disclosures
تم تسجيل براءة اختراع جوانب محددة مثل قياسات خط الخرز للخلايا.
Acknowledgements
تم دعم هذا المشروع من خلال المنحة # 2021-349 من مجال التركيز الاستراتيجي للصحة الشخصية والتقنيات ذات الصلة (PHRT) لمجال ETH (المعاهد الفيدرالية السويسرية للتكنولوجيا) ، ومنحة بدء مجلس البحوث الأوروبي (منحة # 803,336) ، والمؤسسة الوطنية السويسرية للعلوم (منحة #310030_197619). بالإضافة إلى ذلك ، نشكر Guilhem Chenon و Jean Baudry على عملهما وتطوير محلل DropMap الأولي.
Materials
| Name | Company | Catalog Number | Comments |
| 008-FluoroSurfactant | RAN Biotechnologies | 008-FluoroSurfactant-10G | |
| 2-Stream flow-focusing droplet maker, 30 µm nozzle, PFOS hydrophobic surface treatment | Wunderli chips | ||
| Alexa Fluor 647 NHS Ester | ThermoFisher | A20006 | https://www.thermofisher.com/ch/en/home/references/protocols/cell-and-tissue-analysis/labeling-chemistry-protocols/fluorescent-amine-reactive-alexa-fluor-dye-labeling-of-igm-antibodies.html |
| Anti-Human IL-1β (Monoclonal Mouse), AF647 labelled in-house | PeproTech | 500-M01B | |
| ARcare92524 double-sided adhesive tape | Adhesvies Reasearch | ARcare92524 | |
| Bio-Adembeads Streptavidin plus 300nm | Ademtech | Cat#03233 | |
| Biotinylated Goat Anti-Human IL-1β | PeproTech | 500-P21BGBT | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A3059 | |
| Cell Scraper | TPP | 99002 | |
| CellTrace Violet Cell Proliferation Kit | Invitrogen | C34557 | Cell staining solution |
| Chromafil Xtra PTFE-45/25 syringe filters | Macherey-Nagel | 729205 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| D-Biotin | Fluorochem | M02926 | |
| DPBS, no calcium, no magnesium | Gibco | 14196-094 | |
| epT.I.P.S. Standard 2-200 µl | Eppendorf | 30000889 | |
| Ethylenediaminetetraacetic acid disodium salt solution | Sigma-Aldrich | 3690 | |
| EZ-LINK-NHS-PEG4-Biotin | ThermoFisher | A39259 | https://www.thermofisher.com/order/catalog/product/20217 |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| Handy dish soap | Migros | 5.01002E+11 | |
| HEPES (1 M) | Gibco | 15630-080 | |
| HFE-7500 Oil 3M TM Novec | Fluorochem | B40045191 | |
| Idex F-120 Fingertight One-Piece Fitting, Standard Knurl, Natural PEEK, 1/16" OD Tubing, 10-32 Coned | Cole-Parmer | GZ-02014-15 | |
| IL-6 Monoclonal Antibody (MQ2-13A5 - Rat), FITC | ThermoFisher | 11-7069-81 | |
| IL-6 Monoclonal Antibody (MQ2-39C3), Biotin | ThermoFisher | 13-7068-85 | |
| KnockOut Serum Replacement | ThermoFisher | 10828-010 | |
| Loctite AA 3491 curable UV glue | Henkel AG & Co | 3491 | |
| Microscope slides (76x26x1mm, clear white) | Menzel Gläser | ||
| Mineral oil light | Sigma-Aldrich | 330779 | |
| NanoPort Assembly Headless, 10-32 Coned, for 1/16" OD | Idex | N-333 | |
| Neodymium block magnet | K&J Magnetics | BZX082 | |
| Omnifix-F Spritze, 1 ml, LS | Braun | 9161406V | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Phosphate buffered saline | Sigma-Aldrich | P4417 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | ThermoFisher | P6866 | |
| Precision wipes | Kimtech Science | 5511 | |
| PTFE microtubing 0.30 × 0.76 mm | FisherScientific | 1191-9445 | |
| PTFE microtubing 0.56 × 1.07 mm | FisherScientific | 1192-9445 | |
| Recombinant Human IL-1β | Peprotech | Cat#200-01B | |
| Recombinant Human IL-6 | Peprotech | Cat#200-06 | |
| Recombinant human serum albumine (HSA) | Sigma-Aldrich | A9731 | |
| Recombinant Human TNF-α | Peprotech | Cat#300-01A | |
| Reusable biopsy punch diameter 0.75 mm and 6 mm | Stiefel | 504529 and 504532 | |
| RPMI 1640 Medium, no phenol red | Gibco | 11835-030 | |
| Standard LPS, E. coli K12 | InvivoGen | tlrl-eklps | |
| Sterican needles 23 G for 0.56 mm diameter microtubing | FisherScientific | 15351547 | |
| Sterican needles 27 G for 0.30mm diameter microtubing | FisherScientific | 15341557 | |
| TNF alpha Monoclonal Antibody (MAb11), PE | ThermoFisher | 12-7349-81 | |
| TNF-alpha Monoclonal Antibody (MAb1), biotinylated in-house | ThermoFisher | 14-7348-85 | |
| Trypan Blue Stain (0.4%) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99500 | |
| Devices | |||
| Cameo 4 automatic cutting machine | Silhouette | ||
| Cetoni Base 120 + 3x NEMESYS Low Pressure Syringe Pumps | Cetoni | NEM-B101-03 A | |
| Countess II Automated Cell Counter | ThermoFisher | ||
| Inverted Epi-fluorescence microscope Ti2 | Nikon | ECLIPSE Ti2-E, Ti2-E/B*1 | |
| OKO Lab Cage Incubator, dark panels | OKO Lab | ||
| ORCA-Fusion Digital CMOS camera | Hammatsu | C14440 | |
| SOLA Light Engine | Lumencor | sola 80-10247 |
References
- Chen, L., et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 9 (6), 7204-7218 (2017).
- Cicchese, J. M., et al. Dynamic balance of pro- and anti-inflammatory signals controls disease and limits pathology. Immunol Rev. 285 (1), 147-167 (2018).
- Liu, C., et al. Cytokines: From clinical significance to quantification. Adv Sci. 8 (15), e2004433 (2021).
- Rojas, J. M., Avia, M., Martín, V., Sevilla, N. IL-10: A multifunctional cytokine in viral infections. J Immunol Res. 2017, 6104054 (2017).
- Kohanawa, Y. M. A regulatory effect of the balance between TNF-α and IL-6 in the granulomatous and inflammatory response to Rhodococcus aurantiacus infection in mice. J Immunol. 177 (1), 642-650 (2006).
- Geginat, J., et al. Plasticity of human CD4 T cell subsets. Front Immunol. 5, 630 (2014).
- Sallusto, F. Heterogeneity of human CD4+ T cells against microbes. Ann Rev Immunol. 34 (1), 317-334 (2016).
- Chetaille Nézondet, A. L., Poubelle, P. E., Pelletier, M. The evaluation of cytokines to help establish diagnosis and guide treatment of autoinflammatory and autoimmune diseases. J Leukocyte Biol. 108 (2), 647-657 (2020).
- Sims, J. T., et al. Characterization of the cytokine storm reflects hyperinflammatory endothelial dysfunction in COVID-19. J Allergy Clin Immunol. 147 (1), 107-111 (2021).
- Yasen, A., et al. Single-cell RNA sequencing reveals the heterogeneity of infiltrating immune cell profiles in the hepatic cystic echinococcosis microenvironment. Infection and Immunity. 89 (12), (2021).
- Jiang, Y., et al. Single-cell RNA sequencing highlights intratumor heterogeneity and intercellular network featured in adamantinomatous craniopharyngioma. Sci Adv. 9 (15), (2023).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Bucheli, O. T. M., Sigvaldadóttir, I., Eyer, K. Measuring single-cell protein secretion in immunology: Technologies, advances, and applications. Eur J Immunol. 51 (6), 1334-1347 (2021).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab Chip. 20 (12), 2062-2074 (2020).
- Brower, K. K., et al. Double emulsion picoreactors for high-throughput single-cell encapsulation and phenotyping via FACS. Anal Chem. 92 (19), 13262-13270 (2020).
- Luo, X., Chen, J. Y., Ataei, M., Lee, A. Microfluidic compartmentalization platforms for single cell analysis. Biosensors. 12 (2), 58 (2022).
- Bounab, Y., et al. Dynamic single-cell phenotyping of immune cells using the microfluidic platform DropMap. Nat Protoc. 15 (9), 2920-2955 (2020).
- Eyer, K., et al. Single-cell deep phenotyping of IgG-secreting cells for high-resolution immune monitoring. Nat Biotechnol. 35 (10), 977-982 (2017).
- Gaa, R., et al. Versatile and rapid microfluidics-assisted antibody discovery. mAbs. 13 (1), 198130 (2021).
- Gerard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nat Biotechnol. 38 (6), 715-721 (2020).
- De Jonghe, J., et al. spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content. Nat Comm. 14 (1), 4788 (2023).
- Wheeler, M. A., et al. Droplet-based forward genetic screening of astrocyte-microglia cross-talk. Science. 379 (6636), 1023-1030 (2023).
- Portmann, K., Linder, A., Oelgarth, N., Eyer, K. Single-cell deep phenotyping of cytokine release unmasks stimulation-specific biological signatures and distinct secretion dynamics. Cell Rep Meth. 3 (7), 100502 (2023).
- Portmann, K., Linder, A., Eyer, K. Stimulation-induced cytokine polyfunctionality as a dynamic concept. eLife. 12, 89781 (2023).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin Biochem Rev. 29, S49-S52 (2008).
- Yang, J., et al. New insight into neurological degeneration: Inflammatory cytokines and blood-brain barrier. Front Mol Neurosci. 15, 1013933 (2022).
- Kim, P. S., Ahmed, R. Features of responding T cells in cancer and chronic infection. Curr Opin Immunol. 22 (2), 223-230 (2010).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17 (1), 49-59 (2017).
- Cosenza, M., Sacchi, S., Pozzi, S. Cytokine release syndrome associated with T-cell-based therapies for hematological malignancies: Pathophysiology, clinical presentation, and treatment. Int J Mol Sci. 22 (14), 7652 (2021).
- Hu, B., Huang, S., Yin, L. The cytokine storm and COVID-19. J Med Virol. 93 (1), 250-256 (2021).
- Marcuzzi, A., et al. Autoinflammatory diseases and cytokine storms-Imbalances of innate and adaptative immunity. Int J Mol Sci. 22 (20), 11241 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved