فك تشابك تفاعلات بروتين الجليكان: الرنين المغناطيسي النووي (NMR) للإنقاذ
In This Article
Summary
هنا ، نقدم بروتوكولا يوضح بالتفصيل اكتساب ومعالجة وتحليل سلسلة من تجارب الرنين المغناطيسي النووي التي تهدف إلى توصيف تفاعلات البروتين والجليكان في المحلول. تم تحديد المنهجيات الأكثر شيوعا القائمة على الليجند والبروتين ، والتي تساهم بلا شك في مجالات علم الأحياء السكري الهيكلي ودراسات التعرف الجزيئي.
Abstract
تفاعلات الجليكان مع البروتينات تعدل العديد من الأحداث المتعلقة بالصحة والمرض. في الواقع ، يرتبط إنشاء أحداث التعرف هذه وعواقبها البيولوجية ارتباطا وثيقا بالهياكل ثلاثية الأبعاد لكلا الشريكين ، وكذلك بخصائصها الديناميكية وعرضها على مقصورات الخلايا المقابلة. تعتبر تقنيات الرنين المغناطيسي النووي فريدة من نوعها لفصل هذه الخصائص ، وفي الواقع ، تم تطوير منهجيات متنوعة قائمة على الرنين المغناطيسي النووي وتطبيقها لمراقبة أحداث ارتباط الجليكان مع المستقبلات المرتبطة بها. يحدد هذا البروتوكول إجراءات الحصول على اثنتين من أقوى منهجيات الرنين المغناطيسي النووي المستخدمة في مجال البيولوجيا السكرية بالرنين المغناطيسي النووي ومعالجتها وتحليلها ، 1H-Saturation Transfer Difference (STD) و 1H ، 15N-Heterocore أحادي التماسك الكمي (HSQC) تجارب المعايرة ، والتي تقدم معلومات مكملة من منظور الجليكان والبروتين ، على التوالي. في الواقع ، عند دمجها ، فإنها توفر مجموعة أدوات قوية لتوضيح الجوانب الهيكلية والديناميكية لعمليات التعرف الجزيئي. يعزز هذا النهج الشامل فهمنا لتفاعلات البروتين الغليكان ويساهم في تطوير البحث في مجال علم الأحياء السكرية الكيميائي.
Introduction
يعد التعرف الجزيئي على الجليكان أمرا ضروريا للعديد من العمليات المتعلقة بالصحة والمرض. تعتمد خصوصية وانتقائية المستقبلات البيولوجية (المحاضرات والأجسام المضادة والإنزيمات) للجليكان بشكل كبير على ضبط التوازن غير المستقر بين المكونات المتنوعة للمحتوى الحراري (CH-π و van der Waals ، روابط الهيدروجين ، الكهرباء الساكنة) والانتروبيا (الكارهة للماء ، الديناميات ، الذوبان الذوبان)1.
نظرا للتنوع الكيميائي الكبير والطبيعة الديناميكية للجليكان ، فقد تم استخدام طرق الرنين المغناطيسي النووي على نطاق واسع لتشريح تفاعلات الجليكان لأكثر من 25 عاما2 ، نظرا لأن هذه المنهجيات توفر معلومات رائعة عن أحداث التعرف الجزيئي بتفاصيل دقيقة ، بدقةذرية 3,4 ، حتى عندما لا يمكن استرداد دليل التفاعل المطلوب باستخدام منهجيات أخرى. كنقطة أساسية ، فإن الرنين المغناطيسي النووي متعدد الاستخدامات ويسمح بدراسة الأحداث الديناميكية ، على المستوى الذري ، على نطاقات زمنية مختلفة ، مما يشكل أفضل تقنية حتى الآن لدراسة بنية وتشكيل وديناميكيات الجليكان في المحلول. ومع ذلك ، قد يكون فك تشابك هذه المعلومات عملية معقدة إلى حد ما تتطلب استخدام استراتيجيات محددة جيدا جنبا إلى جنب مع تحليل دقيق للبيانات5.
تقنيات الرنين المغناطيسي النووي متنوعة ، وفي الواقع ، هناك العديد من المنهجيات التي يمكن استخدامها لكشف تفاعلات البروتين الغليكان6. نصف هنا نهجين أساسيين للرنين المغناطيسي النووي يستخدمان حاليا لفك تشفير تفاعلات مستقبلات الجليكان 7,8 ، مع التركيز على كيفية فك تشابك عرض حاتمة الجليكان الرئيسية بالإضافة إلى موقع ربط البروتين9.
في أي حدث التعرف الجزيئي ، عندما يرتبط مستقبل برابط معين ، هناك عملية تبادل كيميائي تؤثر على العديد من معلمات الرنين المغناطيسي النووي للمشاركين في الارتباط10. لذلك ، من منظور الرنين المغناطيسي النووي ، يمكن مراقبة التفاعل إما من وجهة نظر ليجند الجليكان أو من وجهة نظر مستقبل البروتين11. بشكل عام ، مستقبل البروتين هو جزيء حيوي كبير (حركة دورانية بطيئة ، مع معدلات في المقياس الزمني ns ، وبالتالي ، استرخاء عرضي سريع) ، في حين يمكن اعتبار الجليكان المتفاعل جزيئا صغيرا ومتوسط الحجم (حركة دورانية سريعة ، مع معدلات في المقياس الزمني ps ، والاسترخاء المستعرض البطيء)12. من منظور قياسي ، تكون إشارات الرنين المغناطيسي النووي للجليكان ضيقة ، في حين أن إشارات المستقبل واسعة13.
تعتمد طرق الرنين المغناطيسي النووي القائمة على الليجند على التغيير الدراماتيكي الذي تتعرض له العديد من معلمات الرنين المغناطيسي النووي الجليكان عند الانتقال من الحالة الحرة إلى الحالةالمقيدة 14. STD-NMR هي تقنية الرنين المغناطيسي النووي التجريبية الأكثر استخداما لتقييم ميزات ربط الجليكان المتنوعة15 ، من استنتاج وجود الارتباط في حالة المحلول إلى تحديد حاتم ربط الجليكان. أي ذرات الرباط التي تتلامس مع مستقبلات البروتين16.
بدلا من ذلك ، تراقب طرق الرنين المغناطيسي النووي القائمة على المستقبلات التغييرات التي تحدث في إشارات مستقبلات البروتين في وجود الجليكان فيما يتعلق بتلك المسجلة لحالة apo17. تركز هذه بشكل أساسي على فحص اضطرابات التحول الكيميائي لإشارات البروتين بين الحالتين. التجربة الأكثر استخداما هي 1 H-15N HSQC ، أو بدائلها TROSY18.
يسمح الجمع بين كلا النهجين بتطبيق الرنين المغناطيسي النووي على العديد من الأنظمة المتنوعة التي تعرض مجموعة واسعة من التقاربات. ومع ذلك ، بالنسبة لطرق الرنين المغناطيسي النووي القائمة على المستقبلات ، على عكس تلك القائمة على الرباط ، يجب أن تتوفر كمية كبيرة نسبيا من البروتين القابل للذوبان وغير المجمع والمستقر الموسوم بالنظائر (15N).
نصف هنا كلتا الطريقتين ، ونسلط الضوء على نقاط القوة والضعف لديهما. لاحظ أن الخطوات الأساسية الموضحة في البروتوكول تعمل كأمثلة لاستخدام مطياف بروكر. وبالتالي ، تتوافق أسماء الأوامر والمعلمات مع تلك المستخدمة في TopSpin (برنامج التحكم في مطياف Bruker).
Protocol
1. فرق نقل التشبع NMR (STD-NMR)
ملاحظة: تحدد الأسطر اللاحقة الإجراءات الأساسية لاكتساب تجارب STD-NMR ومعالجتها وتحليلها. تعمل هذه الخطوات على تجسيد فائدة التقنية للكشف عن ارتباط الليجند ولتوضيح حاتمة ربط الليجند. للحصول على فهم أكثر عمقا لتصميم تجارب الرنين المغناطيسي النووي واقتنائها ، يرجى الرجوع إلى دليل الشركة المصنعة المقابل المقدم مع أداة الرنين المغناطيسي النووي.
- اقتناء
- تحضير العينة مع مجمع البروتين يجند. استخدم الجليكان: النسب المولية لليكتين بين 10: 1 و 100: 1 بتركيزات بروتين تتراوح بين 0.01 و 0.2 مللي مول. لتفاعل hGalectin-7 مع LacNAc ، استخدم البروتين 50: 1: نسبة الرباط في محلول ملحي مخزن بالفوسفات عند الرقم الهيدروجيني 7.4.
ملاحظة: يجب أن يكون مستقبل البروتين نقيا وقابلا للذوبان في المخزن المؤقت المفضل (في حالة تجارب STD-NMR ، يفضل استخدام الإصدارات المثنوية من المخزن المؤقت المقابل لتقليل تداخل إشارة الرنين المغناطيسي النووي 1H المحتمل). يتم فحص تركيز البروتين مسبقا باستخدام مقياس الطيف الضوئي لقياس الامتصاص عند 280 نانومتر. - من المحلول المحضر ، انقل حجما إجماليا قدره 0.6 مل إلى أنبوب NMR 5 مم باستخدام ماصة.
- قم بإعداد أداة الرنين المغناطيسي النووي عند درجة الحرارة المطلوبة (تتراوح درجات حرارة التجربة الشائعة بين 10 درجات مئوية و 45 درجة مئوية). افتح شاشة التحكم في درجة الحرارة باستخدام الأمر edte واضبط درجة الحرارة المطلوبة. بالنسبة لدراسة hGalectin-7 / LacNAc ، تم ضبط درجة الحرارة على 25 درجة مئوية.
- قم بإنشاء مجموعة بيانات جديدة تحتوي على تسلسل نبض zg.
- لإجراء عملية مباشرة، افتح تجربة حالية واكتب الأمر edc . يظهر مربع حوار ، حدد العنوان والخصائص (مواصفات العينة ، المذيب) وبعض معلمات التجربة.
- إذا كان التغيير من تسلسل النبض الأصلي مطلوبا ، فانتقل عبر نوافذ ased (المعلمات) و AcquPars (معلمات الاستحواذ). في هذه المرحلة ، اختر برنامج النبض المطلوب من مكتبة مقياس الطيف.
- للحصول على طيف 1H NMR قياسي ، حدد تسلسل نبضة zg من القائمة المتاحة.
ملاحظة: في حالة العينات ذات المحتوى المائي المتزايد ، قد تكون هناك حاجة لاستخدام مخططات قمع المياه لزيادة نسبة الإشارة إلى الضوضاء. من المستحسن استخدام تسلسل النبضات مثل zgesgp ، والتي توفر وحدات نحت الإثارة التي تقدم قمعا ممتازا ولكنها تتحكم في مرحلة الإشارات المتبقية. يرجى الرجوع إلى البرنامج التعليمي للرنين المغناطيسي النووي الخاص بالمصنعين للحصول على معلومات إضافية حول أنواع مخططات قمع المياه وخصائصها الرئيسية.
- أدخل عينة الرنين المغناطيسي النووي في المسبار عن طريق تنشيط هواء رفع العينة. استخدم الأمر ej ، وضع العينة في الجزء العلوي من المغناطيس ، وقم بإلغاء تنشيط رفع العينة باستخدام الأمر ij.
ملاحظة: لحقن العينة في المغناطيس باستخدام جهاز أخذ العينات التلقائي، استخدم الأمر sx متبوعا برقم الموضع، n، المقابل لموضع أنبوب الرنين المغناطيسي النووي في درج أخذ العينات التلقائي. - قفل على إشارة المذيب عن طريق كتابة قفل الأمر ثم اختيار المذيب المناسب من القائمة.
- بمجرد إدخال العينة في المسبار ، أكمل عملية الضبط والمطابقة باستخدام atma للوحدة النمطية الأوتوماتيكية أو atmm للوحدة اليدوية.
- ابدأ الخلط التلقائي من خلال أمر واجهة المستخدم الرسومية topshim. سيؤدي هذا إلى فتح واجهة رسومية حيث سيتم تحديد البعد الرقاقة 1D وبدء تشغيله.
ملاحظة: لتقليل عدم استقرار التشنج بسبب تغيرات المجال أو درجة الحرارة الدقيقة ، يمكن تنشيط autoshim للحصول على التجربة. يمكن إجراء ذلك عن طريق الوصول إلى نافذة التحكم BSMS والنقر فوق autoshim. يشير التحول إلى تمييز أخضر إلى أنه تم تنشيط autoshim. يرجى الانتباه إلى أنه عند استخدام autoshim ، يجب ألا يلاحظها أحد مشكلات عدم استقرار العينة المحتملة. لذلك ، ينصح بالحذر عند استخدام autoshim. - تحديد نبضة 1H 90 °. يمكن تنفيذ ذلك تلقائيا من خلال الأمر النبضي .
- تعديل المعلمات المختلفة في نافذة AcquPars. بالنسبة لطيف الرنين المغناطيسي النووي العادي 1H ، اضبط عدد عمليات المسح (NS) على 32 ، والنافذة الطيفية المطلوبة (SW) عند ca. 12 جزء في المليون.
ملاحظة: يتضمن تسلسل نبض zgesgp وحدة لقمع المذيبات للتخلص من إشارة HDO المتبقية ، والتي يجب أن تتمركز في منتصف الطيف. لهذا الغرض ، يجب تعريف O1 بدقة في AcquPars. - اضبط كسب جهاز الاستقبال لتجنب تجاوز السعة باستخدام الأمر التلقائي rga.
- الآن ، احصل على طيف 1H NMR القياسي باستخدام الأمر zg.
- بمجرد الانتهاء من الاستحواذ ، قم بمعالجة الطيف من خلال الأمر efp. قم بتطبيق تصحيحات الخط الأساسي والطور باستخدام شريط قوائم TopSpin.
ملاحظة: لوحظت إشارات 1H NMR المستمدة من الجليكان والبروتين (الشكل 1). يوصى بإجراء تحليل مفصل لطيف الرنين المغناطيسي النووي المكتسب لتنفيذ تجربة الرنين المغناطيسي النووي المنقولة بالاتصال الجنسي ، على النحو المبين في القسم 1.1.14. - قم بإنشاء مجموعة بيانات جديدة وتحميل تسلسل نبضات الرنين المغناطيسي النووي STD ليتم استخدامه بنفس الطريقة الموضحة لتجربة 1H NMR في القسم 1.1.4. في أدوات Bruker ، تتوفر تسلسلات نبضات مختلفة في كتالوج برنامج النبض ، وكلها تسمى stddiffXXX. أبسط واحد (stddiff) لا يشمل أي مخطط قمع المياه أو مرشح قمع البروتين.
- بالنسبة للعينات التي تحتوي على محتوى H2O كبير ، حدد إما تسلسلات stddiffgp19 أو stddiffesgp ، والتي تتضمن بوابة مائية أو وحدة نحت مثيرة. في حالة وجود طيف مع إشارات NMR للبروتين المكثف كخلفية ، حدد تسلسلات stddiffXXX.3 . في كل حالة ، قم بتحسين المعلمات المحددة المقابلة لكل وحدة قمع المياه (أي d19 في مخططات ووترغيت).
- تحديد ترددات الرنين والرنين لتجربة الرنين المغناطيسي النووي STD. ابحث عن قائمة التردد في معلمات AcquPars لنافذة ased أسفل إدخال FQ2LIST. يجب كتابة الترددات المحددة على الرنين وخارج الرنين بالهرتز يدويا في القائمة وحفظها تحت اسم جديد. سيتم استخدام هذه القائمة الجديدة في تجربة STD-NMR.
- اختر تردد الرنين في منطقة طيفية خالية من إشارات الجليكان ، عادة حوالي δ (1ساعة) 0 أو 6.6 جزء في المليون ، للجليكان النموذجي (الشكل 1). اضبط تردد الرنين في منطقة لا تظهر أي ليجند أو بروتون بروتيني. يمكن ضبطه بأمان على +18000 أو -18000 هرتز.
- حدد النبضة المشكلة التي سيتم استخدامها أثناء وقت التشبع في معلمات AcquPars لنافذة ased .
ملاحظة: هناك العديد من الاحتمالات. يمكن استخدام الأشكال الغاوسية أو Eburp بأمان ، بعرض 90 درجة من النبضة الانتقائية البالغة 50 مللي ثانية. - قم بتعيين المعلمات المقابلة في قسم AcquPars.
- اضبط طول النبضة 1H 90 °.
- اضبط قيمة الطاقة للنبضة المشكلة (المقدرة من خلال أداة الشكل).
- اضبط إجمالي وقت التشبع. يمكن استخدام القيم بين 1 s و 4 s بانتظام.
- اضبط تأخير الاسترخاء على 3 ثوان.
- اضبط عدد عمليات الفحص (NS) على مضاعف 8. عادة ، يتم ضبطه على 256 أو 512 أو 1024 للحصول على نسبة الإشارة إلى الضوضاء المناسبة في مجموعات من 2 في كل تردد.
- اضبط عدد عمليات الفحص الوهمية (DS) على 8.
- اضبط عدد النقاط في F2 على 16k أو 32k أو 64k.
ملاحظة: سيؤدي زيادة عدد النقاط في F2 إلى تحسين الدقة ونسبة الإشارة إلى الضوضاء. لهذا السبب ، ينصح بشدة باستخدام ما لا يقل عن 16 ألف نقطة بيانات. - اضبط عدد النقاط في F1. هذا هو عدد الترددات التي سيتم استخدامها ، في هذه الحالة ، 2 (الرنين والرنين).
ملاحظة: حسب الاصطلاح ، يشير F2 إلى البعد المباشر ، وهو البعد الذي يتم فيه أخذ عينات من اضمحلال الحث الحر (FID) مباشرة ، بينما يشير F1 إلى البعد غير المباشر. - اضبط كسب جهاز الاستقبال (RG) لتجنب تجاوز السعة باستخدام الأمر التلقائي rga.
- احسب وقت التجربة الإجمالية باستخدام الأمر expt.
- أرسل التجربة للاكتساب من خلال الأمر zg.
- تحقق دائما من أن التجربة تعمل بشكل صحيح بعد بضع دقائق.
- تحضير العينة مع مجمع البروتين يجند. استخدم الجليكان: النسب المولية لليكتين بين 10: 1 و 100: 1 بتركيزات بروتين تتراوح بين 0.01 و 0.2 مللي مول. لتفاعل hGalectin-7 مع LacNAc ، استخدم البروتين 50: 1: نسبة الرباط في محلول ملحي مخزن بالفوسفات عند الرقم الهيدروجيني 7.4.
- تجهيز
ملاحظة: يتم الحصول على طيف 2D زائف بعد تطبيق البروتوكول الموضح أعلاه. يتوافق عدد الصفوف مع عدد الترددات المستخدمة ، وعادة ما يكون اثنان: الرنين والرنين خارج الرنين.- معالجة fid للتجربة الأولى.
- قم بإجراء تحويل فورييه لرقم fid 1 (من خلال الأمر efp) وحدد وجهة الأطياف المعالجة (حدد رقم procno). بدلا من ذلك ، استخدم الأمر rser 1 لقراءة fid الأول.
- بعد ذلك ، اضبط عامل توسيع الخط من خلال الأمر lb (عادة 3-5 هرتز) ، والمرحلة. للمرحلة يدويا ، انقر فوق علامة التبويب "العملية" ثم اضبط القائمة الفرعية للمرحلة. قم بإجراء تصحيحات صفرية ومن الدرجة الأولى بالنقر والسحب على الزر المقابل. احفظ نتائج المراحل. بالإضافة إلى ذلك ، قم بإجراء تصحيح خط الأساس من خلال الأمر abs.
- اقرأ fid للتجربة الثانية ، وقم بتحويل فورييه (من خلال الأمر efp) بنفس عامل توسيع الخط. اضبط الطور بنفس معلمات المرحلة وتصحيح خط الأساس واحفظ الطيف المعالج برمز مختلف.
- اقرأ الطيفين المعالجين بالوظيفة المتعددة (الأمر: .md) واطرحهما (خارج الرنين - عند الرنين) باستخدام الزر المتاح في التصور المتعدد (Δ). الطيف الجديد هو طيف الرنين المغناطيسي النووي STD ، والذي يتم حفظه برمز مختلف.
- قم بعمل تراكب لطيف الرنين المغناطيسي النووي STD مع الطيف خارج الرنين.
- افتح الطيف خارج الرنين (fid 1) واكتب الأمر .md لفتح نافذة العرض المتعددة. ثم قم بتحميل طيف الأمراض المنقولة بالاتصال الجنسي.
- قارن الترددات والشدة (المعروضة تلقائيا في أعلى الجانب الأيمن) للإشارات في طيف الرنين المغناطيسي النووي STD. يوفر هذا المعلومات المطلوبة حول تلك البروتونات القريبة من البروتين وقربها النسبي. كلما زادت الكثافة النسبية ، كلما اقتربت من البروتين (الشكل 2).
- قم بقياس الشدة (التكاملات) في تجربة الرنين باستخدام البرنامج المقابل. في TopSpin، انتقل إلى تحليل > دمج. حدد المناطق واكتب التكاملات في ملف (I0).
- قم بقياس الشدة (التكاملات) في تجربة الرنين المغناطيسي النووي STD باستخدام نفس المعلمات واكتبها في ملف (ISTD).
- احسب قيمة STD لكل إشارة بروتون باستخدام المعادلة التالية:
الأمراض المنقولة جنسيا = (ISTD) / I0.
ملاحظة: ملاحظة: يتطلب استخدام تكامل الإشارة لحساب قيم الأمراض المنقولة بالاتصال الجنسي فصل إشارات البروتون بشكل كاف. عندما يحدث تداخل الإشارة ، كما هو الحال مع السكريات قليلة السكاريد ، يمكن تحديد قيم الأمراض المنقولة بالاتصال الجنسي من خلال تقييم نسبة شدة الإشارة بين الأمراض المنقولة بالاتصال الجنسي والأطياف خارج الرنين. - احسب الأمراض المنقولة جنسيا النسبية كنسبة مئوية. للقيام بذلك ، أعط قيمة 100٪ للبروتون الذي يظهر أقصى فرق بين الشدة في الرنين خارج الرنين وطيف الرنين المغناطيسي النووي STD. احسب الشدة النسبية للأمراض المنقولة جنسيا للبروتونات الأخرى وفقا لذلك.
ملاحظة: يتطلب التحليل السليم لبيانات الأمراض المنقولة جنسيا ، خاصة لتحديد حاتمة ربط الليجند ، التعيين الكامل لإشارات 1H لليجند. لذلك ، يوصى بشدة بإكمال هذه المهمة قبل الحصول على أطياف الأمراض المنقولة بالاتصال الجنسي.
- معالجة fid للتجربة الأولى.
2. 1تجارب H-15N HSQC
ملاحظة: توضح السطور التالية بالتفصيل استخدام تجارب 1 H-15N HSQC لمراقبة التغيرات في التحولات الكيميائية لرنين الرنين المغناطيسي النووي 1H و 15N للمستقبل (lectin) استجابة لوجود كميات متزايدة من الربيطة (oligosaccharide)19. يعد تحليل اضطراب التحول الكيميائي (CSP) المستند إلى البيانات المستخرجة ذا قيمة عالية لتحديد شركاء الربط ولكن أيضا لرسم خرائط لواجهة ربط البروتين وتحديد صلات الارتباط. للحصول على فهم أكثر عمقا لتصميم تجارب الرنين المغناطيسي النووي واقتنائها ، يرجى الرجوع إلى دليل الشركة المصنعة المقابل المقدم مع أداة الرنين المغناطيسي النووي.
- الاستحواذ والتجهيز
- تحضير العينة مع ليكتين الفائدة. تأكد من أن المستقبل يحمل علامة 15N بالكامل في كل بقايا الأحماض الأمينية ، سواء في العمود الفقري أو السلاسل الجانبية. عادة ، للكشف عن قمم HN المتقاطعة القابلة للتبديل بالماء في الطيف ، استخدم خليطا بنسبة 90:10 من H2O: D2O لتحضير المحلول المخزن. تتراوح تركيزات الليكتين المطلوبة بين 0.05 و 0.2 mM ، اعتمادا على توافر المستقبل المسمى 15N ونسبة الإشارة إلى الضوضاء اللازمة.
ملاحظة: يجب أن يكون البروتين مستقرا طوال الوقت التجريبي دون توليد مرئي من الراسب في أنبوب الرنين المغناطيسي النووي. علاوة على ذلك ، يجب أن تكون نقية وقابلة للذوبان في المخزن المؤقت المحدد. يجب أن يكون التخصيص الكامل 1H و 15N للقمم المتقاطعة HSQC قد تم تنفيذه مسبقا بحيث يتم تحديد كل قمة متقاطعة في طيف HSQC بملصق يتوافق مع بقايا الأحماض الأمينية المحددة. - من هذا المستحضر ، قم بنقل حجم إجمالي قدره 0.6 مل إلى أنبوب NMR 5 مم.
- اضبط جهاز الرنين المغناطيسي النووي على درجة الحرارة المطلوبة. راجع الخطوة 1.1.3 واتبع نفس العمليات.
- إنشاء مجموعة بيانات جديدة. راجع الخطوة 1.1.4 وكرر العمليات.
- أدخل عينة الرنين المغناطيسي النووي في المسبار كما هو موضح في الخطوة 1.1.5.
- قفل على إشارة المذيبات. لبدء إجراء القفل ، استخدم قفل الأوامر وحدد المذيب المناسب من القائمة. يمكن تتبع إشارة القفل في نافذة القفل. اضبط كسب القفل بحيث تكون إشارة القفل مرئية في نافذة القفل.
- أكمل عملية الضبط والمطابقة تلقائيا (من خلال الأمر atma) أو يدويا (سيفتح أمر atmm نافذة التحكم في ATM لضبط منحنى التذبذب).
- اضبط الحشوات المثلى باستخدام أداة TopShim. استخدم الأمر topshim gui. راجع التعليمات الواردة في الخطوة 1.1.8.
- حدد طول النبضة 1H 90 ° (كما هو موضح في الخطوة 1.1.9) وتردد الإزاحة (سيقوم الأمر o1calib بتشغيل روتين معايرة O1 تفاعلي ، واسترداد تردد الإزاحة). هذه المعلمة اللاحقة مهمة للغاية عند استخدام التجارب مع مخططات قمع المذيبات.
- إنشاء مجموعة بيانات جديدة كما هو موضح في القسم 1.1.4. لتقليل أو القضاء على تداخل إشارة H2O ، استخدم تسلسل النبض zgesgp.
- قم بإعداد التجربة عن طريق تعديل المعلمات المختلفة في نافذة AcquPars.
- أدخل طول النبضة 1H 90 ° والإزاحة (o1) كما هو محدد مسبقا ، واضبط عدد عمليات المسح (NS) على 32 والنافذة الطيفية (SW) عند حوالي 12 جزء في المليون.
- حدد مستوى طاقة النبضة المشكلة باستخدام أداة الشكل المتوفرة في شريط قوائم Topspin.
- اضبط كسب جهاز الاستقبال باستخدام الأمر التلقائي rga.
- احصل على التجربة باستخدام الأمر zg وقم بمعالجة FID الناتج للحصول على طيف 1H NMR.
- قم بإنشاء مجموعة بيانات جديدة لاستخدامها للحصول على تجربة 1 H-15N HSQC NMR. في علامة التبويب AcquPars ، حدد برنامج النبض hsqcetfpf3gp المتوفر في كتالوج برنامج النبض.
- قم بإعداد التجربة. قم بتحميل الأشكال والقوى والأوقات الافتراضية باستخدام الأمر getprosol. بعد ذلك ، قم بتحديث قيم طول النبضة 1H 90 ° والإزاحة.
- حدد المعلمات التالية.
- اضبط تأخير الاسترخاء على 1-5 ثوان.
- اضبط عدد عمليات الفحص على مضاعف 4. عادة ، يتم ضبطه على 8 أو 16 أو 32 أو 64 للحصول على نسبة الإشارة إلى الضوضاء المناسبة.
- اضبط عدد عمليات المسح الوهمية على 128.
- اضبط عدد النقاط في F2 على 1k أو 2k أو 4k.
- اضبط عدد النقاط في F1: عدد الزيادات t1 المراد استخدامها. اعتمادا على النافذة الطيفية ، يتراوح هذا بين 128 و 256.
- اضبط مركز النافذة الطيفية في البعد 15N إلى δ 117 جزء في المليون وقم بإعداد العرض الطيفي المقابل إلى 36 جزء في المليون. يجب تحسين هذه القيم لكل نظام معين.
- اضبط كسب جهاز الاستقبال لتجنب تجاوز السعة (باستخدام الأمر rga )
- احسب وقت التجربة الكلية. الوقت التجريبي النموذجي حوالي 1 ساعة.
- اكتب zg لإرسال التجربة للاكتساب.
ملاحظة: تحقق دائما من أن التجربة تعمل بشكل صحيح بعد بضع دقائق. - قم بمعالجة FID باستخدام الأمر xfb. قم بإجراء تصحيح خط الأساس باستخدام الأمر abs2 وتصحيحات الطور في علامة التبويب العملية. للمرحلة يدويا ، انقر فوق القائمة الفرعية لضبط المرحلة ثم حدد عدة قمم متقاطعة من أطياف 2D. بعد ذلك ، قم بتطبيق تصحيحات الصفر والدرجة الأولى بالتتابع على كل من الصفوف والأعمدة بالنقر والسحب على الزر المقابل. احفظ نتائج المراحل.
- حفظ الطيف 2D الناتجة.
- إعداد حل الأسهم عالية التركيز من يجند. القيم النموذجية هي 50-100 مللي مول.
- من محلول المخزون عالي التركيز للجليكان ، قم بنقل الحجم المقابل (بضعة ميكرولترات) إلى أنبوب الرنين المغناطيسي النووي الذي يحتوي على المستقبل للحصول على البروتين المطلوب: نسبة ليجند المولية وتسجيل الأطياف.
ملاحظة: تبدأ هذه الخطوة سلسلة المعايرة، حيث تتم معايرة الربيطة في عينة البروتين. يجب تحديد نسب البروتين إلى الليجند المناسبة لكل حالة معينة. إذا كان تقارب الربط غير معروف تماما ، فمن المستحسن استخدام كميات متكافئة من الرباط في النقاط الأولية. - نفذ الخطوات من 2.1.1 إلى 2.1.19 للعينة المعدة حديثا.
- كرر الخطوتين 2.1.21 و2.1.22 للعينات ذات نسب البروتين إلى الليجند المتزايدة.
ملاحظة: يتطلب التركيب الدقيق لبيانات سلسلة المعايرة بالتحليل الحجمي الحصول على تجارب متعددة 1 H-15N-HSQC، تغطي مجموعة واسعة من نسب البروتين إلى الليجند، بما في ذلك تلك اللازمة لتحقيق تشبع البروتين.
- تحضير العينة مع ليكتين الفائدة. تأكد من أن المستقبل يحمل علامة 15N بالكامل في كل بقايا الأحماض الأمينية ، سواء في العمود الفقري أو السلاسل الجانبية. عادة ، للكشف عن قمم HN المتقاطعة القابلة للتبديل بالماء في الطيف ، استخدم خليطا بنسبة 90:10 من H2O: D2O لتحضير المحلول المخزن. تتراوح تركيزات الليكتين المطلوبة بين 0.05 و 0.2 mM ، اعتمادا على توافر المستقبل المسمى 15N ونسبة الإشارة إلى الضوضاء اللازمة.
- تحليل
- تصور طيف 2D HSQC المعالج لأنواع apo باستخدام البرنامج المناسب: TopSpin و MestReNova و CCPNMR كلها برامج مناسبة للتعامل مع بيانات الرنين المغناطيسي النووي.
ملاحظة: هذا هو طيف بصمات البروتين. تعتمد التحولات الكيميائية المرصودة 1H و 15N على البيئة الكيميائية المقابلة لكل حمض أميني ، والتي تعتمد بشدة على بنية 3D للبروتين. يسمى هذا الطيف طيف بصمة البروتين. يشير طيف 2D 1 H-15N HSQC المشتت جيدا والذي تعرض فيه جميع القمم المتقاطعة شدة موحدة بقوة إلى وجود بروتين19 مطوي جيدا. - قم بإنشاء قائمة بترددات 1H و 15N لجميع القمم المتقاطعة. يمكن أن يساعد استخدام البرامج التكميلية ، مثل برنامج CCPNMR20 ، في هذه العملية.
- قم بتركيب طيف نقاط المعايرة الأولى أو الثانية على طيف بروتين apo.
- للقيام بذلك ، افتح الطيف 2D المقابل لحالة apo ، وانقر فوق علامة التبويب عرض متعددة ثم أضف طيف 2D الثاني. يوفر الفحص البصري لكلا الطيفين معلومات عن وجود تفاعل بين الربيطة والبروتين.
ملاحظة: من وجهة نظر البروتين ، يوفر وجود الارتباط تغييرات في البيئة الكيميائية للأحماض الأمينية المشاركة مباشرة في حدث التعرف ، مع اضطرابات التحول الكيميائي المصاحبة (CSP).
- للقيام بذلك ، افتح الطيف 2D المقابل لحالة apo ، وانقر فوق علامة التبويب عرض متعددة ثم أضف طيف 2D الثاني. يوفر الفحص البصري لكلا الطيفين معلومات عن وجود تفاعل بين الربيطة والبروتين.
- كرر الخطوتين 2.2.2 و2.2.3 لكل نقطة معايرة، مع إنشاء قوائم بالترددات 1H و15N لجميع القمم المتقاطعة في الأطياف المختلفة، المقابلة لنسب مولاري مختلفة من البروتين إلى الليجند.
ملاحظة: يمكن قياس التحولات الكيميائية عند كل نقطة معايرة دون الحاجة إلى إجراء أي مهمة جديدة عبر الذروة. في حالة نظام التبادل السريع ، الذي يلاحظ عادة في تفاعلات lectin: glycan ، يمكن للمرء ببساطة متابعة الحركة التدريجية للقمم طوال فترة المعايرة. - تأكد من أنه بالنسبة لنقطة المعايرة الأخيرة، لا توجد في الأساس اضطرابات إزاحة كيميائية فيما يتعلق بالإضافة السابقة. هذه الحقيقة تدل على أن موقع ربط البروتين قد تم تشبعه بالليجند ، وهو في حالة فائضة عالية.
- احسب الحد الأقصى لاضطرابات التحول الكيميائي (maxCSP) باستخدام المعادلة أدناه:
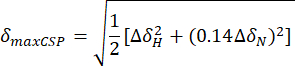
ΔH و ΔδN هي اختلافات التحول الكيميائي في ترددات 1H و 15N بين حالة apo ونقطة المعايرة الأخيرة ، على التوالي. - ارسم الحد الأقصى لاضطرابات التحول الكيميائي (maxCSP) في المحور الصادي الرأسي لمخطط 2D مقابل بقايا الأحماض الأمينية المقابلة (في المحور السيني الأفقي).
- قم بإجراء فحص بصري لبقايا الأحماض الأمينية التي تعرض الحد الأقصى من CSP بين الحالات المرتبطة و apo للبروتين. من المحتمل جدا أنهم ينتمون إلى موقع الربط أو جيران له.
- إذا كان هيكل 3D للبروتين متاحا ، فافتح PDB المقابل باستخدام البرنامج المناسب مثل PyMOL أو BIOVIA Discovery studio. تستخدم برامج التصور الجزيئي هذه على نطاق واسع في تطبيقات البيولوجيا الهيكلية. حدد البقايا التي تعرض أعلى الحد الأقصى ل CSP (أعلى من ضعف الانحراف المعياري) بلون معين لتوطين موقع الربط المفترض.
- في حالة نظام التبادل السريع ، قم بتقدير ثابت التفكك (KD) من تناسب المربعات الصغرى غير الخطية ل CSP المرصود للقمم المتقاطعة 1 H-15N HSQC عند كل نقطة (Δδobs) مقابل تركيز البروتين المعين [P] و ligand [L] عند تلك النقطة:
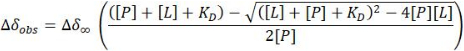
ملاحظة: يمكن تطبيق هذه المعادلة على تلك القمم المتقاطعة التي تعرض إشارات معزولة واضحة. يتم حساب متوسط القيم التي تم الحصول عليها لتوفير تقدير KD.
- تصور طيف 2D HSQC المعالج لأنواع apo باستخدام البرنامج المناسب: TopSpin و MestReNova و CCPNMR كلها برامج مناسبة للتعامل مع بيانات الرنين المغناطيسي النووي.
النتائج
هنا ، نقدم بروتوكولا لاستغلال 1H-STD NMR و 1 H-15N HSQC لكشف تفاصيل التفاعل الملزم بين المحاضرات والسكريات قليلة السكاريد الصغيرة. يتم تضمين النتائج التي تم الحصول عليها في تحليل التعرف الجزيئي ل LacNAc بواسطة hGalectin-7 (hGal-7) ، لتكون بمثابة مثال توضيحي للتنفيذ الناجح للبروتوكول وفعالية منهجيات الرنين المغناطيسي النووي هذه لدراسة التفاصيل الدقيقة لعملية التعرف الجزيئي. يوضح الشكل 3 طيف الرنين المغناطيسي النووي 1H-STD لتفاعل LacNAc مع hGal-7. يشير وجود إشارات الرنين المغناطيسي النووي STD إلى الارتباط (الشكل 3 أ). علاوة على ذلك ، تظهر فقط تلك الإشارات التي تنتمي إلى البروتونات على اتصال وثيق بالبروتين ، مما يسمح بتحديد حاتم الربط (الشكل 3 ب). يوضح الشكل 4 كيف يمكن استخدام طيف 1 H-15N HSQC للبروتين كبصمة له ، ويوضح الشكل 5 تطبيق 1 H-15N تجارب معايرة التماسك الكمي أحادي النواة غير المتجانسة (HSQC) لتحديد اضطراب التحول الكيميائي لمجموعات أميد العمود الفقري hGalectin-7 عند ارتباط LacNAc. لا تكشف هذه البيانات عن وجود تفاعل فحسب ، بل تحدد أيضا واجهة ربط الليكتين. يوضح الشكل 6 كيف يتيح تحليل بيانات المعايرة بالتحليل الحجمي تقدير تقارب الارتباط ل LacNAc بواسطة hGalectin-7 ، والذي يقع في النطاق الدقيق العالي. وتتفق هذه النتيجة مع النتائج التي تم الحصول عليها باستخدام تقنيات بديلة.
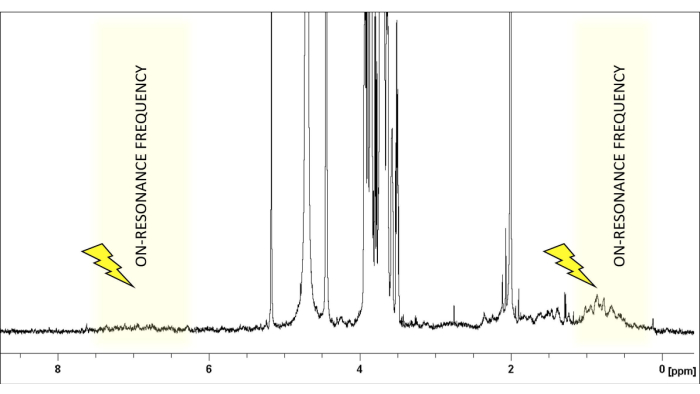
الشكل 1: اختيار تردد الرنين. 1طيف H-NMR من LacNAc: hGal-7 نسبة 50: 1 في محلول ملحي مخزن بالفوسفات عند الرقم الهيدروجيني 7.4. إشارات الربيطة (LacNAc) محصورة في المنطقة بين 2.0-5.2 جزء في المليون. يتم اختيار تردد التشبع بعناية لضمان عدم وجود بروتونات ليجند ضمن نطاق 1-2 جزء في المليون ، مما يسمح بالإشعاع الانتقائي لبروتونات البروتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
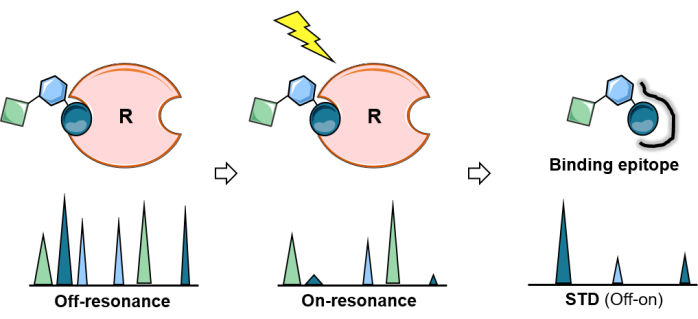
الشكل 2: تجربة الرنين المغناطيسي النووي للأمراض المنقولة جنسيا. التمثيل التخطيطي لتجربة الأمراض المنقولة جنسيا: يعمل الطيف الأول (خارج الرنين) كمرجع بينما في الثاني (على الرنين) ، يتم إجراء تشبع البروتين. يتم نشر التشبع بكفاءة عبر البروتين بأكمله ونقله إلى بروتونات الليجند على اتصال وثيق بالبروتين. طيف الفرق الناتج (طيف الأمراض المنقولة جنسيا) ينتج فقط تلك الرنين التي شهدت التشبع. يسمح تحليل تجربة الأمراض المنقولة بالاتصال الجنسي برسم خرائط خاتمة للسكر الملزم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
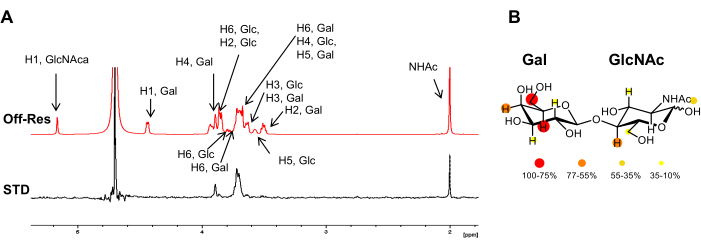
الشكل 3: تحليل ملزم من منظور الرباط. (أ) تراكب أطياف الرنين المتقطع و 1H STD-NMR لتفاعل LacNAc مع hGal-7. في طيف الأمراض المنقولة جنسيا ، تظهر فقط تلك الإشارات التي تنتمي إلى البروتونات على اتصال وثيق بالبروتين. تم الإبلاغ عن التعليق التوضيحي لرنين 1H لليجند في الطيف خارج الرنين. (ب) تم تلوين الشدة النسبية للأمراض المنقولة جنسيا في التركيب الكيميائي ل LacNAc. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
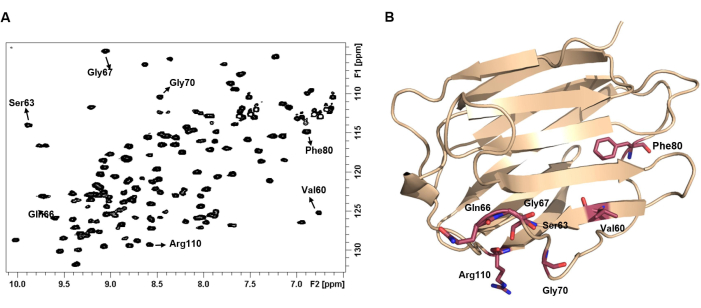
الشكل 4: يمثل طيف 1 H-15N HSQC للبروتين بصمته. (أ) طيف 1 H-15N HSQC من 100 ميكرومتر من hGal-7 في شكل apo. تم تسجيل الطيف عند 25 درجة مئوية. تم شرح بعض قمم NH المتقاطعة بتسمية الأحماض الأمينية المقابلة لها. (ب) يعرض كل زوج NH تحولا كيميائيا فريدا يعتمد على البيئة الكيميائية وبالتالي على بنية 3D للبروتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
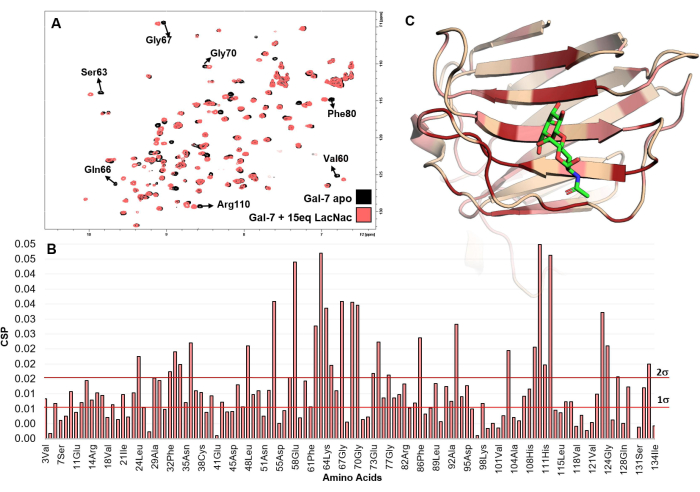
الشكل 5: تحليل ملزم من منظور البروتين. (أ) يظهر تراكب أطياف H-15N HSQC 1 المسجلة لمعايرة LacNAc إلى محلول hGal-7. يشير فحص الأطياف ، حيث تشهد العديد من القمم المتقاطعة تغيرات في التحول الكيميائي ، بوضوح إلى التفاعل. (B) مخطط أقصى اضطرابات التحول الكيميائي (maxCSP) لإشارات أميد العمود الفقري المستنبطة من معايرة LacNAc (15 مكافئا) مع hGal-7. (ج) يتم تعيين الأحماض الأمينية الأكثر اضطرابا في hGal-7 ، وفقا لتحليل CSP في هيكل PDB 5gal. في النموذج ثلاثي الأبعاد ، يشير اللون الأحمر إلى قيمة CSP التي تزيد عن 2σ ، في حين أن اللون الوردي إلى قيم تتراوح بين 1σ و 2σ. من المحتمل أن تمثل المنطقة الملونة موقع الارتباط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
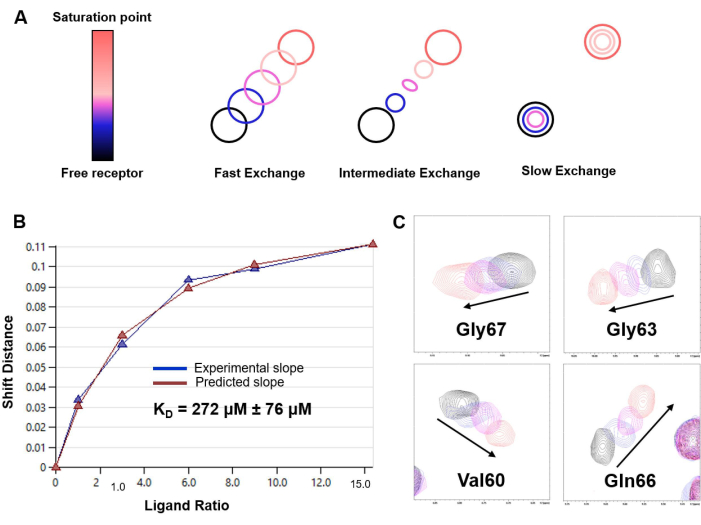
الشكل 6: تحديد KD بناء على 1 H-15N HSQC تجارب المعايرة. (أ) تمثيل نمط المعايرة بالتحليل الحجمي 1 H-15N HSQC اعتمادا على معدل التبادل الكيميائي في المقياس الزمني للرنين المغناطيسي النووي للنظام في الدراسة (سريع أو متوسط أو بطيء). لوحظ نظام تبادل سريع في حالة تفاعل LacNAc / hGal-7. (ب) منحنى التركيب وتقدير KD الذي تم الحصول عليه من تحليل CSP بتركيزات مختلفة من الرباط للنظام النموذجي ل hGal-7 و LacNAc disaccharide. يتم الإبلاغ عن KD المقدر مع الخطأ المقابل كمتوسط للبيانات ل 20 من الأحماض الأمينية المختلفة ؛ (C) مقتطفات من أطياف 1 H,15N-HSQC تعرض إزاحة قمم متقاطعة مختارة أثناء المعايرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
أصبح فرق نقل التشبع NMR (STD-NMR) أكثر طرق الرنين المغناطيسي النووي استخداما وتنوعا لدراسة تفاعلات بروتين الليجند. كما هو موضح أعلاه ، فإنه يعتمد على ظاهرة نقل التشبع ، ويتضمن الإعداد التجريبي الحصول على اثنين من الأطياف أحادية البعد (1D) 1H: أطياف الرنين ¬ و ¬ خارج الرنين. أثناء تجربة الرنين ، يتم تحقيق تشبع بروتونات معينة من البروتين عن طريق تطبيق قطار من نبضات الترددات الراديوية منخفضة الطاقة خلال فترة معينة (يتراوح وقت التشبع عادة من 1-3 ثوان). لتجنب التشبع المباشر لليجند ، يتم تحسين تواتر وطول نبضات التشبع لتشعيع بروتونات معينة من البروتين بشكل انتقائي ؛ أي أنه يجب تطبيقها على تردد شاغر لأي إشارات ليجند وبطول مناسب (الشكل 1). كقاعدة عامة لنبضات تشبع 50 مللي ثانية ، يجب الحفاظ على فرق 1 جزء في المليون من منطقة التشبع إلى أقرب إشارات اليجند. بشكل عام ، توفر نبضات التشبع الانتقائية المطبقة على المنطقة الأليفاتية للبروتين تأثيرات تشبع متزايدة. بدلا من ذلك ، يمكن أيضا تشعيع البروتونات العطرية (6-7 جزء في المليون) إذا كان جزيء الربيطة لا يحتوي على أي إشارات عطرية. هذا مفيد جدا للجليكان الذي يحدث بشكل طبيعي ، لأنها لا تحمل مجموعات عطرية. بمجرد تشعيع منطقة معينة من البروتين بشكل انتقائي ، ينتشر التشبع على طول البروتين عبر الاسترخاء المتقاطع ثنائي القطب 1 H-1 H-1H (انتشار الدوران). في النهاية ، يصل التشبع إلى بروتونات البروتين في موقع الارتباط ، والذي يتم نقله بعد ذلك إلى بروتونات السكر التي تكون على اتصال وثيق (r < 5 Å) مع المستقبل عبر 1 H-1 H-1H NOEs بين الجزيئات. من الواضح أن شدة إشارات بروتونات الليجند المشبعة تتناقص. بعد تلقي التشبع ، بسبب حركية الربط ، تنفصل الروابط المرتبطة بشكل عابر (التبادل السريع مطلوب) وتتراكم معلومات التشبع في الحالة الحرة. بسبب هذه العملية ، تقدم أطياف الرنين المغناطيسي النووي إشارات متناقصة (الشكل 2).
لإظهار هذا الاضطراب الشديد بوضوح لنوى 1H من جليكان ملزم ، يتم الحصول على طيف التحكم في البروتون NMR (خارج الرنين) حيث يتم تطبيق التشبع بعيدا عن أي مستقبلات أو إشارة كربوهيدرات (عادة بين 40-100 جزء في المليون) ، في ظل نفس الظروف. يظهر الطيف 1D المطروح بين الرنين والرنين حصريا إشارات نوى 1H من الربيطة التي عدلت شدتها: تلك التي كانت قريبة بما يكفي من موقع ربط المستقبلات لتلقي المغنطة (الشكل 2).
ومع ذلك ، لا تتلقى جميع نوى 1H من الكربوهيدرات المرتبطة نفس الكمية من التشبع. من الناحية النظرية ، يعتمد نقل المغنطة من المستقبل إلى الربيطة المرتبطة على المسافة (1 / r6). هذا يعني أن شدة التشبع المنقول بين نوى الجليكان 1H تحتوي على معلومات حول القرب المكاني بين بروتونات الربيطة وبروتونات المستقبل ، وشدة الرنين المغناطيسي النووي STD أكبر لتلك البروتونات الأقرب إلى المستقبل. وفقا لذلك ، تسمح تجربة الرنين المغناطيسي النووي STD أيضا بتحديد حاتمة الربط للكربوهيدرات (الشكل 2 والشكل 3) لأن بروتونات الرباط التي تجلس بالقرب من سطح البروتين تظهر كثافة أعلى من تلك التي لا تشارك مباشرة في الربط.
يمكن تطبيق التجربة على الأنظمة ذات التقارب الضعيف المتوسط ، ونادرا ما يتم تطبيقها على الأنظمة ذات الصلات القوية في النطاق المنخفض μM أو nM. في الواقع ، يتطلب أن يكون معدل التفكك سريعا في مقياس وقت الاسترخاء. خلاف ذلك ، يتم فقدان معلومات نقل التشبع من خلال الاسترخاء قبل أن ينفصل الرباط.
من ناحية أخرى ، تعد تجارب الرنين المغناطيسي النووي القائمة على البروتين فريدة من نوعها لكشف تفاعل بروتين الليجند بدقة مستوى الأحماض الأمينية دون حل هياكل الدقة الذرية. يفحص مباشرة ظواهر التعرف الجزيئي في المحلول دون الحاجة إلى التبلور المشترك. يعد رسم خرائط تحليل الطاقة الشمسية المركزة قويا بشكل استثنائي لاكتشاف الروابط ورسم خرائط موقع ارتباط البروتين (الشكل 4 والشكل 5). تنطبق هذه الطريقة على أي نطاق من الصلات بين نطاق mM و nM ، حتى بالنسبة للأنظمة التي يكون فيها سعر الصرف بطيئا في مقياس وقت التحول الكيميائي21.
ومع ذلك ، من المحتمل ألا يعمل هذا النهج مع البروتينات ذات الأوزان الجزيئية التي تزيد عن 30-40 كيلو دالتون بسبب مشاكل الاسترخاء. يمكن بعد ذلك استخدام بديل TROSY18 ، حيث يكون قويا بشكل خاص عندما يقترن بتثنية البروتين. علاوة على ذلك ، يجب تسمية البروتين بشكل موحد ب 15N (وعينة أخرى تحمل علامة مزدوجة ب 13C و 15N لتتمكن من إكمال تعيين العمود الفقري المطلوب). لذلك ، يجب تحسين ظروف التعبير عن البروتين ، بما في ذلك نظام التعبير المقابل لتتمكن من الحصول على كميات ملليغرام من البروتين. البروتينات التي تظهر ميلا إلى قلة القلة، أو التجميع، ليست مناسبة أيضا لهذا التحليل. الأداة المستخدمة هنا لتسجيل بيانات الرنين المغناطيسي النووي هي مطياف Bruker 800 MHz مجهز بمسبار تبريد TCI. سيكون من الصعب للغاية استخدام هذه المنهجية باستخدام أدوات أقل من MHz 600 أو بدون مسبار مبرد.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر الوكالة الحكومية للبحوث في إسبانيا على اعتماد مركز سيفيرو أوتشوا للتميز CEX2021-001136-S ، بتمويل من MCIN / AEI / 10.13039 / 501100011033 ، و CIBERES ، وهي مبادرة من معهد الصحة كارلوس الثالث (ISCIII ، مدريد ، إسبانيا). كما نشكر المفوضية الأوروبية على مشروع GLYCOTWINNING .
Materials
| Name | Company | Catalog Number | Comments |
| 5 mm Shigemi microtube set mat | CortecNet SAS | S30BMS-005B | |
| Alpha-Lactose-Agarose | Sigma-Aldrich Química S.L. | 7634-5ML | |
| Ammonium chloride (15 N, 99%) | LC-0179-N-50G | Tracer Tecnologías Analíticas S.L | |
| Ampicillin (Sodium Salt) | Melford Laboratories LTD | A40040 | |
| BIOVIA Discovery studio | BIOVIA, Dassault Systèmes | ||
| BL21(DE3) Chemically Competent Cells | Merck Life Science, S.L.U. | CMC0014-40X40UL | |
| Centrifuge | Beckman Coulter | Allegra X-22R | |
| D2O | Cambridge Isotope Laboratories, Inc. | DLM-4-1000 | |
| Incubator | Eppendorf | Innova 42 | |
| IPTG (Isopropyl ß-D-1-thiogalactopyranoside) | VWR International Eurolab S.L. | VW437144N | |
| LacNAc | Elicityl | GLY008 | |
| Luria Bertani (LB) Broth | Merck Life Science, S.L.U. | 3397-1KG | |
| Matraz Erlenmeyer B N 5000 CC | VWR International Eurolab S.L. | 214-1137 | |
| PBS 10x | Bio-Rad | 1610780 | |
| PyMOL | PyMOL Molecular Graphics System | Version 2.0 Schrödinger | |
| Sonicator | Sonics & Materials, Inc. | VC 505 | |
| Superconducting NMR magnet | Bruker | 600 MHz AVANCE III | |
| Superconducting NMR magnet | Bruker | 800 MHz AVANCE III |
References
- Solís, D., et al. A guide into glycosciences: How chemistry, biochemistry and biology cooperate to crack the sugar code. Biochim Biophys Acta. 1850 (1), 186-235 (2015).
- Poveda, A., Jimenez-Barbero, J. NMR studies of carbohydrate-protein interactions in solution. Chem Soc Rev. 27, 133-144 (1998).
- Kogelberg, H., Solís, D., Jiménez-Barbero, J. New structural insights into carbohydrate-protein interactions from NMR spectroscopy. Curr Opin Struct Biol. 13 (5), 646-653 (2003).
- Widmalm, G. Glycan shape, motions, and interactions explored by NMR spectroscopy. JACS Au. 4 (1), 20-39 (2024).
- Marchetti, R., et al. 34;Rules of Engagement" of protein-glycoconjugate interactions: A molecular view achievable by using NMR spectroscopy and molecular modeling. ChemistryOpen. 5 (4), 274-296 (2016).
- Ardá, A., Jiménez-Barbero, J. The recognition of glycans by protein receptors. Insights from NMR spectroscopy. Chem Commun. 54 (38), 4761-4769 (2018).
- Gimeno, A., Valverde, P., Ardá, A., Jiménez-Barbero, J. Glycan structures and their interactions with proteins. A NMR view. Curr Opin Struct Biol. 62, 22-30 (2020).
- Cañada, F. J., et al. Conformational and structural characterization of carbohydrates and their interactions studied by NMR. Curr Med Chem. 29 (7), 1147-1172 (2022).
- Valverde, P., Quintana, J. I., Santos, J. I., Ardá, A., Jiménez-Barbero, J. Novel NMR avenues to explore the conformation and interactions of glycans. ACS Omega. 4, 13618-13630 (2019).
- Jiménez-Barbero, J., Asensio, J. L., Cañada, F. J., Poveda, A. Free and protein-bound carbohydrate structures. Curr Opin Struct Biol. 9 (5), 549-555 (1999).
- Quintana, J. I., Atxabal, U., Unione, L., Ardá, A., Jiménez-Barbero, J. Exploring multivalent carbohydrate-protein interactions by NMR. Chem Soc Rev. 52 (5), 1591-1613 (2023).
- Roldós, V., Cañada, F. J., Jiménez-Barbero, J. Carbohydrate-protein interactions: a 3D view by NMR. Chembiochem. 12 (7), 990-1005 (2011).
- Unione, L., Ardá, A., Jiménez-Barbero, J., Millet, O. NMR of glycoproteins: profiling, structure, conformation, and interactions. Curr Opin Struct Biol. 68, 9-17 (2021).
- del Carmen Fernández-Alonso, M., Díaz, D., Berbis, M. A., Marcelo, F., Cañada, J., Jiménez-Barbero, J. Protein-carbohydrate interactions studied by NMR: from molecular recognition to drug design. Curr Protein Pept Sci. 13 (8), 816-830 (2012).
- Angulo, J., Nieto, P. M. STD-NMR: application to transient interactions between biomolecules-a quantitative approach. Eur Biophys J. 40 (12), 1357-1369 (2012).
- Mayer, M., Meyer, B. Group epitope mapping by saturation transfer difference NMR to identify segments of a ligand in direct contact with a protein receptor. J Am Chem Soc. 123 (25), 6108-6117 (2001).
- Williamson, M. P. Using chemical shift perturbation to characterise ligand binding. Prog Nucl Magn Reson Spectrosc. 73, 1-16 (2013).
- Fernández, C., Adeishvili, K., Wüthrich, K. Transverse relaxation-optimized NMR spectroscopy with the outer membrane protein OmpX in dihexanoyl phosphatidylcholine micelles. Proc Natl Acad Sci U S A. 98 (5), 2358-2363 (2001).
- Yee, A., Gutmanas, A., Arrowsmith, C. H. Solution NMR in structural genomics. Curr Opin Struct Biol. 16 (5), 611-617 (2006).
- Skinner, S. P., Fogh, R. H., Boucher, W., Ragan, T. J., Mureddu, L. G., Vuister, G. W. CCPNMR AnalysisAssign: a flexible platform for integrated NMR analysis. J Biomol NMR. 66 (2), 111-124 (2016).
- Gimeno, A., et al. Minimizing the entropy penalty for ligand binding: Lessons from the molecular recognition of the histo blood-group antigens by human Galectin-3. Angew Chem Int Ed Engl. 58 (22), 7268-7272 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved