A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياسات الصلابة الدقيقة على الأسنان والعظم السنخي في نماذج أمراض الفم القوارض
In This Article
Summary
الصلابة الدقيقة هي خاصية ميكانيكية ومعلمة إعلامية لتقييم الفيزيولوجيا المرضية للأنسجة الصلبة. هنا ، نوضح بروتوكولا موحدا (تحضير العينات ، والتلميع ، والسطح المسطح ، ومواقع المسافة البادئة) لتحليل الصلابة الدقيقة في الأسنان والعظام السنخية في نماذج أمراض الفم القوارض ، وهي تسمم الأسنان بالفلور ، وارتشاف عظام اللثة الناجم عن الأربطة.
Abstract
يتم تقييم الخاصية الميكانيكية ، الصلابة الدقيقة ، في مينا الأسنان ، العاج ، والعظام في نماذج أمراض الفم ، بما في ذلك تسمم الأسنان بالفلور والتهاب دواعم السن. يوفر التصوير المقطعي المحوسب الدقيق (μCT) معلومات التصوير 3D (الحجم والكثافة المعدنية) والمسح المجهري الإلكتروني (SEM) ينتج صورا مجهرية (منشور المينا وقناة ثغرة العظام). بالتكامل مع التحليل الهيكلي بواسطة μCT و SEM ، تعد الصلابة الدقيقة واحدة من المعلمات الإعلامية لتقييم كيفية تغيير التغييرات الهيكلية للخصائص الميكانيكية. على الرغم من كونها معلمة مفيدة ، إلا أن الدراسات حول الصلابة الدقيقة للعظام السنخية في أمراض الفم محدودة. حتى الآن ، تم الإبلاغ عن طرق قياس الصلابة الدقيقة المتباينة. نظرا لأن قيم الصلابة الدقيقة تختلف اعتمادا على تحضير العينة (التلميع والسطح المستوي) ومواقع المسافة البادئة ، يمكن أن تسبب البروتوكولات المتنوعة تناقضات بين الدراسات. يعد توحيد بروتوكول الصلابة الدقيقة أمرا ضروريا للتقييم المتسق والدقيق في نماذج أمراض الفم. في هذه الدراسة ، نوضح بروتوكولا موحدا لتحليل الصلابة الدقيقة في الأسنان والعظام السنخية. العينات المستخدمة هي كما يلي: بالنسبة لنموذج التسمم بالفلور السني ، تم جمع القواطع من الفئران المعالجة بالمياه المحتوية على الفلورايد / بدونها لمدة 6 أسابيع. بالنسبة لنموذج ارتشاف عظم اللثة الناجم عن الرباط (L-PBR) ، تم جمع العظام السنخية مع ارتشاف عظم اللثة من الفئران المربوطةعلى ضرس الفك العلوي 2. في 2 أسابيع بعد الربط ، تم جمع الفك العلوي. تم تحليل صلابة فيكرز في هذه العينات وفقا للبروتوكول الموحد. يوفر البروتوكول مواد وطرق مفصلة لتضمين الراتنج والتلميع التسلسلي ومواقع المسافة البادئة للقواطع والسنخية. على حد علمنا ، هذا هو أول بروتوكول صلابة دقيقة موحد لتقييم الخواص الميكانيكية للأسنان والعظام السنخية في نماذج أمراض الفم القوارض.
Introduction
الصلابة هي إحدى الخصائص الميكانيكية (على سبيل المثال ، المرونة والصلابة والمرونة اللزوجة وسلوك الكسر) وتستخدم بشكل شائع لتوصيف القدرة على مقاومة تشوه الانضغاط وكسر منطقة محلية من المادة. اختبار صلابة المسافة البادئة الثابتة هو الطريقة الأكثر استخداما ، بما في ذلك صلابة فيكرز وصلابة Knoop1. يتم تنفيذ اختبار صلابة فيكرز عن طريق الضغط على مسافة بادئة من الماس في السطح تحت حمل اختبار ثابت. المسافة البادئة على شكل هرم ، مع قاعدة مربعة وزاوية 136 درجة بين الوجوه المتقابلة. يتم قياس طول كلا القطرين المتكونين على سطح الاختبار ، ويتم استخدام المتوسط لحساب الصلابة ، والتي يتم تحديدها من خلال النسبة F / A (حيث F هي القوة و A هي مساحة سطح المسافة البادئة). عادة ما يتم التعبير عن رقم صلابة فيكرز الدقيقة (HV = F / A) بالكيلوجرام قوة (kgf) لكل مسافة بادئةمم 2 ، مع 1 HV ≈ 0.1891 F / d2 (N / mm2). تتكون صلابة Knoop أيضا من مسافة بادئة هرمية مربعة من الماس تتكون من زاويتين متقابلتين غير متساويتين. رقم صلابة Knoop (HK) يساوي نسبة الحمل المطبق إلى منطقة التلامس المتوقعة. تصنف اختبارات الصلابة إلى اختبارات المسافة البادئة الدقيقة (الصلابة الدقيقة) واختبارات المسافة البادئة الكلية ، اعتمادا على القوة المطبقة على مادة الاختبار. عادة ما تستخدم اختبارات المسافة البادئة الدقيقة الأحمال في النطاق 0.01-2 نيوتن (حوالي 1-203 gf) ؛ وفي الوقت نفسه ، تستخدم اختبارات المسافة البادئة الكلية أكثر من 10 N (10119 gf) 1.
لتقييم ميزات الأنسجة الصلبة للأسنان في أمراض الفم ، بما في ذلك الأسنان والعظام السنخية ، يتم استخدام التصوير المقطعي المحوسب الدقيق (μCT) والمجهر الإلكتروني الماسح (SEM) للتحليل الهيكلي. يوفر μCT معلومات التصوير ثلاثية الأبعاد (الحجم والكثافة المعدنية)2 ، وينتج SEM صورا مجهرية (منشور المينا وفجوة عظمية قنوية)3. استكمالا للتحليل الهيكلي بواسطة μCT و SEM ، تعد الصلابة الدقيقة واحدة من المعلمات المفيدة لتقييم كيفية تغيير التغييرات الهيكلية للخصائص الميكانيكية للأسنان والعظام السنخية في أمراض الفم ، على سبيل المثال ، تشوه المينا وارتشاف العظام اللثوية. قيمة صلابة فيكرز الدقيقة للمينا البشرية (HV = 283-374) أعلى بحوالي 4 إلى 5 مرات من قيمة العاج (HV = 53-63) 4,5. في نماذج تسمم الأسنان بالفلور القوارض ، تنخفض صلابة المينا الدقيقة بشكل كبير في قواطع الفئران المعالجة بالفلورايد (HV = 136) مقارنة بمينا التحكم (HV = 334) 6,7. هذا يشير إلى أن المينا المفلورة أكثر ليونة وأضعف مع محتوى معدني أقل ومحتوى بروتين أعلى من الموجود في المينا غير المفلورة. يستخدم الصلابة الدقيقة لتقييم الخواص الميكانيكية للعظام. فحصت العديد من الدراسات السابقة السلوك الميكانيكي للعظام البشرية من مواقع تشريحية مختلفة ، بما في ذلك الصلابة الدقيقة للعظامالطويلة 8،9،10. أظهر متوسط الصلابة الدقيقة لعظم الفخذ المفلور البشري انخفاضا كبيرا (HV = 222.4) مقارنة بعظم الفخذ غير المفلور (HV = 294.4)11. على الرغم من كونها معلمة مفيدة ، إلا أن هناك ندرة في الأدبيات التي تصف الصلابة الدقيقة (إما فيكرز12 أو Knoop 13,14) للعظام السنخية في أمراض الفم.
حتى الآن ، تم الإبلاغ عن طرق قياس الصلابة الدقيقة المتباينة. نظرا لأن قيم الصلابة الدقيقة تختلفبمقدار 15 اعتمادا على تحضير العينة (التلميع والسطح المستوي) وموقع المسافة البادئة ، يمكن أن تسبب البروتوكولات المتنوعة تناقضات بين الدراسات. يعد توحيد بروتوكول اختبار الصلابة الدقيقة أمرا ضروريا للتقييم المتسق والدقيق في نماذج أمراض الفم. في هذه الدراسة ، نوضح بروتوكولا موحدا لتحليل الصلابة الدقيقة في الأسنان والعظام السنخية في نموذج تسمم الأسنان بالفلور في الفئران ونموذج ارتشاف العظام اللثوية.
Protocol
تم تنفيذ جميع الإجراءات الموضحة في هذا البروتوكول وفقا للمبادئ التوجيهية واللوائح الخاصة باستخدام الفقارية المعتمدة من قبل لجنة استخدام رعاية المؤسسية (IACUC) في جامعة أوغوستا وفي جامعة نوفا ساوث إيسترن المعتمدة من قبل جمعية تقييم واعتماد رعاية المختبر الدولية (AAALAC). لاحظ أن الدكتور سوزوكي كان يعمل في جامعة أوغوستا حيث تم الانتهاء من تجارب تسمم الأسنان بالفلور على الفئران.
1. استخراج قواطع الفك السفلي في نموذج تسمم الأسنان بالفلور الفأر
- تغذية الوجبات الغذائية الخالية من الفلورايد إلى الفئران C57BL / 6 (5 أسابيع من العمر ، ذكر) من 1 أسبوع قبل الفلورايد حتى إنهاء العلاج بالفلورايد.
- تحضير ماء الفلورايد عن طريق إضافة NaF في الماء المقطر متبوعا بالترشيح الفراغي باستخدام مرشح 0.2 ميكرومتر. أعط ماء الفلورايد مثل NaF (0 جزء في المليون و 125 جزء في المليون ؛ N = 5 / مجموعة) ad libitum لمدة 6 أسابيع. استبدال ماء الفلورايد مع دفعة طازجة كل 2 أيام.
- بعد 6 أسابيع من معالجة مياه الفلورايد ، القتل الرحيم للحيوانات مع CO2 تليها قطع الرأس.
- استخراج الفك السفلي hemi مع القاطعة من كل ماوس. لجمع الفك السفلي النصفي مع القاطعة ، وقطع العضلات حول الفك السفلي دون استخدام القوة المفرطة.
- ضع الفك السفلي النصفي في برنامج تلفزيوني واحتفظ به عند 4 درجات مئوية حتى تحليل μ-CT (اختياري). افصل القاطعة عن الفك السفلي باستخدام مشرط (# 15) ومقص دون إتلاف أو كسر العينة.
- اغسل القاطعة المعزولة باستخدام PBS وقم بإجراء الجفاف عن طريق غمرها في زيادة قوة الكحول (70٪ و 100٪ إيثانول) لمدة 2-3 ساعات.
ملاحظة: إذا لم تكن الأنسجة (مثل اللب) مجففة بما فيه الكفاية ، فمن المحتمل أن يتم تثبيط التشريب بالراتنج ومن المحتمل أن يكون التقييم اللاحق غير كاف. - بعد الجفاف بالإيثانول ، قم بتضمين القاطعة أفقيا في الراتنج. تابع إلى الخطوة 3.
2. استخراج العظام السنخية الفكية في نموذج ارتشاف عظم اللثة الناجم عن الرباط الفأر (L-PBR)
- تطبيق 0.8 مل من الكيتامين (100 ملغ/مل) + 0.1 مل من الزيلازين (100 ملغ/مل) + 9.1 مل من PBS داخل الصفاق (i.p.) لدى الفأر (C57BL/6، 8-12 أسبوعا، ذكر) كمخدر. الجرعة هي 0.01 مل / غرام (الوزن). ضع مرهم العيون على كلتا العينين لمنع الجفاف تحت التخدير.
- ضع الماوس المخدر على وسادة التدفئة لمدة 5-10 دقائق. تقييم الاستجابات لقرصات الذيل / أصابع القدم وسلامة منعكس العين. تأكد من أن الماوس لا يستجيب للمنبهات الضارة وأن المنعكس غائب.
- ضع الماوس على طاولة العلاج واترك الفم مفتوحا عن طريق خيط حرير رباط 5-0 مربوط بعمود مغناطيسي على طاولة العلاج.
- تحت المجهر الجراحي ، قم بلف الرباط (خياطة الحرير المضفر 6-0) حول جانب واحد من الضرس الثاني الفكي العلوي (طبقة واحدة) باستخدام حوامل إبرة دقيقة. قلل الفروق الفردية في التحليل باستخدام جانب واحد كجانب علاجي والجانب الآخر كعنصر تحكم.
- ربط الرباط وجعل عقدة على الجانب الحنك. بعد عمل عقدة ، قم بقطع الرباط المتبقي بأقصر ما يمكن حتى لا يتداخل الرباط المفرط مع المضغ أو الأكل. هذا مهم للتأكد من أن الرباط لن يرتخي عن طريق المضغ خلال فترة المراقبة اللاحقة.
ملاحظة: لا تترك دون مراقبة حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء القصي. لا تعيد الذي خضع لعملية جراحية إلى شركة أخرى حتى يتعافى تماما. الحفاظ على ظروف معقمة أثناء البقاء على قيد الحياة. - تغذية النظام الغذائي والماء للفئران ad libitum لمدة 2 أسابيع. بعد أسبوعين من الربط ، القتل الرحيم للفئران باستخدام CO2 متبوعا بقطع الرأس.
- استخراج كلا الجانبين الفك العلوي (جانب الرباط وجانب التحكم) مع الأضراس من كل فأر. لجمع الفك العلوي مع الأضراس ، وقطع العضلات والعظام حول الفك العلوي باستخدام مقص دون استخدام القوة المفرطة. ضع كل فك سكي في برنامج تلفزيوني واحتفظ به عند 4 درجات مئوية حتى تحليل μCT (اختياري).
- افصل العظم السنخي بالأضراس (من1 إلى 3 الثالثة) عن الفك العلوي باستخدام مشرط (# 15) ومقص دون إتلاف أو كسر العينة.
- اغسل العظم السنخي المعزول باستخدام برنامج تلفزيوني ثم قم بتجفيفه وإزالة الشحوم عن طريق الغمر في زيادة قوة الكحول (70٪ و 100٪ إيثانول) لمدة 2-3 ساعات.
ملاحظة: إذا لم تكن الأنسجة (مثل اللب والعظام) مجففة بما فيه الكفاية ، فمن المحتمل أن يتم تثبيط التشريب بالراتنج ومن المحتمل أن يكون التقييم اللاحق غير كاف. - بعد الجفاف مع الإيثانول ، قم بتضمين العظم السنخي أفقيا في الراتنج. تابع إلى الخطوة 3.
- اختياري: قم بإجراء تقييم μCT قبل اختبار الصلابة الدقيقة.
- قبل اختبار الصلابة الدقيقة ، قم بإجراء تحليل هيكلي غير مدمر (على سبيل المثال ، μCT) باستخدام نفس العينة لاختبار الصلابة الدقيقة كتقييم تكميلي (الشكل 1). يمكن أن تدعم المعلومات الهيكلية (صورة 3D ، الكثافة المعدنية ، الحجم) بواسطة μCT تقييم الخواص الميكانيكية للعينة والجودة التي قد تؤثر على نتائج الصلابة الدقيقة.
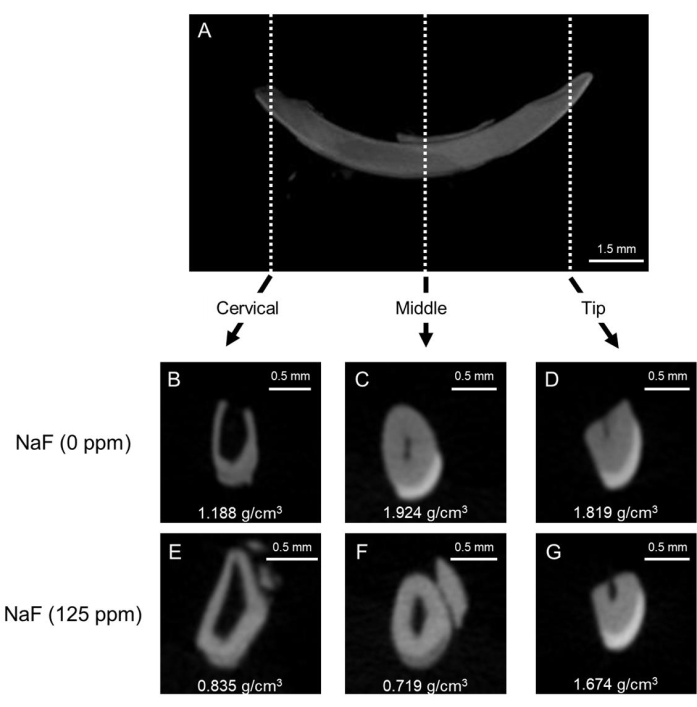
الشكل 1: صور μCT التمثيلية للمينا في السيطرة وقواطع الفئران المعالجة بالفلورايد. (أ) صورة سهمية تمثيلية μCT لقواطع الفك السفلي. (B-D) μCT الصور الإكليلية لقواطع التحكم (NaF 0 جزء في المليون). (E-G) μCT صور إكليلية للقواطع المعالجة ب NaF (125 جزء في المليون). تظهر الكثافة المعدنية التمثيلية للمينا (EMD) (جم / سم3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تضمين العينات في الراتنج
- تابع من الخطوة 1.7 (نموذج التسمم بالفلور السني) أو الخطوة 2.10 (نموذج L-PBR).
- قم بتغطية السطح الداخلي لكوب التثبيت (1 بوصة) بطبقة رقيقة من الفازلين. امزج الراتنج (راتنج تضمين الإعداد البارد) وفقا للتعليمات. صب الراتنج والمصلب في الكوب البلاستيكي المرفق بنسبة حجم 15: 2 واخلطه بعناية باستخدام ملعقة خشبية لمدة دقيقتين على الأقل. تجنب فقاعات الهواء.
- ضع القاطعة المجففة والمنزوعة الشحوم (الشكل 2 أ) أو العظم السنخي مع الأضراس (الشكل 2 ب) موجهة أفقيا وموازية لقاع كوب التثبيت (1 عينة لكل كوب).
- صب الراتنج المختلط (ما يكفي من الراتنج ، حوالي 1.5 مل) في كوب التثبيت لتغطية العينة بالكامل. تجنب إضافة المزيد من الراتنج أكثر من اللازم ، لأن الراتنج الزائد سيعيق عملية التلميع (الشكل 2 ج ، د). ضع كوب التثبيت الذي يحتوي على عينة على طبق ساخن عند 50 درجة مئوية لمدة 8 ساعات على الأقل لتعزيز بلمرة الراتنج. يساهم هذا الإجراء في الاحتفاظ بالعينة في وضع مستقر.
ملاحظة: اعتمادا على حجم العينة ، اضبط كمية الراتنج لتغطية العينة بالكامل. لا تملأ الكثير من الراتنج ، وإلا فستكون هناك حاجة إلى مزيد من الوقت لإزالة الراتنج غير الضروري. - بعد المعالجة ، قم بإزالة الراتنج الذي يحتوي على العينة من كوب التثبيت. قم بإزالة النتوءات وترتيب مستوى العينة والمستوى الجانبي المقابل على أنهما متوازيان ومسطحان باستخدام مطحنة تلميع متقدم مع ورق جلخ خشن مقاوم للماء (Grit 60 / P60 و 120 / P120) تحت فيضان المياه. حافظ على ارتفاع العينة إلى حوالي 3 مم للعظم القاطع والسنخية (الشكل 2E ، F).
ملاحظة: عندما يتم تحليل العينة بواسطة SEM بعد قياس الصلابة الدقيقة ، يجب أن يكون سمك العينة حوالي 3 مم حتى لا تتأثر مراقبة SEM اللاحقة. يصعب التعامل مع العينات الأصغر باستخدام المطحنة. بالنسبة للعينات المخصصة للصلابة الدقيقة فقط ، يمكن أن يزيد ارتفاع العينة إلى حوالي 10-20 مم. - قم بقص الشكل الخارجي لعمل كتلة راتنجية صلبة مستطيلة وزوايا مستديرة (تقريبا ، العرض 30 مم ، الطول 10 مم للقواطع (الشكل 2G) والعرض 10 مم ، الطول 5 مم ، للعظم السنخي (الشكل 2H)) باستخدام منشار تقسيم دقيق.
- بمجرد اكتمال تصحيح الشكل الخام ، قم بإزالة الحطام والجزيئات من كتلة الراتنج باستخدام منظف بالموجات فوق الصوتية (حوالي 1 دقيقة). تابع إلى الخطوة 4.

الشكل 2: تدفق عملية تضمين وتلميع الراتنج. أ: قاطعة مجففة ومنزوعة الشحوم. ب: العظم السنخي المجفف والمنزوع الشحوم في L-PBR. (ج، د) القواطع والعظام السنخية مغمورة في الراتنج. (ه، واو) عن طريق قطع الراتنج ، يكون من الأسهل تلميع سطح الأنسجة المستهدف. (ز ، ح) زوايا الراتنج مدورة لعملية التلميع. الاختصارات: L-PBR = ارتشاف عظم اللثة الناجم عن الرباط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تلميع العينات
ملاحظة: يتم تلميع العينات يدويا باستخدام أوراق كاشطة مقاومة للماء (من الخام إلى الأدق) على مطحنة تلميع متقدمة تحت فيضان المياه.
- ضع ورقة كاشطة خشنة مقاومة للماء (Grit 600 / P1200) على المطحنة. ضع كتلة الراتينج المشذبة والنظيفة (من الخطوة 3.7) على الورق الكاشطة الخام المقاوم للماء.
- أثناء صب الماء ، أمسك كتلة الراتنج وقم بتلميع سطح تقييم العينة على المطحنة الملمع (السرعة 1-10 × جم). في هذا الوقت ، احرص على إمساك كتلة الراتنج بحيث يكون سطح التقييم موازيا للأرض. للحفاظ على سطح التقييم سليما ، تحقق من السطح بالعين المجردة أو تحت المجهر.
ملاحظة: لاحظ أن المطحنة تدور في اتجاه عقارب الساعة ، ويمكن أن يؤدي الضغط المنتظم إلى سطح لا مثيل له. للحصول على سطح متوازي ، حافظ على سرعة دوران الطائرة الشراعية ثابتة واضغط على العينة بعناية لبضع ثوان ، ثم قم بتدوير العينة 180 درجة للضغط لنفس الفترة الزمنية. قد يزيل الورق الكاشطة الخام ليس فقط الراتنج ولكن أيضا العينة. - قم بتغيير الورق الكاشطة إلى Grit 800 / P2400 وضع كتلة الراتنج عليه. كرر الخطوة 4.2.
- إزالة الحطام والجزيئات من كتلة الراتنج باستخدام منظف بالموجات فوق الصوتية (حوالي 1 دقيقة).
ملاحظة: قبل المتابعة ، يوصى باستخدام منظف بالموجات فوق الصوتية لإزالة أي حطام سطحي لمنع الانسداد. - بعد ذلك ، قم بإجراء التلميع التسلسلي باستخدام أوراق كاشطة أدق ؛ ترتيب التلميع هو 12 ميكرومتر ، 9 ميكرومتر ، 3 ميكرومتر ، 1 ميكرومتر و 0.3 ميكرومتر.
- ضع فيلم لف (12 ميكرومتر) على طاولة مطحنة التلميع دون دوران وضع كتلة الراتنج على فيلم اللف.
ملاحظة: في هذه التجربة ، تكون طاولة المطحنة مناسبة للحصول على حالة سطح مستو تحت فيضان المياه. بدلا من ذلك ، يمكن أيضا استخدام مرآة مستوية كبيرة (أو مرآة مماثلة) توفر التوازي. - تحت التبريد بالماء ، قم بتلميع سطح تقييم العينة بعناية على فيلم اللف يدويا. حرك العينة رأسيا وأفقيا وقطريا لنفس عدد الثواني تحت حقن الماء بضربات من 2 إلى 3 سم (1 بوصة). عندما يتم إجراء عملية التلميع بشكل صحيح ، ستلتصق عينة الراتنج بفيلم اللف.
- قم بإزالة الحطام والجسيمات كما في الخطوة 4.4. قم بتغيير الورق الكاشطة إلى الحجم التالي وفقا لترتيب التلميع التسلسلي (من 12 ميكرومتر إلى 0.3 ميكرومتر) وضع كتلة الراتنج عليه.
- أثناء صب الماء ، أمسك كتلة الراتنج وقم بتلميع سطح العينة بعناية على فيلم اللف يدويا. قم بإزالة الحطام والجسيمات كما في الخطوة 4.4.
- كرر الخطوات 4.5 - 4.8 لإكمال التلميع النهائي (0.3 ميكرومتر). بعد الانتهاء من التلميع النهائي (0.3 ميكرومتر) ، يجب أن يكون للعينة سطح نهائي مرآة (الشكل 3 أ).
- نظف سطح العينة بالإيثانول (100٪) لإزالة الشحوم والجفاف وتخزين كتل الراتنج في درجة حرارة الغرفة حتى اختبار الصلابة الدقيقة. أثناء التخزين ، تجنب الرطوبة الزائدة والغبار. تابع إلى الخطوة 5.
5. اختبار فيكرز للصلابة الدقيقة
ملاحظة: يتم إجراء المسافة البادئة لعينة سطح تشطيب المرآة باستخدام جهاز اختبار الصلابة الدقيقة. يتم إجراء الاختبار بحمولة 25 جم لمدة 10 ثوان مع طرف فيكرز.
- اختبار فيكرز للصلابة الدقيقة للقواطع (نموذج تسمم الأسنان بالفلور)
ملاحظة: يمكن تقسيم المينا إلى ثلاث طبقات من الخارج (جانب تجويف الفم) إلى الداخل (جانب اللب) ؛ وهي الطبقة السطحية والطبقة الوسطى والطبقة العميقة (تقاطع العاج والمينا ، DEJ) (الشكل 3 ب)16. في هذا البروتوكول ، يتم اختبار ثلاث طبقات من المينا.- اضبط قوة التحميل على 25 جم ومدة التحميل على 10 ثوان. ضع كتلة الراتنج على المسرح.
- مسافة بادئة 6 نقاط في كل طبقة مينا (سطحية ومتوسطة و DEJ) وعاج في كل منطقة (عنق الرحم والوسط والطرف ؛ الشكل 3 ب).
- قياس طول القطرين (d1 و d2 ؛ الشكل 3 ب) لحساب قيمة صلابة فيكرز الدقيقة (HV; الشكل 4).
- اختبار فيكرز للصلابة الدقيقة للعظم السنخي (نموذج L-PPR)
- اضبط قوة التحميل على 25 جم ومدة التحميل على 10 ثوان. ضع كتلة الراتنج على المسرح.
- مسافة بادئة 3-6 نقاط في كل جانب متوسط وبعيد من العظم السنخي من القمة السنخية. المسافة البادئة للعظام السنخية بين 1ش و 2الضرس الثاني (مربع أبيض) ، و 2الضرس الثاني و 3.
ملاحظة: في هذا البروتوكول ، تم تقييم 6 نقاط في كل جانب متوسط وبعيد (إجمالي 12 نقطة) للعظم الضابط (السليم) ، وتم تقييم 3 نقاط في كل جانب (إجمالي 6 نقاط) ل L-PBR. يعتمد عدد نقاط المسافة البادئة على ظروف الآفة (على سبيل المثال ، الكثير من فقدان العظام يحد من منطقة المسافة البادئة).
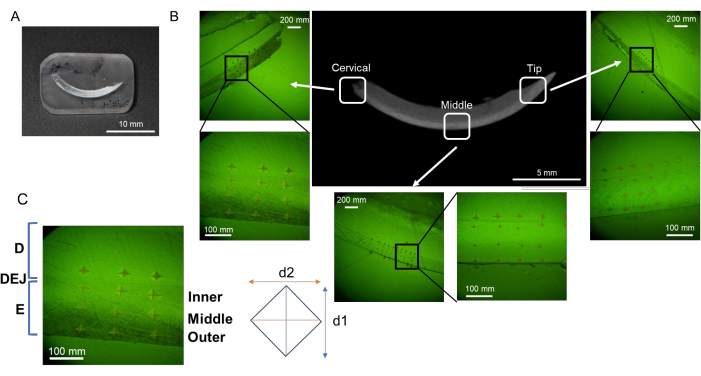
الشكل 3: تقييم مناطق الصلابة الدقيقة في قاطعة الفك السفلي. (أ) عينة سطح تشطيب المرآة التي تحتوي على قاطعة الفك السفلي. (ب) المسافات البادئة في كل منطقة؛ عنق الرحم والوسط والطرف (NaF 0 جزء في المليون). (ج) ثلاث طبقات من المينا؛ من DEJ ، المينا الداخلية والوسطى والخارجية. الاختصارات: D = العاج ، E = المينا ، DEJ = تقاطع مينا العاج يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
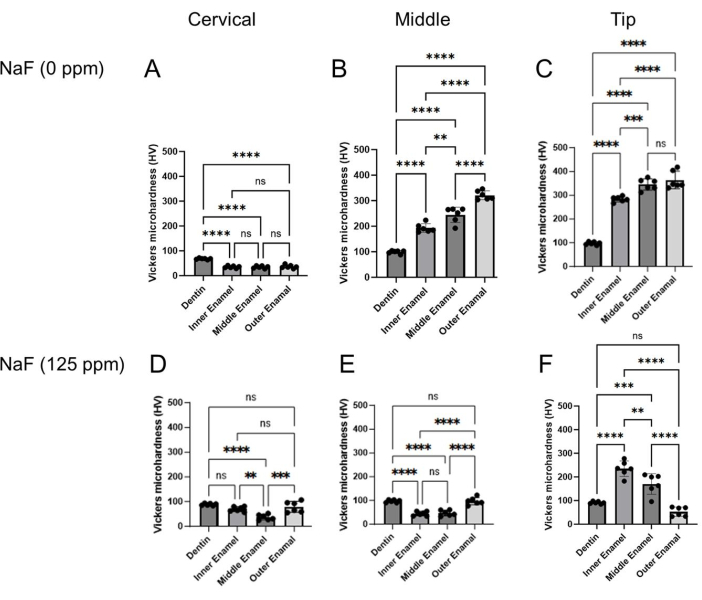
الشكل 4: صلابة فيكرز الدقيقة للمينا المعالجة ب NaF أو بدونه. تم تقييم الصلابة الدقيقة للعاج وثلاث طبقات مينا في كل منطقة ، منطقة عنق الرحم ، الوسطى ، والطرف. (أ-ج) التحكم و (D-F) NaF (125 جزء في المليون) العلاج. يتم تقديم البيانات كمتوسط ± SD. تم تقييم الاختلافات ذات الدلالة الدلالة إحصائية بواسطة ANOVA أحادي الاتجاه مع اختبار Tukey اللاحق. تم اعتبار قيم p < 0.05 ذات دلالة إحصائية. ** p < 0.005 ، *** p < 0.0005 ، ****p < 0.0001 الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
نموذج تسمم الأسنان بالفلور: يوضح الشكل 1 صورا تمثيلية μCT للقواطع في السيطرة والفئران المعالجة بالفلورايد. في المجموعة الضابطة (الشكل 1B-D) ، أظهرت منطقة عنق الرحم كثافة معدنية أقل للمينا (EMD) تبلغ 1.188 جم / سم3 (الشكل 1B) مقارنة بالوس...
Discussion
يتم إجراء الصلابة الدقيقة لتقييم الخواص الميكانيكية للأنسجة الصلبة مثل الأسنان والعظام. حتى الآن ، تم الإبلاغ عن طرق قياس الصلابة الدقيقة المتباينة. من المحتمل أن تكون معظم معلومات القياس ، وخاصة مستحضرات العينات ومواقع المسافة البادئة غير كافية. ركزت هذه الدراسة على بروتوكول الصلابة ال...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم البحث الوارد في هذا المنشور من قبل JSPS KAKENHI JP21K09915 (MO) والمعهد الوطني للعلوم الطبية العامة. T34GM145509 (MM) والمعهد الوطني لأبحاث الأسنان والقحف الوجهي ؛ R01DE025255 و R21DE032156 (XH) ؛ R01DE029709 و R21DE028715 و R15DE027851 (المعارف التقليدية)؛ R01DE027648 و K02DE029531 (MS).
Materials
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
References
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved