A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس امتثال الوريد الأجوف السفلي وقابلية التمدد في نموذج أغنام في الجسم الحي باستخدام تصوير الأوعية 3D
* These authors contributed equally
In This Article
Summary
يسمح هذا البروتوكول بالقياس الكمي في الجسم الحي للامتثال الوريدي والتمدد باستخدام القسطرة وتصوير الأوعية 3D كإجراء للبقاء على قيد الحياة مما يسمح بمجموعة متنوعة من التطبيقات المحتملة.
Abstract
تتغلب الطعوم الوعائية الاصطناعية على بعض تحديات الطعم الخيفي والطعوم الذاتية والطعوم الخارجية ولكنها غالبا ما تكون أكثر صلابة وأقل امتثالا من الوعاء الأصلي الذي يتم زرعها فيه. تظهر مطابقة الامتثال مع السفينة الأصلية كخاصية رئيسية لنجاح الكسب غير المشروع. يتضمن المعيار الذهبي الحالي لتقييم امتثال السفينة استئصال السفينة والاختبار الميكانيكي ثنائي المحور خارج الجسم الحي . لقد طورنا طريقة في الجسم الحي لتقييم الامتثال الوريدي والقابلية للتمدد التي تعكس بشكل أفضل علم وظائف الأعضاء الطبيعي وتأخذ في الاعتبار تأثير تغير الضغط الناجم عن تدفق الدم وأي تغييرات مورفولوجية موجودة.
تم تصميم هذه الطريقة كإجراء للبقاء على قيد الحياة ، مما يسهل الدراسات الطولية مع تقليل الحاجة إلى استخدام. تتضمن طريقتنا حقن بلعة ملحية سعة 20 مل / كجم في الأوعية الدموية الوريدية ، يليها الحصول على صور وعائية ثلاثية الأبعاد قبل وبعد البلعة لمراقبة التغيرات التي تسببها البلعة ، بالتزامن مع قياسات الضغط داخل الأوعية في المناطق المستهدفة. يمكننا بعد ذلك قياس محيط الوعاء ومساحة المقطع العرضي قبل البلعة وبعدها.
باستخدام هذه البيانات والضغط داخل الأوعية الدموية ، يمكننا حساب التوافق والتمدد بمعادلات محددة. تم استخدام هذه الطريقة لمقارنة امتثال الوريد الأجوف السفلي وقابليته للتمدد في الأغنام المحلية غير المشغلة بقناة الأغنام المزروعة بطعم بولي تترافلوريثيلين الموسع طويل الأجل (PTFE). تم العثور على السفينة الأصلية لتكون أكثر امتثالا وقابلية للتمدد من الكسب غير المشروع PTFE في جميع المواقع المقاسة. نستنتج أن هذه الطريقة توفر بأمان قياسات في الجسم الحي لامتثال الوريد وقابليته للتمدد.
Introduction
يحتاج المرضى الذين يعانون من تشوهات قلبية حرجة إلى جراحة ترميمية. تتطلب معظم العمليات الترميمية استخدام مواد تعويضية ، بما في ذلك الطعوم الوعائية. تشمل القنوات المحتملة لسد هذا الفضاء المواد الاصطناعية أو البيولوجية. في البداية ، تم استخدام الطعوم المتجانسة كقناة فونتان ولكن تم التخلي عنها منذ ذلك الحين بسبب ارتفاع معدل حدوث التكلس وحوادث المرحلة الحادة1. حاليا ، يتم استخدام الطعوم الوعائية الاصطناعية المشتقة من البوليمرات غير العضوية. لا يزال هناك تحد يتمثل في أن هذه الطعوم أقل امتثالا من الوعاء الأصلي الذي يتم زرعها فيه ولها مضاعفات طويلة المدى ، مثل التضيق والانسداد والتكلس1،2،3،4،5.
إن بنية الطعوم الوعائية الاصطناعية تفسح المجال لقوة الشد الميكانيكية ، مما يؤدي إلى انخفاض امتثالها دائما مقارنة بالأنسجة الأصلية2. يعمل الامتثال الوعائي ، الذي يحدد تغير حجم الوعاء على التغير في الضغط ، كمؤشر على استجابة السفينة للأحمال الميكانيكية. يخلق الاختلاف بين مادة الكسب غير المشروع وخصائص الأوعية الأصلية عدم تطابق الامتثال ، والذي ثبت أنه يعطل أنماط تدفق الدم ، مما يؤدي إلى مناطق إعادة الدوران وفصل التدفق2،6،7،8،9. هذه الظاهرة تغير إجهاد القص على جدار البطانية وتحفز تضخم داخلي2،7،8،9. يمكن أن تؤدي هذه الاستجابات إلى مضاعفات مرتبطة بالكسب غير المشروع ، مما يستلزم استبدال الكسب غير المشروع أو إعادة التدخل6.
نظرا لأن الامتثال الوعائي يفترض دورا رئيسيا في تحديد نتائج الكسب غير المشروع ، فإن القياس الدقيق لهذه الخاصية أمر ضروري. المعيار الذهبي الحالي لقياس امتثال الأوعية الدموية هو الاختبار الميكانيكي ثنائي المحور الأنبوبي خارج الجسم الحي . تتضمن هذه الطريقة استئصال الكسب غير المشروع أو الوعاء محل الاهتمام ، وتوصيله بأنابيب اللاتكس ، والضغط عليه لتقييم سلوك تمدد الإجهاد المحيطي عبر الضغوط المختلفة. يتم تحديد الامتثال من خلال مقارنة الضغط بقياس القطر الداخلي10. ومع ذلك ، فإن الطرق خارج الجسم الحي لها بعض العيوب. عند تقييم وظائف الطعوم المزروعة باستخدام طريقة خارج الجسم الحي ، من الضروري التضحية بالحيوانات وزرع الطعوم ، مما يجعل من المستحيل إجراء فحوصات مطولة. لذلك ، قمنا بتطوير بروتوكول قياس الامتثال في الجسم الحي .
تركز مجموعتنا على تطوير الطعوم الوعائية المهندسة بالأنسجة (TEVGs) لاستخدامها في جراحة فونتان لتحسين عيوب القلب الخلقية متلازمة القلب الأيسر ناقص التنسج (HLHS). أدت التطورات الأخيرة في مجال جراحة القلب الخلقية إلى تحسين نتائج ما بعد الجراحة ، مما أدى إلى إطالة العمر المتوقع. هذا يجعل الخصائص طويلة المدى ونجاح قناة الأوعية الدموية المزروعة أمرا بالغ الأهمية بشكل متزايد. حاليا ، لا يوجد نموذج حيواني ل HLHS ، لذلك نقوم بتقييم الطعوم لدينا في نموذج الكسب غير المشروع للوريد الأجوف السفلي للحيوان الكبير المتسارع (IVC). في حين أن هذا النموذج لا يحاول إنشاء تدفق دوران فونتان ، إلا أنه يلخص بشكل فعال ظروف الدورة الدموية الفريدة. أظهر استخدامنا الأخير لهذا البروتوكول في الجسم الحي اختلافات كبيرة في الامتثال للكسب غير المشروع بين TEVG والطعوم التقليدية متعددة تترافلورو إيثيلين (PTFE)11. نظرا لأن هذه الدراسة السابقة لم تركز على المنهجية ، فقد أجرينا تجارب إضافية توضح بالتفصيل هذه الطريقة الجديدة في الجسم الحي .
قمنا بزرع الطعم الاصطناعي الذي يعمل حاليا كمعيار للرعاية ، والذي يتألف من بولي تترافلورو إيثيلين الموسع (PTFE) ، في دراسة الأغنام في دورست وقارناه ب IVC الأصلي في التحكم الساذجة جراحيا. تم تنفيذ هذا البروتوكول على مجموعة PTFE بعد 5-7 سنوات من زرع قناة PTFE التحكم غير المشغلة من مختلف الأعمار. وبالتالي ، في الأقسام اللاحقة التي تصف البروتوكول والنتائج التمثيلية ، سنشير أحيانا إلى المنطقة ذات الاهتمام ، على سبيل المثال ، منتصف منطقة الكسب غير المشروع (midgraft) من طعم التداخل IVC.
يسمح لنا هذا البروتوكول بتحليل الامتثال في الجسم الحي لقناة PTFE ، والمعروفة بأنها غير متوافقة في نقطة زمنية طويلة الأجل ، مع الوريد الأصلي. اخترنا مقارنة المادة القياسية السريرية ، PTFE ، مع الوريد الأصلي غير المشغل. لقد اخترنا نقطة زمنية طويلة الأجل لأن قناة PTFE معروفة بأنها لا تزال غير متوافقة وعرضة للتكلس ، مما يقلل من امتثالها11. اخترنا إجراء جميع المقارنات في الجسم الحي حيث تنعكس التغيرات الديناميكية الدموية الجهازية بدقة في القياسات التي تم الحصول عليها من خلال طرق الجسم الحي. من هذه المقارنة ، وجدنا أن هذا البروتوكول قادر على تأكيد عدم امتثال PTFE والحصول على قياسات الامتثال الوريدي في الجسم الحي بطريقة آمنة وقابلة للتكرار. تم تنفيذ هذه الطريقة بنجاح في دراسة منشورة لإثبات الاختلافات ذات الدلالة الإحصائية بين قنوات PTFE وترقيع الأوعية الدموية المهندسة بالأنسجة (TEVGs) في الجسم الحي11.
الهدف العام من هذا البروتوكول هو حساب الامتثال وقابلية التمدد للIVC الصدري في نموذج حيواني كبير من الأغنام باستخدام قياسات في الجسم الحي من إجراء البقاء على قيد الحياة. تحقيقا لهذه الغاية ، قمنا بتصور وقياس التغيرات في محيط ومنطقة المقطع العرضي ل IVC الصدري إلى بلعة سائلة. قمنا في نفس الوقت بقياس التغير داخل الأوعية في الضغط واستخدمنا هذه القياسات لحساب الامتثال والتمدد. يتيح لنا استخدام تصوير الأوعية 3D مزايا متعددة ، بما في ذلك القدرة على ضبط عرض الصورة بعد الالتقاط لضمان أخذ قياساتنا من مقطع عرضي للوريد ، وكذلك السماح لنا بقياس مواقع متعددة على طول السفينة. كانت مجالات الاهتمام الثلاثة في هذه الدراسة هي منطقة الكسب غير المشروع ، بالإضافة إلى موقعي المفاغرة المجاورين لطعم PTFE ، والمناطق المماثلة في IVC الأصلي. من خلال إجراء التجارب في الجسم الحي ، هناك مزايا في تقييم وظائف الطعوم ضمن التدفق الفعلي للدم وتحيط بها الأنسجة والأعضاء. يعتقد أن القياسات التي تم الحصول عليها من خلال هذه الطريقة تعكس الوظيفة الفعلية للطعوم في الكائن الحي.
ينقسم البروتوكول إلى ستة أقسام رئيسية بما في ذلك إعداد الأغنام قبل الإجراء ، والقسطرة ، وجمع بيانات ما قبل البلعة الأساسية ، وجمع بيانات الدراسة ، واستعادة ، وتحليل البيانات. في قسم إعداد ، نناقش التخدير ، وبدء التخدير ، ووضع معدات المراقبة المستخدمة أثناء إجراء القسطرة. في القسم الثاني ، نوضح عملية وضع غمد القسطرة اللازمين للحصول على البيانات. بالنسبة لهذا البروتوكول ، يتم وضع كلا الغمد في الوريد الوداجي الداخلي الأيمن (IJV) للسماح بإدخال قسطرة متعددة المسارات في الوعاء. سيتم وضع أحدهما في المنطقة محل الاهتمام لتسجيل التغير في الضغط ، وسيتم وضع الآخر في أسفل الوريد لحقن التباين. بمجرد وضع القسطرة ، يتم أخذ صورة الأوعية الأساسية قبل البلعة 3D للمقارنة. يبدأ جمع بيانات الدراسة بإعداد البلعة الملحية في نظام كيس مضغوط للإعطاء ، وتزويد البلعة الملحية بتسجيل الضغوط داخل الأوعية الدموية ، وأخذ جهاز تصوير الأوعية الدموية 3D بعد البلعة. ثم نصف العملية لتسهيل استعادة الأغنام بعد البروتوكول. أخيرا ، نناقش طريقة الحصول على الصور المناسبة والقياسات المقطعية للتحليل والمقارنة الإحصائية.
Protocol
تمت الموافقة على بروتوكول الدراسة من قبل اللجنة المؤسسية لرعاية واستخدام في معهد أبحاث أبيجيل ويكسنر التابع لمستشفى الأطفال الوطني (AR22-0004). تلقت جميع رعاية إنسانية وفقا لدليل رعاية واستخدام المختبر ، الذي نشرته المعاهد الوطنية للصحة.
1. إعداد
- اطلب من فريق بيطري تقييم الأغنام قبل أسبوع من القسطرة ، بما في ذلك الفحص البدني وتحليل العلامات الحيوية ، لضمان حصول على التخدير بأمان.
- صوم طوال الليل ، أو حتى 12 ساعة قبل الإجراء ، للحد من خطر شفط محتويات المعدة عند تحريض التخدير.
- اضغط على زر التشغيل في لوحة التحكم لتشغيل نظام C-arm و 3D لتصوير الأوعية (الشكل 1A). انتظر حتى يتم تحميل النظام بالكامل.
ملاحظة: تأكد من إيقاف التنظير الفلوري مؤقتا حتى يصبح جاهزا للتصوير وأن جميع الأفراد يرتدون الرصاص الواقي. - تحضير محلول ملحي هيبارين لاستخدامه في الإجراء عن طريق إضافة 1 مل من الهيبارين (1000 وحدة USP / تركيز مل) إلى 1000 مل من محلول ملحي 0.9٪.
- حلق الجانب الأيسر من الرقبة وافركه بالكحول. يجب تطبيق التخدير عن طريق حقن مزيج من الكيتامين (4 ملغ/كغ)، بوتورفانول (0.1 ملغ/كغ)، وديازيبام (0.5 ملغ/كغ) في الوريد الوداجي الأيسر.
- ضع الخروف المخدر على سرير المستشفى وضعه في راقد القص للتنبيب. التنبيب باستخدام أنبوب القصبة الهوائية 9-14 مم (ET) ، بناء على حجم الأغنام ، عن طريق الضغط على اللسان ولسان المزمار باستخدام منظار الحنجرة وإدخال أنبوب ET في القصبة الهوائية.
- ضع الأغنام في وضع جانبي صحيح. قم بتوصيل أنبوب ET بجهاز التنفس الصناعي وقم بالتهوية ميكانيكيا بأكسجين 100٪ بمعدل 1-3 لتر / دقيقة.
- الحفاظ على التخدير مع 1-3 ٪ استنشاق isoflurane. اضبط معدل التنفس على 15-30 نفسا / دقيقة وحجم المد والجزر عند 8-10 مل / كجم.
- ضع معدات المراقبة القياسية ، بما في ذلك سوار ضغط الدم على الساق الأمامية اليمنى ، ومشبك الأذن لمراقبة تشبع الأكسجين على الأذن اليمنى ، ومسبار درجة الحرارة في المريء ، وجهاز مراقبة CO2 في نهاية المد والجزر على أنبوب ET. حلق الصوف من الجانب الذيلي لكل حافر بين مخالب الندى والكعب. ضع عقد مخطط كهربية القلب (ECG) وقم بتأمين عقد تخطيط القلب بشريط.
- تليين كلتا العينين عن طريق تطبيق مرهم العيون وإدخال أنبوب الفم المعدي لضمان إخلاء الغاز والطعام.
- إنشاء خط IV في IJV الأيسر للسماح بإعطاء ضخ معدل ثابت البروبوفول (CRI) (20-40 mg∙kg-1∙h-1) ، وسوائل الصيانة (10 mL∙kg-1∙h-1) ، والبلعة المالحة.
- ضع الأغنام في راقد جانبي أيسر. احلق الجانب الأيمن من الرقبة للوصول إلى موقع القسطرة (الشكل 2 أ). مسحة المنطقة مع فرك الكلورهيكسيدين والكحول.
- افصل عن معدات المراقبة وجهاز التنفس الصناعي وانقل الأغنام إلى طاولة مختبر القسطرة. مرة أخرى ، ضع في وضع راقد جانبي أيسر (الشكل 3 أ).
- أعد توصيله بجهاز التنفس الصناعي ومعدات المراقبة (أسلاك تخطيط القلب ، مسبار درجة الحرارة ، سوار ضغط الدم ، مقياس التأكسج النبضي).
- الحفاظ على التخدير أثناء العملية عن طريق إعطاء الأيزوفلوران المستنشق 1-3٪ مع 100٪ O2 ، و / أو البروبوفول CRI (20-40 مجم ∙ كجم -1∙ ساعة -1).
ملاحظة: تقييم مستوى التخدير عن طريق قياس حركة ، والاستجابة للمنبهات المؤلمة ، ومعدل التنفس ، ومعدل النبض ، وضغط الدم. قم بإجراء تعديلات في التخدير حسب الاقتضاء ، مثل استخدام بلعة 5-10 مل من البروبوفول للحث على مستوى أعمق من التخدير. - قم بقياس عرض الأغنام في منطقة القلب باستخدام الفرجار الكبير. اقسم العرض على 2 لضبط محول الضغط.
- قم بتنظيف موقع الجراحة بشكل معقم وثنيه بطريقة معقمة (الشكل 2B ، C).
2. القسطرة
- حرك الذراع C من الوضع المتوقف إلى صدر الأغنام وارفع الطاولة حسب الحاجة. اضغط على الزرين 7 و 3 في لوحة التحكم ، ثم اضغط مع الاستمرار على الزر "ابدأ " لاستخدام الإعدادات المبرمجة مسبقا لوضع الطاولة والذراع C تلقائيا على الجانب الأيسر من الجدول (الشكل 1 أ).
- الوصول إلى IJV الصحيح باستخدام إبرة ثقب دقيقة 21 G وحقنة Luer Slip 10 سم مكعب ؛ الوصول إلى IJV في اتجاه الجمجمة / الذيلية من خلال الجلد أثناء سحب مكبس المحقنة. تأكد من شفط الدم للتأكد من وجود الإبرة في الوعاء (الشكل 2 أ ، ب).
- افصل المحقنة بعناية أثناء تثبيت الإبرة.
- أدخل دليل سلك الفولاذ المقاوم للصدأ (SS) مقاس 0.018 بوصة عبر الإبرة في الوعاء في منتصف الطريق تقريبا. قم بإزالة الإبرة من فوق سلك SS.
- ضع موسعا 5 فرنسي (Fr) فوق سلك SS وفي الوعاء. قم بإزالة القطعة الداخلية من الموسع وسلك SS. قم بتغذية سلك توجيه 0.038 بوصة عبر الموسع في الوعاء في منتصف الطريق تقريبا وقم بإزالة الموسع.
- استخدم مشرطا من 11 شفرة لقطع الجلد فوق الوريد حيث يدخل السلك. قم بتغذية غمد 9-Fr فوق سلك التوجيه وفي الوعاء. قم بإزالة قسم الغلاف الداخلي وسلك التوجيه.
- تأكد من وضع الغمد المناسب عن طريق شفط الدم ثم شطف الغمد بمحلول ملحي هيبارين.
- كرر الخطوات 2.2-2.7 بحيث يكون هناك غمادان 9-Fr في IJV الصحيح.
- يتم تطبيق 150 وحدة/ كغ من الهيبارين عن طريق الوريد لمنع التخثر.
- استخدم دواسة القدم لبدء التنظير الفلوري (الشكل 1 ب). أدخل قسطرة Judkins Right (JR) عبر الغمد ، بعد IVC الصدري عبر الحجاب الحاجز إلى IVC البطني.
- قم بتمرير سلك روزن عبر قسطرة JR حتى يصل إلى IVC البطني ويخرج الطرف من قسطرة JR. أثناء تثبيت سلك Rosen في مكانه ، قم بإزالة قسطرة JR برفق.
- كرر الخطوات 2.10-2.11 مع الغلاف الثاني.
- قم بتمرير قسطرة متعددة المسارات 7-Fr فوق كل سلك روزين.
- تحت توجيه التنظير الفلوري ، ضع قسطرة تصوير الأوعية متعددة المسارات في IVC البطني لحقن التباين.
- باستخدام التنظير الفلوري ، ضع قسطرة تصوير الأوعية الدموية متعددة المسارات في المنطقة المحددة محل الاهتمام (على سبيل المثال ، مركز الطعم) لقياس الضغط (الشكل 2C).

الشكل 1: لوحة التحكم. (أ) لوحة تحكم نظام تصوير الأوعية 3D (ب) دواسات القدم التنظير الفلوري يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
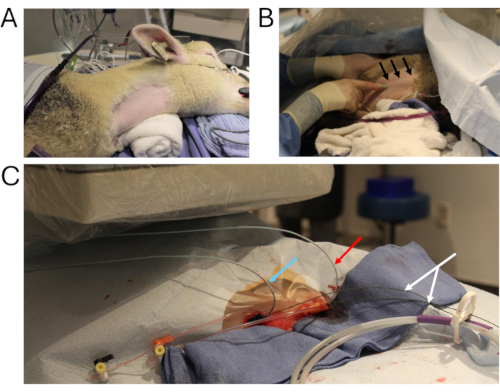
الشكل 2: قسطرة. أ: موقع الجراحة الرئيسي، المعد للقسطرة. (ب) تقنية تصور الوريد الوداجي الداخلي الأيمن (الأسهم السوداء). (ج) يتم وضع قسطرة تصوير الأوعية متعددة المسارات من خلال الوريد الوداجي الداخلي الأيمن (السهم الأزرق: قياس الضغط في الكسب غير المشروع ؛ السهم الأحمر: حقن التباين في IVC البطني ؛ السهم الأبيض: الأسلاك الصلبة). اختصار: IVC = الوريد الأجوف السفلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. جمع البيانات المسبقة
- قم بتوصيل المسار المتعدد المتمركز في المنطقة محل الاهتمام بمحول الضغط باستخدام محبس ثلاثي الاتجاهات. مع فتح المحبس على المسار المتعدد ، اسحب للخلف باستخدام حقنة سعة 10 مل حتى تتم إزالة فقاعات الهواء ورؤية الدم.
- مع قلب حقنة 10 مل رأسا على عقب ، أعد الدم إلى الأغنام مع الحرص على عدم دفع أي هواء مرة أخرى إلى المسار المتعدد. اغسل المسارات المتعددة بمحلول ملحي هيبارين.
- اقلب وضع إيقاف تشغيل المحبس إلى المحقنة بحيث يكون محول الضغط والمسار المتعدد مفتوحين لبعضهما البعض.
- تحضير حاقن التباين عن طريق إضافة عامل تباين. الحد الأدنى لحجم تصوير الأوعية ثلاثي الأبعاد هو 60 مل ولا يمكن أن يتجاوز التباين الكلي 5 مل / كجم أو 250 مل.
- قم بتوصيل حاقن التباين بالمسار المتعدد المتمركز في IVC البطني. باستخدام حاقن التباين ، أدر المقبض عكس اتجاه عقارب الساعة ببطء لسحب فقاعات الهواء من المسارات المتعددة حتى يتم رؤية الدم. أدر المقبض في اتجاه عقارب الساعة لدفع التباين للأمام ببطء إلى المسار المتعدد.
- استخدم التنظير الفلوري للتأكيد عندما يصل التباين إلى طرف المسار المتعدد.
- خذ التباين الكلي المستخدم في تصوير الأوعية ثلاثي الأبعاد واقسمه على 5 للحصول على مل / ثانية. اضبط ارتفاع السعر على 0 و 600 رطل / بوصة مربعة.
- اضبط C-arm على الوضع المبرمج مسبقا بالنقر فوق الزر "برنامج " في الجزء العلوي الأيمن من الشاشة والزر 3D DSA 110 مقاس 8 بوصات (تصوير الأوعية ثلاثي الأبعاد مع SID بحجم 110 سم وعرض المجال عند 8 بوصات).
- انقل جميع الأشياء والأشخاص بعيدا عن مقدمة الطاولة أو جوانبها. ابدأ برنامج C-Arm بالنقر فوق الزر رقم 3 في لوحة التحكم. ضع المنطقة المستهدفة (على سبيل المثال ، midgraft) في مركز المستوى x-y (الشكل 3A-C).
- تقدم إلى البرنامج الثاني بالنقر فوق الزر رقم 4 في لوحة التحكم. اضبط ارتفاع الجدول وفقا لذلك لتوسيط منطقة الاهتمام.
- اضغط على الزر رقم 5 والتقط صورة الاختبار.
- اختبر نطاق حركة C-Arm مسبقا بالنقر فوق الزر تأكيد الشروط | ابدأ (الشكل 3D ، E).
- اطلب من طبيب التخدير إجراء التهوية وأخذ صورة وعائية دورانية 3D مع حقن التباين عن طريق بدء البرنامج باستخدام دواسة الاستحواذ الوسطى. قياس وتسجيل متوسط الضغط للمنطقة المستهدفة في نفس الوقت.
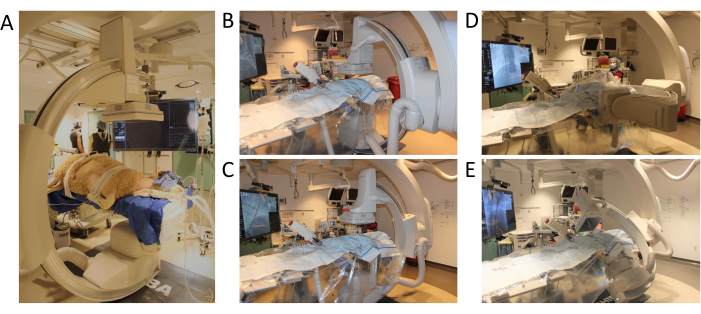
الشكل 3: موضع الذراع C ونطاق الحركة. (أ) وضع الأغنام لبداية الإجراء (ب) الموضع الأول لبرنامج تصوير الأوعية 3D (ج) تحرك الذراع C في المحور xy (D) تحرك الذراع C في المحور z (E) الذراع C يكمل اختبار الدوران مع نطاق كامل من الحركة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إدارة البلعة الملحية وجمع البيانات
- تحضير 20 مل / كجم من محلول ملحي 0.9٪.
- لتحضير كيس البلعة المضغوط ، أضف كيسا سعة 1000 مل من محلول ملحي بنسبة 0.9٪ إلى وحدة كيس مضغوط. استخدم وحدة ثانية إذا لزم الأمر لتحقيق الحجم الإجمالي المراد إدارته.
- اضغط على لمبة التضخم حتى يرتفع مقياس الضغط إلى المنطقة الخضراء ، مباشرة قبل الخط الأحمر (الضغط 250-300 مم زئبق). اغسل المياه المالحة عبر الخط وأزل فقاعات الهواء.
- قم بتوصيل الكيس الملحي المضغوط بغلاف 9-Fr وحافظ على 250-300 مم زئبق للحفاظ على سرعة ثابتة للبلعة. اتركه يتدفق حتى تتلقى الأغنام بلعة تعادل 20 مل / كجم أو يصل متوسط الضغط إلى 15 مم زئبق.
- أثناء تدفق البلعة ، سجل الضغوط داخل الأوعية الدموية للمنطقة المستهدفة كل دقيقة.
- اجعل الذراع C جاهزا لتصوير الأوعية الدورانية ثلاثية الأبعاد الثانية عن طريق تكرار الخطوات 3.9-3.12. بمجرد انتهاء البلعة ، قبل أن يبدأ الضغط في الانخفاض ، خذ تصوير الأوعية ثلاثي الأبعاد الثاني وقياس الضغط المتزامن داخل الأوعية عن طريق البدء كما هو موضح في الخطوة 3.13.
5. الانتعاش
- بعد الانتهاء من التصوير ، ضع C-Arm مرة أخرى في وضع الركن المبرمج مسبقا عن طريق إدخال الرقم 77 مع الاستمرار في الضغط على زر البدء حتى يتم وضع C-Arm نفسه.
- قم بإزالة قسطرة تصوير الأوعية متعددة المسارات وأسلاك روزين.
- قم بإزالة كلا الغمدين أثناء الضغط المباشر على مواقع الإدخال باستخدام رقعة إرقاء لمدة 7 دقائق على الأقل لوقف النزيف.
- لف لفافة معقمة من الشاش حول البقع والرقبة بحيث يكون الغلاف آمنا للحفاظ على الضغط ، ولكن ليس ضيقا جدا بحيث لا يخاطر بقطع الدورة الدموية أو منع التنفس.
- قم بإيقاف تشغيل التخدير (إيزوفلوران و / أو بروبوفول CRI).
- حافظ على الأغنام على جهاز التنفس الصناعي بنسبة 100٪ O2 حتى تتنفس باستمرار من تلقاء نفسها.
ملاحظة: تشمل العلامات التي تشير إلى استيقاظ الأغنام الحركة ، والوميض ، والاستجابة للمنبهات المؤلمة ، ونغمة الفك أو محاولات المضغ ، والتنفس دون مساعدة من جهاز التنفس الصناعي. - بمجرد أن تتمكن الأغنام من التنفس من تلقاء نفسها ، قم بإخراج الأنبوب (إزالة أنبوب ET) وإزالة الأنبوب الفموي.
- قم بإزالة جميع معدات المراقبة ونقل الأغنام إلى سرير المستشفى. انقله مرة أخرى إلى غرفة السكن.
- ساعد الأغنام في البقاء في راقد القص أو عند محاولة الوقوف حتى تتمكن الأغنام من الحفاظ على التوازن بمفردها. منعهم من الاصطدام بالجدران.
- بمجرد أن تظهر مستيقظة بما فيه الكفاية ، أعط كميات صغيرة من القش أو الحبوب.
6. تحليل البيانات
- تصدير بيانات تصوير الأوعية 3D الخام الأصلي من برنامج تصوير الأوعية بتنسيق ملف DICOM.
- قم بتشغيل برنامج عارض DICOM. قم بسحب وإسقاط ملف تصوير الأوعية ثلاثي الأبعاد في العارض لفتحه (الشكل 4 أ).
- ضمن برنامج عارض DICOM ، حدد أداة 3D MPR (إعادة الإعمار متعدد المستويات) لإنشاء عرض ثلاثي الأبعاد معاد بناؤه لبيانات تصوير الأوعية. سيقدم هذا ثلاث وجهات نظر ثنائية الأبعاد متميزة من ثلاث زوايا مختلفة: المستويات المحورية والسهمية (الشكل 4B) والإكليلية (الشكل 4C).
- اضبط موضع واتجاه المنطقة المستهدفة في المستويين السهمي والإكليلي لتحقيق الموضع الرأسي المطلوب عن طريق وضع المنطقة المستهدفة في المركز وتدوير اتجاه الخطوط المرجعية على كل مستوى باستخدام أداة يدوية (الشكل 4 د).
- استخدم أداة القلم الرصاص داخل عارض DICOM لتحديد جدار الوعاء في المنظر المحوري للمنطقة المستهدفة (الشكل 4E). يقوم البرنامج تلقائيا بحساب وإظهار كل من المساحة والمحيط (محيط) المنطقة في منتصف العرض المحوري.
- استخدم المعادلة (1) لحساب الامتثال ، حيث A هي مساحة المقطع العرضي (سم2) و P هي الضغط (مم زئبق):
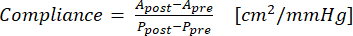 (1)
(1) - استخدم المعادلة (2) لحساب التمدد حيث C هو المحيط (cm) و P هو الضغط (mmHg):
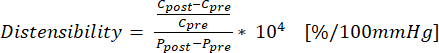 (2)
(2)
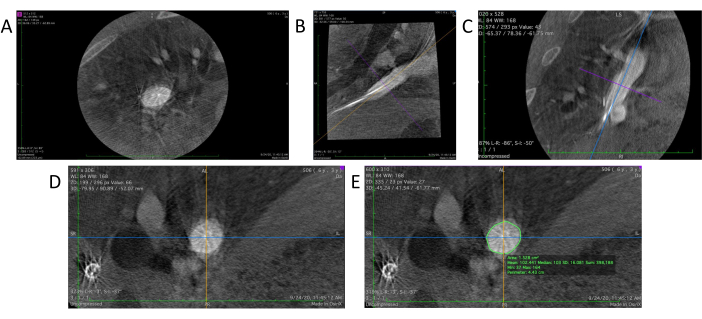
الشكل 4: تحليل البيانات في عارض DICOM. (أ) البيانات الخام لتصوير الأوعية الدموية 3D المحملة في عارض DICOM. ب: الجزء السهمي من الكسب غير المشروع. ج: القسم الإكليلي. (د) يتصور مقطع عرضي حقيقي بعد ضبط الزاوية على المقطع السهمي والإكليلي. (ه) تستخدم أداة القلم الرصاص لتحديد الوعاء المستهدف لإجراء قياسات للمحيط ومساحة المقطع العرضي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
لقد نجحنا في تنفيذ هذا الإجراء مع أكثر من 25 من الأغنام. الأهم من ذلك ، لم تكن هناك حالات مراضة ووفيات مرتبطة بهذا الإجراء. أظهرت جميع الأغنام عمليات استرداد غير معقدة. تم أخذ هذه النتائج التمثيلية من ثلاثة أغنام مزروعة بترقيع PTFE وثلاثة أغنام محلية غير مشغلة. يوضح الشكل 5 قياس...
Discussion
يعد الامتثال والقابلية للتمدد من الخصائص الرئيسية لوظيفة الأوعية الدموية ، حيث يعملان كمؤشرات للمضاعفات والتدخلات المحتملة. يعد التحديد الكمي الدقيق للتغيرات في هذه المعلمات ومقارنتها أمرا مهما لتقييم فعالية الكسب غير المشروع. تتغلب طريقتنا في الجسم الحي على قيود التحليل خارج ا?...
Disclosures
وقد رعت هذه الدراسة جزئيا شركة Gunze Ltd.
Acknowledgements
تم دعم هذا العمل من قبل R01 HL163065 و W81XWH1810518. نعرب عن تقديرنا للموظفين المتفانين في مركز أبحاث. كما نود أن نعرب عن امتناننا لكارمن أرسواغا على خبرتها القيمة ورعايتها اليقظة طوال فترة الدراسة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.035" x 260 cm Rosen Curved Wire Guide | Cook Medical | G01253 | Guide for holding placement swapping caths (Multi-track, IVUS, etc) |
| 0.035"x 150 cm Glidewire | Terumo | GR3507 | Guide for JR cath |
| 0.9% Sodium Chloride Saline | Baxter Healthcare Corporation | NCH pharmacy | For diluting norepinpherine, pressure monitoring |
| 10.0 Endotracheal tube | Coviden | 86117 | To secure airway |
| 16 G IV catheter | BD | 382259 | To administer fluids and anesthetic drugs |
| 22 G IV catheter | BD | 381423 | For invasive blood pressure |
| 5Fr x .35" JR2.5 | Cook Medical | G05035 | Guide for rosen wire |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| 7Fr x 100 cm Multi-track | B. Braun | 615001 | Collecting pressure, Administering contrast to specific intravascular location |
| 9Fr Introducer sheath | Terumo | RSS901 | Access catheter through skin into vessel for wires to pass through |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated Clotting Time |
| Angiographic syringe w/ filling spike | Guerbet | 900103S | For contrast injector |
| Bag decanter | Advance Medical Designs, LLC | 10-102 | Punctures saline bag to pour and fill sterile bowl with saline |
| Butorphanol | Zoetis | NCH pharmacy | Sedation drug: Concentration 10 mg/mL, Dosage 0.1 mg/kg |
| Cath Research Pack | Cardinal Health | SAN33RTCH6 | Cath pack with misc. supplies |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray |
| Chloraprep | BD | 930825 | Topical cleaning solution |
| Chlorhexidine 2% solution | Vedco INC | VINV-CLOR-SOLN | Topical cleaning solution |
| Conform stretch bandage | Coviden | 2232 | Neck wrap to prevent bleeding |
| Connection tubing | Deroyal | 77-301713 | Connects t-port to fluid/drug lines |
| Diazepam | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 5 mg/mL, Dosage 0.5 mg/kg |
| EKG monitoring dots | 3M | 2570 | |
| Fluid administration set | Alaris | 2420-0007 | |
| Fluid warming set | Carefusion | 50056 | |
| Hemcon Patch | Tricol Biomedical | 1102 | Patch for hemostasis |
| Heparin | Hospira, Inc | NCH pharmacy | Angicoagulant: 1,000 USP units/mL |
| Infinix-i INFX-8000C | Toshiba Medical Systems | 2B308-124EN*E | Interventional angiography system |
| Invasive pressure transducer | Medline | 23DBB538 | For invasive blood pressure |
| Isoflurane | Baxter Healthcare Corporation | NCH pharmacy | Anesthetic used in prep room |
| Ketamine | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 100 mg/mL, Dosage 4 mg/kg |
| Lubricating Jelly | MedLine | MDS0322273Z | ET tube lubricant |
| Micropuncture Introducer Set | Cook Medical | G47945 | Access through skin into vessel |
| Needle & syringes | Cardinal Health | 309604 | For sedation |
| Norepinpherine Bitartrate Injection, USP | Baxter Healthcare Corporation | NCH pharmacy | 1 mg/mL |
| Optiray 320 | Liebel-Flarsheim Company, LLC | NCH pharmacy | Contrast |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| OsiriX MD | Pixmeo SARL | - | DICOM Viewer and Analysis software |
| Pressure infusor bag | Carefusion | 64-10029 | To maintain invasive blood pressure |
| Propofol | Fresenius Kabi | NCH pharmacy | Anesthetic drug: Concentration 10 mg/mL, Dosage 20-45 mg·kg-1·h-1 |
| Silk suture 3-0 | Ethicon | C013D | To secure IV catheter |
| SoftCarry Stretcher | Four Flags Over Aspen | SSTR-4 | |
| Stomach tube | Jorgensen Lab, INC | J0348R | To release gastric juices and gas and prevent bloat |
| T-port | Medline | DYNDTN0001 | Connects to IV catheter |
| Urine drainage bag | Coviden | 3512 | Connects to stomach tube to collect gastric juices |
| Warming blanket | Jorgensen Lab, INC | J1034B |
References
- Hagler, D. J., et al. Fate of the Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis. 14 (4), 571-581 (2019).
- Nezerati, R. M., Eifert, M. B., Dempsey, D. K., Cosgriff-Hernandez, E. Electrospun vascular grafts with improved compliance matching to native vessels. J Biomed Mater Res B Appl Biomater. 103 (2), 313-323 (2015).
- Bates, O., Semple, T., Krupickova, S., Bautisa-Rodriguez, C. Case report of a Gore-Tex TCPC conduit dissection causing severe stenosis. Eur Heart J Case Rep. 5 (11), 1-6 (2021).
- Sathananthan, G., et al. Clinical importance of Fontan Circuit thrombus in the adult population: Significant association with increased risk of cardiovascular events. Can J Cardiol. 35 (12), 1807-1814 (2019).
- Kumar, P., Bhatia, M. Computed tomography in the evaluation of Fontan Circulation. J Cardiovasc Imaging. 29 (2), 108-122 (2021).
- Abbott, W. M., Megerman, J., Hasson, J. E., L'Italien, G., Warnock, D. F. Effect of compliance mismatch on graft patency. J Vasc Surg. 5 (2), 376-382 (1987).
- Weston, M. W., Rhee, K., Tarbell, J. M. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis. J Biomech. 29 (2), 187-198 (1996).
- Ballyk, P. D., Walsh, C., Butany, J., Ojha, M. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stress. J Biomech. 31 (3), 229-237 (1997).
- Lemson, M. S., Tordoir, J. H. M., Daemen, M. J. A. P., Kitslaar, P. J. E. H. M. Intimal hyperplasia in vascular grafts. Eur J Vasc Endovasc Surg. 19 (4), 336-350 (2000).
- Blum, K. M., et al. Tissue engineered vascular grafts transform into autologous neovessels capable of native function and growth. Commun Med. 2, 3 (2022).
- Turner, M. E., et al. Tissue engineered vascular grafts are resistant to the formation of dystrophic calcification. Nat Commun. 15, 2187 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved