A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطوير قطب كهربائي منخفض التكلفة لتخطيط كهربية العضل: سير عمل مبسط للتصنيع والاختبار
In This Article
Summary
كان هدفنا هو توفير دليل محدث وسهل المتابعة حول تصنيع واختبار أقطاب تخطيط كهربية العضل. تحقيقا لهذه الغاية ، نقدم تعليمات لمصادر المواد وإرشادات مفصلة لعملية التصنيع والاختبار.
Abstract
تخطيط كهربية العضل (EMG) هو أداة تشخيصية قيمة للكشف عن التشوهات العصبية العضلية. تستخدم الأقطاب الكهربائية القابلة للزرع بشكل شائع لقياس إشارات EMG في النماذج قبل السريرية. على الرغم من وجود موارد كلاسيكية تصف مبادئ تصنيع القطب الكهربائي ، إلا أن هناك ندرة في المعلومات التوضيحية التي تترجم نظرية القطب إلى ممارسة. لعلاج هذا ، نقدم دليلا محدثا وسهل المتابعة حول تصنيع واختبار قطب كهربائي منخفض التكلفة.
تم تصنيع الأقطاب الكهربائية عن طريق طي وإدخال رقاقتين من البلاتين والإيريديوم في قاعدة سيليكون مقطوعة مسبقا لتشكيل الأسطح الملامسة. بعد ذلك ، تم لحام أسلاك الفولاذ المقاوم للصدأ المطلية بكل سطح تلامس لتشكيل أسلاك القطب. أخيرا ، تم استخدام خليط سيليكون لإغلاق القطب. تم إجراء اختبار خارج الجسم الحي لمقارنة قطبنا الكهربائي المصنع خصيصا بقطب قياسي صناعي في حمام ملحي ، حيث تم العثور على مستويات عالية من اتفاق الإشارة (جيب [الارتباط داخل الفئة - ICC = 0.993] ، مربع [ICC = 0.995] ، مثلث [ICC = 0.958]) ، والتزامن الزمني (جيب [r = 0.987] ، مربع [r = 0.990] ، مثلث [r = 0.931]) عبر جميع أشكال الموجة. كما تم قياس المستويات المنخفضة من مقاومة القطب عن طريق التحليل الطيفي للمعاوقة الكهروكيميائية.
كما تم إجراء تقييم للأداء في الجسم الحي حيث تم استخدام العضلة الوعائية الجانبية للفأر جراحيا باستخدام القطب الكهربائي المصنع خصيصا وتم الحصول على الإشارات أثناء المشي صعودا وهبوطا. كما هو متوقع ، كان نشاط EMG الذروة أقل بكثير أثناء المشي على المنحدرات (0.008 ± 0.005 مللي فولت) من الصعود (0.031 ± 0.180 مللي فولت ، p = 0.005) ، مما يدعم صلاحية الجهاز. كما تم دعم موثوقية الجهاز وتوافقه الحيوي من خلال الإشارات المتسقة أثناء المشي على المستوى في 14 يوما و 56 يوما بعد الزرع (0.01 ± 0.007 مللي فولت ، 0.012 ± 0.007 مللي فولت على التوالي ؛ p > 0.05) وغياب الالتهاب النسيجي. بشكل جماعي ، نقدم سير عمل محدث لتصنيع واختبار أقطاب إبيميسية منخفضة التكلفة.
Introduction
تخطيط كهربية العضل (EMG) هو أداة قوية لدراسة النشاط الكهربائي للعضلات. يمكن أن تكون تسجيلات EMG مفيدة بشكل خاص في النماذج الحيوانية قبل السريرية لتقييم فعالية التدخلات لعلاج الخلل العصبي العضلي. في هذه النماذج ، تستخدم الأقطاب الكهربائية المتوافقة حيويا القابلة للزرع بشكل شائع لتقييم الواجهة الفسيولوجية العصبية بين الخلايا العصبية الحركية والألياف العضلية. يمكن أن توفر هذه الأقطاب الكهربائية القابلة للزرع قياسات موضعية لإثارة العضلات ويمكن أن تكون متنوعة من حيث تكوينها وشكلها وموادها ، مع التصميم الأمثل الذي يمليه الموقع والاستخدام المقصود في النهاية.
على الرغم من ملاءمتها لتقييم إثارة العضلات في النماذج قبل السريرية ، يمكن أن يكون استخدام الأقطاب الكهربائية epimysial محدودا بالتكلفة. نتيجة لذلك ، يستخدم العديد من الباحثين أقطاب كهربائية ملفقة حسب الطلب يتم إنتاجها داخليا. على الرغم من وجود موارد توضح بالتفصيل الاعتبارات الأساسية لتصنيع الأقطاب الكهربائية واختبارها واستخدامها1،2 ، إلا أن هناك حاجة إلى دليل تعليمي محدث يوضح بالتفصيل مصادر الأقطاب الكهربائية وتصنيعها والتحقق من صحتها باستخدام الأساليب الحديثة. استنادا إلى الأعمال التأسيسية ل Loeb و Gans3 وآخرين في نظرية الأقطاب الكهربائية ، نقدم تعليمات حديثة حول مصادر وتصنيع أقطاب إبيميسية منخفضة التكلفة واختبار أدائها في سلسلة من التجارب خارج الجسم الحي وفي الجسم الحي . والهدف من ذلك هو تقديم دليل سهل الاستخدام للآخرين في المجتمع العلمي لمصدر وتصنيع واختبار أقطاب كهربائية داخلية منخفضة التكلفة للاستخدام الحيواني ، مما يتيح القياس الكمي الأوسع لإثارة العضلات في النماذج قبل السريرية.
في هذا البروتوكول ، نقدم دليلا إرشاديا لتحديد مصادر وتصنيع واختبار الأقطاب الكهربائية للاستخدام الحيواني في مختبر الفيزيولوجيا الكهربية الحديث. تم اختيار معلمات القطب الكهربائي المختارة للتصنيع ، مثل الشكل والأبعاد ومساحة سطح التلامس والمسافة بين الأقطاب الكهربائية وطول الرصاص وما إلى ذلك ، لتناسب احتياجاتنا التجريبية وكانت قابلة للمقارنة مع قطب كهربائي قياسي متاح تجاريا (انظر جدول المواد). نحن نشجع المجموعات الأخرى على تعديل هذه المعلمات لتناسب احتياجاتهم بالإضافة إلى اختيار قطب كهربائي قياسي موثوق به في الصناعة يطابق حالة الاستخدام الخاصة بهم.
في محاولة لإعطاء القراء إحساسا سريعا نسبيا بأداء القطب ، نقدم أيضا مثالا على بروتوكول اختبار خارج الجسم الحي مع خيار قياس مقاومة القطب الكهربائي. بالإضافة إلى ذلك ، نقدم مثالا على تقييم أداء القطب في الجسم الحي. قارنت التجربة خارج الجسم الحي القطب الكهربائي المصنع خصيصا بمعيار صناعي في حمام ملحي لتقليد الظروف الفسيولوجية المستقرة. كما تم تقييم المعاوقة خارج الجسم الحي عبر التحليل الطيفي للمعاوقة الكهروكيميائية (EIS). تألفت التجربة في الجسم الحي من الزرع الجراحي للقطب الكهربائي المصنع خصيصا في عضلة الأوعية الجانبية (VL) لأنثى فأر Long Evans البالغة من العمر 16 أسبوعا (HsdBlu: LE ، Envigo) لقياس إشارة EMG خلال الظروف المعروفة باستنباط إشارة عالية أو منخفضة (صعودا ، نزولا على المنحدرات). لتقييم موثوقية القطب الكهربائي المصنع خصيصا ، تم الحصول على إشارات EMG أثناء المشي على مستوى بعد الشفاء الجراحي الكامل وقبل التضحية (14 يوما و 56 يوما بعد الزرع ، على التوالي). تم إجراء تلطيخ الهيماتوكسيلين-يوزين (H&E) على العضلات المزودة بأجهزة لتقييم التوافق الحيوي للقطب الكهربائي المصنع خصيصا.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم إجراء الإجراء في الجسم الحي بموجب موافقة اللجنة المؤسسية لرعاية واستخدام في جامعة ميشيغان (موافقة IACUC #PRO00010765) ووفقا لإرشادات المعاهد الوطنية للصحة بشأن رعاية واستخدام المختبر.
1. مصادر القطب والتصنيع
ملاحظة: يقدم الشكل 1 ملخصا عالي المستوى لجميع خطوات التصنيع الرئيسية مع رابط QR الذي يوفر تعليمات مرئية إضافية.
- مصدر مواد القطب المتوافقة حيويا مباشرة من الشركة المصنعة بكميات كبيرة للتصنيع. انظر جدول المواد ، الذي يحتوي على جميع مكونات القطب وتفاصيل حول المصادر.
ملاحظة: تأكد من أن قاعدة السيليكون ومانع التسرب السيليكوني ورقائق ملامسة البلاتين والإيريديوم متوافقة حيويا لتجنب الاستجابة المناعية الضارة والسماح بالزرع المزمن. لدعم المزايا الاقتصادية للتصنيع الداخلي ، نقدم تحليلا مفصلا لتكلفة القطب الأنبوبي المصنع خصيصا مقارنة بمعيار الصناعة (جدول المواد). - قم بإعداد رقصة القطع والطي (الملف التكميلي 1 ، الملف التكميلي 2). استخدم برنامج الطباعة 3D المحدد لتصميم رقصات القطع والطي لإنتاج الدفعات من أقطاب كهربائية متطابقة.
- صمم رقصة القطع لضمان وجود ثقوب متباعدة ومتباعدة باستمرار لقاعدة السيليكون لمساحة سطح التلامس المتساوية والمسافة بين الأقطاب الكهربائية عبر جميع الأقطاب الكهربائية.
- قم بإنشاء الرقصة القابلة للطي لطي أسطح التلامس البلاتينية والإيريديوم وتبسيط وضع الرقائق في قاعدة السيليكون.
ملاحظة: يتم توفير ملفات Gcode; تعديل أبعاد ومواصفات رقصة القطع والطي لتناسب الاحتياجات التجريبية.
- ثقب قاعدة السيليكون. ضع قاعدة السيليكون على رقصة القطع وقم بلصقها. قم بثقب السيليكون باستخدام الأدلة الموجودة في رقصة القطع باستخدام سكين X-acto لوضع رقائق التلامس.
- أدخل الرقائق في قاعدة السيليكون لتشكيل الأسطح الملامسة. قم بطي رقائق التلامس البلاتينية والإيريديوم المتوافقة حيويا (1.25 مم × 5 مم) على شكل حرف U باستخدام الرقصة القابلة للطي. بعد ذلك ، قم بتوجيه أذرع الرقائق المطوية إلى الفتحات المثقبة في قاعدة السيليكون لبناء الأسطح الملامسة للقطب الكهربائي. بهذه الطريقة ، أدخل جميع الرقائق ال 12 في قاعدة السيليكون ؛ اترك عمودا واحدا مفتوحا بين الأقطاب الكهربائية لضمان التباعد المناسب.
ملاحظة: سيسمح هذا التكوين بتصنيع 6 أقطاب ثنائية القطب ؛ يمكن أن يؤدي تحرير رقصة القطع إلى زيادة السعة إذا لزم الأمر. - قم بإزالة قاعدة السيليكون من رقصة القطع. ضع قطعة من الشريط الجراحي على الأسطح الملامسة لتثبيت الرقائق في مكانها. بعد ذلك ، قم بإزالة قاعدة السيليكون من رقصة القطع ، واقلبها حتى تنكشف أذرع الرقاقة على شكل حرف U ، وقم بطي ذراع واحدة من الرقاقة على شكل حرف U مع قاعدة السيليكون.
- قم بتوصيل أسلاك القطب. قم بإعداد سلك فولاذي مقاوم للصدأ مطلي بالبيرفلوروألكوكسي (PFA) عن طريق قطعه إلى الطول المطلوب. بعد ذلك ، قم بتجريد أحد طرفي سلك الفولاذ المقاوم للصدأ بمقدار ~ 1 سم باستخدام ولاعة متوفرة تجاريا. ضع الطرف المكشوف لسلك الفولاذ المقاوم للصدأ داخل الذراع غير المطوي للرقاقة. قم بلحام سلك الفولاذ المقاوم للصدأ بذراع الرقاقة باستخدام آلة لحام Micro TIG (عرض النبضة = 0 ، طاقة اللحام = 25).
- افحص واجهة رقائق الرصاص. اختبر اتصال رقائق الأسلاك عن طريق تطبيق الشد على سلك الفولاذ المقاوم للصدأ. إذا استمر الاتصال ، فقم بطي ذراع الرقاقة لأسفل مع قاعدة السيليكون وإزالة الشريط المتاخم لورقة السيليكون.
ملاحظة: قم بتطبيق شد يمثل الشد المطبق في حالة الاستخدام المحددة. - ختم القطب. لتحقيق تناسق أرق ، امزج 1 غرام من السيليكون السائل المتوافق حيويا مع 0.75 مل من التولوين. ارسم الخليط باستخدام حقنة حادة 18 جم وضعها على الجانب الملحوم لكل قطب كهربائي لإغلاق الجزء الخلفي من الأقطاب الكهربائية.
تنبيه: التولوين قابل للاشتعال ، وقد يكون قاتلا إذا ابتلع أو دخل الشعب الهوائية ويسبب تهيج الجلد. اعمل تحت غطاء الدخان وابتعد عن اللهب المكشوف. - افصل الدفعة إلى أقطاب كهربائية فردية. اترك السيليكون التولوين يضبط لمدة 72 ساعة قبل التعامل مع القطب. بعد ذلك ، استخدم المقص لقطع قاعدة السيليكون إلى أقطاب كهربائية فردية بحجم 10 × 5 مم.
ملاحظة: يعتمد حجم القطب على أبعاد رقصة القطع وحالة الاستخدام المحددة. الأوتوكلاف و / أو الأقطاب الكهربائية النظيفة في حمام بالموجات فوق الصوتية.
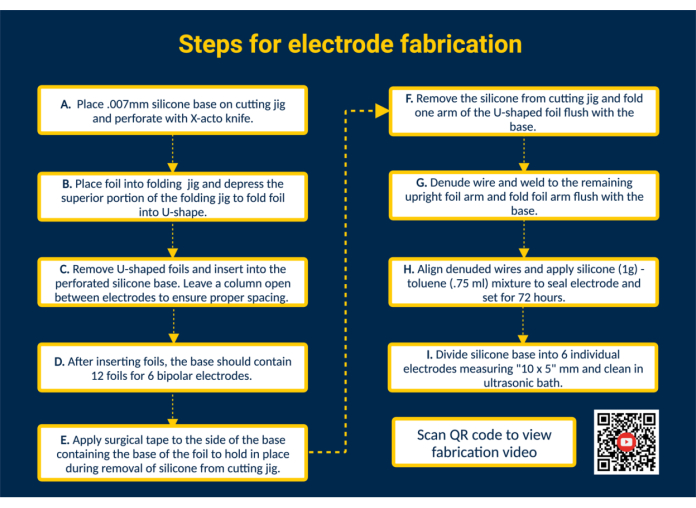
الشكل 1. خطوات تصنيع القطب. (أ) قاعدة سيليكون مثقوبة. (ب) تشكيل رقائق على شكل حرف U باستخدام الرقصة القابلة للطي. (ج) أدخل رقائق معدنية على شكل حرف U في قاعدة سيليكون مثقبة. (د) تحتوي قاعدة السيليكون على 12 رقاقة لتكوين 6 أقطاب ثنائية القطب. (ه) ضع شريطا جراحيا على القاعدة لتأمين الرقائق أثناء الإزالة من رقصة القطع. (F) قم بإزالة قاعدة السيليكون من رقصة القطع. (ز) قم بتجريد الأسلاك المصنوعة من الفولاذ المقاوم للصدأ المطلي ب PFA وقم بلحامها بذراع الرقائق المستقيمة باستخدام آلة لحام Micro TIG. (ح) قم بمحاذاة الأسلاك المجردة ، وقم بتطبيق مادة مانعة للتسرب من السيليكون والتولوين ، واتركها ثابتة. (ط) قسم قاعدة السيليكون إلى أقطاب كهربائية فردية ونظفها في حمام بالموجات فوق الصوتية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. اختبار خارج الجسم الحي
- قم بتوصيل الأقطاب الكهربائية بجهاز تسجيل. قم بتثبيت كل سلك سلك سلك سلك قطب كهربائي بقناة على لوحة واجهة القطب (EIB). كرر هذه الخطوة (باستخدام نفس بنك الاستثمار الأوروبي) لقطب كهربائي قياسي محدد في الصناعة للمقارنة. قم بتوصيل بنك الاستثمار الأوروبي بمنصة الحصول على البيانات عبر نظام كابل مغناطيسي مربوط.
ملاحظة: يمكن أن يكون القطب القياسي في الصناعة أي قطب كهربائي يعتبر موثوقا به ويناسب الاحتياجات التجريبية. - أسس بنك الاستثمار الأوروبي. قم بتجريد أحد طرفي الفولاذ المقاوم للصدأ المطلي ب PFA وقم باللحام الموضعي بمصدر تأريض (على سبيل المثال ، برغي من الفولاذ المقاوم للصدأ). قم بتثبيت سلك الرصاص الأرضي بنفس لوحة واجهة القطب في الوضع "الأرضي" المعين.
- قم بإعداد الحمام الملحي. املأ دورقا زجاجيا (250 مل) ب 180 مل من محلول ملحي فسيولوجي (محلول ملحي معقم 0.9٪)4. اغمر الأقطاب الكهربائية المصنعة حسب الطلب والقياسية الصناعية في الحمام الملحي وقم بتثبيتها في وضع مستقر. بعد ذلك ، اغمر مصدر التأريض في الحمام الملحي وقم بتأمين موضعه. أخيرا ، قم بغمر وتثبيت قطبين كهربائيين محفزين في الحمام الملحي وقم بتوصيل الأقطاب الكهربائية المحفزة بمولد الإشارة.
- استخدم مولد إشارة لتقييم اتفاق الإشارة والتزامن الزمني. استخدم مولد إشارة لتوصيل أشكال موجية متكررة بجهد وتردد محددين (0.1 فولت و 5 هرتز) في الحمام الملحي عبر الأقطاب الكهربائية المحفزة (الشكل 2). تقديم أشكال موجية مختلفة (جيب الزاوية والمربع والمثلث) لمقارنة الإشارات المسجلة بين القطب الحلقي المصنع خصيصا بالنسبة لمعيار الصناعة.
- تقييم الأداء بشكل غير رسمي ومرئي في الوقت الفعلي لتقييم درجة اختلاف الإشارات بين الأقطاب الكهربائية. إجراء الارتباطات داخل الفئة (ICCs) وارتباطات بيرسون لتقييم اتفاق الإشارة والتزامن الزمني ، على التوالي.
ملاحظة: لأغراض تحليلنا ، تم الحصول على 8000 عينة عند 4000 هرتز وتصفيتها في الوقت الفعلي باستخدام مرشح Butterworth عالي ومنخفض التمرير (تمرير مرتفع = 75 هرتز ؛ تمرير منخفض = 2 كيلو هرتز). - قياس مقاومة القطب. لقياس مقاومة القطب ، اجمع EIS على الأقطاب الكهربائية المصنعة خصيصا (على سبيل المثال ، 10 أقطاب كهربائية) على ترددات 10 هرتز -31 كيلو هرتز5 باستخدام جهد باستخدام الإجراء الموضح أدناه بواسطة Richie et al.6. انظر Sarolic et al. للحصول على معلومات إضافية حول قياس مقاومة القطب على الأقطاب الكهربائيةثنائية القطب 7.
- باتباع الإجراء من Richie et al. ، اغمر القطب الفوقي 1 مم في 1x محلول ملحي مخزن بالفوسفات (PBS). استخدم كلوريد الفضة والفضة (Ag|AgCl) قطب كهربائي مرجعي وقضيب من الفولاذ المقاوم للصدأ كقطب كهربائي مضاد لإكمال الدائرة.
- تعليق Ag |القطب المرجعي AgCl وقضيب الفولاذ المقاوم للصدأ في 1x PBS باستخدام مشبك الدورق. قم بتوصيل القطب المرجعي بمرجع نظام المعاوقة المستخدم وقم بتوصيله بإدخال القطب المضاد لنظام المعاوقة المستخدم.
- استخدم potentiostat لتشغيل فحص مقاومة 1 كيلو هرتز. اضبط على تردد مسح 1 كيلو هرتز عند 0.01 فولتrms في شكل موجة جيبية واحدة. خلال أول 5 ثوان من الفحص ، اضبط الجهد على 0 فولت لتثبيت الإشارة المسجلة. استخدم البرنامج المرتبط ب potentiostat لتسجيل القياسات.
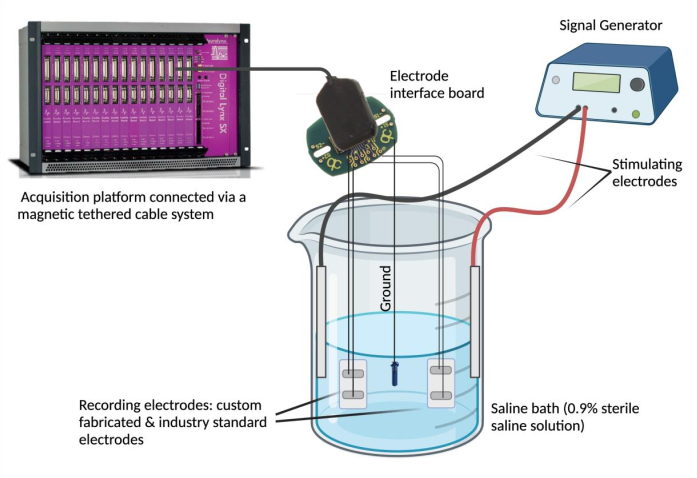
الشكل 2: اختبار خارج الجسم الحي : حمام ملحي يحتوي على قطب كهربائي مصنع حسب الطلب ، وأقطاب كهربائية قياسية في الصناعة ، وأقطاب كهربائية محفزة ، ومصدر أرضي. تم تقييم اتفاق الإشارة والتزامن الزمني عن طريق توصيل موجات جيبية ومربعة ومثلثة إلى الحمام الملحي من مولد الإشارة وتسجيل الأشكال الموجية المكتشفة بواسطة الأقطاب الكهربائية المعنية باستخدام منصة الحصول على البيانات. ملاحظة: لم يتم تصوير التحليل الطيفي للمعاوقة الكهروكيميائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. اختبار في الجسم الحي
ملاحظة: يصف إجراء الاختبار في الجسم الحي حالة الاستخدام التجريبية الخاصة بنا. يوصى باختبار الأقطاب الكهربائية المصنعة حسب الطلب في الجسم الحي بطريقة تتطابق مع الظروف التجريبية المقصودة للمستخدم.
- مراجعة المعلومات الجراحية; استشر معلومات للجراحين الذين يتعلمون عملية زرع أقطاب تسجيل عصبية مزمنة باستخدام الموارد التالية 8,9.
ملاحظة: نظرا لتركيز مخطوطتنا على تصنيع الأقطاب الكهربائية واختبارها ، فإننا نقدم هنا فقط لمحة موجزة عن التقنيات الجراحية المستخدمة في مختبرنا لاختبار القطب الكهربائي في الجسم الحي . - حدد فأرا ليتم تجهيزه (على سبيل المثال ، أنثى فأر Long Evans في عمر 16 أسبوعا). هل يخضع الجرذ لفترة 1 أسبوع من التأقلم المختبري قبل التأقلم مع جهاز المشي. بعد التأقلم المختبري ، قم بتعريض الجرذ تدريجيا لجهاز المشي القوارض بسرعات متزايدة تصل إلى 16 م / دقيقة.
- قم بإعداد بنك الاستثمار الأوروبي عن طريق توصيل قطب كهربائي ملفق خصيصا أولا ببنك الاستثمار الأوروبي عن طريق تثبيت كل قطب كهربائي على قناة على بنك الاستثمار الأوروبي. لتأريض بنك الاستثمار الأوروبي ، قم بتجريد أحد طرفي سلك الفولاذ المقاوم للصدأ المطلي ب PFA وقم بلحام موضعي على أساس محدد (على سبيل المثال ، برغي من الفولاذ المقاوم للصدأ). بعد ذلك ، قم بتثبيت سلك الرصاص الأرضي بنفس بنك الاستثمار الأوروبي في الموضع "الأرضي" المحدد.
ملاحظة: لحماية القطب الكهربائي أثناء الأجهزة ، لفه بغطاء واقي (على سبيل المثال ، parafilm). - تطهير جميع الأدوات الجراحية وكذلك المنطقة الجراحية قبل البدء. استخدم المستلزمات الجراحية المختومة والمعقمة والأوتوكلاف جميع الأدوات الجراحية غير الموجودة في عبوات معقمة. إنشاء مجال جراحي معقم باستخدام الستارة الجراحية.
- تخدير باستخدام غرفة الحث مع 3-5 ٪ إيزوفلوران و 1 لتر / دقيقة من الأكسجين والحفاظ عليها عن طريق مخروط الأنف مع 2 ٪ إيزوفلوران و 500 مل من الأكسجين أثناء إعداد الفئران. بعد الوصول إلى المستوى الجراحي للتخدير ، يتم تقييمه عن طريق قرصة إصبع القدم ، ضع مرهم العين ، راقب معدل التنفس (70-110 نفسا / دقيقة) ، وقم بتقييم درجة الحرارة الأساسية باستخدام مسبار المستقيم.
- بعد ذلك ، احلق موقع الجراحة باستخدام كليبرز وقم بإزالة الحطام من موقع الجراحة. بمجرد حلق المنطقة الجراحية ، قم بتطهير موقع الجراحة باستخدام الكلورهيكسيدين وكحول الأيزوبروبيل والبوفيدون اليود عن طريق التنظيف من المركز إلى خارج منطقة الجراحة. تطبيق المسكنات حسب الاقتضاء والموافقة وتوفير الحرارة للحفاظ على درجة حرارة الجسم الأساسية (37.5-38.5 درجة مئوية). بعد التحضير ، ضع الجرذ في إطار تجسيمي وإنشاء الحقل المعقم.
- للتحضير الجراحي السليم للجراح ، اغسل يديك جيدا باستخدام الصابون و / أو المطهر (الكلورهيكسيدين). ارتد معدات الوقاية الشخصية المناسبة: قناع وقفازات معقمة وثوب / غطاء فرك يمكن التخلص منه. ارتد قفازات معقمة جديدة إذا تم انتهاك تقنية التعقيم لأي سبب من الأسباب.
- لأداة VL اليمنى ، استخدم مشرطا لعمل شق 3-5 سم على الجزء الأمامي الجانبي من الطرف الخلفي الأيمن واستخدم تشريحا حادا لتحديد عضلة VL.
- قم بعمل شق مستوي سهمي 1 سم على طول الخيط الإكليلي وكشف الجمجمة. باستخدام زوج رفيع من الملقط ، قم بعمل نفق تحت الجلد من الطرف الخلفي الأيمن إلى قاعدة الجمجمة. استخدم الملقط للإمساك بالقطب وتوجيه القطب إلى VL.
- استخدم مثقابا عظميا لإنشاء ثقب في الكالفاريا (تأكد من أن مواصفات الحفر تتطابق مع مواصفات المسمار الأرضي). قم بتأمين المسمار الأرضي وإرفاق بنك الاستثمار الأوروبي بالجمجمة باستخدام الأسمنت السني.
ملاحظة: يمكن تطبيق كميات صغيرة من بيروكسيد الهيدروجين لزيادة مسامية الجمجمة وتعزيز التصاق الأسمنت السني. - بعد تحديد عضلة VL ، قم بزرع القطب الفوقي المصنع خصيصا المزروع بما يتماشى مع ألياف العضلات باستخدام خيوط أحادية 4-0 غير قابلة للامتصاص. أغلق الشق باستخدام مشابك الجرح أو عن طريق الخياطة.
- بعد الإغلاق ، أخرج من التخدير ووضعه بشكل فردي في قفص نظيف وجاف. اسمح للفأر بالتعافي على وسادة ساخنة ومراقبة درجة حرارة الجرذ ومعدل التنفس كل 15 دقيقة حتى يصبح متنقلا. علاج آلام ما بعد الجراحة عن طريق إعطاء مسكن معتمد في الأيام التالية للأجهزة.
ملاحظة: يجب إيواء الفئران بشكل فردي حتى يتم شفاؤها بالكامل. - بعد فترة 14 يوما ، قم بإجراء اختبار القطب الكهربائي في الجسم الحي لتقييم صلاحية القطب الزجاجي المصنع خصيصا لالتقاط التغيرات الفسيولوجية في نشاط العضلات. ضع الجرذ المجهز على جهاز المشي القوارض وقم بتعريضه بشكل عشوائي لظروف المشي صعودا وهبوطا تؤدي إلى زيادة أو انخفاض في إشارات VL EMG (انحدار 16 درجة ، انخفاض 16 درجة عند 16 مترا / دقيقة). جمع البيانات الطولية (على سبيل المثال ، 14 يوما و 56 يوما بعد الأجهزة) لضمان الموثوقية بمرور الوقت.
ملاحظة: تم اختيار التقييمات لمدة 14 و 56 يوما حيث تسمح فترة 14 يوما بالشفاء الجراحي الكامل وتتجاوز فترة 56 يوما جدولنا الزمني التجريبي. نحن نشجع الآخرين على اختبار أداء القطب وموثوقيته باستخدام إطار زمني يكرر جدولهم الزمني التجريبي قبل الاستخدام. تم اختيار السرعة (16 م / دقيقة) وظروف المشي (انحدار 16 درجة ، انخفاض 16 درجة) لتتناسب مع الظروف المحددة لزيادة وانخفاض إثارة VL في هذا النموذج10. - تعديل معلمات الاستحواذ لتناسب الاحتياجات التجريبية. التقط إشارات EMG أثناء المشي بمعدل 2000 هرتز باستخدام منصة الحصول على البيانات وقم بمزامنتها مع نظام التقاط الحركة.
ملاحظة: إذا كنت تستخدم جهاز اكتساب مختلفا ، فقم بجمع EMG والتقاط الحركة وفقا لتعليمات الشركة المصنعة ولتلبية الاحتياجات التجريبية. - استخرج 25 ثانية من بيانات المشي من كل حالة مشي وقم بتصديرها إلى برنامج نصي Python مخصص لمزيد من معالجة الإشارات وتحليلها. اضبط خط الأساس (صفر) وصحح وسلس باستخدام خوارزمية جذر متوسط مربع بعرض حاوية 50 مللي ثانية. قم بتطبيق خوارزمية اكتشاف الذروة لتحديد قمم RMS-EMG لاستخدامها في تحليلات البيانات اللاحقة.
ملاحظة: لقد وصفنا بإيجاز طرق المعالجة المسبقة لبيانات EMG وتحليلها ، حيث تختلف هذه الخطوة اختلافا كبيرا بسبب لغات البرمجة وبرامج وأجهزة الحصول على EMG. نشجع المؤلفين على الرجوع إلى الموارد التالية للحصول على معلومات إضافية3،11،12،13.
4. اختبار التوافق الحيوي
- بعد نهاية مجموعات EMG الطولية (أو في نقطة زمنية محددة) ، القتل الرحيم للفأر باستخدام الطرق المناسبة والمعتمدة (على سبيل المثال ، الاختناق باستخدام CO2 متبوعا ببضع الصدر الثنائي).
- بعد القتل الرحيم ، استخرج عضلات VL الثنائية عن طريق إنشاء شق على الأطراف الخلفية الأمامية اليمنى واليسرى. تجمد في النيتروجين السائل وتخزن في درجة حرارة -80 درجة مئوية.
ملاحظة: احرص على إبقاء القطب في موضعه على العضلة المزودة بأجهزة (على سبيل المثال ، VL الأيمن) أثناء الاستخراج. بدلا من ذلك ، حدد منطقة القطب الفرعي أو استخرج العضلات فقط من منطقة القطب الفرعي. هذا لا ينطبق على العضلات المقابلة / السيطرة. - استخدم جهاز التبريد لقطع المقاطع العرضية التسلسلية للعضلات (7 ميكرومتر) من المنطقة الموجودة أسفل واجهة القطب واللفافة مباشرة. قطع أقسام من بطن العضلات من VL المقابل لتكون بمثابة عنصر تحكم. انظر Kumar et al. للحصول على تفاصيل حول التقسيم بالتبريد14.
- وصمة عار مع الهيماتوكسيلين و Eosin (H &E) ؛ انظر Wang et al. للحصول على تفاصيل حول تلطيخ H& E على المقاطع العرضية للعضلات الهيكلية15.
- افحص المقاطع الملطخة (المزودة بأجهزة وتحكم) باستخدام مجهر ضوئي بتكبير 20x. تحليل التغيرات النسيجية العمياء عن أصل العينات. تقييم صحة الأنسجة التي تم تقييمها باستخدام السمات المرضية التالية: تسلل الخلايا المناعية ، وتراكم النواة العضلية الداخلية ، وتكوين الألياف ، وتجزئة الساركوليما.
5. التحليلات الإحصائية المقترحة
- لتقييم أداء القطب الفوقي المصنع خصيصا مقارنة بمعيار الصناعة ، قم باستيراد البيانات خارج الجسم الحي إلى حزمة إحصائية مختارة. قم بتطبيق الاختبارات الإحصائية التالية على البيانات خارج الجسم الحي التي تم جمعها من الأقطاب الكهربائية المصنعة خصيصا والقياسية الصناعية (على سبيل المثال ، 8000 عينة تمثيلية من الأشكال الموجية الجيبية والمثلثية والمربعة). اضبط مستوى ألفا مسبقا عند p ≤ 0.05.
- لاختبار مستوى اتفاق الإشارة بين الأقطاب الكهربائية ، استخدم الارتباطات داخل الفئة (ICCs) ومخططات Bland-Altman. احسب تقديرات ICC وفترات الثقة الخاصة بها بنسبة 95٪ بناء على تصنيف واحد (k = 2) ، واتفاق مطلق ، ونموذج تأثيرات عشوائية ثنائي الاتجاه.
- لاختبار الدرجة التي يتنوع بها تسجيل الأشكال الموجية بمرور الوقت ، والمعروف أيضا باسم التزامن الزمني ، قم بإجراء ارتباط بيرسون على القيم التي تم جمعها باستخدام الأقطاب الكهربائية المصنعة خصيصا والقياسية الصناعية.
- قارن متوسط مقاومة القطب الكهربائي لكل من أسطح التلامس (المقاسة عند 1 كيلو هرتز) من أقطاب كهربائية مختارة مصنعة خصيصا (على سبيل المثال ، 10 أقطاب كهربائية) بمقاومة القطب القياسي في الصناعة.
ملاحظة: ستختلف قيم مقاومة القطب الكهربائي بناء على حالة الاستخدام والمواد المستخدمة أثناء تصنيع القطب.
- لتقييم جودة التسجيلات في الجسم الحي ، قم باستيراد البيانات التي تم جمعها أثناء المشي على جهاز المشي إلى حزمة إحصائية محددة.
- لتقييم صحة القطب الكهربائي المصنع خصيصا أثناء الاختبار في الجسم الحي (حيث كانت مشية الجرذ مضطربة عن طريق المشي صعودا وهبوطا للحث على تغييرات فسيولوجية في نشاط العضلات) ، قم بإجراء اختبار Welch t لمقارنة متوسط قيم الذروة لظروف المشي صعودا وهبوطا.
ملاحظة: يتم تشجيع القراء على إجراء اختبارات وتحليلات إضافية (على سبيل المثال ، تقييمات نسبة الإشارة إلى الضوضاء (SNR) ؛ انظر مفاهيم Delysys الأساسية في اكتساب إشارة EMG) التي لم يتم تقديمها هنا للإيجاز16. - لتقييم موثوقية إشارات القطب بمرور الوقت ، قم بتقييم البيانات الطولية التي تم جمعها خلال ظروف متسقة (مستوى المشي بسرعة 16 م / دقيقة على فترات 14 و 56 يوما بعد الزرع) عبر اختبارات t المقترنة.
- لتقييم صحة القطب الكهربائي المصنع خصيصا أثناء الاختبار في الجسم الحي (حيث كانت مشية الجرذ مضطربة عن طريق المشي صعودا وهبوطا للحث على تغييرات فسيولوجية في نشاط العضلات) ، قم بإجراء اختبار Welch t لمقارنة متوسط قيم الذروة لظروف المشي صعودا وهبوطا.
Access restricted. Please log in or start a trial to view this content.
النتائج
أداء خارج الجسم الحي
كشفت ICCs عن مستويات عالية من الاتفاق بين الأقطاب الكهربائية المصنعة خصيصا والأقطاب القياسية الصناعية عبر جميع الأشكال الموجية (جيب [ICC = 0.993] ، مربع [ICC = 0.995] ، مثلث [ICC = 0.958] ؛ p < .001). كشفت مؤامرات بلاند-ألتمان أيضا عن درجة عالية من اتفاق الإش...
Access restricted. Please log in or start a trial to view this content.
Discussion
كان هدفنا هو تبسيط عملية تصنيع EMG ، مما يتيح اعتماد وتنفيذ تصميمات الأقطاب الكهربائية على نطاق أوسع ، وبالتالي تعزيز إمكانية الوصول ، وتطوير البحوث العصبية العضلية. تحقيقا لهذه الغاية ، نقدم دليلا سهل الاستخدام لتحديد مصادر وتصنيع واختبار الأقطاب الكهربائية منخفضة الت?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة معروفة أو علاقات شخصية يمكن أن يبدو أنها تؤثر على العمل المذكور في هذه الورقة.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني لالتهاب المفاصل وأمراض الجهاز العضلي الهيكلي والأمراض الجلدية R01AR081235 (إلى L. K. Lepley). يشكر المؤلفون الأفراد التالية أسماؤهم على مساهمتهم في تصنيع واختبار قطبنا المتوافق حيويا: جويل بينجل ، جرانت جيلر ، أخيل راميش ، جو ليتنر ، جاكي تيان ، وروس برانكاتي.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
References
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved