Method Article
اختبار في المختبر لدراسة هجرة الصفائح الدموية باستخدام حبال أفيدين-بيوتين الوظيفية RGD
In This Article
Summary
تم توفير بروتوكول مفصل لتصوير الصفائح الدموية المهاجرة المفردة باستخدام حبال أفيدين-بيوتين الوظيفية RGD ذات الكثافة القابلة للضبط ، مما يكشف أن الصفائح الدموية تولد قوة كافية لتمزيق رابطة أفيدين والبيوتين.
Abstract
على الرغم من كونها شظايا خلوية منزوعة النواة ، إلا أن الصفائح الدموية معروفة الآن على نطاق واسع بقدراتها متعددة الأوجه. فهي لا تشكل جلطات دموية لمنع النزيف بعد الإصابة فحسب ، بل إنها تحارب أيضا الالتهابات وتحافظ على سلامة الأوعية الدموية أثناء الأمراض الالتهابية. بينما تتطلب السدادات المرقئة التنشيط الجماعي وتجميع الصفائح الدموية ، يتم تنفيذ دورها في حماية الأوعية الدموية الملتهبة على مستوى الخلية الواحدة. في هذا السياق ، أظهرت البيانات الحديثة أن الصفائح الدموية يمكن أن تهاجر بشكل مستقل ، وهي عملية تعتمد على الاستشعار الميكانيكي لبيئتها اللاصقة. هنا ، يتم تقديم بروتوكول مفصل لتصوير هجرة الصفائح الدموية المفردة ، باستخدام نظام طلاء ثلاثي الطبقات يتكون من عمود فقري بولي L-lysine (إيثيلين جلايكول) (PLL-PEG) - العمود الفقري للبيوتين (1) ، رابط أفيدين الفلورسنت (2) ، والبيوتين الدوري Arg-Gly-Asp (cRGD) (3) كشكل ربط الصفائح الدموية. يسمح هذا النهج الاختزالي بالتحكم الدقيق في خصائص التصاق الركيزة ويعمل كمقايسة بسيطة وموحدة في المختبر لدراسة الآليات الكامنة وراء هجرة الصفائح الدموية. تشير النتائج إلى أن الصفائح الدموية المهاجرة المرتبطة ب cRGD تمارس قوى قادرة على تعطيل رابطة أفيدين والبيوتين. علاوة على ذلك ، تؤثر كثافة البيوتين cRGD بشكل كبير على كل من انتشار الصفائح الدموية وهجرتها.
Introduction
الصفائح الدموية عبارة عن شظايا صغيرة من الخلايا ذات النواة المشتقة من الخلايا الضخمة في نخاع العظام. تتجمع الصفائح الدموية المنشطة في مجاميع تشكل أساس جلطة دموية لإغلاق الآفات الوعائية في الإرقاء الفسيولوجي أو لسد الأوعية الدموية المريضة في تجلط الدم المرضي1. ومع ذلك ، في العقود الأخيرة ، أصبح من الواضح أن الصفائح الدموية تلعب أيضا دورا مركزيا في الفيزيولوجيا المرضية للالتهاب والعدوى والأورام الخبيثة ، حيث تعتبر التفاعلات متعددة الأوجه مع الخلايا المناعية والخلايا السرطانية ومسببات الأمراض الغازية ضرورية لتشكيل الاستجابة المناعية للمضيف2،3. أظهرت البيانات الحديثة أن الصفائح الدموية لديها القدرة على الهجرة بشكل مستقل4. استجابة لتجرثم الدم الجهازي ، يتم تجنيد الصفائح الدموية في الجيوب الأنفية للكبد ، حيث تلتصق وتهاجر. تسمح الهجرة للصفائح الدموية بالتقاط البكتيريا وربطها ، والتي بدورها تدعم تنشيط الكريات البيض. والجدير بالذكر أن الصفائح الدموية تظل داخل الأوعية الدموية خلال هذه العملية ولا تهاجر إلى الأنسجة البطانيةالفرعية 4. بالإضافة إلى ذلك ، فإن الصفائح الدموية هي حراس التهاب الأوعية الدموية ، وتقوم بمسح الأوعية الدموية الملتهبة بحثا عن الإصابات الدقيقة الناجمة عن تسرب الخلايا المناعية5 واستخدام الهجرة لحماية الأوعية الدموية الملتهبة6،7. هنا ، تستخدم الصفائح الدموية الإنتجرينات الخاصة بها لربط الفيبرينوجين المودع على البطانة الملتهبة. ثم تشكل الصفائح الدموية نتوءات صفائحية تسمح لها بمسح الخصائص اللاصقة لبيئتها. ثم تستقطب الصفائح الدموية وتهاجر نحو كثافات أعلى من الفيبرينوجين ، وهي عملية تعرف باسم الانجذاب الهابتو. تدعم هجرة الصفائح الدموية الموجهة في النهاية تحديد المواقع عند الآفات الدقيقة البطانية التي تمنع النزيف في الأنسجة الملتهبة ، بما في ذلك العضلات والرئة.
تعتمد هجرة الصفائح الدموية بشكل حاسم على الخصائص الميكانيكية للركيزة اللاصقة4،8. يتم التوسط في مهمة استشعار وتحويل الخصائص الميكانيكية للبيئة بشكل أساسي بواسطة مستقبلات الإنتجرين ، وهي بروتينات غير متجانسة عبر الغشاء تتكون من وحدة فرعية α و β مع ارتباط المجال خارج الخلية بالترابط على المصفوفة خارج الخلية والمجال داخل الخلايا المرتبط بالهيكل الخلوي للأكتين عبر بروتينات المحول9،10. أكثر أنواع الصفائح الدموية وفرة هو αIIbβ3 ، والترابط الرئيسي هو الفيبرين (الوجين) 11. يؤدي اشتباك Integrin-ligand إلى أحداث الإشارة التي تبلغ ذروتها في تكوين صفيحة مدفوعة ب Arp2 / 3 والتي تشكل الحافة الأمامية للصفائح الدموية الملتصقة7. تقوم الصفائح الدموية الملتصقة على الفور بفحص الخصائص الميكانيكية لبيئتها اللاصقة عن طريق سحبها4. عندما تتغلب قوى السحب المعتمدة على الميوسين IIa على الاستقرار الميكانيكي للمصفوفة خارج الخلية (على سبيل المثال ، الفيبرين (الجين)) ، تقوم الصفائح الدموية بتمزيق الروابط الضعيفة ميكانيكيا واستخدام نتوءاتها الصفيحية لمسح البيئة المكروية بحثا عن روابط لاصقة ، وإنشاء روابط ركيزة جديدة ، والهجرة بعيدا عن البيئة المستنفدةبالترابط 6. من المرجح أن تلعب هجرة الخلايا المدفوعة بنضوب الترابط الميكانيكي غير المحلل للبروتين دورا يتجاوز وظيفة الصفائح الدموية ، حيث يبدو أنها ظاهرة عامة لوحظت في الخلايا القادرة على إعادة تشكيل مصفوفة لاصقة ميكانيكيا8. يحدد معدل استنفاد الترابط سرعة الهجرة ويعتمد على كل من استقرار الترابط وكثافة الترابطللركيزة 8. الصفائح الدموية ذات الكثافة المنخفضة قادرة على تعطيل روابط الإنتجرين الهندسية ميكانيكيا (Arg-Gly-Asp الدورية (cRGD))6،7 المرتبطة بأغطية زجاجية مع حبال البيوتين أفيدين التي لها قوة غير ملزمة تبلغ حوالي 160 بيكونيوتن (pN) 12،13،14،15.
هنا ، يتم استغلال هذه الملاحظات لتطوير بروتوكول بسيط في المختبر لتوليد أسطح لاصقة قابلة للربط ، مما يسهل دراسة آليات هجرة الصفائح الدموية. يتكون الطلاء اللاصق الموضح في هذا البروتوكول من ثلاثة عناصر أساسية: (1) العمود الفقري PLL-PEG-biotin و (2) رابط نيوترافيدين - فلوريسين إيزوثيوسيانات (NA-FITC) الذي يسهل ارتباط (3) البيوتين-cRGD (رابط لاصق) بالعمود الفقري PLL-PEG-biotin (انظر أيضا الشكل 1 ب). يعتمد استقرار هذا البناء على قوة رابطة البيوتين - أفيدين ، والتي يمكن أن تنكسر إما عند واجهة (A) PLL-PEG-biotin-NA-FITC أو (B) FITC-NA-biotin-cRGD. بالإضافة إلى ذلك ، يمكن ضبط كثافة الروابط اللاصقة عن طريق تكييف نسبة PLL-PEG-biotin إلى PLL-PEG في الطبقة السفلية. يؤدي تعطيل الرابطة (A) إلى إطلاق FITC من الطلاء ، مما يؤدي إلى انخفاض في إشارة التألق تحت الصفائح الدموية المهاجرة. وبالتالي ، فإن الطلاء الموصوف في هذا البروتوكول يسمح معا بقابلية ضبط دقيقة لخصائص الركيزة الميكانيكية واللاصقة ويوفر قراءة سهلة قائمة على الفلورسنت لهجرة الصفائح الدموية.
Protocol
أجريت التجارب على التي أجريت في هذه الدراسة وفقا لجميع اللوائح الأخلاقية ذات الصلة للدراسات التي شملت الفئران وتمت الموافقة عليها من قبل التشريعات المحلية بشأن حماية (Regierung von Oberbayern ، ميونيخ ، 190-15 ، 2015). تم استخدام الإناث والذكور C57BL / 6 الفئران ، الذين تتراوح أعمارهم بين 8 و 10 أسابيع (وزن الجسم 20-25 جم) ، في هذه الدراسة. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. طلاء البيوتين - النيوترافيدين - البيوتين cRGD
- أغطية زجاجية سونيكات (24 مم × 24 مم ؛ # 1.5) في غضون 20٪ HNO3 لمدة دقيقة واحدة ، تليها صوتنة داخل الأيزوبروبانول والإيثانول و H2O لمدة دقيقة واحدة. بعد كل صوتنة ، اشطف الأغطية بالماء المقطر (ddH2O) على نطاق واسع وأخيرا جففها في الحاضنة.
- عالج الأغطية التي تم تنظيفها مسبقا باستخدام O2 plasma في منظف البلازما لمدة دقيقتين ، ثم قم بتجميعها بشرائح لاصقة كما هو موضح سابقا16. ستشكل الشرائح اللاصقة والأغطية الزجاجية قناة بينهما (كما هو موضح في الشكل 1 أ).
ملاحظة: العلاج الفعال بالبلازما مهم. استخدم O2 كمصدر للبلازما. - املأ القناة ب 2.5 ميكرولتر من PLL-PEG-biotin (1 مجم / مل) مخفف في 97.5 ميكرولتر من PLL-PEG (1 مجم / مل) واحتضانه لمدة 30 دقيقة في درجة حرارة الغرفة (RT) ، ثم اغسلها ثلاث مرات باستخدام PBS. يربط PLL-PEG-biotin النيوترافيدين في الخطوة التالية ، بينما يشكل العمود الفقري PLL-PEG ركيزة خاملة تمنع الارتباط غير المحدد للبروتينات والصفائح الدموية.
ملاحظة: يحدد تركيز PLL-PEG-biotin في محاليل الطلاء الكثافة النهائية لروابط cRGD. - أضف 100 ميكرولتر من Neutravidin-FITC (25 ميكروغرام / مل) واحتضنه لمدة 30 دقيقة في الظلام عند RT ، ثم اغسله ثلاث مرات باستخدام PBS.
ملاحظة: اضبط تركيز Neutravidin-FITC على تركيز PLL-PEG-biotin. زيادة تركيز نيوترافيدين-FITC إذا تم طلاء كثافة أعلى PLL-PEG-biotin. - أضف 100 ميكرولتر من cyclo [Arg-Gly-Asp-D-Phe-Lys (Biotin-PEG-PEG)] (cRGD-biotin) (0.1-1 ميكرومتر) ، واحتضنه لمدة 30 دقيقة في RT ، واغسله ثلاث مرات باستخدام PBS. أغطية جاهزة للاستخدام. تم تصوير رسم تخطيطي للطلاء في الشكل 1 ب.
2. عزل الصفائح الدموية للفأر عن الدم
- قم بإعداد المخزن المؤقت للتيرود المعدل ، والذي يحتوي على 136.9 ملي مولار من كلوريد الصوديوم ، و 12.1 ملي مولار من NaHCO3 ، و 2.6 ملي مولار من KCl ، و 5.5 ملي مولار من الجلوكوز ، و 10 ملي مولار من HEPES ، واضبط الرقم الهيدروجيني على 7.4 و 6.5.
- تخدير الفئران (باتباع البروتوكولات المعتمدة مؤسسيا) عن طريق الحقن داخل الصفاق 0.5 ملغم/كغ فنتانيل، 5 ملغم/كغ ميدازولام، و0.05 ملغم/كغ ميديتوميدين. بعد التأكد من عمق التخدير عن طريق قرصة إصبع القدم ، قم بإزالة الجلد الصدري بالمقص.
- تحضير حقنة سعة 2 مل (إبرة 26 جم) مع 150 ميكرولتر من حمض السترات وسكر العنب (ACD) كمضاد للتخثر. أدخل الإبرة بين الضلعين الثاني والثالث على الجانب الأيسر من القص لسحب الدم من القلب. بعد ذلك ، قتل الفأر عن طريق خلع عنق الرحم.
ملاحظة: (1) تكوين عازلة ACD: 85 ملي مولار من مجفف سترات الصوديوم ثلاثي القاعدة و 65 ملي مولار من أحادي هيدرات حامض الستريك في 111 ملي مولار من الجلوكوز. (2) يجب أن يتم سحب الدم بسلاسة لتجنب أي جلطة. يمكن الحصول على حوالي 1 مل من الدم من الفئران التي تتراوح أعمارها بين 8 و 10 أسابيع. - امزج الدم مع 1 مل من عازلة Tyrode (درجة الحموضة 6.5) في أنبوب FACS سعة 5 مل (قاع دائري من البوليسترين) ، وجهاز طرد مركزي عند 70 × جم لمدة 20 دقيقة عند RT مع إيقاف تشغيل الفرامل.
- بعد الطرد المركزي ، خذ الجزء العلوي (حوالي 1 مل) الذي يحتوي على بلازما غنية بالصفائح الدموية (PRP). تخلط مع 3 مل من عازلة Tyrode (درجة الحموضة 6.5) وتضاف 100 نانوغرام / مل من البروستاسيكلين (PGI2) لمنع تنشيط الصفائح الدموية.
- جهاز الطرد المركزي عند 1200 × جم لمدة 5 دقائق في RT ، وتخلص من المادة الطافية ، وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت لتيرود (درجة الحموضة 6.5) ، وقم بقياس عدد الصفائح الدموية باستخدام مقياس كثافة الدم.
3. هجرة الصفائح الدموية في الفأر على طلاء cRGD للبيوتين - نيوترافيدين - البيوتين
- استكمل المخزن المؤقت للتيرود المعدل (الرقم الهيدروجيني 7.4) ب 10 × 103 / ميكرولتر من الصفائح الدموية للفأر ، و 1 ملي مولار من CaCl2 ، و 2 ميكرومتر من U46619 ، و 4 ميكرومتر من ملح الصوديوم Adenosine 5′-diphosphate (ADP) ، وقم بإدخال حجم إجمالي قدره 240 ميكرولتر في القنوات المعدة في الخطوة 1.
- سجل هجرة الصفائح الدموية الحية باستخدام مجهر مقلوب مزود بحاضنة مرحلة. بدلا من ذلك ، احتضان القناة لمدة ساعة واحدة عند 37 درجة مئوية في حاضنة.
- قم بإصلاح العينة بنسبة 4٪ بارافورمالدهايد لمدة 10 دقائق في RT واغسلها خمس مرات باستخدام PBS.
- قم باختراق الصفائح الدموية باستخدام Triton-X (0.2٪ في PBS) لمدة 5 دقائق ، واغسلها خمس مرات باستخدام PBS.
- خفف 2.5 ميكرولتر من أليكسا فلور 594 فالويد (40 ضعفا من مخزون الميثانول) في 100 ميكرولتر من PBS. احتضن الصفائح الدموية لمدة 30 دقيقة في الظلام ، ثم اغسلها خمس مرات باستخدام PBS.
- صور الشرائح تحت المجهر الفلوري.
4. القياس الكمي
ملاحظة: تم حساب الصفائح الدموية التي تشكل الصفائح الدموية (نتوءات تشبه الأصابع) أو صفائح الأرجل (نتوءات تشبه الصفائح) على أنها صفائح بلاستيكيةملتصقة 4. تم تعريف الصفائح الدموية التي تبلغ مسافة الهجرة أكثر من قطر واحد على أنها صفائح دموية مهاجرة.
- جزء من الصفائح الدموية المهاجرة: احسب أرقام التصاق الصفائح الدموية أو الترحيل باستخدام أداة Multi Point في فيجي. انقر بزر الماوس الأيمن فوق القائمة المنسدلة لأداة النقطة في شريط الأدوات لتحديد أداة متعددة النقاط . احسب جزء الصفائح الدموية المهاجرة بقسمة عدد الصفائح الدموية المهاجرة على عدد الصفائح الدموية اللاصقة.
- متوسط مسافة الهجرة: استخرج مسافة الهجرة من العينات الثابتة عن طريق قياس طول مسار الهجرة "المطبوع" في طلاء النيوترافيدين FITC باستخدام أداة خط اليد الحرة . انقر بزر الماوس الأيمن على القائمة المنسدلة ل خط مستقيم في شريط الأدوات لتحديد ملف خط اليد الحرة أداة.
- واصفات شكل الصفائح الدموية: قم بإنشاء أقنعة ثنائية عن طريق تقسيم الصفائح الدموية الفلورية (Alexa594-Phalloidin) باستخدام وظيفة العتبة . حدد Image > Adjust > Threshold في شريط الأدوات.
- يمكن الحصول على واصفات الشكل مثل المساحة والمحيط والدائرية ونسبة العرض إلى الارتفاع في تحليل الجسيمات. حدد واصفات الأشكال في تحليل > تعيين القياسات، ثم حدد عرض النتائج في تحليل الجسيمات > تحليلها.
النتائج
تلتصق الصفائح الدموية المنشطة بسهولة وتنتشر على الشرائح المطلية PLL-PEG-biotin-neutravidin-FITC-biotin-cRGD (الشكل 1ج والشكل 2 أ ؛ 0 دقيقة و 5 دقائق) ثم تستقطب لاحقا عن طريق تشكيل صفيحة في الحافة الأمامية (الشكل 2 أ ؛ 10 دقائق). خلال هذه العملية ، انتقلت النواة الكاذبة (المنطقة المظلمة في وسط الصفائح الدموية) من المركز إلى الجزء الخلفي من الصفائح الدموية (الشكل 2 أ). ثم تبدأ الصفائح الدموية المستقطبة في الهجرة دون اتجاه واضح (الشكل 2 أ ؛ 15 دقيقة و 20 دقيقة والشكل 2 ب). لاحظنا أن الصفائح الدموية المهاجرة على طلاءات PLL-PEG-biotin-neutravidin-FITC-biotin-cRGD يمكن أن تكسر رابطة neutravidin-FITC-biotin-PLL-PEG ، كما يتضح من انخفاض شدة التألق على طول مسار الهجرة (الشكل 1ج والشكل 2 أ ، ب). علاوة على ذلك ، يتراكم مركب النيوترافيدين - FITC - البيوتين - cRGD المعطل على سطح الصفائح الدموية (الشكل 2 أ ، ب). تشبه هذه الظاهرة النتائج السابقة حيث قامت الصفائح الدموية المهاجرة بإزالة الفيبرينوجين من الركيزة وتراكمها داخل نظام القناة المفتوحة (OCS)4.
للتحقيق في كيفية تأثير كثافة الترابط على هجرة الصفائح الدموية ، تم تعديل كثافة cRGD عن طريق تغيير نسبة PLL-PEG-biotin إلى PLL-PEG في طبقة الطلاء الأولى. تكشف هذه البيانات أن الصفائح الدموية في الفئران تحقق الهجرة المثلى بتركيز 2.5٪ من PLL-PEG-biotin. يتم تقليل الهجرة عند تركيزات أقل (1٪) وأعلى (10٪) من PLL-PEG-biotin (الشكل 3 أ ، ب). هذه التغييرات المعتمدة على الركيزة في سلوك الهجرة مصحوبة بتغييرات في مورفولوجيا الصفائح الدموية (الشكل 3 ج). عند كثافة الترابط المنخفضة (1٪) ، لا تنتشر الصفائح الدموية بشكل كاف ، كما يتضح من انخفاض مساحة الصفائح الدموية المتوقعة والمحيط (الشكل 3C). يشير هذا إلى عدم كفاية تنشيط الإنتجرين والإشارات الخارجيةإلى الداخل 7. وبالتالي ، فإن الصفائح الدموية غير قادرة على ممارسة قوى على روابط cRGD ، وتفشل في إعادة تشكيل الركيزة ، ولا تهاجر (الشكل 3 أ ، ب).
عند كثافة الترابط المتوسطة (2.5٪) ، هناك زيادة كبيرة في مساحة الصفائح الدموية ومحيطها (الشكل 3C). تنتشر الصفائح الدموية بشكل فعال ، مما يؤدي إلى تعطيل روابط cRGD المتقابلة ميكانيكيا ، وتهاجر (الشكل 3 أ ، ب). ومع ذلك ، عند كثافات الترابط العالية (10٪) ، على الرغم من زيادة الانتشار ، تفشل الصفائح الدموية في الاستقطاب ، ويشار إليها بنسبة العرض إلى الارتفاع المنخفضة (الشكل 3C). في ظل هذه الظروف ، تظل الصفائح الدموية ملتصقة بالركيزة اللاصقة ولا تهاجر لأنها لا تستطيع كسر روابط cRGD المتقابلة (الشكل 3 أ ، ب).
توضح هذه النتائج أن هجرة الصفائح الدموية تعتمد بشكل حاسم على الخصائص اللاصقة للركيزة. لا يمكن أن تهاجر الصفائح الدموية إلا عندما تتفاعل بشكل كاف مع الروابط اللاصقة وتولد في نفس الوقت قوى جر قوية بما يكفي للتغلب على تحمل التوتر للركيزة اللاصقة4،6،7،8.
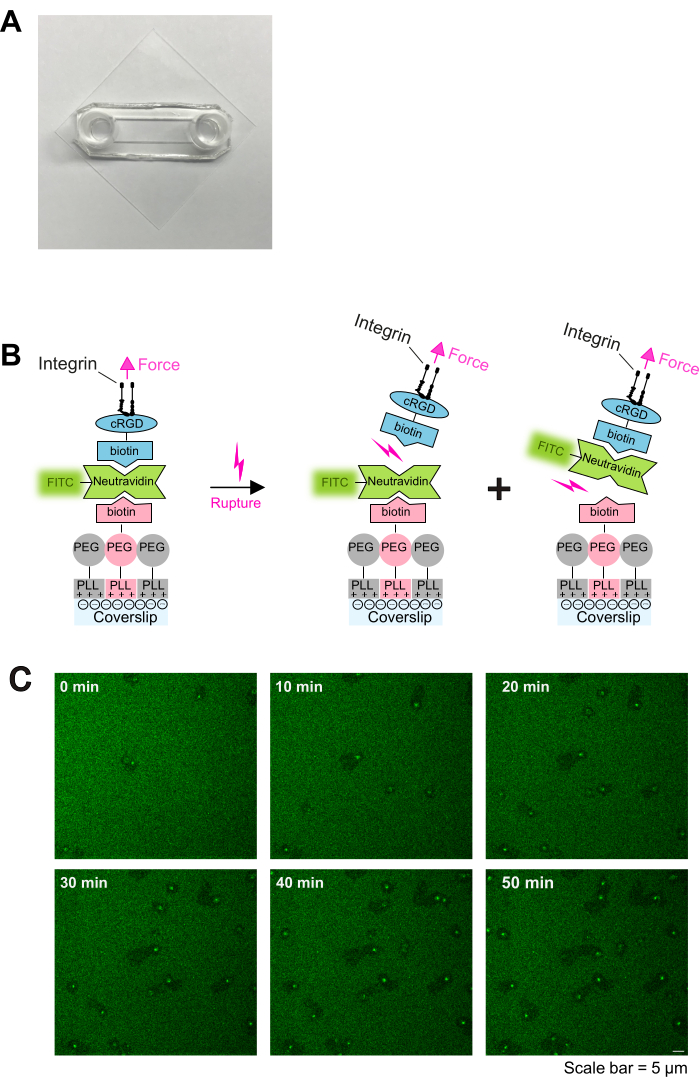
الشكل 1: إجراء الطلاء والتصوير المباشر لتفاعل الصفائح الدموية والركيزة. (أ) صورة للغرفة المجمعة. (ب) مبدأ البروتوكول. اليسار: تخطيطي للطلاء. تم طلاء الأغطية الزجاجية المعالجة بالبلازما بثلاث طبقات. الطبقة الأولى هي خليط PLL-PEG و PLL-PEG-biotin (العمود الفقري PLL-PEG خامل للخلايا ويمنع الارتباط غير المحدد). الطبقة الثانية هي neutravidin-FITC ، والطبقة الثالثة هي البيوتين-cRGD. يربط Neutravidin-FITC بين PLL-PEG-biotin و biotin-cRGD. ترتبط الصفائح الدموية بالبيوتين cRGD عبر الإنتجرينات في غشاء البلازما. على اليمين: رسم توضيحي للبيوتين أفيدين غير المرتبط بإنتجرينات الصفائح الدموية. تمارس الصفائح الدموية قوى على الركيزة من خلال اشتباك الإنتجرين-cRGD وتمزق إما الرابطة العلوية cRGD-biotin - neutravidin-FITC - أو الرابطة السفلية للنيوترافيدين-FITC - PLL-PEG-البيوتين - الرابطة. يؤدي تمزق الرابطة السفلية بين neutravidin-FITC و biotin-PLL-PEG إلى انخفاض إشارة الفلورسنت ، في حين أن تمزق الرابطة العلوية بين البيوتين-cRGD والنيوترافيدين-FITC لا يفعل ذلك. (ج) السلاسل الزمنية التي تظهر هجرة الصفائح الدموية واستنفاد روابط cRGD المتقلبة. تشير مناطق التألق المنخفض إلى مسارات هجرة الصفائح الدموية (انظر أيضا الشكل 2 أ) ، وتشير مناطق التألق المتزايد إلى تراكم FTIC-neutravidin-biotin-cRGD على الصفائح الدموية المهاجرة. شريط المقياس: 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: التصوير المناعي الفلوري لهجرة الصفائح الدموية المشفرة بواسطة الركيزة المعاد تشكيلها. (أ) تسلسل الفيلم التمثيلي لهجرة الصفائح الدموية المفردة. إلى اليسار: صور تباين الطور للصفائح الدموية المهاجرة. تستقطب الصفائح الدموية عن طريق تكوين صفيحة في الحافة الأمامية ثم تهاجر لاحقا. على اليمين: تمت إزالة Neutravidin-FITC من الركيزة ، تاركا "بصمة" هجرة الصفائح الدموية. يتراكم تمزق cRGD-biotin-neutravidin-FITC في مركز الصفائح الدموية المهاجرة. (ب) صور تمثيلية لهجرة الصفائح الدموية على الطلاءات المتحركة cRGD-biotin-avidin المتقلبة. الجزء العلوي: أظهرت الصفائح الدموية الملطخة بالفالودين (Alexa FluorTM 594) تكوينا كبيرا للصفائح وشكل مستقطب يذكرنا بالصفائح الدموية المهاجرة. تؤدي الصفائح الدموية المهاجرة إلى تمزق رابطة cRGD-biotin-neutravidin-FITC ، مما يولد مسارات للهجرة على الركيزة المشار إليها بإشارة FITC المخفضة. أسفل: صورة مقصوصة بتكبير أكبر. (ج) تم رسم مسارات الهجرة يدويا في فيجي بخطوط صفراء. أشرطة المقياس: 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: تحدد نسبة PLL-PEG-biotin إلى PLL-PEG هجرة الصفائح الدموية وشكلها. (أ) صور تمثيلية للصفائح الدموية على طلاءات PLL-PEG-biotin بنسبة 1٪ و 2.5٪ و 10٪ ، شريط المقياس: 5 ميكرومتر. (ب) القياس الكمي للتصاق الصفائح الدموية وكفاءة الهجرة ومسافة الهجرة ، ن = 4 تجارب مستقلة ؛ يعني / SD ؛ طريقة واحدة ANOVA / Tukey. ** ص < 0.01 ؛ ص < 0.001 ؛ ص < 0.0001 ، ns: غير مهم (C) القياس الكمي لواصفات شكل الصفائح الدموية (المساحة ، والمحيط ، والدائرية ، ونسبة العرض إلى الارتفاع) ، ن = 4 تجارب مستقلة ؛ متوسط / الحد الأدنى ماكس ؛ طريقة واحدة ANOVA / Tukey. ** ص < 0.01 ؛ ص < 0.001; ص < 0.0001 ، NS: ليس مهما. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذا البروتوكول ، يتم تقديم إجراء طلاء ثلاثي الطبقات يتكون من (1) العمود الفقري PLL-PEG-biotin و (2) رابط neutravidin-FITC الذي يسهل ارتباط (3) biotin-cRGD (رابط لاصق) بالعمود الفقري PLL-PEG-biotin (انظر أيضا الشكل 1 ب) والذي يسمح بالضبط الدقيق لخصائص الركيزة الميكانيكية واللاصقة عن طريق تغيير نسبة PLL-PEG-biotin إلى PLL-PEG ويوفر قراءة سهلة قائمة على الفلورسنت لهجرة الصفائح الدموية. بينما يستخدم هذا البروتوكول نيوترافيدين مترافق ب FITC والفالودين المترافق Alexa Fluor 594 لتتبع هجرة الصفائح الدموية وشكلها ، يمكن استخدام أفيدين وفالودين مترافق بالفلوروفور. نظرا لأن جميع كواشف الطلاء ، بما في ذلك PLL-PEG و PLL-PEG-biotin و neutravidin-FITC و cRGD-biotin ، بالإضافة إلى منشطات الصفائح الدموية متوفرة تجاريا ، يمكن إجراء هذه التجربة دون بذل الكثير من الجهد الإضافي. الخطوة الحاسمة هي معالجة البلازما لأن العلاج غير الفعال بالبلازما يؤدي إلى عدم كفاية ارتباط البيوتين PLL-PEG / PLL-PEG-بالركيزة ، مما يؤدي إلى فشل التصاق الصفائح الدموية وهجرتها. أداء منظف البلازما مهم. بشكل عام ، تعمل منظفات البلازما المزودة بمولدات 13.6 ميجاهرتز بشكل أفضل من تلك التي تحتوي على 40 كيلو هرتز أو 100 كيلو هرتز. بالإضافة إلى ذلك ، فإن مصدر بلازما الأكسجين أكثر ملاءمة من الهواء المحيط. بعد العلاج الناجح بالبلازما ، فإن خطوات الطلاء تكاد تكون غير عرضة للأخطاء.
لقد ثبت سابقا أن الصفائح الدموية تستخدم وضع الهجرة الوسيط ، والذي يعتمد بشكل كبير على التصاقات الركيزة4،17. على غرار الخلايا الليفية ، تعيق كثافة الترابط المنخفضة الهجرة حيث تكافح الصفائح الدموية للالتصاق بالركيزة ، في حين أن كثافة الترابط العالية تعيق الهجرة عن طريق منع فك ارتباط الالتصاقات الصلبة18 (الشكل 3). عند الكثافة المتوسطة ، تلتصق الصفائح الدموية بينما لا تزال قوى السحب المعتمدة على الميوسين IIA لكل رابطة إنتجرين كافية لكسر الالتصاقات. من الجدير بالذكر أن التقارب العالي بين الإنتجرين αIIbβ3 والفيبرين (الجين) يؤدي إلى تفكيك الالتصاقات ليس من خلال إطلاق الترابط اللاصق ، ولكن بالأحرى من خلال تمزقه أو انفصاله عن الركيزة الأساسية ، مثل الخلايا البطانية في الجسم الحي أو الغطاء في المختبر4،6. تتأثر قوة عدم الربط المطلوبة لفصل الفيبرينوجين عن الركيزة الأساسية بشدة بالخصائص الفيزيائية والكيميائية (الحيوية) التي غالبا ما يصعب التحكم فيها ، مما قد يؤدي إلى تباين كبير في كفاءة الهجرة. يقدم الاختبار الذي تم تقديمه هنا نهجا اختزاليا لمعالجة هذه المشكلة. ومع ذلك ، فإن قوة الكسر لرابطة أفيدين والبيوتين ثابتة عند حوالي 160 pN ، لذلك يجب استخدام مستشعرات التوتر الأكثر تطورا ، مثل تلك القائمة على حبل الحمض النووي مزدوج الشريطة ، لدراسة التصاق الصفائح الدموية في أنظمة القوة المنخفضة19.
وجدت الدراسات السابقة أن هجرة الصفائح الدموية متورطة في العدوى البكتيرية والتهاب الأوعية الدموية في الجسم الحي. وبالتالي ، فإن الصفائح الدموية ذات عيوب الهجرة ، مثل ضعف انقباض الميوسين ، أو بلمرة الأكتين ، أو إشارات الإنتجرين الخارجية ، تظهر ضعف في إزالة البكتيريا وسلامة الأوعية الدموية4،6،7. الاختبار المقدم هنا بسيط ومستقر ، وبالتالي فهو مناسب لفحص المثبطات الجزيئية الصغيرة وتأثيراتها على هجرة الصفائح الدموية. يوفر أداة جديدة في المختبر لاستكشاف الأهداف العلاجية في الالتهاب أو تجلط الدم.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل Deutsche Forschungsgemeinschaft (DFG; مؤسسة البحوث الألمانية) 514478744 و 514477451 إلى F.G. يتم تمويل المشروع من قبل الاتحاد الأوروبي (ERC ، MEKanics ، 101078110). الآراء والآراء المعبر عنها هي آراء المؤلف (المؤلفين) فقط ولا تعكس بالضرورة آراء الاتحاد الأوروبي أو الوكالة التنفيذية لمجلس البحوث الأوروبي. لا يمكن تحميل الاتحاد الأوروبي ولا السلطة المانحة المسؤولية عنها.
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
References
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778 (2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018 (2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537 (1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved