A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القوارض الوريد السفلي الأجوف بالون الوريد نموذج
In This Article
Summary
يقدم البروتوكول نموذجا للقوارض للبقاء على قيد الحياة لاختبار تدخلات بالون رأب الوريد (VB) في الأوردة العميقة غير الخثارية والخثارية وما بعد التخثر.
Abstract
رأب الوريد بالبالون هو تقنية سريرية شائعة الاستخدام لعلاج تضيق الوريد العميق وانسداده نتيجة للصدمة أو التشوهات التشريحية الخلقية أو تجلط الأوردة العميقة الحاد (DVT) أو الدعامات. يتميز الانسداد الوريدي العميق المزمن من الناحية النسيجية بالجلطة أو التليف أو كليهما. حاليا ، لا يوجد علاج مباشر متاح لاستهداف هذه العمليات المرضية. لذلك ، من الضروري وجود نموذج حيواني موثوق به في الجسم الحي لاختبار التدخلات الجديدة. يسمح نموذج بالون رأب الوريد السفلي لبقاء القوارض (IVC) (VBM) بدراسة رأب الوريد بالبالون في الحالات غير الخثارية وما بعد الجلطة عبر نقاط زمنية متعددة. يمكن قياس التأثير الموضعي والنظامي لبالونات رأب الوريد المغلفة وغير المطلية عن طريق فحوصات الأنسجة والجلطة والدم مثل تفاعل البوليميراز المتسلسل في الوقت الفعلي (RT-PCR) ، واللطخة الغربية ، ومقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) ، والتصوير الزيموي ، وجدار الوريد والتحليل الخلوي للخثرة ، وفحوصات الدم الكامل والبلازما ، والتحليل النسيجي. إن VBM قابل للتكرار ، ويكرر التدخلات البشرية الجراحية ، ويمكنه تحديد تغيرات بروتين الجلطات الدموية في جدار الوريد المحلي ، ويسمح بإجراء تحليلات متعددة من نفس العينة ، مما يقلل من عدد المطلوبة لكل مجموعة.
Introduction
انسداد الوريد العميق من الجلطات الدموية التي لم يتم حلها هي نتيجة شائعة لتجلط الأوردة العميقة (DVT) وهي أحد أسباب متلازمة ما بعد التخثر (PTS) ، والتي تكلف مليارات الدولارات في الرعاية الصحية وتؤثر بشكل كبير على نوعية الحياة1،2،3. PTS هو مرض التهابي فريد من نوعه مع تليف جدار الوريد4 الذي لم يتم التقاطه بالكامل في نماذج DVT الحيوانية الصغيرة5،6،7 ، والأهم من ذلك ، لا يمكن للنماذج السابقة تقييم الاستجابة للتدخلات العلاجية. غالبا ما يتم علاج العوائق الوريدية الخثارية عن طريق الدعامات ورأب الوريد بالبالون 8,9 ؛ يعوق هذه التدخلات ارتفاع معدل إعادة التدخل بسبب عودة التضيق والانسداد10،11،12.
على الرغم من توفر البالونات المغلفة بالأدوية لمعالجة تضيق / انسداد الشرايين ، لا يوجد أي منها للأوردة العميقة. الآلية الجزيئية وراء عودة التضيق غير مفهومة بشكل جيد في الأوردة وليس لها علاج مباشر4. لذلك ، هدفنا هو تقديم نموذج حيواني يمكنه اختبار العلاجات المقدمة محليا عبر بالونات رأب الوريد التي تحاكي انسداد الوريد العميق بعد الخثار. يعيد هذا النموذج إنتاج حالة ما بعد التخثر ويقيم كيفية تأثير الأنواع المختلفة من بالونات رأب الوريد على جدار الوريد في الجسم الحي.
Protocol
يتبع البروتوكول التالي سياسات وإرشادات اللجنة المؤسسية لرعاية واستخدام (IACUC) بجامعة ميشيغان (UMICH) ، ومبادئ الحكومة الأمريكية لاستخدام ورعاية الفقارية المستخدمة في الاختبار والبحث والتدريب ، وإرشادات REACH 2.0. تتوافق اتفاقية ضمان رعاية UMICH مع OLAW و USDA وهي معتمدة بالكامل من قبل AAALAC International. تمت الموافقة على هذا البروتوكول برقم الهوية PRO00010841. تم استخدام ذكور فئران Sprague Dawley المهجنة من مختبرات Charles River ، والتي تزن 450 جم وعمر 15 أسبوعا.
1. تخدير الفئران
- أخرج من قفصها وضعها في غرفة غاز تحريض مخدر قبل الجراحة بنسبة 5٪ إيزوفلوران و 100٪ أكسجين بمعدل تدفق من 0.8 إلى 1 لتر / دقيقة (يتم التحكم فيه بواسطة المرذاذ) للحث على التخدير العام.
- الفئران المهدئة في غرفة تحريض التخدير ، وإزالتها من الغرفة ، ووزنها ، وتليين عيونهم مع مرهم العيون المعقم ، ثم وضعها في راقد الظهرية على جهاز تسخين يدور الماء الدافئ. تأكد من عمق التخدير الكافي باستخدام منعكس الدواسة (قرصة إصبع القدم الثابتة).
- حلق البطن البطني مع كليبرز الكهربائية. الحفاظ على التخدير العام عند 2.5٪ إيزوفلوران و 100٪ أكسجين عند 0.8 إلى 1 لتر / دقيقة مع دائرة غير قابلة لإعادة التنفس من خلال مخروط الأنف.
2. مسح الفئران بالموجات فوق الصوتية
- مراقبة التقييمات الفسيولوجية ، بما في ذلك معدل التنفس ومعدل ضربات القلب ودرجة الحرارة أثناء التصوير.
- لتصوير البطن للوريد الأجوف السفلي (IVC) ، ضع الجل الموصل وقم بتوجيه محول الطاقة في وضع عرضي. أثناء الضبط المسبق للأوعية الدموية المحيطية ، استخدم وضع التصوير ثنائي الأبعاد أو الوضع B ، وقم بخفض المسبار الخطي (10 ميجاهرتز) في وسط البطن ، واضبط العمق مع الضغط حتى تظهر الأوعية البطنية.
- قم بتمييز IVC عن الشريان الأورطي البطني من خلال تقييم الانضغاطية وتقييم التدفق باستخدام كل من وضع دوبلر الملون والموجة النبضية مع مسبار خطي عالي التردد (10 ميجا هرتز).
- عند تطبيق الضغط باستخدام مسبار الموجات فوق الصوتية ، قم بالتفريق بين الاثنين لأن IVC قابل للانضغاط ، بينما يحافظ الشريان الأورطي على شكله وسالكه.
- تقييم اتجاه وسرعة تدفق الدم باستخدام كل من دوبلر اللون والموجة النبضية. تمثل نافذة دوبلر الملونة التدفق نحو المسبار باللون الأحمر وتتدفق بعيدا عن المسبار باللون الأزرق. قم بتبديل الجهاز إلى وضع دوبلر بموجة النبض (وضع الازدواج) لتقييم اتجاه تدفق الدم وسرعته بمرور الوقت. احصل على صور التدفق الضرورية باستخدام أداة التقاط الصور الآلية لجهاز الموجات فوق الصوتية (قد تختلف المواصفات الدقيقة للحصول على الصور بين أنظمة الموجات فوق الصوتية).
- استخدم طريقة التقييم التالية: الشريان الأورطي لديه تدفق الدم نحو المسبار وشكل موجي ثلاثي ، في حين أن IVC لديه تدفق تلقائي بعيدا عن المسبار بسعة أقل بكثير.
- إذا أظهر IVC القريب شكلا موجيا طبيعيا ، ومع ذلك تم اكتشاف شكل موجي غير طوري أو غائب (مسطح) بعيدا ، فاستكشف إمكانية وجود انسداد وريدي بين نقاط الفحص هذه.
- بمجرد تحديد موقع IVC ، حدد القسم الأوسط ، الذي يقع في الجزء الثالث الأوسط ، أدنى من الأوردة الكلوية ومتفوقا على تشعب IVC ، على الأرجح حيث توجد الأوردة القطنية.
- قم بقياس قطر الجدار إلى الجدار في المنظر العرضي في منتصف القسم IVC باستخدام صورة وضع B المستعرضة ، وتسجيل أوسع قطر للوعاء. قد يختلف الحصول على التصوير في أجهزة الموجات فوق الصوتية المختلفة. تخزين البيانات باستخدام الأقراص المضغوطة (CDs) في ملفات DICOM.
3. الجراحة المجهرية للفئران والتعافي
- نظف البطن باستخدام مقشر الكلورهيكسيدين المنقوع بالشاش ومحلول الكلورهيكسيدين 3x لضمان حالة جراحية معقمة.
- ضع فيلم التشبث المعقم كغلاف جراحي لتغطية صدر الفئران ومنطقة البطن ومقابض المجهر (التكبير والتركيز) والعدسة.
- قم بعمل شق خط الوسط البطني (3 سم) حوالي 2 سم تحت عملية الخنجري بمقص القزحية عبر الجلد وجدار البطن ، مما يؤدي إلى كشف محتويات البطن. استخدم شاشا معقما منقوعا بالمحلول الملحي مقاس 2 بوصة × 2 بوصة ليعكس الأمعاء إلى الجانب الأيمن للحيوان.
- للتعرض ل IVC ، قم بإجراء تشريح حاد باستخدام قضيب معقم برأس قطني. ضع منظارا سلكيا في الشق ، مما يسمح بتصور IVC.
- قم بكي جميع فروع IVC القطنية باستخدام كي طرف ناعم بدرجة حرارة منخفضة ، من الأوردة الكلوية إلى التشعب الحرقفي ، وربط الفروع الجانبية بخيوط البولي بروبيلين 7-0 غير قابلة للامتصاص.
- ضع مشبكا دقيقا للأوعية الدموية المنحنية القريبة على IVC ، والذي يتم فصله عن الشريان الأورطي ويكون أدنى من الأوردة الكلوية. ضع مشبكا صغيرا مستقيما على IVC البعيد ، والذي يتم فصله عن الشريان الأورطي وأعلى من تشعب IVC.
- ضع 8-0 النايلون U خياطة الذيلية إلى الوريد الكلوي الأيسر المتمركز على السطح الأمامي لل IVC.
- أدخل سلك توجيه شحذ 0.014 مم مع تحميل بالون رأب الوريد ، إلى الوراء لتدفق الدم إلى IVC تحت الكلوي ، ذيلية إلى المشبك الصغير المنحني.
- دفع البالون إلى منتصف IVC باستخدام تقنية Seldinger. قم بإزالة سلك التوجيه الحاد ونفخ بالون رأب الوريد لمدة 3 دقائق باستخدام تمدد IVC بنسبة 10٪ إلى 15٪ باستخدام حقنة نفخ سعة 20 مل لتوليد ضغط إيجابي على نطاق من 0-30 ضغط جوي. اغسل جميع الأنظمة بمحلول ملحي معقم قبل إزالة IVC لتجنب انسداد الهواء.
ملاحظة: سيخضع IVC مقاس 2.8 مم لعملية رأب الوريد إلى 3.22 مم (تمدد زائد بنسبة 15٪). يتم تحديد ضغط النفخ المطلوب للوصول إلى التمدد الزائد المطلوب من خلال خصائص البالون وهو متاح على عبوة الشركة المصنعة. - شد غرزة U عند انكماش بالون تجميل الوريد وإزالته. قم بإزالة المشابك الصغيرة.
- أغلق موقع فتح البطن بطريقة من طبقتين. استخدم خياطة اصطناعية قابلة للامتصاص 5-0 بولي جلاكتين بنمط مستمر لإغلاق كل من جدار البطن والجلد.
- تطبيق معلق حقن ممتد المفعول بالبوبرينورفين، 0.65 ملغم/كغ تحت الجلد بعد الجراحة كمسكن للفئران لأنه لا يتداخل مع ألواح المؤشرات الحيوية للجزيئات الالتهابية لتحليل البروتين.
- استعادة الفئران في قفص فردي ، ومراقبة ما بعد الجراحة (30 دقيقة) تحت مصباح التدفئة (الحد الأدنى للمسافة - 24 بوصة بعيدا عن القفص) ، ثم العودة إلى وحداتهم السكنية الأصلية.
- بالنسبة للحيوانات الوهمية من كل مجموعة تجريبية ، قم بإجراء التشريح فقط ، دون ربط فروع IVC ، والكي ، والقنية.
- لحالات ما بعد التخثر ، ضع مشبكا صغيرا للأوعية الدموية المستقيمة القريبة على IVC ، والذي يتم فصله عن الشريان الأورطي ، وهو أدنى من الأوردة الكلوية ، لمدة 24 ساعة. استخدم نفس تقنيات التشريح والإغلاق.
- تحقق من علامات الموجات فوق الصوتية لانسداد IVC ، والتي تشمل تصور مقطع IVC ، وتأكيد IVC البعيد بدون تدفق ، والأوردة الحرقفية الشائعة المنتفخة. يمكن تخصيص النقاط الزمنية للمتابعة لتناسب مواصفات الدراسة.
- لمراقبة التغيرات الفسيولوجية التي يتم نمذجتها ، حدد نقاطا زمنية في أول 72 ساعة لتشكيل الجلطات الدموية المبكرة ومن 3 إلى 7 أيام بعد الإجراء لحل الجلطات الدموية لاحقا. تشمل النقاط الزمنية اللاحقة التي تم اختبارها في هذا النموذج من 7 إلى 28 يوما 5,13.
- استخدم التقنيات الواردة في الخطوات 3.5-3.9 لرأب الوريد بالبالون بعد التخثر مع المحاذير التالية: قد تكون هناك حاجة إلى ضغط نفخ أعلى لتحقيق التمدد الزائد المطلوب لأن قطر IVC يزداد في ظروف ما بعد التخثر.
- إجراء القتل الرحيم بموجب التوصيات المنصوص عليها في المبادئ التوجيهية الحالية للجمعية الطبية البيطرية الأمريكية بشأن القتل الرحيم للقوارض عن طريق إجراء طريقتين تأكيديتين (إزالة الدم وإزالة الأعضاء الحيوية) لضمان عدم إحياء.
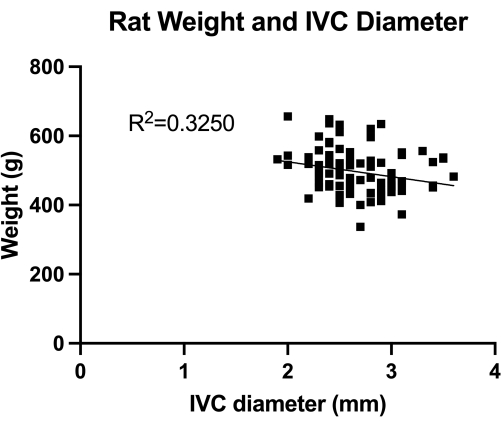
الشكل 1: توزيع المقاييس المزدوجة عبر البطن لقطر IVC المستعرض (القسم تحت الكاتري). تم القياس حسب وزن. لم يتم العثور على ارتباط كبير بين الوزن وقطر IVC. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إعداد عينة
- إجراء نقل الأنسجة التأكيدي لبالونات رأب الوريد المغلفة بالأدوية باستخدام تقنية مقايسة كروماتوغرافيا سائلة عالية الأداء (HPLC).
- تشريح IVC والشريان الأورطي وإزالة en bloc لتضمين البارافين الثابت بالفورمالين والتحليل النسيجي.
- لتحليل البروتين، استخدم محلول RIPA بتركيز مخفف قدره 60000 ميكروغرام/غرام من العينة، وقم بمعالجته باستخدام خالط الأنسجة في إعدادات غرفة ذات درجة حرارة منخفضة عند 4 درجات مئوية، ثم قم بتخزينه عند -80 درجة مئوية بعد المعالجة.
النتائج
VBM هو نموذج يقيم تأثير بالونات رأب الوريد في السيطرة الكاملة على الإرقاء. أولا ، قمنا بتحديد قطر IVC (القسم الأوسط تحت الأرضي) ، كما هو موضح في الشكل 1 ، لتحديد حجم البالون الصحيح. ثانيا ، يتم توضيح تقنية الجراحة المجهرية المطورة خطوة بخطوة في الشكل 2 ، ونعرض أيض...
Discussion
يمكن إجراء VBM على الفئران ≥ 250 جم باستخدام بالونات في نطاق 2.5-3.5 ملم. بالنسبة للفئران التي تزيد عن 750 جراما ، فإن هذه التقنية محدودة بكمية أكبر من الأنسجة الدهنية في تجويف البطن وحجم العضو بدلا من التغيرات في قطر IVC. من تجربتنا ، وجدنا أن هناك حاجة إلى 10 أو أكثر لكل مجموعة للحصول على دلالة إحصائ...
Disclosures
ولم يعلن عن أي تضارب في المصالح.
Acknowledgements
هذه الدراسة مدعومة من قبل منحة أبحاث العلوم الأساسية للمنتدى الوريدي الأمريكي (AVF) لعام 2023 و Surmodics، Inc.
Materials
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
References
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved