A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير بالرنين المغناطيسي للرئة 129Xe مفرط الاستقطاب والتحليل الطيفي في الفئران ذات التهوية الميكانيكية
In This Article
Summary
يمكن للتصوير بالرنين المغناطيسي للزينون مفرط الاستقطاب تحديد البنية المجهرية الإقليمية للرئة (أبعاد الهواء والفضاء) وعلم وظائف الأعضاء (التهوية وتبادل الغازات) في البحوث الانتقالية والرعاية السريرية. على الرغم من أنه يمثل تحديا ، إلا أنه يمكن أن يوفر رؤى رئوية مماثلة في الدراسات قبل السريرية. يصف هذا البروتوكول البنية التحتية والإجراءات اللازمة لإجراء التصوير بالرنين المغناطيسي الرئوي الروتيني للزينون في الفئران.
Abstract
زينون فرط الاستقطاب (HP) 129 (129Xe) هو عامل تباين للتصوير بالرنين المغناطيسي المستنشق (MRI) ذو خصائص طيفية وفيزيائية فريدة يمكن استغلالها لتحديد فسيولوجيا الرئة ، بما في ذلك التهوية والانتشار المقيد (حجم الفضاء الجوي السنخي) وتبادل الغازات. في البشر ، تم استخدامه لتقييم شدة المرض وتطوره في مجموعة متنوعة من الاضطرابات الرئوية وتمت الموافقة عليه للاستخدام السريري في الولايات المتحدة والمملكة المتحدة. بالإضافة إلى تطبيقاته السريرية ، فإن قدرة 129Xe MRI على تقييم الفيزيولوجيا المرضية الرئوية بشكل غير جراحي وتوفير المعلومات التي تم حلها مكانيا هي قيمة للبحث قبل السريري. من بين النماذج الحيوانية ، تعد الفئران هي الأكثر استخداما بسبب إمكانية الوصول إلى نماذج الأمراض المعدلة وراثيا. هنا ، يعد التصوير بالرنين المغناطيسي 129Xe واعدا كتقنية طفيفة التوغل وخالية من الإشعاع وحساسة لمراقبة تطور مرض الرئة طوليا والاستجابة للعلاج (على سبيل المثال ، في اكتشاف الأدوية). يمكن أن تمتد هذه التقنية إلى التطبيقات قبل السريرية من خلال دمج جهاز التنفس الحر الذي يتم تشغيله بالرنين المغناطيسي أو جهاز التنفس الصناعي لتوصيل الغاز. هنا ، نصف الخطوات ونقدم قوائم مرجعية لضمان جمع البيانات وتحليلها بشكل قوي ، بما في ذلك إنشاء شبح غاز زينون مستقطب حراريا لمراقبة الجودة ، وتحسين الاستقطاب ، والتعامل مع (التخدير ، والتنبيب ، والتهوية ، ورعاية الفئران) ، وبروتوكولات التهوية ، والانتشار المقيد ، وبيانات تبادل الغازات. بينما يمكن تطبيق التصوير بالرنين المغناطيسي قبل السريري 129Xe في نماذج حيوانية مختلفة (مثل الفئران والخنازير والأغنام) ، يركز هذا البروتوكول على الفئران بسبب التحديات التي يفرضها تشريحها الصغير ، والتي تتوازن مع قدرتها على تحمل التكاليف وتوافر العديد من نماذج الأمراض.
Introduction
في حين أن الاضطرابات الرئوية لا تزال الأسباب الرئيسية للمراضة والوفيات العالمية1 ، فقد شهد العقد الماضي تحسنا كبيرا في نتائج المرضى. هذه التحسينات مدفوعة جزئيا بعاملين. أولا ، تعطي المرحلة الثالثة من التجارب السريرية الآن الأولوية للتغييرات في وظائف الرئة كنقاط نهاية بدلا من الوفيات ، مما يؤدي إلى تسريع تجارب الأدوية2،3،4،5. ثانيا ، قدمت التطورات في النماذج الحيوانية المحسنة رؤى حول آليات المرض وساعدت في تطوير العلاج6،7. غالبا ما تفضل نماذج الفئران للأبحاث الانتقالية لأنها توفر أوجه تشابه فسيولوجية مع البشر ، والقدرة على تحمل التكاليف ، والتطور السريع للمرض. وسعت الهندسة الوراثية نطاق وجودة النماذج المتاحة ، حيث يضم المورد الدولي لسلالة الفئران الآن أكثر من 32,000 سلالة فأر8 ، مقارنة ب 4,218 سلالة فقط من الفئران (قاعدة بيانات جينوم الفئران9). فتحت هذه النماذج طرقا جديدة للتحقيق في الدوافع الميكانيكية واستجابات العلاج لمجموعة من أمراض الرئة ، بما في ذلك مرض الانسداد الرئوي المزمن (COPD) 10 ، والتليف الكيسي (CF) 11 ، والتليف الرئوي12،13 ، وارتفاع ضغط الدم الرئوي14،15 ، والربو16.
لسوء الحظ ، فإن أبحاث الرئة التي تشمل الفئران محدودة بالتقنيات المتاحة لتحديد عبء المرض. غالبا ما تعتمد الدراسات على الإجراءات النهائية التي 1) توفر معلومات الرئة الكاملة (المقايسات الكيميائية الحيوية) أو المعلومات الموضعية (الأنسجة) و 2) تتطلب تصميمات مقطعية وأحجام عينات كبيرة. وبالتالي ، فإنها لا تلتقط ديناميكيات المرض المكانية أو الزمنية. في المقابل ، يمكن للتصوير ثلاثي الأبعاد غير الجراحي تقييم البنية والعمليات الجزيئية والوظيفة في الرئتين بمرور الوقت.
يمكن تصور بنية الرئة (على سبيل المثال ، تشوهات مجرى الهواء والتليف الخلالي) باستخدام التصوير بالرنين المغناطيسي لوقت الصدى القصير للغاية (UTE) والتصوير المقطعي المحوسب الدقيق (μCT) بدقة عالية. يمكن الحصول على المعلومات الوظيفية والميكانيكية (على سبيل المثال ، التهوية ، والتروية ، واستقلاب الورم ، والعمليات الالتهابية) باستخدام عوامل التباين الخارجية (على سبيل المثال ، التصوير المقطعي المحوسب المعزز بالزينون والالتهابات المسوبة المعززة بالأكسجين) وأساليب الطب النووي المؤين (على سبيل المثال ، التصوير المقطعي بالإصدار البوزيتروني [PET] ، والتصوير المقطعي المحوسب بإصدار فوتون واحد [SPECT]). ومع ذلك ، فإن التصوير الوظيفي يمثل تحديا بسبب التباين المتواضع مع الضوضاء (خاصة بالنسبة للرطوبة المعززة بالأكسجين في شدة المجال المغناطيسي العالية المستخدمة في التصوير بالرنين المغناطيسي قبل السريري ، حيث يتم إطالة T1 ) المتاحة دون استخدام طرائق مؤينة بمستويات إشعاع أعلى من المعتاد. في حين أن التصوير بهذه الطرائق جيد التحمل في النماذج الحيوانية باستخدام الجرعات التقليدية ، فإن الإشعاع التراكمي قد يربك النتائج في الدراسات التي أجريت على علم المناعة والالتهاب وسرطان الرئة17. ومع ذلك ، فإن التصوير بالرنين المغناطيسي (MRI) زينون 129 (129Xe) مفرط الاستقطاب (HP) يوفر معلومات هيكلية ووظيفية طفيفة التوغل وغير قابلة للإشعاع وحساسة للغاية. في حين تم استخدام هذه التقنية في الأبحاث قبل السريرية لتوصيف الحالات بما في ذلك انتفاخ الرئة18،19 ، والتليف20 ، وسرطان الرئة21 ، ومرض الانسداد الرئويالمزمن 22 ، وإصابة الرئة الناجمة عن الإشعاع23 في نقاط زمنية واحدة أو متعددة ، إلا أنها لا تزال غير مستغلة بشكل كاف في بيئة ما قبل السريرية.
لتمكين التصوير بالرنين المغناطيسي 129Xe الروتيني قبل السريري ، هناك حاجة إلى العديد من المتطلبات الأساسية ، بما في ذلك الدعم التنظيمي المؤسسي ، وجهاز الاستقطاب المفرط ، وملف الترددات الراديوية (RF) 129Xe ، وماسح ضوئي متعدد النواة. على الرغم من أن التطبيقات المتقدمة24،25،26،27،28،29،30،31،32،33 تتطلب برمجة نبضية خاصة بالبائع خارج نطاق هذا البروتوكول ، يمكن تحقيق التطبيقات الأساسية من خلال تعديلات متواضعة على البرامج. لذلك ، نركز على مراقبة الجودة ، ومعالجة المغنطة ، وجمع البيانات ، وإجراءات التعامل مع - بما في ذلك التهوية الميكانيكية - الفريدة من نوعها في التصوير بالرنين المغناطيسي قبل السريري 129Xe (الشكل 1).
حتى الآن ، استخدم تصوير الصغيرة 129Xe ثلاثة طرق لتوصيل الغاز الآمن للتصوير بالرنين المغناطيسي ، ولكل منها مزايا وعيوب: التنفس الحر ، والمدفوع بالمكبس ، وانخفاض الضغط. يسمح التنفس الحر بالاستنشاق التلقائي دون التعرض لخطر الإصابة من التنبيب أو فغر القصبة الهوائية ولكنه يستهلك المزيد من غاز HP بشكل ملحوظ ويمكن أن يقدم قطع أثرية للحركة34،35. الأجهزة التجارية التي تعمل بالمكبس ذاتية المعايرة وسهلة الاستخدام خارج الصندوق ولكنها قد تكون باهظة الثمن36. تم وصف النهج القائم على انخفاض الضغط المستخدم هنا جيدا في الأدبيات ، المعيارية ، والقابلة للتخصيص ، ويتم تشغيلها بواسطة رمز مفتوح المصدر37،38،39،40. علاوة على ذلك ، فهي فعالة من حيث التكلفة ، وعادة ما يبلغ مجموعها أقل من 10 آلاف دولار وبضعة أسابيع من وقت البناء المخصص. يوفر جهاز التنفس الصناعي بالضغط 129Xe من كيس جرعة داخل علبة مضغوطة أثناء مراقبة ضغط مجرى الهواء للفأر التنبيب.
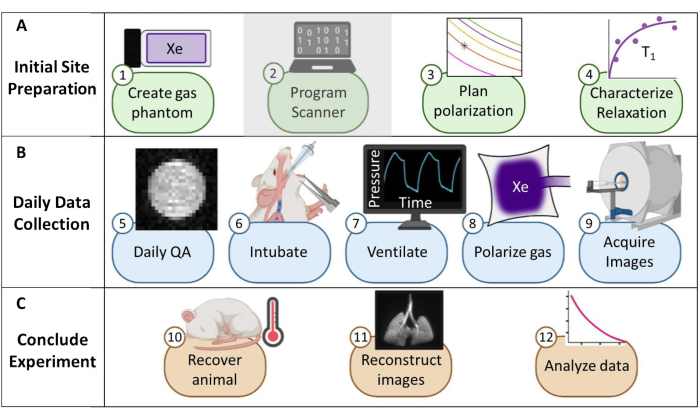
الشكل 1: نظرة عامة على بروتوكول جمع التصوير بالرنين المغناطيسي الروتيني xenon-129 (129Xe) في الفئران. (أ) خطوات الإعداد الأولي. (ملاحظة: برمجة الماسح الضوئي فريدة لكل مورد وغير موصوفة في هذا البروتوكول). (ب) خطوات لجمع البيانات اليومية عن ضمان الجودة. (ج) خطوات النجاح في الانتهاء من التجربة وتحليل البيانات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
هنا ، نقوم بجمع وتحليل الفئات الثلاث الشائعة ل 129بيانات التصوير بالرنين المغناطيسي Xe: التهوية ، والتصوير المرجح بالانتشار (حجم المجال الجوي السنخي) ، وتبادل الغازات. تصور صور التهوية توزيع غاز 129Xe المستنشق. تظهر مناطق الرئتين ذات تدفق الهواء المنخفض مظلمة في صور غاز HP ، ويتم قياس علم الأمراض من خلال حجم التهوية المعيبة. في البشر ، أظهرت نسبة عيب التهوية (VDP) قابلية تكرار قوية41،42 وحساسية عالية لانسداد الرئة في أمراض مثل مرض الانسداد الرئويالمزمن 43،44،45 والربو46،47.
يمكن قياس الانتشار المقيد لذرات Xe البالغ عددها 129في المجال الجوي عبر معامل الانتشار الظاهري (ADC) ويعمل كبديل لحجم الفضاء الجوي. يتم حساب ADC عن طريق الحصول على صورة أساسية (b0) بدون ترجيح الانتشار وصورة واحدة أو أكثر تم الحصول عليها في وجود ترجيح الانتشار الناجم عن التدرج ثنائي القطب (bN). يعكس ADC المرتفع زيادة في حجم المجال الجوي بسبب الشيخوخة أو إعادة تشكيل انتفاخالرئة 18،48. علاوة على ذلك ، يسمح استخدام صور متعددة ذات قيمة b (≥4) بحساب معلومات مورفومترية أكثر تفصيلا (على سبيل المثال ، متوسط الاعتراض الخطي)49،50.
يمكن وصف تبادل الغازات بسبب 1) قابلية ذوبان 129Xe في أنسجة الغشاء الشعري والبلازما وكرات الدم الحمراء (خلايا الدم الحمراء) و 2) التحول الكيميائي >200 جزء في المليون في الحقل السفلي ل 129Xe عند إذابته في هذه المقصورات. توفر كل من البيانات الطيفية والتصوير نظرة ثاقبة للأمراض القلبية الرئوية (على سبيل المثال ، ارتفاع ضغط الدم الرئوي وفشل القلب الأيسر51،52،53). في حين أن العديد من الأنواع (البشر والأنياب والجرذان) تعرض قمما طيفية فريدة تنشأ من كل حجرة ، فإن الفئران تفتقر إلى إشارة كرات الدم الحمراء الفريدة بسبب الاختلافات في تفاعلات موقع ربط الهيموجلوبين والزينون. بدلا من ذلك ، يتم دمج جميع المكونات الذائبة في إشارة واحدة في الفئران54. ومع ذلك ، من الممكن ملاحظة رنين صبغي الدم الحمراء المميز في الفئران المعدلة وراثيا التي تعبر عن الهيموجلوبين البشري ، مثل تلك المستخدمة في نماذج مرض فقر الدم المنجلي54. بشكل عام ، يوفر التحليل الطيفي والتصوير المذاب 129Xe رؤى فريدة حول الفيزيولوجيا المرضية القلبية الرئوية في الفئران55،56.
قبل محاولة هذا البروتوكول ، من الضروري فهم المعلومات الأساسية حول ماسح التصوير بالرنين المغناطيسي والتهوية الميكانيكية وتقنيات التعامل مع الفأر المطلوبة لدراسات الفئران. قبل الشروع في الدراسات على ، يجب الموافقة على جميع الإجراءات من قبل اللجنة المؤسسية المحلية لرعاية واستخدامه (IACUC) 57. نظرا لأن إجمالي العزم المغناطيسي المتاح في رئة الفأر منخفض جوهريا (أي حجم المد والجزر ~ 250 ميكرولتر) ، يجب أن يكون حجم الفوكسل أصغر بمقدار 1000 مرة مما هو عليه في البشر لتحقيق دقة مكافئة تشريحيا. معدل تنفس الفئران سريع للغاية (>100 نفس / دقيقة). على هذا النحو ، فإن إجراءات حبس النفس الفردي المستخدمة عادة للتصوير البشري غير مجدية. بدلا من ذلك ، يمكن تطبيق عدد قليل فقط من إثارة الترددات اللاسلكية في كل نفس ، لذلك يجب ترميز 129صورة Xe على عشرات إلى مئات الأنفاس. قد تكون هناك حاجة إلى برمجة النبضات للسماح بالتشغيل الخارجي للعمليات الاستحواذ وتكرار الشرائح بشكل صحيح ، وترميز الطور ، و / أو الصور المرجحة بالانتشار مع موازنة نسبة الإشارة إلى الضوضاء (SNR) والدقة ومدة المسح. هنا ، يقوم جهاز التنفس الصناعي بإخراج نبضة منطق الترانزستور والترانزستور (TTL) مرة واحدة لكل نفس لتحفيز الحصول على البيانات (الشكل 2).
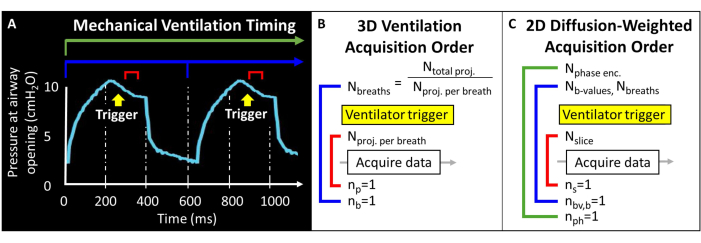
الشكل 2: التهوية الميكانيكية التمثيلية وتوقيت الحصول على البيانات. (أ) يمكن أن تؤدي التهوية التي يتحكم فيها المستخدم إلى الحصول على البيانات عند الإلهام النهائي أو أثناء حبس التنفس أو عند انتهاء الصلاحية. (ب) بالنسبة لتسلسل التهوية الشعاعية ثلاثية الأبعاد هذا ، يحدد المستخدم العدد الإجمالي للإسقاطات المكتسبة وعدد الإسقاطات لكل نفس. (ج) بالنسبة للصورة الانتقائية للشريحة ، ثنائية الأبعاد مرجحة بالانتشار ، يحدد المستخدم ترتيب الشرائح وصور b-value وترميز الطور. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
لتمكين التهوية الموثوقة والولادة 129Xe ، يلزم إجراء التخدير والتنبيب القوية. لكل دراسة ، يجب مراعاة التأثيرات النهائية لكل مخدر - بما في ذلك التغييرات في التهوية الدقيقة ومعدل ضربات القلب (HR) وضغط الدم58،59،60،61،62،63،64،65،66. بينما تم استخدام مجموعة متنوعة من المهدئات للتصوير بالرنين المغناطيسي لغاز HP قبل السريري ، فإننا نستخدم مزيجا من الكيتامين والزيلازين والأسيبرومازين ، نظرا لتوفره وفعاليته من حيث التكلفة وموثوقيته ومدته67،68. بمجرد التخدير ، يجب تنبيب من أجل التهوية الميكانيكية الفعالة. يصعب تنبيب الفئران بسبب صغر حجم تشريحها ، وبالتالي ، من المهم التدريب الشامل على هذه التقنية. نحن نشجع المحققين على مراجعة بروتوكولات الفيديو المنشورة69،70. نظرا لأن معظم قنيات التنبيب التجارية تحتوي على الفولاذ المقاوم للصدأ ، فإننا نقدم تقنية لصنع قنيات خالية من المعادن (أي متوافقة مع التصوير بالرنين المغناطيسي وغاز HP) ، على شكل إسفين يمكن تخصيصها لتتناسب مع قطر مجرى الهواء لإنشاء ختم محكم مع جدار القصبة الهوائية بالفأر.
نظرا لأنه يتم جمع 129صورة Xe على مدى العديد من الأنفاس ، فإن إعدادات جهاز التنفس الصناعي أمر بالغ الأهمية. يجب النظر بعناية في استراتيجيات التهوية الوقائية لمنع إصابة الرئة71،72،73،74. على وجه الخصوص ، يقلل استخدام حجم المد والجزر المنخفض (TV) ، وضغط الزفير الإيجابي المعتدل (PEEP) ، ومناورات التجنيد السنخية (RMs) من خطر إصابة الرئة التي يسببها جهاز التنفس الصناعي في المرضى من البشر والنماذج الحيوانية75،76،77،78،79،80،81. هنا ، نوصي بتقنية بسيطة متوافقة مع التهوية الميكانيكية لانخفاض الضغط 129Xe وهي واقية وتوفر ما يكفي من 129Xe صورة SNR. على وجه التحديد ، نقوم بتطبيق PEEP عن طريق إضافة صمام PEEP تجاري إلى خط الزفير لجهاز التنفس الصناعي. لأداء RMs ، يجب إغلاق خط الزفير بحيث يتلقى استنشاقا متعدد دون زفير حتى يتم الوصول إلى الضغط المستهدف والمدة.
طوال الوقت ، نقدم إعدادات تهوية عامة ، ولكن ينصح بمراجعة الأدبيات لمعالجة أهداف الدراسة المحددة82،83. بالإضافة إلى مراقبة ذروة ضغط الشهيق أثناء التهوية الميكانيكية ، من المهم مراقبة درجة حرارة ، والتي يمكن إجراؤها باستخدام طرق مراقبة درجة حرارة الفأر القياسية. على الرغم من عدم الحاجة إلى التصوير ، إلا أن مراقبة معدل ضربات القلب عن طريق مخطط كهربية القلب (ECG) يمكن أن تكون مفيدة. يمكن أن يشير مخطط كهربية القلب إلى ما إذا كان يستيقظ من التخدير أو جرعة زائدة أو محزن ، مما يسمح للباحث بالتدخل.
تم تصميم البروتوكول الذي نصفه لجمع 129بيانات تهوية شعاعية Xe 3D61 ، وبيانات 2D GRE مرجحةبالانتشار 76 ، وبيانات تبادل الغازات الطيفية للنبض الديناميكي. يهدف هذا البروتوكول إلى سد الفجوة بين الأبحاث قبل السريرية في نماذج الصغيرة وإمكانية إجراء التصوير بالرنين المغناطيسي 129Xe لتعزيز فهمنا للاضطرابات الرئوية.
Protocol
تمت الموافقة على جميع الطرق الموضحة هنا من قبل اللجنة المؤسسية لرعاية واستخدامه (IACUC) التابعة للمركز الطبي لمستشفى سينسيناتي للأطفال.
1. الإعداد الأولي للموقع
- قم بإنشاء واختبار شبح غاز 129Xe مستقطب حراريا (الشكل 3).
- احصل على وعاء زجاجي من البورسليكات (~ 60 مل) ، وصمام مكبس بحلقة O أمامية مانعة للتسرب ، وجذع زجاجي من البورسليكات المطحون ، وكلها مصنفة تصل إلى 150 رطل لكل بوصة مربعة. تأكد من عدم وجود أجزاء مغناطيسية. قم بتوصيل تركيبات ضغط بالجذع الزجاجي. شد لإنتاج مانع تسرب للغاز.
- قم بتوصيل الوعاء بمضخة تفريغ وخزان أكسجين وفقا للشكل 3 أ. وعاء مفرغ إلى أقل من 100 mTorr الضغط المطلق.
- املأ الوعاء بالأكسجين إلى ضغط 1.5 ضغط جوي لتقليل 129Xe T1 من > 30 دقيقة إلى ~ 2 ثانية (عند شدة المجال المغناطيسي 7 طن ؛ بالنسبة للماسح الضوئي 9.4 T ، استخدم 1.6 أكسجين ضغط جوي). سفينة الختم.
ملاحظة: بالنسبة لشدة المجال الأعلى ، ستكون هناك حاجة إلى ضغط جزئي أعلى للأكسجين إلى حد ما لتحقيق T1 ≤ 2 s84. - املأ خزانا غير منفذ للغاز ب 400 مل من الزينون المخصب نظيريا (85٪ 129Xe).
ملاحظة: يمكن أيضا استخدام زينون الوفرة الطبيعية (26٪ 129Xe) ، ولكن يجب زيادة الإشارة إلى التخفيف من الانخفاض ~ 3 أضعاف في SNR. - قم بتوصيل السفينة بخزان 129Xe. أنابيب فراغ إلى أقل من 100 mTorr الضغط المطلق.
- املأ سائلا مفتوح الفم على الطاولة N2 Dewar إلى ~ 90٪. اغمر قاع الإناء (~ 5 سم) في النيتروجين السائل لتكثيف O2 وإنشاء فراغ (الشكل 3 ب). أثناء الغمر ، افتح الصمام للسماح ل 129Xe من الخزان بالتدفق إلى الوعاء (الشكل 3C).
- أغلق صمام المكبس عن طريق سحب الجذع ببطء حتى يتم سحب فتحة التدفق في المكبس بعد الحلقة O. مباشرة بعد اجتياز الثقب للحلقة O ، قم بتشديد اليد لإغلاق الوعاء. قم بإزالة الوعاء من النيتروجين السائل واتركه يذوب.
ملاحظة: بمجرد إذابة الجليد ، ستضغط السفينة إلى ~ 4.5 ضغط جوي (2 ضغط جوي O2 + 2.5 ضغط جوي 129Xe). - حماية الأواني الزجاجية (على سبيل المثال ، أدخل الوعاء في حاوية أنابيب البولي فينيل كلوريد المبطنة (PVC) ، الشكل 3 د).
ملاحظة: إذا تم صيانتها بشكل صحيح ، يمكن أن تحافظ الشبح على الضغط لمدة عقد أو أكثر. - قم بقياس T1 من الشبح (على سبيل المثال ، باستخدام تسلسل استعادة الانعكاس الطيفي). قم بتأكيد T1 < 2 ثانية للماسحات الضوئية 7 T. تتبع الإشارة و T1 بمرور الوقت لضمان الجودة (QA).
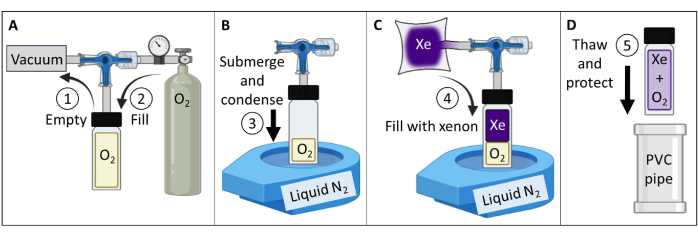
الشكل 3: إنشاء شبح غاز 129Xe مستقطب حراريا مسترشدا بالبروتوكول المفصل في الخطوة 1.1. يمكن تغيير الضغطين الجزئيين O2 و 129Xe لتخصيص T1 لإنتاج 129Xe T1 مرة وقوة الإشارة عند شدة مجالمعينة 84. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بإجراء ضمان الجودة باستخدام شبح الغاز المستقطب حراريا (الجدول 1 والشكل 4).
- ضع ملف 129Xe في مركز المغناطيس وقم بتوسيط شبح الغاز 129Xe داخل الملف. في تسلسل نبضة واكتساب واحد ("نبضة واحدة") ، اضبط تردد العمل ليطابق تردد الغاز التقريبي 129Xe في الشبح (~ 83.07 ميجاهرتز عند 7T).
- قم بتوسيط ترددات الاستحواذ والإثارة على تردد 129Xe Larmor ، واستخدم هذا التردد لجميع عمليات المعايرة الوهمية ومراقبة الجودة 129Xe. انظر الجدول 1 للاطلاع على المعلمات التجريبية لجميع عمليات فحص ضمان الجودة. تأكد من أن الشبح متمركز مع مترجم وهمي (الشكل 4 أ).
- قم بإجراء تجربة التعويذة لمعايرة زاوية القلب: بافتراض أن SNR كاف ، استخدم نبضات تردد لاسلكي مفردة مع تباعد وقت التكرار (TR) > 5 × T1. لكل عملية استحواذ ، قم بزيادة طاقة التردد اللاسلكي بشكل تدريجي حتى تصبح الإشارة فارغة وتبدأ في الانعكاس. المعيار المستخدم هنا هو: عدد النبضات = 65. TR = 10 ثوان ؛ مدة النبض = 125 ميكرو ثانية ؛ طاقة التردد اللاسلكي = 1-13.8 واط ، معززة بمقدار 0.2 واط
- يقوم فورييه بتحويل الطيف الأول ومرحلته (أي الطيف المكتسب بأقل طاقة تردد لاسلكي). تطبيق نفس المراحل لجميع الأطياف. ارسم الأطياف الحقيقية كدالة لقوة نبضة التردد اللاسلكي (الشكل 4 ب).
- تتوافق الطاقة التي تنتج ذروة فارغة (أي الحد الأدنى لارتفاع الذروة) مع زاوية الوجه 180 درجة. حقق زاوية قلب 90 درجة باستخدام نفس الطاقة بنصف طول النبضة اللازمة لإنتاج زاوية الوجه 180 درجة. بافتراض أن برنامج الماسح الضوئي يسمح بذلك ، اضبط هذه الطاقة المرجعية 90 درجة وطول النبضة لقياس زاوية الوجه اللاحقة.
- استخدم نبضة واحدة للرقائق عن طريق تقليل العرض الكامل بنصف طيف Xe 129كحد أقصى (TR ~ 1 ثانية). إذا لزم الأمر ، أعد توسيط التردد بعد الحشوة. سجل نصف العرض الكامل كحد أقصى.
- قم بتشغيل فحص 129Xe QA (الجدول 1 والشكل 4C). سجل بيانات ضمان الجودة: SNR ، ومتوسط الإشارة الوهمية ، والانحراف المعياري للضوضاء.
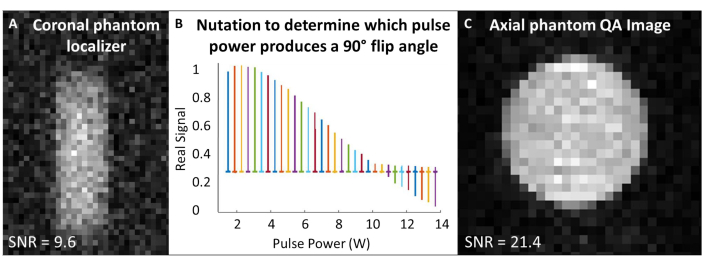
الشكل 4: ضمان جودة المسح المسبق. (أ) يضمن المحدد الوهمي الإكليلي 2D GRE منخفض الدقة تمركز الشبح في المغناطيس. (ب) تظهر تجربة التعويذة لضبط نبضة 90 درجة ذروة فارغة عند النبضة 180 درجة. (ج) بعد توطين زاوية الوجه ومعايرتها ، احصل على صورة 2D GRE QA بدقة أعلى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم البروتوكول القصير | وصف التسلسل | TR (مللي ثانية) | TE (مللي ثانية) | المتوسطات / التكرار | زاوية الوجه (°) | حجم المصفوفة أو Npts | مجال الرؤية (مم2) | الترددات اللاسلكية BW (كيلو هرتز) | سمك الشريحة / البلاطة (مم) | مدة المسح |
| نبضة واحدة | اكتساب النبض | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 ثانية | |||
| المترجم الوهمي | 2D GRE | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 دقيقة |
| معايرة زاوية الوجه | اكتساب النبض | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7.5 دقيقة | |||
| 129Xe ضمان الجودة | 2D GRE | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 دقيقة |
الجدول 1: معلمات تسلسل ضمان جودة المعايرة الوهمية. TR = وقت التكرار ، TE = وقت الصدى ، Npts = عدد النقاط ، مجال الرؤية = مجال الرؤية ، BW = عرض النطاق الترددي. الرجاء النقر هنا لتنزيل هذا الجدول.
- خطة الاستقطاب (الشكل 5 أ ، ب).
- حدد حجم 129Xe المستقطب ووقت التراكم: 400 مل في 15 دقيقة هو الأمثل لهذا البروتوكول (الشكل 5) ولكن يمكن تعديله بسهولة للتطبيقات والمعدات الأخرى.
- بافتراض وجود حجم ميت معروف داخل مفرط الاستقطاب (على سبيل المثال ، Vالمحجم الميت = 80 مل) ، احسب معدل التدفق (FXe في SLM) للحجم الموزع Vالمطلوب ، 129Xe كسر الغاز f ، ووقت التراكم tacc:
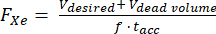 (1)
(1)
ملاحظة: في حين أن أوقات الإنتاج الأطول ستؤدي عادة إلى استقطاب أعلى ، إلا أنها قد لا تكون عملية للتصوير في الجسم الحي . استخدم نموذجا مناسبا لمفرط الاستقطاب85،86،87،88 لتحديد معدل التدفق الذي يوازن بين وقت الإنتاج والاستقطاب. هنا ، تم استخدام نموذج JW Plummer et al.89 (الشكل 5 أ). ينطبق هذا على المستقطبات ذات التدفق المستمر ولا ينطبق على المستقطبات المفرطة المتوقفة90. - استقطاب الغاز وفقا لهذه المعلمات ، وقم بقياس الاستقطاب باستخدام جهاز تجاري أو محلي الصنع ومقارنته بالاستقطاب المتوقع لضمان الجودة.
- قياس فقدان الاستقطاب أثناء النقل. إذا انخفض الاستقطاب بمقدار كبير بما فيه الكفاية (على سبيل المثال ، >10٪) ، فقم ببناء حقيبة حمل مغناطيسية لحماية الاستقطاب أثناء النقل. انظر الملف التكميلي 1: إدارة الاستقطاب أثناء النقل والشكل التكميلي 1.
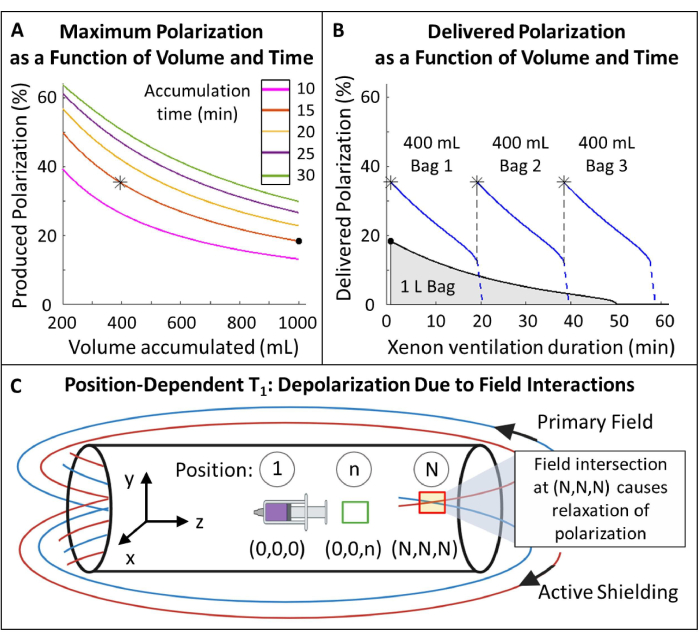
الشكل 5: إدارة الاستقطاب. (أ) الاستقطاب والحجم الناتج هما دالة لوقت التراكم ومعدل التدفق. يوفر كيس غاز سعة 400 مل استقطابا أوليا عاليا (~ 35٪) على مدار 20 دقيقة. في حين أن استخدام 1 لتر من الغاز قد يبدو جذابا ، إلا أنه سيكون له استقطاب أولي أقل (~ 20٪). (ب) بعد ~ 15 دقيقة من التهوية ، ستنضب دفعة سعة 1 لتر من HP 129Xe إلى استقطاب <10٪ بينما يظل 600 مل من الغاز116. وبالتالي ، فإن استخدام أكياس متعددة سعة 400 مل من 129Xe يحافظ على متوسط استقطاب أعلى يتم تسليمه. ج) يمكن أن تتسبب المواقع التي يتقاطع فيها المجال الأساسي ومجال التدريع النشط (الصندوق الأحمر في الموضع (N ، N ، N)) في حدوث استرخاء سريع ل HP 129Xe. يساعد توصيف المجال الهامشي للمغناطيس في تحديد المناطق الآمنة حيث يمكن وضع خزانات HP 129Xe دون استرخاء سريع (الصندوق الأخضر في الموضع (0,0,n)). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملف تكميلي 1: إدارة الاستقطاب أثناء النقل. الرجاء النقر هنا لتنزيل هذا الملف.
- قم بقياس T1 المعتمد على الموضع من HP 129Xe داخل الحقل الهامشي (الشكل 5C).
- قم بإنشاء نقاط مرجعية ذات مسافات ومواضع معروفة بالنسبة لمركز متساوي المغناطيس على طول أبعاد X و Y و Z. قم بتسمية مركز متساوي وقم بتسمية المواضع الأخرى من n إلى N. يعتمد عدد الوظائف التي يجب التحقيق فيها على المساحة المتاحة.
- فرط استقطاب حجم صغير من 129Xe (~ 250 مل) ونقله إلى غرفة التحكم في التصوير بالرنين المغناطيسي. املأ حقنة كبيرة (50-100 مل) ب 129Xe وضعها في مركز متساوي داخل المغناطيس (الموضع 1 في الشكل 5C). قم بتشغيل نبضة زاوية الوجه ~ 1 درجة لقياس الإشارة.
- اترك المحقنة في موضعها لمدة ~ 10 دقائق ، ثم احصل على طيف آخر. أعد قياس الإشارة كل 10 دقائق حتى تتحلل الإشارة على الأقل 1 T1 (أي أن الإشارة قد اضمحلت إلى ~ 1/3rd قيمتها الأولية).
- ابدأ تجربة T1 جديدة بحقنة جديدة من 129Xe بتكرار الخطوة 1.4.2.
- انقل المحقنة إلى موضع جديد (على سبيل المثال ، الموضع n في الشكل 5C) واتركها هناك لمدة 10 دقائق. أعد المحقنة إلى المركز المتساوي للحصول على طيف زاوية قلب إضافي ~ 1 درجة.
- كرر هذه العملية: حرك المحقنة إلى الموضع n ، وانتظر لمدة 10 دقائق ، ثم أعدها إلى مركز التساوي ، وأعد قياس الإشارة حتى تتحلل على الأقل 1 T1.
- كرر الخطوات 1.4.4 - 1.4.6 للمواضع المرجعية المتبقية التي تغطي اتجاهات X و Y و Z.
- سوف تتحلل الإشارة الأولية (S0) بشكل أحادي أضعاف على نبضات n RF بزاوية قلب θ . قم بتركيب الإشارة (S) كدالة للوقت (t) في المجال الهامشي لحساب T1 في كل موضع:
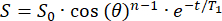 (2)
(2) - حدد موقعا به T1 كاف (>20 دقيقة) لوضع خزان 129Xe.
- قم بإنشاء قنيات تنبيب خالية من المعادن (الشكل 6).
- احصل على اثنين من القسطرة الوريدية السكنية من البولي تترافلورو إيثيلين (PTFE) مع موصلات Luer. تخلص من الإبر في حاوية التخلص من الأدوات الحادة.
ملاحظة: بالنسبة للفئران >25 جم ، استخدم قسطرة 18 جم و 20 جم. بالنسبة للحيوانات الصغيرة، استخدم قسطرة 20 جم و 22 جم. - اقطع موصل Luer من القسطرة. قم بتغذية القسطرة الأصغر في الطرف العلوي من القسطرة الأكبر لإنشاء قنية مدببة أكثر حدة وأطول. اقطع القنية المركبة إلى ~ 4.6 سم بنهاية مشطوفة ، لا تشمل قاعدة Luer (الشكل 6 أ ، ب).
- اقطع الطرف الأوسع لطرف ماصة سعة 200 ميكرولتر بطول ~2.6 سم (الشكل 6C).
- قم بتغطية طرف الماصة من الداخل بمادة تشحيم عامة لتحرير العفن. استخدم طرف ماصة آخر يتم إدخاله بالداخل لتوزيع مادة التشحيم بشكل رقيق. املأ طرف الماصة بمعجون الكبريت السيليكوني الأسيتوكسي الإيبوكسي (الشكل 6D ، E).
- قم بتوصيل القنية بسلك 22 جيجا يمتد من كلا الطرفين. قم بتغذية أنبوب القنية من خلال السيليكون الموجود في طرف الماصة. قم بتمديد الأنبوب ~7 مم بعد نهاية طرف الماصة (الشكل 6F، G).
- حرك أنبوب القنية على الجانب الأوسع من طرف الماصة من خلال موصل لوير ذو انزلاق ذكر بلاستيكي ، وقم بلصق القطع مع الإيبوكسي. قم بقطع الأنابيب التي تمتد إلى ما بعد موصل Luer (الشكل 6H).
- انتظر حتى يجف الإيبوكسي (>24 ساعة) ، ثم قم بإزالة قنية التنبيب المصنوعة من السيليكون بعناية من قالب طرف الماصة. قم بإزالة السلك من القنية ، مع التأكد من عدم انسداد الأنبوب (الشكل 6I).
- لعمل مقبض لسهولة التنبيب ، قم بتوصيل الأنبوب (1/16 بوصة أو 1/8 بوصة) بموصل Luer الأنثوي. عندما تكون جاهزا للتنبيب ، قم بتوصيل موصل Luer الأنثوي هذا بقنية التنبيب الذكرية. يمكن فصل هذه القطعة بسهولة بعد التنبيب (الشكل 6J).
- قم بالتعقيم قبل كل استخدام على: امسح الجزء الخارجي من القنية بنسبة 70٪ كحول. امسح سلك 20 جم بالمطهر ثم قم بتغذية السلك من خلال القنية لتعقيم الداخل والتأكد من عدم وجود انسداد.
- احصل على اثنين من القسطرة الوريدية السكنية من البولي تترافلورو إيثيلين (PTFE) مع موصلات Luer. تخلص من الإبر في حاوية التخلص من الأدوات الحادة.
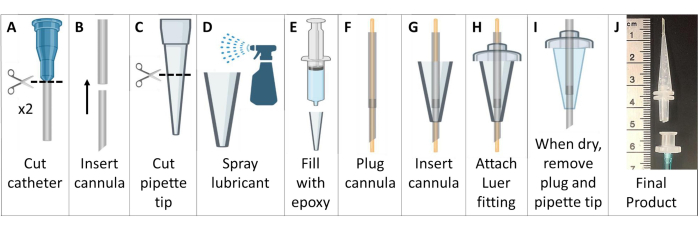
الشكل 6: إنشاء قنيات تنبيب الماوس المتوافقة مع التصوير بالرنين المغناطيسي و HP 129Xe. تتكون هذه القنيات من قسطرة وريدية وأطراف ماصة ومادة مانعة للتسرب من السيليكون، كما هو موضح في الخطوة 1.5. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. جمع البيانات اليومية
ملاحظة: انظر الملف التكميلي 2: قائمة مراجعة ضمان الجودة للفحص قبل السريري.
الملف التكميلي 2: قائمة مراجعة ضمان الجودة قبل السريرية. الرجاء النقر هنا لتنزيل هذا الملف.
- مراقبة جودة الماسحة الضوئية اليومية الكاملة وإعداد جهاز التنفس الصناعي (الشكل 4).
- باستخدام الأشباح، قم بتشغيل بروتوكولات ضمان الجودة على الماسحة الضوئية (انظر الجدول 1 للاطلاع على معلمات مسح ضمان الجودة والخطوة 1.2 للاطلاع على خطوات مراقبة الجودة اليومية).
- معايرة جهاز التنفس الصناعي وفقا لطريقة J. Nouls et al.38. انظر الملف التكميلي 3: معايرة جهاز التنفس الصناعي ، الشكل التكميلي 2 ، والشكل التكميلي 3.
- اضبط إعدادات جهاز التنفس الصناعي للتصوير عند الإلهام النهائي (الجدول 2). ضع سرير على رف الماسح الضوئي ووحدة دعم الحياة (أي أجزاء جهاز التنفس الصناعي الميكانيكي) على الطاولة بجوار الماسح الضوئي.
- قم بتنشيط نظام تسخين الخاص بالموقع. اضبط السخان على 35.5 - 40 درجة مئوية ، وقم بتشغيل الهواء المتداول ، وضع خرطوم الهواء في حدود ~ 5 بوصات من المكان الذي سيستريح فيه رأس لتسخين تجويف الماسح الضوئي مسبقا.
| إعداد التهوية | توصية بشأن HP 129Xe MRI | تلاحظ |
| حجم المد والجزر (التلفزيون) | 8-10 مل / كجم من وزن الجسم المثالي | تلفزيون معتدل يتطلب التلفزيون المنخفض BR أعلى مما قد يتسبب في ظهور عناصر الحركة في الصور |
| ضغط الزفير الإيجابي (PEEP) | 2-6 سم 2 O | |
| معدل التنفس (BR) | 80-120 برف/دقيقة | |
| مناورات التوظيف (RMs) | ~ 35 سم H2O لمدة 6 ثوان كل 5 دقائق | |
| مدة التهوية موضع | < 6 ساعات ؛ ضعيف | الاستلقاء لرؤية حركة الصدر بشكل أفضل |
| جزء من الأكسجين المستوحى (FIO2) | 0.3–0.5 | منع نقص الأكسجة في الفئران المخدرة |
| نسبة الشهيق إلى الزفير (I: E) | 1:2–1:4 | |
| اللهامي إلى مدة الدورة الإجمالية | 0.2–0.4 | |
| تهوية دقيقة | ≥0.57 مل جم -1 دقيقة 1 | |
| معاييرنا: | ||
| BR = 80 br / دقيقة ، مدة الإلهام = 200 مللي ثانية ، FIO2 = 0.3 | ||
| التصوير عند الإلهام النهائي: حبس التنفس = 200 مللي ثانية ، تأخير الزناد = 200 مللي ثانية بعد بدء الإلهام | ||
| التصوير أثناء حبس التنفس: حبس التنفس = 250 مللي ثانية ، تأخير الزناد = 250 مللي ثانية بعد بدء الشهيق | ||
| التصوير عند انتهاء الزفير: حبس التنفس = 200 مللي ثانية ، تأخير الزناد = 650 مللي ثانية بعد بدء الشهيق | ||
الجدول 2: إعدادات جهاز التنفس الصناعي الموصى بها للتصوير 129Xe. يمكن ضبط المعلمات لأهداف الدراسة المحددة والظروفالتجريبية 117،118،119،120،121،122،123،124. الرجاء النقر هنا لتنزيل هذا الجدول.
الملف التكميلي 3: معايرة جهاز التنفس الصناعي. الرجاء النقر هنا لتنزيل هذا الملف.
- مهدئ وتنبيب.
- قم بتشغيل الحاضنة على 27.7 درجة مئوية و / أو وسادة التسخين الكهربائية إلى 37.7 درجة مئوية. قياس وتسجيل كتلة جسم. احسب الجرعات المهدئة بناء على الكتلة. انظر الجدول 3 للاطلاع على نظام الجرعات النموذجي.
- حقن المهدئ داخل الصفاق. لاحظ وقت الحقن واضبط المؤقت للجرعة التالية من المهدئ.
ملاحظة: أكمل الخطوات المتبقية في القسم 2 (جمع البيانات اليومية) في أسرع وقت ممكن لتقليل الوقت الذي تتعرض له التخدير وخطر الجرعة الزائدة. - ضع مادة تشحيم العين على عيون وضع في قفص على وسادة التدفئة أو داخل حاضنة لمنع انخفاض حرارة الجسم.
- تأكد من أن مخدر بالكامل عن طريق إجراء اختبار قرصة إصبع القدم بعد 10-15 دقيقة من الحقن المهدئ68. التنبيب باتباع الإجراءات الموضحة في Das et al.69.
ملاحظة: مقال Das et al.69 مصحوب بعرض فيديو شامل لهذه التقنية. الخطوات هي كما يلي: - مستلق من الأسنان على لوح مائل. استخدم خافض لسان القوارض لسحب اللسان.
- لضمان ظهور الحبال الصوتية ، قم بتوفير الضوء الأبيض عبر كابل الألياف الضوئية داخل قنية التنبيب أو ضوء ساطع يوضع على الجزء الخارجي من الحلق. أدخل القنية على بعد أقل من 5 مم من الحبال الصوتية.
- تأكد من أن القنية في القصبة الهوائية ، وليس المريء ، عن طريق توصيلها بقطعة من الأنابيب بها قطرة صغيرة من الماء بداخلها. إذا تحركت قطرة الماء في الوقت المناسب مع أنفاس ، فمن المحتمل أن يكون الوضع صحيحا.
| عامل | جرعة | مسار | مدة | التعليقات | |||
| العوامل المستنشقة | |||||||
| إيزوفلوران | الحث: 4٪ -5٪ الصيانة: 1٪ - 3٪ أو للتأثير | استنشاقه | أثناء التدفق المستمر | • يتطلب استخدام المرذاذ المعاير | |||
| عوامل الحقن | |||||||
| موصى به: كيتامين + زيلازين + أسيبرومازين | 90 + 9 + 3 مجم / كجم | داخل الصفاق | 20-60 دقيقة | • يخلق قابلية لانخفاض حرارة الجسم | |||
| • للجرعات المتكررة ، يوصى بالتبديل إلى خليط الكيتامين + الزيلازين لمنع الجرعة الزائدة | |||||||
| • يسبب الاهتزاز أثناء تلاشيها. للتصوير ، التزم الصارم بجدول الجرعات | |||||||
| • قد يسبب بطء القلب | |||||||
| كيتامين + زيلازين | 90 + 9 مجم / كجم | داخل الصفاق | 20-40 دقيقة | • انظر أعلاه (كيتامين + زيلازين + أسيبرومازين) | |||
| بنتوباربيتال | 50 - 70 مجم / كجم | داخل الصفاق | 20-60 دقيقة | • يخفض معدل التنفس والحركة | |||
| • قد تكون النفقات باهظة التكلفة | |||||||
| • قد لا تكون الدرجة الصيدلانية متوفرة | |||||||
| إخلاء المسؤولية: هذه إرشادات عامة. استشر طبيبا بيطريا لمزيد من المعلومات قبل التنفيذ. | |||||||
الجدول 3: وصفات التخدير الشائعة للفئران. الرجاء النقر هنا لتنزيل هذا الجدول.
- تهوية (الجدول 2).
- قم بتوصيل بجهاز التنفس الصناعي عبر موصل Luer على قنية التنبيب. راقب حركة الحجاب الحاجز وذروة ضغط الشهيق (~ 10-12 سم H2O لحجم المد والجزر 10 مل / كجم من وزن الجسم). إذا كان الضغط أو حركة التنفس غير طبيعية ، فاضبط زاوية العنق وعمق القنية بعناية حسب الحاجة.
- تأكد من أن قنية التنبيب محكمة الإغلاق عن طريق إجراء مناورة تجنيد: منع الزفير (على سبيل المثال ، بإصبع ، سد منفذ الزفير) بحيث يستنشق عدة مرات دون زفير.
ملاحظة: إذا وصل ضغط مجرى الهواء إلى 35 سم في الساعة2ذروة ضغط الشهيق أكثر من ~ 6 ثوان ، فإن ختم مجرى الهواء يكون ضيقا بدرجة كافية. إذا لم يكن الأمر كذلك، فراجع المناقشة لاستكشاف الأخطاء وإصلاحها. - اسمح للزفير الطبيعي باستئنافه. قم بإجراء مناورات التجنيد بين عمليات الفحص وكل ~ 5 دقائق عند عدم المسح للحفاظ على امتثال الرئة ومنع انخماص الرئة. قم بتوصيل صمام PEEP بخط الزفير. اضبط PEEP على 4 سم H2O. شاهد ذروة ضغط الشهيق تزداد بهذه المقدار.
- بعد التنبيب الناجح ، قم بتخطيط وتهيئة إنتاج HP 129Xe حول جدول إعادة الجرعة المهدئة لمنع من الاستيقاظ أثناء الفحص. راقب درجة حرارة الجسم طوال التجربة.
- الحصول على البيانات: جمع صور التهوية.
ملاحظة: يمكن تنفيذ خطوات الحصول على البيانات 2.4 و2.5 و2.6 بأي ترتيب- اضبط جهاز التنفس الصناعي وفقا للجدول 2 للتصوير عند الإلهام النهائي.
- قم بتحميل بروتوكولات الإعداد التالية: مترجم البروتون ، نبضة واحدة للتركيز على تردد الغاز في رئتي الفأر ، و 129مترجم Xe. انظر الجدول 4 للاطلاع على معلمات المسح.
- ضع في المركز المتساوي وتأكد من أن التجويف الصدري في وسط مجال الرؤية مع توطين البروتون. في حالة استخدام ملفات أحادية التردد ، استبدل ملف البروتون بملف RF 129Xe مضبوط.
- سجل 129استقطاب Xe وانقله إلى ماسح التصوير بالرنين المغناطيسي. انظر الملف التكميلي 4: قائمة مراجعة ضمان الجودة في استقطاب الزينون.
- ضع كيسا يحتوي على 129Xe داخل علبة جهاز التنفس الصناعي وأغلقها. قم بتوصيل العلبة بما يتماشى مع جهاز التنفس الصناعي واسمح للعلبة بالضغط (3-6 رطل لكل بوصة مربعة).
- ابدأ 129Xe التهوية الميكانيكية. في كل مرة يتم فيها تنشيط تهوية 129Xe ، اسمح للحيوان بإكمال ~ 5 أنفاس قبل بدء الفحص لتحويل السعة الوظيفية المتبقية للرئتين.
ملاحظة: قم بالتبديل إلى خليط N2 / O2 بين 129عملية مسح Xe للحفاظ على الغاز شديد الاستقطاب. - باستخدام نبضة واحدة ، اضبط تردد العمل ليتناسب مع تردد الرنين في الجسم الحي للغازات 129Xe (~ 83.07 ميجاهرتز عند 7 تيران). انسخ التردد إلى جميع عمليات مسح الغاز اللاحقة لمرحلة الغاز 129Xe. قم بإجراء توطين 129Xe للتأكد من أن الرئتين في مركز متساوي.
- قم بتحميل وتشغيل تسلسل التهوية الشعاعي 129Xe. مراقبة ذروة ضغط الشهيق.
ملاحظة: إذا نفد غاز 129Xe قبل انتهاء البروتوكول ، فسوف ينخفض ضغط الشهيق الأقصى بسرعة. يمكن لكيس سعة 400 مل من 129Xe تهوية فأر 30 جراما لمدة ~ 24 دقيقة عند التهوية بنسبة 70٪ 129Xe عند 80 نفسا في الدقيقة بحجم مد وجزر يبلغ 10 مل / كجم من وزن الجسم المثالي. - عند الانتهاء من الفحص ، قم بالتبديل إلى التهوية بخليط N2 / O2 وقم بإزالة الكيس الفارغ من 129Xe.
- للتصوير عند انتهاء الزفير ، قم بتغيير مدة حبس التنفس وتأخير الزناد وفقا للجدول 2 وكرر الخطوات 2.4.2 - 2.4.9.
- تصدير البيانات الأولية من الماسحة الضوئية.
| اسم البروتوكول القصير | وصف التسلسل | الزناد | TR (مللي ثانية) | TE (مللي ثانية) | التكرار | زاوية الوجه (°) | حجم المصفوفة أو Npts | مجال الرؤية (مم2) | الترددات اللاسلكية BW (كيلو هرتز) | شريحة / سمك البلاطة (مم) | مدة المسح |
| نبضة واحدة | اكتساب النبض (طور الغاز) | اختياري | 1000 | 1 | 60 | 2048 | 10 | 1 ثانية | |||
| مترجم | 2D GRE | نعم | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60 ثانية |
| التهوية الشعاعية | 3D متعدد الصدى شعاعي | نعم | 20 | انظر التسمية التوضيحية | 1 | 30 | 613 | 223 | 32.05 | 30 | 16 دقيقة |
| نبضة واحدة للمرحلة الذائبة | اكتساب النبض (المرحلة الذائبة) | لا | 80 | 1 | 90 | 512 | 10.35 | 80 مللي ثانية | |||
| المواصفات الديناميكية للمرحلة الذائبة. | اكتساب النبض (المرحلة الذائبة) | لا | 50 | 1000 | 90 | 512 | 10.5 | 50 ثانية | |||
| الانتشار المرجح | 2D GRE | نعم | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18 دقيقة |
الجدول 4: معلمات التسلسل في الجسم الحي . يكتسب تسلسل التهوية الشعاعي ثلاثي الأبعاد متعدد الصدى الموصوفسابقا 39 صورا في 6 مرات صدى. تظهر النتائج لصورة الصدى الأولى (TE = 1.12 مللي ثانية ، الشكل 7). الرجاء النقر هنا لتنزيل هذا الجدول.
الملف التكميلي 4: قائمة مراجعة ضمان الجودة لاستقطاب الزينون. الرجاء النقر هنا لتنزيل هذا الملف.
- الحصول على البيانات: قم بتشغيل التحليل الطيفي الديناميكي للطور الذائب.
- اضبط جهاز التنفس الصناعي وفقا للجدول 2 للتصوير أثناء حبس التنفس. اضبط BR على 100 نفس / دقيقة. استعد لحقيبة جديدة من 129Xe كما في الخطوات 2.4.2 - 2.4.5.
- ابدأ 129Xe التهوية الميكانيكية. قم بتحميل وتشغيل نبضة واحدة لضبط تردد العمل ليتناسب مع التردد المذاب (~ 83.084 ميجاهرتز عند 7 تيران). انسخ تردد العمل إلى التحليل الطيفي الديناميكي للطور الذائب.
ملاحظة: ستكون هذه ذروة واحدة في الفئران التي تحتوي على الهيموجلوبينمن النوع البري 54. - قم بتحميل وتشغيل تسلسل التحليل الطيفي الديناميكي المتمركز على التردد المذاب في رئتي. عند الانتهاء من الفحص ، قم بالتبديل إلى التهوية بخليط N2 / O2 وقم بإزالة الكيس الفارغ من 129Xe. تصدير البيانات الأولية من الماسحة الضوئية.
- الحصول على البيانات: جمع الصور المرجحة بالانتشار.
- اضبط جهاز التنفس الصناعي وفقا للجدول 2 للتصوير أثناء حبس التنفس. استعد لحقيبة جديدة من 129Xe كما في الخطوات 2.4.2 - 2.4.7.
- قم بتحميل وتشغيل التسلسل المرجح بالانتشار. عند الانتهاء من الفحص ، قم بالتبديل إلى التهوية بخليط N2 / O2 وقم بإزالة الكيس الفارغ من 129Xe. تصدير البيانات الأولية من الماسحة الضوئية.
3. اختتام التجربة
- استعادة.
- اسحب قنية التنبيب مباشرة من فم. إذا لم يبدأ على الفور في التنفس تلقائيا ، فقم بإجراء ضغطات خفيفة على الصدر. إذا كان ذلك متاحا ، فقم بإدارة تدفق خفيف من الأكسجين الطبي بالقرب من وجه لدعم التعافي من التخدير.
- بمجرد أن يتنفس بثبات من تلقاء نفسه وإذا تم تخدير لمدة >2 ساعة ، قم بإعطاء 0.5 - 1 مل من المحلول الملحي العادي تحت الجلد لمنع الجفاف.
- أعد إلى قفص بمفرده. ضع القفص في حاضنة أو على وسادة تدفئة.
ملاحظة: المخدرة عرضة لأكل لحوم البشر ولا يمكن وضعها في قفص مع رفقاء القفص حتى تتعافى تماما (أي تتجول بشكل مستقل). لا يمكن للحيوانات المهدئة تنظيم درجة حرارة أجسامها. استخدم ظهر اليد لتشعر بدرجة حرارة كل بضع دقائق. - راقب عن كثب حتى يعود منعكس الصحيح (أي يمكن أن ينقلب بشكل مستقل من وضعية الاستلقاء إلى وضعية الانبطاح).
- قم بإزالة من الدعم الحراري بمجرد أن يتمكن من التجول بشكل مستقل. أعد إلى قفص مع زملائه في القفص.
ملاحظة: إذا لم يكن للحيوان رفقاء في القفص ، فهو أكثر عرضة لانخفاض حرارة الجسم الناجم عن التخدير. زود بفراش إضافي ، وإذا كان ذلك متاحا ، اترك في حاضنة طوال الليل. - سجل وزن مرة واحدة في الأسبوع لمدة أسبوعين لمراقبة صحته.
ملاحظة: إذا أصيب بإصابة في الفم أو المريء من التنبيب ، فقد يتوقف عن الأكل. إذا فقد >20٪ من وزن جسمه الأولي ، فاستشر طبيبا بيطريا حول القتل الرحيم.
- تحليل صور التهوية (الشكل 7).
- قم بتحميل البيانات الأولية في نظام أساسي للبرمجة. قم بتنزيل إطار إعادة البناء مفتوح المصدر للصور غير الديكارتية91.
- إعادة بناء الصور وفقا لتعليمات إطار العمل مفتوحة المصدر. تطبيع النقطة الأولى في كل إسقاط شعاعي39.
- قم بتقسيم حمة الرئة في الصور ، بما في ذلك voxels ذات إشارة 129Xe منخفضة أو معدومة. لا تشمل الشعب الهوائية الكبيرة. قم بتقسيم ضوضاء الخلفية في الصورة، باستثناء الرئتين والممرات الهوائية وعناصر التصوير.
ملاحظة: يمكن أن تساعد صورة مترجم البروتون في تحديد الحدود المتنية. - احسب SNR باستخدام الصيغة:
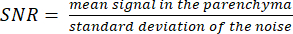 (3)
(3) - تحديد التهوية المعيبة.
ملاحظة: تم اقتراح طرق مختلفة لتحديد ضعف التهوية في نماذج الصغيرة. تظل طرق التحليل مجالا مفتوحا للاستفسار ، ولكن الأساليب التي يسهل تنفيذها تشمل: (1) التجزئة اليدوية شبه الكمية92 ، (ثانيا) نهج الرسم البياني باستخدام الإشارة من القصبة الهوائية لتطبيع الإشارة المتني47 ، و (ثالثا) تقسيم الحجم الكلي للرئة (TLV) وتحديد عتبة الإشارة (على سبيل المثال ، <60٪ من متوسط الرئة بالكامل) لتقسيم الرئتين إلى حجم معيب وحجم رئة متهوية (VV). حدد VDP 93,94 وفقا لما يلي:
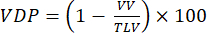 (4)
(4)
- تحليل التحليل الطيفي الديناميكي للطور الذائب (الشكل 8).
- قم بتحميل البيانات الأولية في نظام أساسي للبرمجة. قم بإجراء تحويل فورييه سريع وقم بوضع الأطياف (الترتيب اليدوي المتزامن للأطياف بترتيب صفري كاف لهذا التطبيق.)
- احسب بيانات الرنين المغناطيسي النووي القياسي (NMR)95،96: SNR ، نصف العرض الكامل ، المساحة المتكاملة ، التحول الكيميائي ، ومرحلة كلا القمتين.
- من بيانات الحجم ، اقسم اتساع إشارة الطيف المذاب على اتساع طيف الغاز لكل تكرار لإيجاد نسبة المذاب إلى الغاز بمرور الوقت.
- تحليل الصور المرجحة بالانتشار (الشكل 9).
- قم بتحميل البيانات الأولية في نظام أساسي للبرمجة. قم بتقسيم حمة الرئة للصورة b0 كما في الخطوة 3.2.3. احسب SNR لكل صورة b-value.
- احسب نسبة قيمة الإشارة إلى الضوضاء، SVNR0، بقسمة الإشارة في كل فوكسل من صورة b0 على الانحراف المعياري لضوضاء الصورة. استبعاد فوكسل مع SVNR0 < 2.5 ضعف تشويش الصورة97.
ملاحظة: SVNR0 هو مقياس فوكسل فردي ، في حين أن SNR المتني هو مقياس للرئة بأكملها. - احسب ADC عن طريق تركيب اضمحلال الإشارة على القيم b (bi) وفقا للمعادلة 598,99:
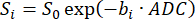 (5)
(5)
النتائج
صور التهوية
إذا تم تنفيذ إجراءات تحضير والتهوية بشكل صحيح ، يمكن للتصوير الشعاعي ثلاثي الأبعاد التقاط أنماط التهوية بنجاح عند إجراء الحصول على البيانات إما عند الإلهام أو انتهاء الصلاحية (الشكل 7). بينما يتم جمع هذه الصور على العد...
Discussion
يظهر التصوير بالرنين المغناطيسي 129Xe مفرط الاستقطاب كتقنية متطورة وقوية لدراسة البنية المجهرية للرئة ووظيفتها في نماذج الصغيرة. يهدف هذا البروتوكول إلى توجيه الإعداد الأولي للموقع ووصف الإجراءات التجريبية اللازمة لتحديد التهوية والانتشار وتبادل الغازات في رئتي ...
Disclosures
بيتر نيدبالسكي هو مستشار لشركة Polarean Imaging ، Plc.
Acknowledgements
يعرب المؤلفون عن امتنانهم العميق لجيري دالك لكونه ضوءا إرشاديا في بناء أجهزة التنفس الصناعي. نود أن نشكر كارتر ماكماستر على تخمير غاز HP 129Xe. نود أيضا أن نشكر الدكتور ماثيو ويلمرينغ والدكتور خوان بارا روبلز على مناقشاتهما العلمية المثيرة للتفكير. الأرقام التي تم إنشاؤها باستخدام BioRender.com. تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة (أرقام المنح: NHLBI R01HL143011 ، R01HL151588)
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
References
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved