A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تخليق حبات الحبة السوداء المحملة بالزيت والقائمة على الجينات والحساسة للأس الهيدروجيني باستخدام تقنية الرش الكهربائي
In This Article
Summary
يتم تقديم تقنية تستخدم الجهد الكهربائي العالي ومستحلب مستهدف محمل بالمكونات النشطة لتصنيع ميكروبيدات موحدة مستجيبة للأس الهيدروجيني.
Abstract
حظي زيت الحبة السوداء (BSO) ، المشتق من بذور نبات حبة البركة ، بالاهتمام لخصائصه المحتملة المضادة للسرطان ، لا سيما في سياق سرطان القولون. قد يساعد مركبه النشط ، ثيموكينون ، في تثبيط نمو الخلايا السرطانية والحث على موت الخلايا المبرمج في خلايا سرطان القولون. بالإضافة إلى ذلك ، يمكن أن تساهم التأثيرات المضادة للالتهابات ومضادات الأكسدة لزيت الحبة السوداء في بيئة أمعاء أكثر صحة ، مما قد يقلل من خطر الإصابة بالسرطان. لذلك ، قامت هذه الدراسة بتصنيع حبات الجينات الحساسة للأس الهيدروجيني لتوصيل BSO إلى القولون بطريقة تسيطر عليها دون إطلاق الدواء عند درجة الحموضة 1.2 (المعدة) ، وبالتالي توفير نمط إطلاق محدد جيدا عند درجة الحموضة 6.8. يعمل استخدام تقنية الرش الكهربائي على تحسين أداء العملية من خلال تسهيل صياغة حبات صغيرة متجانسة بمعدل تورم وانتشار أعلى في وسط الجهاز الهضمي.
تميزت الخرزات المركبة باختبار قوة اللصق المخاطي خارج الجسم الحي ، وحجم الخرزة ، وعامل الكروية (SF) ، وكفاءة التغليف (EE) ، والمجهر الإلكتروني الماسح (SEM) ، وسلوك التورم في المختبر (SB) ، وإطلاق الدواء في المختبر في الوسط الحمضي والعازلة. أظهرت كل هذه الخرزات المصنعة أحجاما متواضعة من 0.58 ± 0.01 مم وشكل كروي من 0.03 ± 0.00 مم في هذا الاختبار. أظهرت الصيغة خصائص عائمة وأطلقت واعدة في المختبر. مع نسبة تراكمية منخفضة جدا من الخرز ، كان معدل كفاءة الزيت بنسبة 90.13٪ ± 0.93٪ مرتفعا ، وأظهرت دراسة الإطلاق أكثر من 90٪ في درجة الحموضة 6.8 مع طبيعة عائمة جيدة في المعدة. بالإضافة إلى ذلك ، كانت الخرزات متباعدة بشكل متساو في جميع أنحاء الأمعاء. يمكن أن يكون نهج الرش الكهربائي المستخدم في هذا البروتوكول قابلا للتكرار ، مما يؤدي إلى نتائج متسقة. لذلك ، يمكن استخدام هذا البروتوكول للإنتاج على نطاق واسع لأغراض التسويق.
Introduction
تم استخدام الحبة السوداء ، وخاصة BSO ، على مر العصور لعلاج مجموعة واسعة من الأمراض بسبب خصائصها الطبية الراسخة. ربما يكون الثيموكينون أحد أهم المواد الكيميائية النباتية الموجودة في BSO1. في السنوات الأخيرة ، درس الباحثون الفوائد العلاجية المحتملة للثيموكينون في الجسم الحي وفي المختبر ، مما أدى إلى تقديم أدلة تجريبية لدعم استخدام BSO. تم إثبات خصائص خافضة ضغط الدم ، ومضادة للبكتيريا ، ومضادة للعرق ، ومضادة للفطريات ، ومسكنات ، ومضادة لمرض السكر ، وخفض الدهون ، ومضادة للالتهابات من خلال هذه الدراسات ل BSO ، والتي يمكن استخدامها لعلاج أعراض مثل الأكزيما وارتفاع ضغط الدم والربو والسعال والصداع والإنفلونزا والحمى ومضاد السرطان والدوخة والنشاط2،3.
يعرف تطبيق أغطية رقيقة نسبيا على قطرات صغيرة من السوائل والتشتتات ، أو جزيئات المواد الصلبة ، باسم الكبسولة الدقيقة. عندما يتعلق الأمر بالزيت ، عادة ما يكون الزيت المصغر ذا قيمة كبيرة لأن بعض أشكال الزيت ، مثل BSO ، تعتبر أطعمة مغذية وتقدم مزاياطبية 4. ومع ذلك ، فإن إضافة الزيوت مباشرة إلى مصفوفة الطعام قد يؤدي إلى التطاير ، مما قد يتسبب في اختفاء الأنشطة بسرعة نتيجة التعرض للأكسجين والأشعة فوق البنفسجية5. علاوة على ذلك ، فإن عدم التحكم في معدل إطلاق الزيوت يؤدي إلى تأثير فوري وعابر. يعد إنشاء طلاء بوليمري حول الزيت العطري عن طريق التغليف الدقيق أو الميكروية إحدى الطرق لتجاوز هذه العيوب6.
الكبسولات الدقيقة ، والمعروفة أيضا باسم الكريات المجهرية ، تحمي الزيوت من الظروف البيئيةالضارة 7. تم استخدام هذه العملية على نطاق واسع لزيادة فعالية الدواء ، والحفاظ على محتويات الأدوية ، وتمكين الأقراص التي يتم إصدارها بمرور الوقت ، وتحسين إخفاء التذوق ، وتقليل فقدان النكهة أثناء العمر الافتراضي للمنتج ، وإطالة ملمس الفم ، وفصل المكونات غير المتوافقة في جرعة واحدة8. يساعد الكبسولة الدقيقة أيضا في الحفاظ على امتصاص التمثيل الغذائي ، والتحكم في معدل إطلاق الزيت ، والحفاظ على التركيزات المناسبة لتحقيق النتيجة المرجوة في موقعمعين 9.
التغليف الكهروديناميكي هو طريقة مباشرة وقابلة للتكيف. توجد المادة الفعالة في اللب الداخلي لمحفظة دقيقة ، والتي تتكون من غلاف خارجي. في هذا الصدد ، يتميز بمصفوفة قوية إلى حد ما لضمان إمكانية نشر المكون النشط بشكل أكثر فعالية بدلا من نواة محددة بوضوح. قبل إعادة التدوير الكروي ، يجب الجمع بين المادة الفعالة ومحلول البوليمر لإنتاج الكرياتالمجهرية 9. من ناحية أخرى ، نظرا لأن الزيت متطاير ، فقد يكون التغليف الدقيق أمرا صعبا للغاية ويتطلب تحكما دقيقا في درجة الحرارة.
هناك طرق مختلفة لتغليف الزيوت. على سبيل المثال ، يجب تغليف بعض الزيوت في درجات حرارة منخفضة لمنع انهيار أو تطاير مكوناتها النشطة بيولوجيا. لإنشاء هياكل صغيرة ونانوية الحجم ، تمت دراسة الانحلال الكهروهيدروديناميكي (EHDA) على نطاق واسع من قبلالباحثين 10. وبهذا المعنى ، فإن ظروف المعالجة ، والتي تشمل معدل التدفق والجهد المطبق وحجم الفوهة ، بالإضافة إلى خصائص مسافة التجميع للمحلول البوليمري ، هما العاملان الأساسيان اللذان يجب أخذهما في الاعتبار لإنتاج حجم الجسيمات المطلوب أو مورفولوجيا11،12.
في هذا التحقيق ، تم استخدام الجينات - وهو نوع من السكريات التي تحدث بشكل طبيعي ومناسبة للابتلاع عن طريق الفم - لتغليف BSO. تحتوي الأعشاب البحرية البنية على الجينات ، وهو بوليمر أنيوني يحدث بشكل طبيعي. وهي مكونة من هيكلين أحاديين: α-L-guluronic (G) و 1-4βD-manuronic (M) acid13. البوليمر الخاص به غير سام14 ، وله درجة عالية من التوافق الحيوي ، وغير مكلف ، ويتحلل بشكل فعال15. لذلك ، يتم استخدامه بشكل متكرر في قطاعي التكنولوجيا الأحيائية والهندسة.
الجينات هي المادة المفضلة للتغليف عن طريق الهلام الأيوني لأنها قد تخلق بنية متشابكة بين مجموعات G لسلاسل الجينات المختلفة عن طريق تكوين اتصالات أيونية مع الكاتيونات ثنائية التكافؤ مثل أيونات Sr2+ أو Ca2+ أو Zn2+ . يمكن تمييز عملية التبلور بشكل كاف من خلال نموذج صندوق البيض ، والذي يحد من الكاتيون ثنائي التكافؤ إلى مجموعتين من الكربوكسيل على جزيئات الألجينات جنبا إلى جنب. لقد تم اقتراح أن خصائص الهيدروجيل لحبات ألجينات الصوديوم قد تنظم إطلاق الجزيئات الكبيرة والجزيئات الصغيرة. قد تتشبث حبات ألجينات الصوديوم بالغشاء المخاطي للأمعاء لفترة طويلة من الزمن بسبب خصائصها اللاصقة للمخاط. علاوة على ذلك ، يوفر الجينات درعا قد يحمي الزيوت من العناصر الخارجية مثل الوسائط الحمضية16 وينقل الزيوت إلى قنوات توصيل الجهاز الهضمي17. ومنذ ذلك الحين تم استخدامه في البحث للمساعدة في إدارة الدواء الخاصة بالموقع للأنسجة المخاطية18،19.
تم استخدام النهج الكهروديناميكي الهيدروديناميكي في هذه الدراسة للتحقيق في جدوى استحلاب الزيوت التجارية لإنشاء كبسولات20. هنا ، تم استخدام النهج الكهروديناميكي لتوليد وتحليل الكريات المجهرية المحملة بالجيناتBSO 20. قيمت هذه الدراسة عددا من العوامل الأخرى ، بما في ذلك SF للكريات المجهرية ، والجسم الحي ، وخصائص اللصق المخاطي ، و EE ، والمظهر المادي ، وتوزيع الحجم ، وإمكانات زيتا. تم استخدام التحليل الطيفي للانعكاس الكلي الموهن - تحويل فورييه بالأشعة تحت الحمراء (ATR-FTIR) لاختبار التوافق الكيميائي20.
Protocol
1. تحضير مستحلب الجينات BSO
- تفريق 10٪ وزن / حجم BSO في 1٪ وزن / حجم محلول ألجينات الصوديوم يحتوي على 1, 3, و 5٪ وزن / حجم الليسيثين في دورق 50 مل.
- احصل على مستحلب نانوي باستخدام الخالط بالموجات فوق الصوتية. اضبط مستوى الطاقة على 20٪. قم بتشغيل الخالط لمدة 55 ثانية بالنقر فوق الزر "ابدأ" لإكمال العملية.
2. توصيف مستحلب الجينات BSO
- تحليل إمكانات زيتا وتوزيع حجم الجسيمات
- خذ 0.1 مل من المستحلب الطازج في دورق زجاجي سعة 25 مل وقم بتخفيفه ب 9.9 مل من الماء المقطر.
- خذ 2.5 مل من هذا المحلول المخفف في كوفيت كوارتز سعة 3 مل وضع الكوفيت في حجرة قياس.
- افتح الغطاء وضع الكوفيت داخل الجهاز ، وتأكد من توجيه الكوفيت بشكل صحيح فيما يتعلق بمسار شعاع الضوء. انقر فوق رمز القياس .
- أخرج الكوفيت. استرجع العينة أو تخلص منها بشكل صحيح.
- احفظ البيانات كملف pdf في مجلد شخصي لاستخدامها مرة أخرى.
- تحديد استقرار المستحلب (ES)
- خذ 5 مل من المستحلب الطازج في أنابيب الطرد المركزي سعة 10 مل. الطرد المركزي المستحلبات (ن = 3) لمدة 5 دقائق عند 894 × جم.
- باستخدام المعادلة (1) ، حدد ES بناء على موضع واجهة فصل الطور.
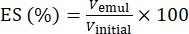 (1)
(1)
حيث Vemul هو حجم المستحلب المتبقي بعد الطرد المركزي و Vinitial هو حجم المستحلب الأولي.
- تحضير حبة
- حبات الجينات BSO
- قم بإعداد حبات الجينات BSO باستخدام تقنية الرش الكهربائي المسماة EHDA. استخدم وزنا من حيث الحجم (وزن / حجم) مستحلب BSO يتكون من 10٪ BSO و 1٪ ألجينات الصوديوم و 3٪ محلول الليسيثين).
- باستخدام مضخة حقنة لتنظيم معدل التدفق ، قم بتحميل المستحلب في حقنة بلاستيكية سعة 10 مل وادفعها من خلال إبرة 22 جرام. قم بتوصيل طرف الإبرة بالقطب الموجب لمصدر طاقة عالي الجهد.
- بصفتك المجمع ، استخدم دورق مؤرض يحتوي على 50 مل من 1٪ وزن / وزن من كلوريد الكالسيوم (حمام التبلور). قم بتبديل معدل تدفق التنقيط بين 1 مل / دقيقة و 3 مل / دقيقة بجهد 3 و 5 و 7 كيلو فولت مع الحفاظ على مسافة 10 سم فوق سطح محلول كلوريد الكالسيوم.
- لتأكيد التبلور الكامل ، اترك الخرزات في حمام التبلور لمدة 30 دقيقة أثناء تحريكها. استخدم مرشحا من الفولاذ المقاوم للصدأ لإزالة الخرزات من حمام التبلور وغسل الخرزات المجمعة بالماء المقطر فائق النقاء.
- دع الخرزات تجف لمدة 16 ساعة في درجة حرارة الغرفة على مقعد المختبر. استخدم المعادلة (2) لحساب النسبة المئوية لعائد الخرز.
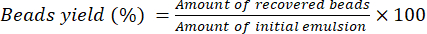 (2)
(2)
- حبات الجينات الخالية من BSO
- تحضير محلول 1٪ وزن / حجم من ألجينات الصوديوم. إضافة الليسيثين بتركيزات 1٪, 3٪, و 5٪ وزن / حجم إلى المحلول. امزج المحلول جيدا حتى يذوب الليسيثين تماما.
- استخدم المحلول من الخطوة 2.3.2.1 لإعداد حبات الجينات الخالية من BSO كما هو موضح في الخطوات 2.3.1.2-2.3.1.5. احسب العائد باستخدام المعادلة (2).
- حبات الجينات BSO
3. توصيف حبة
- تحديد الحجم والشكل
- للتأكد من حجم وشكل الخرزات ، استخدم محلل الصور. التقط صورا باستخدام كاميرا رقمية للخرز المبلل والمجفف.
- بعد ذلك ، قم بقياس قطر الخرزة باستخدام شريط المقياس المثبت مسبقا على الأداة. باستخدام قيم القطر ، احسب SF من قيم القطر التي تم الحصول عليها باستخدام المعادلة (3):
SF =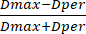 (3)
(3)
حيث يمثل Dmax أكبر قطر يمر عبر مركز الخرزة (بالمليمتر) ، بينما يشير Dper إلى القطر العمودي على Dmax ويمر عبر مركز الخرزة (بالمليمتر).
ملاحظة: يشير SF للصفر إلى حبة كروية بشكل مثالي ، مع زيادة قيم SF مما يدل على انحراف أكبر عن الشكل الكروي. علاوة على ذلك ، تعتبر الخرزات كروية إذا كان SF الخاص بها 0.05 أو أقل.
4. تحديد EE٪
- تفكيك الخرزات في محلول ملحي مخزن بالفوسفات (PBS) لإعادتها إلى مستحلب. قم بقياس امتصاص المستحلب الناتج عند 600 نانومتر باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية.
- استخدم قيمة الامتصاص لتمثيل تعكر المستحلب. قم بإنشاء منحنى قياسي باستخدام كمية معروفة من BSO في المستحلب.
- احسب EE٪ باستخدام المعادلة (4):
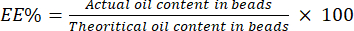 (4)
(4)
5. مسح المجهر الإلكتروني (SEM)
ملاحظة: استخدم SEM لمراقبة البنية المجهرية والتشكل السطحي لخرز الجينات BSO.
- لفحص الجزء الداخلي من الخرز المجفف ، قم بقطع القليل منها. ضع الخرزات المقطوعة على بذرة الألمنيوم والصقها باستخدام أشرطة لاصقة من الكربون.
- قم بتغطية الخرزات بوحدة رش الكربون في مبخر فراغي في جو الأرجون. ضع سمكة 100 Å و 50 Å لطلاء الكربون.
- احصل على صور للخرز المطلي في فراغ عال بمسرع جهد بين 10 كيلو فولت و 15 كيلو فولت.
6. تحديد التفاعل بين الدواء السواغ باستخدام ATR-FTIR
- اضبط أرقام موجات الأداة بين 4,000 سم −1 و 400 سم −1 باستخدام الهواء المحيط كخلفية ودقة 1 سم −1. انظر الملف التكميلي 1.
- سجل أطياف BSO ، ألجينات الصوديوم ، الليسيثين ، كلوريد الكالسيوم ، الخرز الخالي من BSO ، حبات الجينات BSO ، والمزيج الفيزيائي للمكونات الفعالة والسواغات (ألجينات الصوديوم ، الليسيثين ، كلوريد الكالسيوم ، و BSO) بشكل منفصل.
- ضع العينة (5-10 مجم) على منطقة أخذ العينات. اضبط 20 عملية مسح ، الدقة 4 ، قوة القياس 80 ، ذراع الضغط بطرف مسطح. تحقق من أن الزيادة التلقائية تظل مضبوطة على الخيار فارغ بحيث يتم تخزين الطيف تلقائيا في المجلد المطلوب.
- لبدء قياس العينة، انقر فوق الزر [عينة]. بعد تحديد [عينة] ، نظرا لعدم وجود فترة انتظار ، تأكد من تجهيز العينة وتقليل مشبك الضغط. تحليل جميع العينات بشكل فردي. تحليل جميع الأطياف المسجلة بشكل فردي باستخدام برنامج التحليل الطيفي.
7. كالوريمتر المسح التفاضلي (DSC)
ملاحظة: تم فحص الخصائص الحرارية وتوافق الخرزات المحملة ب BSO باستخدام DSC (الملف التكميلي 1).
- حبات ختم تزن ~ 3.20 مجم في وعاء عادي من الألومنيوم. تسخين العينات بمعدل 10 درجات مئوية / دقيقة أثناء تحليلها في نطاق درجة حرارة 50-350 درجة مئوية تحت تيار من النيتروجين المتدفق بمعدل 20 لتر / دقيقة.
8. خصائص تورم الخرز
- تحضير 100 مجم من حبات الجينات المجففة.
- قم بإعداد السائل المعوي المحاكي (SIF) والسائل المعدي المحاكي (SGF) في وعاء خلط نظيف وجاف بحجم مناسب - 6 لتر أو 10 لتر أو 25 لتر. أضف الماء النقي إلى ما يقرب من 33٪ من الحجم المطلوب - 2 لتر أو 3 لتر أو 8 لتر ، وانقل محتويات زجاجة التركيز إلى الوعاء. اشطف الزجاجة بالماء النقي وأضف الشطف والماء النقي إلى وعاء الخلط للحصول على الحجم المطلوب ؛ تخلط جيدا. قياس الرقم الهيدروجيني والمضي قدما إذا كان ضمن المواصفات ؛ اضبط درجة الحموضة إذا لزم الأمر.
- اغمر الخرزات في 50 مل من الوسائط التي تحتوي على سائل معوي محاكي (SIF) والسائل المعدي المحاكي (SGF). حافظ على الظروف لمدة ساعتين عند 37 ± 0.5 درجة مئوية.
- قم بإزالة الخرزات المنتفخة وقم بتصفيتها من خلال شبكة معدنية على فترات محددة مسبقا من 0 و 10 و 20 و 30 و 40 و 50 و 60 و 70 و 80 و 90 و 100 و 110 و 120 دقيقة أو أكثر. استخدم منشفة ورقية لإزالة السوائل الزائدة من الخرز المتورم.
- قم بقياس وزن الخرزات الممسوحة باستخدام ميزان تحليلي إلكتروني. تحديد النسبة المئوية لمؤشر التورم (٪SI) باستخدام المعادلة (5):
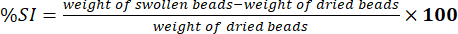 (5)
(5)
النتائج
تحضير ميكروبيدات الجينات المحملة ب BSO
يمثل الشكل 1 الإعداد التجريبي لإعداد ميكروبيدات الجينات المحملة ب BSO. كان لكمية الليسيثين المستخدمة تأثير كبير على استقرار مستحلب BSO. كانت المستحلبات المصنوعة من جميع تركيزات الليسيثين الثلاثة مستقرة نسب?...
Discussion
باستخدام عملية EHDA ، تم إنشاء ميكروبيدات الجينات المحملة ب BSO كحامل حساس للأس الهيدروجيني. أظهرت شبكة الخرز تورما يعتمد على درجة الحموضة وسلوكا في إطلاق الأدوية بسبب الوجود الوفير لمجموعات حمض الكربوكسيل. تم الكشف عن الترابط الهيدروجيني القوي بين الجزيئات بين سلاسل البو...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل مشروع دعم الباحثين بجامعة الأميرة نورة بنت عبد الرحمن رقم (PNURSP2024R30) ، جامعة الأميرة نورة بنت عبد الرحمن ، الرياض ، المملكة العربية السعودية. تم تمويل هذا البحث من قبل مشروع دعم الباحثين رقم (RSPD2024R811) ، جامعة الملك سعود ، الرياض ، المملكة العربية السعودية.
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
References
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved