Method Article
تصوير المجالات الدقيقة الأولية Ca2+ في الخلايا التائية الأولية
* These authors contributed equally
In This Article
Summary
هنا ، نقدم بروتوكولا شاملا لحل إشارات Ca2+ المحلية الأولية ، والمعروفة باسم المجالات الدقيقة Ca2 + ، في الفئران الأولية والخلايا التائية البشرية باستخدام الفحص المجهري الفلوري. يعمل هذا البروتوكول كمورد قيم للباحثين الذين يفحصون مسارات إشارات Ca2 + داخل الخلايا المناعية والكشف عن وظيفتها.
Abstract
إشارات Ca2+ المحلية دون الثانية ، والتي تسمى المجالات الدقيقة Ca2 + ، هي إشارات Ca2+ ديناميكية للغاية وقصيرة العمر ، مما يؤدي إلى ارتفاع [Ca2 +] i عالمي وقد تحدد بالفعل مصير الخلية التائية. عند تنشيط مستقبلات الخلايا التائية ، يتم تشكيل NAADP بسرعة ، ويرتبط ببروتينات ربط NAADP (HN1L / JPT2 ، LSM12) ومستقبلاتها الخاصة (RyR1 ، TPC2) الموجودة على مخازن Ca2+ داخل الخلايا ، مثل ER والجسيمات الحالة ، مما يؤدي إلى إطلاق وارتفاع لاحق ل [Ca2 +]i. لالتقاط إشارات Ca2+ السريعة والديناميكية ، قمنا بتطوير تقنية تصوير عالية الدقة باستخدام مزيج من مؤشرين Ca2+ ، Fluo-4 AM و FuraRed AM. بالنسبة للمعالجة اللاحقة ، تم تطوير نهج الكشف عن المجال المصغر Ca2 + مفتوح المصدر وشبه آلي بناء على لغة البرمجة Python. باستخدام سير العمل هذا ، نحن قادرون على اكتشاف المجالات الدقيقة Ca2 + بشكل موثوق على المستوى الخلوي في الفئران الأولية والخلايا التائية البشرية في مقاطع فيديو مضان عالية الدقة الزمنية والمكانية. يمكن أيضا تطبيق هذه الطريقة على أنواع الخلايا الأخرى ، مثل الخلايا القاتلة الطبيعية وخطوط الخلايا العصبية الفئرانية.
Introduction
تتيح تقنية الفحص المجهري الفلوري المقدمة تصور إشارات الكالسيوم الأولية المحلية والزمنية (Ca2+) في الخلايا التائية الأولية للفأر ، والتي تسمى المجالات الدقيقة Ca2+ . تمثل المجالات الدقيقة Ca2 + أحداث إشارات Ca2+ ديناميكية للغاية وقصيرة العمر ، مما يشكل تحديات للتصوير والتحليل الفعال للخلاياالحية 1.
تمثل الخلايا التائية تحديا لتصوير الخلايا الحية بسبب الاختلافات النسبية في شدة التألق المركزي والمحيطي ، والتي يمكن أن تعزى إلى شكلها الكروي وقطرها الصغير البالغ ~ 6-8 ميكرومتر. عند التحفيز وتكوين المشبك المناعي ، تخضع الخلايا التائية لتغييرات مورفولوجية ، مما يزيد من تعقيد تصوير الخلاياالتائية 1. لذلك ، يصبح استخدام تحليل النسبة القياسية أمرا ضروريا ، ويتم تحقيقه إما عن طريق تسجيل صورتين تمثلان خصائص مختلفة لصبغة Ca2+ أو استخدام مزيج من صبغتين من Ca2+ . تشمل الخصائص الصعبة للنطاقات الدقيقة Ca2+ طبيعتها السريعة والمحدودة زمانيا ومكانيا. لالتقاط ذلك ، يجب أن تمتلك أصباغ Ca2+ المستخدمة سطوعا قاعديا عاليا ونسبة إشارة إلى ضوضاء عالية (SNR) للحصول على أعلى دقة زمنية ومكانية ممكنة. تم تحقيق النتائج المثلى باستخدام مزيج من صبغة Fura Red ذات الطول الموجي المزدوج والصبغة أحادية الطول الموجي Fluo-4. تعمل خلايا التحميل المشترك مع Fluo-4 و Fura Red على تخفيف التحديات التي يفرضها التبييض الضوئي القوي للأصباغ ذات الطول الموجي مزدوج الانبعاث والتأخير الزمني المرتبط بأصباغ الإثارة المزدوجة ، مما يضمن ملاءمة الحصول على الصور بسرعة. يسهل هذا النهج أيضا تصور التغييرات في الشكل والحركات الدقيقة. يتم أيضا وضع متطلبات خاصة على نظام التصوير من حيث الدقة المكانية لتمكين تصور إشارات Ca2+ الناشئة عن فتح مجموعات صغيرة من القنوات أو حتى القنواتالمفردة 1.
تلعب إشارات Ca2+ دورا محوريا في تنشيط وظائف المناعة داخل الخلايا التائية ، بما في ذلك تكوين المشبك وإنتاج السيتوكين وإطلاق2،3. يتم تنظيم المصير المحدد للخلية من خلال إشارات Ca2+ الواضحة والموزعة محليا بشكل مختلف ، المجالات الدقيقة Ca2+ 3. والجدير بالذكر أن إشارات Ca2+ المحلية تسبق ارتفاعا واسع النطاق في مستويات Ca2+ داخل الخلايا في الخلايا التائية ويعتمد تكوين المجالات الدقيقة Ca2+ على كل من دخول Ca2+ وإصداره 1،4،5. عند تحفيز مستقبلات الخلايا التائية (TCR) / CD3 ، يتم تشغيل تكوين Ca2+ الذي يطلق رسلا ثانيا ، مثل فوسفات ثنائي النوكليوتيد من حمض النيكوتينيك (NAADP) ، و D-myo-inositol 1،4،5-trisphosphate (IP3) والريبوز الدوري ADP (cADPR) ، مما يؤدي إلى ارتفاع مستويات Ca2+ داخل الخلايا حتى 1 ميكرومتر6،7. ترتبط أحداث إشارات Ca2+ المبكرة بإطلاق Ca2+ من مخازن Ca2+ داخل الخلايا مثل الشبكة الإندوبلازمية (ER) ، مع قنوات مثل مستقبل الريانودين 1 (RyR1) ومستقبل IP3 (IP3R) هي المسؤولة في الغالب عن هذه الإشارات. يؤدي هذا لاحقا إلى تدفق Ca2+ خارج الخلية وينتج عنه إشارة Ca2+ عالمية عبر إدخال Ca2+ (SOCE) الذي يتم تشغيله في المتجر 8. بالإضافة إلى ذلك ، هناك قنوات أخرى تشارك في إشارات Ca2+ أثناء تنشيط الخلاياالتائية 9 ، على سبيل المثال ، تضمن قنوات P2X4 و P2X7 تدفق الكاتيون المعتمد على الأدينوسين ثلاثي الفوسفات (ATP) ، مما يساهم في ارتفاع Ca2+ داخل الخلايا. من اللافت للنظر أن المجالات الدقيقة Ca2+ الأولية المعتمدة على الالتصاق (ADCMs) قد تشكلت بالفعل قبل تحفيز TCR ولكن مع سعات وترددات Ca2 + أقل. من المرجح أن تخدم إشارات Ca2+ الأولية المستقلة عن TCR هجرة الخلية التائية إلى موقع الالتهاب وتهيئة الخلايا التائية لإعادة التحفيز في موقعالإصابة 10،11.
من خلال تطوير الطريقة الموصوفة للتصوير المحلي Ca2+ ، اكتسبنا أداة إضافية لاستكشاف أصل وأهمية إشارات Ca2+ المبكرة في تنشيط الخلايا التائية. تمكن هذه الطريقة المستخدم من اكتشاف إشارات Ca2+ أصغر وقصيرة العمر وأسرع مما كان ممكنا في السابق. علاوة على ذلك ، يتيح Deconvolulation والتحليل والتسجيل والتتبع وتطبيع الشكل (DARTS) ، وهو خط أنابيب التحليل المستند إلى Python ، مشاركة أدوات التحليل مع جمهور أوسع12.
Protocol
تمت الموافقة على جميع التجارب على وإجراؤها وفقا لإرشادات رعاية للجنة رعاية المؤسسي واستخدامه في المركز الطبي الجامعي هامبورغ-إيبندورف.
1. عزل الخلايا التائية الأولية للفأر عن الغدد الليمفاوية والطحال
- حصاد الطحال / الغدد الليمفاوية في ظروف معقمة وفقا للإرشادات الأخلاقية ووضعها في أنبوب به وسط Ice-cold Clicks (10٪ مصل عجل الجنين (FCS) ، 2 ملي لجلوتامين ، بنسلين / ستربتومايسين (P / S) 100 وحدة / مل ، 50 نانومتر β-ميركابتو إيثانول).
ملاحظة: يتم عزل الخلايا التائية من النوع البري وخلايا KO الماوس بنفس الطريقة. - قم بتبريد جهاز الطرد المركزي إلى 4 درجات مئوية.
- ضع الطحال والغدد الليمفاوية في مصفاة خلوية 70 ميكرومتر في طبق بتري معقم وأضف وسط عزل الطحال (وسط RPMI + 7.5٪ NCS + 1٪ P / S) إلى حجم إجمالي قدره 20 مل.
- قم بتعطيل الطحال جيدا ولكن برفق باستخدام ملاط بلاستيكي. انقل الخلايا بعد ذلك إلى أنبوب طرد مركزي سعة 50 مل.
ملاحظة: يجب أن يكون الحجم الإجمالي البالغ 20 مل الآن في أنبوب الطرد المركزي سعة 50 مل. يجب تعطيل الطحال والغدد الليمفاوية تماما. اعمل على الجليد من هذه النقطة فصاعدا. يؤدي الحفاظ على الخلايا على الجليد إلى إبطاء عملية التمثيل الغذائي ومنع موت الخلايا ، مما يضمن بقائها قابلة للحياة وسليمة وظيفيا. يساعد هذا في الحفاظ على حالتها الفسيولوجية لفترة أطول من الوقت ، وهو أمر مهم بشكل خاص للتجارب الدقيقة في المصب - جهاز الطرد المركزي لتعليق الخلية عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية وتأكد من إعادة تعليق الحبيبات الناتجة في 2 مل من محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco (بدون Ca2+ و Mg2+). نقل إلى أنبوب طرد مركزي جديد سعة 12 مل.
2. الاختيار السلبي لخلايا CD4 + T
ملاحظة: للاختيار السلبي للخلايا التائية CD4 + ، يتم استخدام مجموعة عزل الخلايا التائية التي تحتوي على مانع FcR ، والأجسام المضادة الحيوية ضد الخلايا التائية غير CD4 + ، والجسيمات المغناطيسية المطلية بالستربتافيدين.
- أضف 20 ميكرولتر / مل من مانع FcR للماوس من مجموعة عزل الخلايا التائية إلى تعليق الخلية.
- علاوة على ذلك ، أضف 100 ميكرولتر من كوكتيلات عزل الخلايا التائية CD4 + بتركيز 50 ميكرولتر / مل ، واخلطها جيدا ، واحتضنها لمدة 10 دقائق في درجة حرارة الغرفة (RT).
- الجسيمات المغناطيسية المطلية بالستربتافيدين الدوامة لمدة 30 ثانية ، أضف 150 ميكرولتر إلى تعليق الخلية ، واخلطها جيدا ، واحتضانها لمدة دقيقتين و 30 ثانية في RT.
- أضف DPBS إلى تعليق الخلية ، واملأه بحجم إجمالي يبلغ 7 مل. تأكد من تحريك الماصة لأعلى ولأسفل برفق، ثم احتضنها في المغناطيس لمدة دقيقتين و 30 ثانية عند RT.
- بعد ذلك ، اجمع الخلايا التائية المخصبة برفق في المادة الطافية وانقلها إلى أنبوب طرد مركزي جديد سعة 12 مل.
- خلايا الطرد المركزي عند 300 × جم عند RT لمدة 5 دقائق.
- تخلص من المادة الطافية.
- أعد تعليق خلايا CD4+ T المعزولة والمخصبة في 1 مل من DPBS، مع سحب العينة جيدا لأعلى ولأسفل. احتضان الخليط لمدة 2 دقيقة و 30 ثانية في المغناطيس عند RT لضمان عدم تلوث الخرزة.
- اجمع المادة الطافية ، وانقله إلى أنبوب طرد مركزي جديد واحسب الخلايا التائية المخصبة.
- لحساب الخلايا ، قم بتلطيخ الخلايا باللون الأزرق والعد باستخدام عداد الخلايا الآلي.
ملاحظة: من الأفضل تحميل خلايا CD4 + T المعزولة مباشرة وتصويرها في نفس يوم العزل. ومع ذلك ، يمكن زراعة الخلايا التائية الأولية للفئران دون أي تحفيز بين عشية وضحاها في حاضنة عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 في وسط عزل (RPMI 1640 + 10٪ FCS + P / S).
3. تحميل خلايا CD4 + T الأساسية للماوس
ملاحظة: لقياس تركيزات العصارة الخلوية الحرة Ca2+ ، يتم استخدام الأصباغ الفلورية ونفاذة الغشاء في تجارب التصوير Ca2+ . مزيج من إستر Fluo-4- acetoxymethyl (AM) والصبغة النسبية Fura Red-AM بمثابة مؤشر للكشف السريع عن إشارات Ca2+ المحلية. تأكد من العمل في الظلام أثناء استخدام أصباغ الفلورسنت.
- جهاز طرد مركزي 2-5 × 106 خلايا لمدة 5 دقائق ، 300 × جم ، تخلص من المادة الطافية وأعد تعليقها في 480 ميكرولتر من وسط الخلية التائية (RPMI 1640 ، 10٪ FCS) مع 10 ميكرومتر Fluo-4-AM (المخزون: [1 مليمتر]) ، و 20 ميكرومتر Fura Red-AM (المخزون: [4 مليمتر]).
- احتضن في البداية لمدة 20 دقيقة في RT تحت المقعد في الظلام ، وقم بتغطية الصقر بورق الألمنيوم.
ملاحظة: لا تتجاوز وقت الحضانة الأول ، حيث يتم تخفيف مؤشرات Ca2+ في DMSO ، مما قد يكون ضارا بالخلايا في وقت التعرض الأطول في الحجم الكلي المنخفض. حافظ على الخلايا محمية من الضوء بعد التحميل بسبب حساسية الأصباغ للضوء. - في نهاية الحضانة الأولية التي تبلغ 20 دقيقة ، أضف 2 مل من وسط الخلية التائية إلى الخلايا واستمر في الحضانة لمدة 30 دقيقة إضافية في الظلام في RT.
- الطرد المركزي تعليق الخلية عند 300 × جم لمدة 5 دقائق في RT.
- تخلص من المادة الطافية ونظف الحبيبات عن طريق غسلها ب 2 مل من محلول قياس Ca2+ (140 ملي كلوريد الصوديوم ، 5 ملي كلوريد الهيدروجين ، 1 ملي ملي كلوريد4 ، 1 ملي كلوريدالكالسيوم 2 ، 20 ملي هيبيس ، 1 ملي هيدروهيدروهيدروكسيد2PO4 ، 5 ملي مولار جلوكوز ، درجة الحموضة 7.4) متبوعا بالطرد المركزي عند 300 × جم لمدة 5 دقائق في RT.
- أخيرا ، تخلص من المادة الطافية وأعد تعليقها باستخدام المخزن المؤقت لقياس Ca2+ . اضبط رقم الخلية على ~ 100,000 خلية لكل 10 ميكرولتر.
ملاحظة: يتم استخدام حجم 10 ميكرولتر لقياس واحد. تجنب الإفراط في تخفيف الخلايا ، حيث قد يحتاج المرء إلى ضبط عدد الخلايا تحت المجهر للوصول إلى المستوى الأمثل لظروف القياس. - اسمح للخلايا بالتحتضن لمدة ~ 20 دقيقة لضمان تسلل الخلايا بالكامل وإزالة الأسترة من الأصباغ. قم بتخزين الخلايا على الجليد وفي الظلام حتى القياس.
ملاحظة: يمكن استخدام الخلايا التائية الأولية المحملة حتى ~ 4 ساعات بعد التحميل.
4. التصوير المحلي Ca2+
- إعداد الشريحة
- غطاء مجهر معطف (24 مم × 46 مم) مع ألبومين مصل الأبقار (BSA ، 5 مجم / مل) وبولي L-lysine (PLL ، 0.1 مجم / مل) (الشكل 1 أ). اسمح ل BSA بالجلوس لمدة ~ 20 دقيقة قبل تطبيق PLL.
ملاحظة: الطلاء يسهل التصاق الخلية. من أجل التصاق الخلايا بشكل صحيح ، انشر بدقة كل من BSA و PLL حتى لا تظهر المزيد من الخطوط. - لإنشاء غرف تفاعل ، قم بلصق حلقات O مطاطية قابلة لإعادة الاستخدام على الشرائح باستخدام معجون سيليكون (الشكل 1 ب ، ج).
ملاحظة: يمكن استخدام الشرائح/الغرف أو الألواح الأخرى مثل الشرائح مقاس 35 مم أو الغرف المعدنية القابلة لإعادة الاستخدام أو الألواح ذات 8 أو 24 أو 48 بئرا للحصول على الصور.
- غطاء مجهر معطف (24 مم × 46 مم) مع ألبومين مصل الأبقار (BSA ، 5 مجم / مل) وبولي L-lysine (PLL ، 0.1 مجم / مل) (الشكل 1 أ). اسمح ل BSA بالجلوس لمدة ~ 20 دقيقة قبل تطبيق PLL.
- طلاء الخرز المغناطيسي للبروتين G (قطره 10 ميكرومتر) بالأجسام المضادة
- امزج معلق الخرزة المغناطيسية البروتينية برفق وانقل 12.5 ميكرولتر إلى أنبوب جديد.
- ضع الأنبوب على حامل مغناطيسي لإزالة المخزن المؤقت للتخزين والسماح للحبات بالهجرة إلى المغناطيس. قم بإزالة المخزن المؤقت للتخزين برفق عن طريق سحب العينة على الجانب الآخر من المغناطيس.
- لإزالة أي مخزن تخزين متبقي ، اغسل الخرزات بإضافة 500 ميكرولتر من PBS-T (PBS ، 0.1٪ Tween) والدوامة لمدة 10 ثوان. ضع الأنبوب في الحامل المغناطيسي مرة أخرى وقم بإزالة المخزن المؤقت.
- لتغليف الخرزات بالأجسام المضادة ، أعد تعليقها في 7.5 ميكرولتر من PBS-T وأضف 5 ميكرولتر من مضاد CD3 (0.5 مجم / مل) ومضاد CD28 (0.5 مجم / مل) ، على التوالي. احتضن لمدة 30-60 دقيقة مع الخلط المستمر في RT.
- اغسل الخرزات المطلية ثلاث مرات باستخدام 500 ميكرولتر من PBS-T ، متبوعا بغسلها مرة واحدة باستخدام 500 ميكرولتر من المخزن المؤقت لقياس Ca2+ باستخدام الحامل المغناطيسي.
- أعد تعليق الخرزات في 200-400 ميكرولتر من المخزن المؤقت لقياس Ca2+.
ملاحظة: تحقق من كثافة الخرزة أثناء القياسات ، وقم بتخفيفها إذا لزم الأمر.
- الفحص المجهري الموضعي Ca2+
ملاحظة: يتم إجراء التصوير باستخدام مجهر ضوئي للمجال الساطع مع تكبير 100 ضعف، ومزود بمصباح قوس زينون كمصدر للضوء. يتم التقاط الإطارات في وضع 14 بت مع تجميع مزدوج باستخدام كاميرا مقترنة بالشحنة لمضاعفة الإلكترون. لتسجيل وتقسيم الأطوال الموجية للانبعاث لكلتا الصبغتين ، يتم استخدام وحدة مزدوجة العرض ، تتميز بالمرشحات التالية بالنانومتر (على سبيل المثال ، 480/40 ؛ bs ، 495 ؛ em1 ، 542/50 ؛ em2 ، 650/57). يتضمن إعداد التصوير مركز اكتساب وبرنامج تصوير للحصول على الصور.- ضع 10 ميكرولتر من الخلايا المحملة على الشريحة المعدة واتركها متصلة بالشريحة لمدة 3-5 دقائق.
- أضف برفق 80 ميكرولتر من المخزن المؤقت لقياس Ca2+ إلى الشريحة.
- حدد عدسة الغمر بالزيت 100x وقم بتطبيق قطرة صغيرة من زيت الغمر. ضع الشريحة على طاولة المجهر.
- اضبط التركيز في تعديل المجال الساطع ، وحدد بعناية مجال رؤية به ما يصل إلى 10 خلايا غير متلامسة مع بعضها البعض ، واحصل على صورة.
ملاحظة: سيكون من الصعب تحليل الخلايا المتداخلة واللمس لاحقا.- قم بتشغيل المصباح ، وتحقق من تألق الخلايا التائية وتحميلها ، وقارن الخلايا في كلتا القناتين للتحقق من أنها غير نشطة مسبقا.
- تأكد من التقاط صور لمجال الرؤية لكل من قنوات المجال الساطع والفلورة قبل وبعد القياس للتحقق من حركة الخلية وتحميلها.
- ابدأ القياس والتقط النشاط القاعدي لمدة 1 دقيقة بمعدل اكتساب 1 إطار لكل 5 ثوان.
- أضف 10 ميكرولتر من المركب / المنشط (حبة أو محفز / مثبط) بعد دقيقة واحدة وقم بالقياس لمدة 3 دقائق باستخدام 40 إطارا في الثانية أو الحد الأقصى لمعدل الإطارات الممكن.
ملاحظة: إضافة الخرز هي الخطوة الحاسمة. تأكد من إضافة الخرزات بالقرب من ضوء الإثارة على الشريحة مع عدم تحريك الشريحة. تظهر أمثلة تمثيلية للمجالات الدقيقة Ca2 + في خلايا CD4 + T الأولية عند ملامسة الخرزة من WT و P2x4 - / - و P2x7 - / - في الشكل 2.
5. المعالجة اللاحقة / تحليل البيانات
ملاحظة: لمعالجة الصور وتحليل البيانات ، يتم استخدام DARTS لمسار ربط العمليات التجارية مفتوح المصدر المستند إلى Python. تم تطويره بواسطة Woelk et al.12 بناء على عمل Diercks et al.13.
- تركيب خط أنابيب DARTS
- قم بتثبيت Python 3.10.014 و anaconda15 و git16 ، واستنساخ مستودع GitHub باستخدام استنساخ الأمر الطرفي git: https://github.com/IPMI-ICNS-UKE/DARTS.git
- قم بإنشاء بيئة conda باستخدام conda create --name DARTS وقم بتثبيت جميع حزم Python الضرورية باستخدام pip install <package>.
ملاحظة: اتبع تعليمات التثبيت في مستودع DARTS GitHub17,18 للحصول على معلومات أكثر تفصيلا. - قبل استخدام التنسيقات الحيوية، تأكد من تثبيت Java Runtime Environment بشكل صحيح19.
- استخدام خط أنابيب DARTS
ملاحظة: بمجرد التثبيت ، يمكن بدء تشغيل DART من نافذة المحطة الطرفية.- انتقل إلى النسخة المحلية من مستودع DARTS (مسار القرص المضغوط / إلى / DARTS) الذي يحتوي على ملف main.py. تأكد من تنشيط بيئة conda (conda تنشيط DARTS).
- قم بتنفيذ DARTS عن طريق كتابة python main.py في نافذة المحطة الطرفية والضغط على Enter.
- في واجهة المستخدم الرسومية (GUI)، حدد دليل المصدر والنتائج بالإضافة إلى تنسيق الصورة في القسم العلوي الأيسر (انظر الشكل 3).
- حدد خصائص القياس ، مثل المقياس (البكسل لكل ميكرومتر) ، ومعدل الإطارات ، ونوع الخلية ، وما إلى ذلك. يمكن تجميع خط أنابيب المعالجة بناء على بيانات الصورة المحددة وسؤال البحث.
ملاحظة: اقرأ المزيد عن معلمات الالتفاف ، على سبيل المثال ، في الوثائقالمقابلة 20. - احفظ الإعدادات على الكمبيوتر قبل النقر فوق ابدأ. يمكن العثور على وصف أكثر تفصيلا لواجهة المستخدم الرسومية في وثائق DARTS.
- Ca2+ التصوير الدقيق واتصالات الخرزة
ملاحظة: للتصوير المحلي والتحفيز باستخدام الخرز وتحليل الصور اللاحق ، يجب أن يحدد المستخدم جهات اتصال الخرزة الخاصة بالخلية لتحديد نقطة البداية (t = 0) لفترة القياس محل الاهتمام (انظر الشكل 4). يتم تعريف ملامسة الخرزة على أنها موقع التلامس لخرزة (محفزة) مع خلية ذات أهمية. وهو يتألف من مواصفات (1) وقت ملامسة الخرزة ، على سبيل المثال ، الإطار 300 ، و (2) موضع ملامسة الخرزة بالنسبة لمركز الخلية ، على سبيل المثال ، الساعة 1 أو الساعة 12. مع إصدار DARTS الحالي ، يحتاج المستخدم إلى تحديد المعلومات وإدخالها يدويا لكل جهة اتصال حبة. استخدم الإجراء التالي لتعريف جهات اتصال الخرزة:- استخدم شريط التمرير لتحديد وقت الاتصال بين الخرزة والخلية ذات الاهتمام.
- في قائمة الخيارات على الجانب الأيمن ، حدد جهة اتصال الخرزة: x ، y ، t.
- حدد المكان الموجود على الجانب الأيسر من الصورة حيث تتلامس الخلية والخرزة.
- حدد اختيار خلية بالنقر فوق نقطة بداخلها. انقر فوق الخلية التي تحفزها هذه الخرزة ، ويفضل أن يكون ذلك في المنتصف.
- انقر فوق إضافة جهة اتصال حبة.
- كرر الخطوات 5.3.1 - 5.3.5 لكل جهة اتصال حبة إضافية في هذا الملف. بمجرد تحديد جميع جهات اتصال الخرزة ، انقر فوق الزر "متابعة ".
- تابع مع الملفات الإضافية. بعد الوصول إلى الملف الأخير ، سيبدأ البرنامج النصي تلقائيا في تحليل جميع الملفات.
- تحليل البيانات
- ابحث عن صور النسبة المعالجة وبيانات المجال المصغر لكل خلية بمرور الوقت (بما في ذلك الترجمة والسعة والحجم) وبيانات المصدر لإسقاط لوحة السهام والمزيد من الموارد في مجلد النتائج.
- لإنشاء لوحات السهام ، انتقل إلى المجلد /src/analysis/ داخل مجلد DARTS (النمط: مسار القرص المضغوط / إلى / DARTS / src / analysis) الذي يحتوي على البرنامج النصي DartboardPlotGUI.py. ثم اكتب python DartboardPlotGUI.py واضغط على Enter.
- تأكد من توفير المعلومات الضرورية وتحديد ملفات جداول البيانات من مجلد النتائج بدقة كملفات المصدر لإنشاء لوحة السهام.
النتائج
في هذا البروتوكول ، حددنا طريقة محدثة لتصوير وتحليل المجالات الدقيقة الأولية Ca2+ في خلايا T الأولية للفأر بناء على العمل السابق لمجموعتنا1،13. كان هذا النهج مفيدا في كشف مشاركة قنوات CRAC مثل ORAI1 و STIM1 و STIM2 ، بالإضافة إلى قنوات إطلاق Ca2+ داخل الخلايا مثل RyR1 في أحداث إشارات Ca2+ المبكرة 4.
للقيام بذلك ، قمنا بالتحقيق في تكوين المجال الدقيق التلقائي Ca2 + عن طريق تصوير الفأر الأولي غير المحفز Orai1 - / - و Stim1 - / - و Stim2 - / - و Ryr1 - / - ومقارنتها بخلايا الفأر التائية الأولية WT. شمل تحليل تكوين المجال الدقيق Ca2+ سرعة بدء الإشارة ، وسعة Ca2+ ، وعدد الإشارات لكل مستوى متحد البؤر. والجدير بالذكر أنه باستثناء الخلايا التائية Stim2 - / - ، أظهرت جميع خلايا KO T انخفاضا كبيرا في إشارات Ca2+ المحلية وانخفاض تركيز العصارة الخلوية القاعديةالحرة Ca 2 + مقارنة بخلايا WT. قادنا هذا إلى استنتاج أن تكوين المجالات الدقيقة Ca2+ يرتبط ارتباطا وثيقا بتفاعل ORAI1 و STIM1 و RyR14. بالإضافة إلى ذلك ، نجحنا في تحديد وتمييز المجالات الدقيقة العفوية Ca2+ في غشاء البلازما. تميزت هذه المجالات الدقيقة Ca2 + بسعة Ca2+ تبلغ 290 نانومتر ± 12 نانومتر. سمح استخدام نهج مرمز بالألوان لإشارات Ca2 + بتصور المجالات الدقيقة Ca2+ عبر الخلية. سلطت النتائج الضوء أيضا على البداية السريعة للنطاقات الدقيقة Ca2+ ، المرئية في غضون أجزاء من الثانية ، وقدرة هذه الطريقة على اكتشاف إشارات Ca2+ بعمر طويل يبلغ بضعة أجزاء من الثانية4. تم تحديد هذه المجالات الدقيقة العفوية Ca2+ لاحقا على أنها مجالات دقيقة Ca2+ تعتمد على الالتصاق (ADCM) ، لا تعتمد فقط على SOCE ولكنها تعمل أيضا عبر سلسلة إشارات FAK / PLC-γ / IP3 10 وإشراك P2X49. علاوة على ذلك ، كانت هذه التقنية أساسية في تأكيد الأوكسيديز المزدوج 1 و 2 (DUOX1 / 2) كإنزيمات منتجة ل NAADP21 و HN1L / JPT222 كواحد من البروتينات المكتشفة حديثا المرتبطة ب NAADP23.
يوضح الشكل 2 أمثلة تمثيلية للمجالات الدقيقة Ca2 + في خلايا CD4 + T الأولية عند ملامسة الخرزة من WT بالإضافة إلى الفئران P2x4 - / - و P2x7 - / - . تم تحميل الخلايا بأصباغ Ca2+ Fluo-4 AM و Fura Red AM وتم تصويرها بمعدل اكتساب 25 مللي ثانية (40 إطارا / ثانية). لتقليد تكوين مشبك الخلايا التائية ، تم تحفيز الخلايا بخرز مغلف مضاد ل CD3 / مضاد ل CD28. تم تحليل التكوين الأولي للمجال الدقيق Ca2+ قبل 1 ثانية وحتى 15 ثانية بعد ملامسة الخرزة باستخدام خط أنابيب DARTS. عند ملامسة الخرزة ، أظهرت خلية WT تكوينا سريعا للمجالات الدقيقة Ca2+ في الثانية الأولى بعد التحفيز في موقع ملامسة الخرزة (الشكل 2 أ). توسعت هذه المجالات الدقيقة Ca2+ في جميع أنحاء الخلية في ال 15 ثانية التالية بعد ملامسة الخرزة. على عكس خلية WT ، أظهرت خلايا P2x4 - / - و P2x7 - / - (الشكل 2 ب) انخفاضا في تكوين المجال الدقيق Ca2 + عند تحفيز الخرزة ، وكذلك بالنسبة ل P2x4 - / - مستوى قاعدي أقل قبل ملامسة الخرزة. تتماشى هذه النتائج التمثيلية مع النتائج المنشورة سابقا بواسطة Brock et al.9 ، مما يشير إلى تكوين المجال الدقيق Ca2 + في خلايا WT T مباشرة بعد ملامسة الخرزة على مدى 15 ثانية وإشارات أقل لكل إطار في خلايا P2x4 - / - و P2x7 - /-. علاوة على ذلك ، تم تقليل السعة في خلايا P2x4 - / بشكل كبير ، مما أدى إلى زيادة ترسيخ دور إشارات البيورينرجيك في المجالات الدقيقة Ca2+ المعتمدة على الالتصاق.
علاوة على ذلك ، يمكن أيضا استخدام هذه الطريقة لتصور المجالات الدقيقة الأولية Ca2 + في خلايا CD4 + T البشرية الأولية (الشكل 3). تماشيا مع الخلايا التائية الأولية للفئران ، يتم استحضار المجالات الدقيقة الأولية Ca2+ في موقع ملامسة الخرزة. ومع ذلك ، يبدو أن استجابة Ca2 + الإجمالية تحدث على نطاق زمني مختلف مقارنة بخلايا CD4 + T في الفئران.
تحليل إشارات Ca2+ المحلية بطريقة يدوية غير ممكن لأنه شاق للغاية وشخصي للمحقق الفردي. لذلك ، قمنا سابقا بتطوير خوارزمية في MATLAB Simulink باستخدام صناديق أدوات معالجة الصور والتحسين للمعالجة اللاحقة13 لتحليل المجالات الدقيقة المحليةCa 2+ .
في الآونة الأخيرة ، قمنا بتطوير خط أنابيب جديد مفتوح المصدر ومعالجته بعد المعالجة يسمى DARTS لتحليل المجال المصغر Ca2 + في تصوير الخلايا الحية عالي الدقة باستخدام منصة البرنامج Python12. هنا ، يمكن تحديد خوارزميات مختلفة لإزالة الالتواء ، اعتمادا على تفضيلات المستخدم ، وتطبيع شكل الخلية الذي يتم إجراؤه للتعويض عن تغيرات شكل الخلية المورفولوجية ، وتحديد معلمات محددة بالمجهر والقياس (على سبيل المثال ، المقياس ، معدل الإطارات ، الوقت المقاس) (الشكل 4).
بعد تحديد المعلمات لتحليل المجال المصغر Ca2 + ، يتم فتح نافذة منبثقة ثانية لكل قياس فردي لتحديد جهة اتصال الخرزة (الشكل 5). لتحديد جهة اتصال الخرزة ، يمكن للمستخدم التمرير يدويا عبر ملف tiff باستخدام شريط التمرير وتحديد إطار جهة اتصال الخرزة بشكل فردي. يتم تحديد جهة اتصال الخرزة بالنقر فوق موقع اتصال الخرزة (الشكل 5 ، يشار إلى اتصال الخرزة والخرزة بالحلقة الصفراء والسهم) بالإضافة إلى اختيار الخلية. يجب تكرار هذه الخطوة لكل خلية ذات أهمية. أخيرا ، يتم تطبيق المعالجة اللاحقة للصور الآلية ويتم تلخيص بيانات النتائج وحفظها في جدول بيانات.
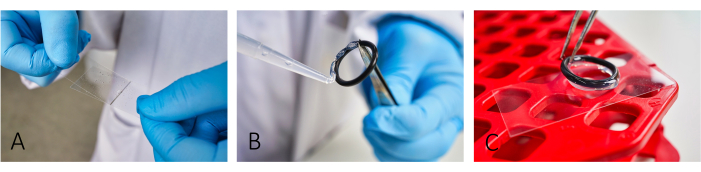
الشكل 1: سير عمل إعداد الشرائح للتصوير. (أ) أضف وانشر كل من BSA و PLL على الشريحة باستخدام زلة غطاء زجاجية ثانية. (ب ، ج) لبناء غرفة ، قم بلصق الحلقات المطاطية باستخدام شحم السيليكون على الشريحة. تأكد من تغطية الحلقة بأكملها بطبقة رقيقة من الشحوم للحصول على عزل مناسب للغرفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
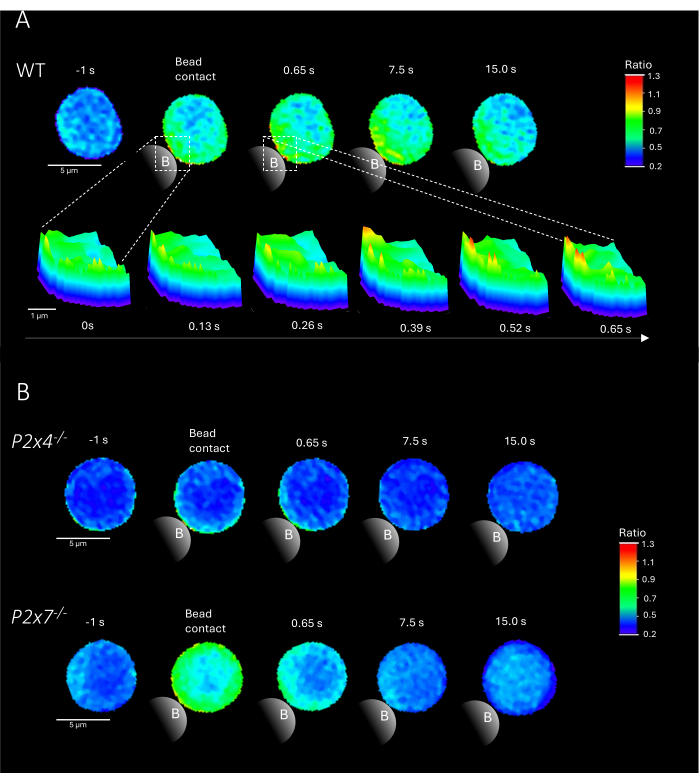
الشكل 2: الخلايا التمثيلية للمجالات الدقيقة Ca2+ المعتمدة على مستقبلات الخلايا التائية في خلية الفئران البرية الأولية (WT) (A) أو P2x4 - /- أو P2x7 - / (B) CD4 + T الخلية. تم عزل خلايا CD4 + T سلبا وتحميلها ب Fluo-4 AM و Fura Red ، كما هو موضح أعلاه. تم تحليل الخلايا التائية باستخدام خط أنابيب DARTS ، مما أدى إلى صور خلوية قابلة للمقارنة بالنتائج المنشورةسابقا 9. (أ) الخلية التائية الأولية WT 1 ثانية قبل التحفيز بخرز مغلف مضاد ل CD3 / مضاد ل CD28 وما يصل إلى 15 ثانية بعد التحفيز (شريط المقياس 5 ميكرومتر) ، بالإضافة إلى مخطط سطح ثلاثي الأبعاد للتكبير من 0 ثانية إلى 0.65 ثانية في منطقة التلامس مع الخرزة (شريط المقياس 1 ميكرومتر). (ب) الممر العلوي: ممثل P2x4-/- الخلية التائية الأولية 1 ثانية قبل وحتى 15 ثانية بعد تحفيز الخرزة. الممر السفلي: ممثل P2x7 - / - الخلية التائية الأولية 1 ثانية قبل وحتى 15 ثانية بعد تحفيز الخرزة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
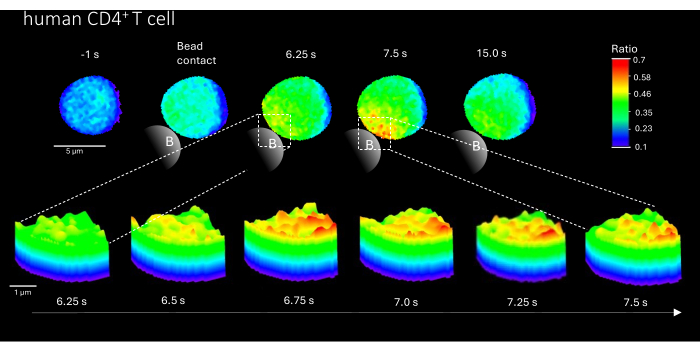
الشكل 3: المجالات الدقيقة Ca2+ في خلية تائية بشرية أولية تمثيلية بعد تحفيز TCR. تم عزل الخلايا التائية البشرية الأولية CD4 + من خلايا الدم المحيطية أحادية النواة (PBMCs) عن طريق فرز الخلايا المنشطة بالفلورة (FACS) من المعاطف المصقولة وتحميلها ب Fluo-4 AM و Fura Red ، كما هو موضح أعلاه. يوضح الشكل خلية تائية بشرية أولية 1 ثانية قبل التحفيز بخرز مغلف بمضاد ل CD3 وما يصل إلى 15 ثانية بعد التحفيز (شريط المقياس 5 ميكرومتر) ، بالإضافة إلى مخطط سطح ثلاثي الأبعاد للتكبير من 6.25 ثانية إلى 7.5 ثانية في منطقة ملامسة الخرزة (شريط المقياس 1 ميكرومتر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
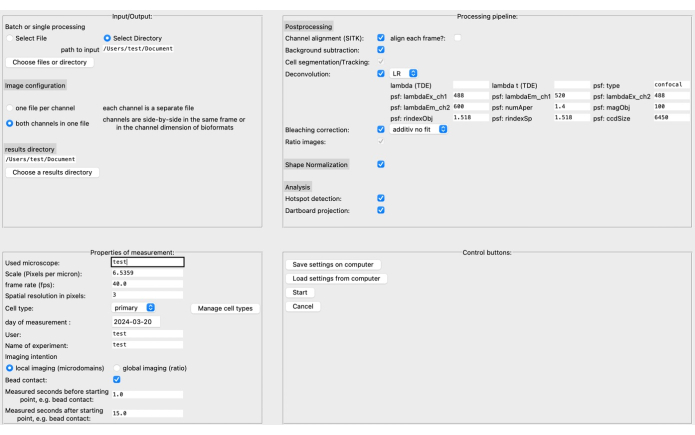
الشكل 4: واجهة المستخدم الرسومية DARTS (GUI). تنقسم واجهة المستخدم الرسومية إلى أربع مناطق. في منطقة الإدخال/الإخراج، تحتاج إلى توفير معلومات حول البيانات الأولية، بما في ذلك الدليل المصدر وتكوين الصورة (إما قناتان لكل ملف أو قنوات منفصلة)، بالإضافة إلى دليل النتائج. في منطقة خصائص القياس ، يجب وصف التجربة بجميع معلوماتها ذات الصلة ، مثل المقياس (ميكرون لكل بكسل) ومعدل الإطارات والفاصل الزمني للقياس بالنسبة لنقطة البداية المحددة لاحقا. بعد ذلك ، يمكن تجميع خط أنابيب معالجة يتكون من خطوات ما بعد المعالجة ، وتطبيع الشكل ، والتحليل الفعلي (اكتشاف المجال المصغر وتراكم بيانات لوحة السهام). أخيرا ، يمكن حفظ الإعدادات على الكمبيوتر أو تحميلها منه. بمجرد إعداد التحليل ، انقر فوق ابدأ للمتابعة. لقراءة المزيد حول الإعداد، تفضل بزيارة https://ipmi-icns-uke.github.io/DARTS/General/Usage.html. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
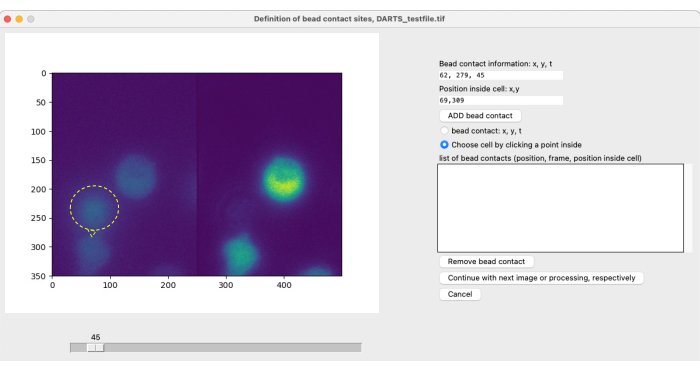
الشكل 5: التعريف اليدوي لاتصالات الخرزة. إذا تمت إضافة الخرزات إلى الخلايا أثناء التجربة ، فيجب تحديد وقت التلامس الأولي للحبة مع خلية ذات أهمية وموقع جهة الاتصال يدويا. يتم ذلك عن طريق التمرير عبر الإطارات باستخدام شريط التمرير والعثور على موضع (x ، y) عند نقطة زمنية t. لملء حقل معلومات جهة اتصال الخرزة تلقائيا ، ينقر المستخدم على النصف الأيسر من صورة المجهر في موضع ملامسة الخرزة. بعد ذلك ، لربط خلية بجهة اتصال الخرزة ، ينقر المستخدم على موضع داخل الخلية التي تحتوي على جهة اتصال خرزة. يجب تأكيد المعلومات عن طريق تحديد إضافة حبة الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وصفنا بروتوكولا شاملا لتصوير الخلايا الحية عالي الدقة للمجالات الدقيقة المحلية Ca2+ في الفئران الأولية والخلايا التائية البشرية الناتجة عن تحفيز TCR / CD3 من خلال حبات مغلفة بالأجسام المضادة. علاوة على ذلك ، قمنا بتنفيذ خوارزمية سهلة الاستخدام ومفتوحة المصدر تستند إلى Python لتحديد وتحليل إشارات Ca2+ المحلية. والجدير بالذكر أن البروتوكول لا يقتصر على الكشف عن المجالات الدقيقة Ca2+ في سياق تحفيز TCR / CD3 ولكنه قابل للتكيف مع أنواع الخلايا الأخرى (المناعية) مثل خطوط الخلايا NK (KHYG-1) 12 أو المجالات الدقيقة Ca2+ المستقلة عن TCR10،11.
الخطوة الحاسمة في البروتوكول هي حجم وعدد الخرزات المحفزة. لتقليد المشبك المناعي ، يجب أن تكون الخرزات متشابهة في الحجم مع الخلايا. ومن ثم ، بالنسبة للفئران الأولية والخلايا التائية البشرية وكذلك خطوط الخلايا (Jurkat و KHYG1) ، نستخدم حبات مغناطيسية بقطر 10 ميكرومتر. علاوة على ذلك ، يجب تحفيز كل خلية فقط بواسطة حبة واحدة. لذلك ، يجب أن يكون عدد الخرزات المضافة إلى كل شريحة كافيا من ناحية ، ولكن إذا كان هناك عدد كبير جدا من الخرز في مجال الرؤية ، تزداد الخلفية ، ولا يمكن اكتشاف نقطة زمنية واحدة للتنشيط وجانب الاتصال.
يستخدم البروتوكول الفلورسنت Ca2+ الأصباغ Fluo-4 AM و FuraRed AM بطريقة نسبية ، مما يسمح بمعايرة البيانات13. بالإضافة إلى ذلك ، يمكن تكييف البروتوكول مع أزواج مؤشرات Ca2+ الأخرى ، ولكن يجب توخي الحذر في عملية الاختيار من حيث حركية ربط Ca2+ ، والتوزيع تحت الخلوي ، والتبييض الضوئي1. علاوة على ذلك ، يجب تطوير ظروف التحميل وتحسينها لكل نوع خلية على حدة ، لكن التركيزات المشار إليها هنا هي نقطة انطلاق جيدة. لتصور المجالات الدقيقة Ca2+ ، يجب أن يكون Kd لأصباغ Ca2+ في حدود 300-1200 نانومتر ويجب أن يكون وقت الاستحواذ لكل إطار ≤60 مللي ثانية. إذا كانت شدة التألق منخفضة جدا ، فيجب فحص مجموعة المرشحات ، ولكن من الممكن أيضا تحميل كمية مضاعفة من صبغة Ca2+ في الخلايا التائية. ومع ذلك ، يمكن أن تخطئ صبغة Ca2 + في عضيات أخرى أو تعزل عن الحويصلات ، ولكنها قد تعمل أيضا كمخزن مؤقت Ca2+ وتؤثر على استجابات Ca2+ .
أحد قيود خوارزمية التحليل هو افتراض شكل كروي للخلية. وبالتالي ، قد تحتاج أنواع الخلايا ذات الأشكال المختلفة إلى تكييف صندوق أدوات التحليل. تم استخدام الخوارزمية لتحليل المجالات الدقيقة المحلية Ca2+ في الخلايا التائية الأولية للفئران ، بالإضافة إلى خلايا Jurkat T وخط الخلايا NK (KHYG-1) 12 ونجحت في تحليل المجالات الدقيقة Ca2+ لخط الخلايا العصبية الفئرانية (N2a ، بيانات غير منشورة). من حيث المبدأ ، يمكن استخدام صندوق أدوات البروتوكول والتحليل لتحليل أنواع الخلايا غير الكروية مثل خلايا HEK293 أو HeLa ، ولكن بالنسبة لهذه الأنواع من الخلايا ، لا يمكن تكييف إسقاط لوح السهام لأنه يعتمد على بنية دائرية وتطبيع شكل الخلايا. بالإضافة إلى ذلك ، يمكن تكييف بروتوكول الكشف عن المجالات الدقيقة الأولية الموضعية Ca2 + عند تحفيز الخرزة لتحليل إشارات Ca2+ المحلية المشتقة من محفزات أخرى ، مثل المركبات المنشطة أو المثبطة القابلة للذوبان ، بالإضافة إلى المجالات الدقيقة المعتمدة على الالتصاق و TCR / CD3 المستقلة Ca2 + 10،11. وتجدر الإشارة إلى أنه من الأسهل تحديد اتصال حبة واحدة من حيث الوقت والموقع بدلا من تحديد نقطة البداية للتنشيط بعد المركبات القابلة للذوبان.
يكمن القيد العام للكشف عن تكوين المجال الجزئي Ca2+ في الاستبانة الزمانية المكانية العالية المطلوبة ونسبة الإشارة إلى الضوضاء العالية الضرورية (SNR). حاليا ، تصل الدقة المشتقة من إعدادنا إلى دقة مكانية محسوبة تبلغ ~ 0.368 ميكرومتر ودقة زمنية ~ 40 إطارا في الثانية (fps) 1. قد تؤدي التطورات الحديثة في تطوير الكاميرا وأجهزة الكشف ، بالإضافة إلى تحسين الأصباغ الفلورية ، إلى إمكانية الوصول إلى تسجيلات بصرية أحادية القناة كما تم وصفها ل ORAI-GECI (مؤشرات Ca2 + المعبر عنها وراثيا)24 لتصوير الخلايا الحية باستخدام مؤشرات Ca2 + بدقة زمنية ومكانية أعلى في المستقبل.
مجتمعة ، يمكن استخدام البروتوكول وأداة التحليل لتصوير المجال الدقيق Ca2 + عالي الدقة الموصوف هنا ليس فقط لتحليل إشارات Ca2+ المحلية الأولية في الخلايا التائية ولكن يمكن أيضا تكييفها مع أنواع الخلايا الأخرى لفك تشفير أهمية إشارات Ca2 + المحلية في هذه.
Disclosures
ويؤكد المؤلفون أن البحث أجري في غياب أي علاقة تجارية أو مالية يمكن اعتبارها تضاربا محتملا في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل Deutsche Forschungsgemeinschaft (DFG) (المشروع رقم 335447717; SFB1328 ، A02 إلى B-PD و RW ؛ A14 إلى ET ؛ رقم المشروع 516286863 إلى B-PD). يشكر المؤلفون المتبرعين بالدم وقسم طب نقل الدم في UKE على تعاونهم.
Materials
| Name | Company | Catalog Number | Comments |
| α-CD3 | BD Pharmingen | 553058 | |
| α-CD28 | BD Pharmingen | 553295 | |
| Anaconda | Anaconda | https://docs.anaconda.com/free/anaconda/install/index.html | |
| Bovine serum albumin | Sigma-Aldrich | A2058 | |
| Cell strainer | Biofil | CSS-013-070 | 70 µm diameter |
| Countess Automated Cell Counter | Invitrogen | A49865 | |
| Cover slips | Paul Marienfeld GmbH | 101202 | |
| DARTS | GitHub | https://github.com/IPMI-ICNS-UKE/DARTS | |
| Dulbecco’s Phosphate buffered saline | Gibco, Thermo Fisher | 14190144 | |
| EasySep CD4+ T cell Isolation Kit | Stemcell | 19852 | |
| EasySep Magnetic Multistand | Stemcell | 18010 | |
| Fluo 4-AM | Invitrogen | F14201 | |
| Fura Red-AM | Invitrogen | F3020 | |
| Gibco RPMI 1640 medium | Gibco, Thermo Fisher | 11875093 | |
| Git | GitHub | https://git-scm.com/book/en/v2/Getting-Started-Installing-Git | |
| immersion oil | Leica | 11513859 | |
| Newborn calf serum | Sigma-Aldrich | N4637 | |
| Oracle | Oracle | https://www.oracle.com/de/java/technologies/downloads/ | |
| Penicillin/Streptamycin | Gibco, Thermo Fisher | 15240062 | |
| Poly-L-lysine | Sigma-Aldrich | P4707 | |
| Protein G magnetic beads | Merck | LSKMAGG02 | 10 µM diameter |
| Python | Python | https://www.python.org/downloads/ | |
| Silicon grease (basylone) | Bayer | 291-1220 | |
| Time-Dependent Entropy Deconvolution | GitHub | https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters | |
| Tween | q-biogene | TWEEN201 |
References
- Wolf, I. M. A., et al. Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor. Sci Signal. 8 (398), 102(2015).
- Taguchi, T., Mukai, K. Innate immunity signalling and membrane trafficking. Curr Opin Cell Biol. 59, 1-7 (2019).
- Trebak, M., Kinet, J. -P. Calcium signalling in T cells. Nat Rev Immunol. 19 (3), 154-169 (2019).
- Diercks, B. -P., et al. ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation. Sci Signal. 11, 0358(2018).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: Elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1 (1), 11-21 (2000).
- Kummerow, C., Junker, C., Kruse, K., Rieger, H., Quintana, A., Hoth, M. The immunological synapse controls local and global calcium signals in T lymphocytes. Immunol Rev. 231 (1), 132-147 (2009).
- Brock, V. J., et al. P2X4 and P2X7 are essential players in basal T cell activity and Ca2+ signaling milliseconds after T cell activation. Sci Adv. 8 (5), 9770(2022).
- Weiß, M., et al. Adhesion to laminin-1 and collagen IV induces the formation of Ca2+ microdomains that sensitize mouse T cells for activation. Sci Signal. 16 (790), 9405(2023).
- Diercks, B. -P. The importance of Ca2+ microdomains for the adaptive immune response. Biochim Biophys Acta Mol Cell Res. 1871 (5), 119710(2024).
- Woelk, L. -M., et al. DARTS: an open-source Python pipeline for Ca2+ microdomain analysis in live cell imaging data. Front Immunol. 14, 1299435(2024).
- Diercks, B. -P., Werner, R., Schetelig, D., Wolf, I. M. A., Guse, A. H. High-resolution calcium imaging method for local calcium signaling. Methods Mol Biol. 1929, 27-39 (2019).
- Python. Python. , Available from: https://www.python.org/downloads/ (2024).
- Anaconda. Anaconda. , Available from: https://docs.anaconda.com/free/anaconda/install/index.html (2024).
- git. git. , Available from: https://git-scm.com/book/en/v2/Getting-Started-Installing-Git (2024).
- DARTS. DARTS. , Available from: https://github.com/IPMI-ICNS-UKE/DARTS (2024).
- DARTS. DARTS GitHub Repository. , Available from: https://ipmi-icns-uke.github.io/DARTS/ (2024).
- Oracle. , Available from: https://www.oracle.com/de/java/technologies/downloads/ (2024).
- Time-Dependent Entropy Deconvolution. , Available from: https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters (2024).
- Gu, F., et al. Dual NADPH oxidases DUOX1 and DUOX2 synthesize NAADP and are necessary for Ca2+ signaling during T cell activation. Sci Signal. 14 (709), 3800(2021).
- Roggenkamp, H. G., et al. HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation. Sci Signal. 14 (675), 5647(2021).
- Heßling, L. D., Troost-Kind, B., Weiß, M. NAADP-binding proteins - Linking NAADP signaling to cancer and immunity. Biochim Biophy. Acta Mol Cell Res. 1870 (7), 119531(2023).
- Dynes, J. L., Amcheslavsky, A., Cahalan, M. D. Genetically targeted single-channel optical recording reveals multiple Orai1 gating states and oscillations in calcium influx. Proc Natl Acad Sci U S A. 113 (2), 440-445 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved