A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إجراءات التشغيل والاحتواء الحيوي لمنشأة لفئران المختبر ذات الميكروبيوم الطبيعي: إجراء التنميط المناعي
* These authors contributed equally
In This Article
Summary
هنا ، نصف الهيكل وإجراءات التشغيل ، بما في ذلك تدابير الاحتواء الميكروبي لمنشأة "الفئران البرية" باستخدام أخذ عينات الدم للتنميط المناعي كمثال.
Abstract
يوفر استخدام فئران المختبر ذات الميكروبيوم الطبيعي ، مثل "الفئران البرية" ، أداة بحثية واعدة لكل من العلوم الأساسية والتطبيقية نظرا لتشابهها الوثيق مع الكائن الحي البشري الخارق. ومع ذلك ، فإن تربية وصيانة هذه الفئران ، التي تؤوي ميكروبيوم متنوع بما في ذلك البكتيريا والفيروسات والطفيليات ، تشكل تحديات كبيرة لمرافق تربية في المؤسسات البحثية. لمواجهة هذه التحديات ، تم تطوير مفهوم منشأة متخصصة لإسكان "الفئران البرية" في Charité - Universitätsmedizin Berlin. تضمن هذا النهج تصميم منشأة ذات ميزات هيكلية محددة وبروتوكولات تشغيلية لاحتواء الميكروبيوم الطبيعي بشكل فعال ، وبالتالي حماية المناطق ذات معايير النظافة الأعلى.
تم عرض منهجية لأخذ عينات الدم من كل من الحماية من الأمراض المحددة الخالية من مسببات الأمراض (SPF) و "الفئران البرية" للتنميط المناعي ، مما يسلط الضوء على سير العمل وتدابير الاحتواء الحيوي المنفذة في المنشأة. تكشف النتائج الرائعة أن "الفئران البرية" المعرضة لميكروبيوم طبيعي تطور مجموعات خلايا مناعية مميزة ، والتي يتم تقليصها بشكل كبير في الفئران التي يتم تربيتها وصيانتها في ظل ظروف نظافة صارمة.
تكمن أهمية هذه الدراسة في قدرتها على تزويد الباحثين بإمكانية الوصول إلى الفئران التي تمتلك ميكروبيوم طبيعي وجهاز مناعة ناضج مشابه لتلك الموجودة لدى البالغين. يمكن أن يعزز هذا النهج قابلية ترجمة النتائج قبل السريرية إلى ممارسة سريرية ، وبالتالي تطوير مجال البحوث الطبية الحيوية.
Introduction
لا تزال التجارب على الفئران لا غنى عنها في العلوم الأساسية والتطبيقية ، مثل البحوث قبل السريرية والسمية. ومع ذلك ، فإن توحيد النظافة في بيئات المختبرات ، الذي يهدف إلى تقليل الضوضاء البيولوجية وتقليل التباين في النتائج التجريبية ، أدى إلى استبعاد الجراثيم الطبيعية إلى حد كبير. وبالتالي ، فإن الظروف التي تولد فيها فئران المختبر القياسية صحيا والخالية من مسببات الأمراض (SPF) وتحتفظ بها تختلف عن ظروف العالم الحقيقي التي يتعرض لها البشر عادة. يؤدي عدم التطابق هذا بين ظروف المختبر والبيئات الطبيعية التي تحدث فيها الأمراض البشرية إلى "مغالطة التوحيد القياسي": بافتراض أن تقليل التباين في الظروف التجريبية يحسن النتائج الانتقالية. ومع ذلك ، في الواقع ، فإنه يحد من الأهمية البيولوجية للنتائج1،2. على سبيل المثال ، أظهرت الأبحاث أن غياب التنوع الميكروبي والبيئي في الفئران SPF يمكن أن يؤدي إلى تخلف جهاز المناعة ، مما يقوض صحة الدراسات المناعية وما قبلالسريرية 3.
تم اقتراح العديد من الأساليب لمعالجة التباين البيولوجي في نماذج الفئران ، ولكل منها مزاياها وقيودها الخاصة ، بما في ذلك السكن المشترك مع الفئران الوحشية الأليفة3،4،5،6،7،8 ، والتعرض المتسلسل للحيوانات9 ، وإبقاء في حاويات خارجية10 أو على فراش من الكبيرة11 ، وزرع البراز من الفئران البرية12. نموذج الفأر الجديد الواعد للأبحاث قبل السريرية والسمية هو نموذج "الفئران البرية" ، والذي يتكون من سلالات فئران المختبر القياسية التي تؤوي ميكروبيومطبيعي 13. يتم إنشاء هذه "الفئران البرية" عن طريق زرع أجنة من سلالات فئران المختبر إلى الفئران التي يتم اصطيادها في البرية. أثناء الولادة ، تكتسب سلالات فأر المختبر الميكروبيوم الطبيعي لأمهاتها البديلات ، وتحاكي التلقيح الطبيعي الذي يحدث أثناء الولادةالبشرية 13. يمكن تربية "الفئران البرية" مثل أي سلالة أخرى من فئران المختبر ، مع الحفاظ على ميكروبيومها الطبيعي عبر الأجيال.
تستضيف "الفئران البرية" ميكروبات متنوعة - بما في ذلك البكتيريا والفيروسات والطفيليات - والتي يتم استبعادها عادة من مرافق الفئران SPF. وبالتالي ، فإن الحفاظ على ميكروبيوم طبيعي في مرافق البحث يمثل تحديات ، حيث يجب احتواء هذه الميكروبات دون المساس بمعايير النظافة العامة لعامل الحماية من الشمس.
في Charité - Universitätsmedizin Berlin ، تم إنشاء منشأة مخصصة ل "الفئران البرية" ، مفصولة عن مناطق SPF من خلال تدابير احتواء حيوي صارمة. تشتمل المنشأة على غرف تربية وتجريب ، مما يضمن الحفاظ على الميكروبيوم الطبيعي ل "الفئران البرية" أثناء حماية مناطق SPF (الشكل 1).
تم استيراد الأزواج المؤسسين لمستعمرة Charité من مستعمرة "الفئران البرية" التي تم إنشاؤها في قسم أبحاث الميكروبيوم ، مستشفى جامعة إرلانغن ، جامعة فريدريش ألكسندر إرلانغن نورنبرغ (FAU) ، ألمانيا. يتم تزويدهم بشهادة صحية ومراقبتهم بلوحة موسعة لمسببات الأمراض الحيوانية المنشأ قبل استيراد مؤسسي المستعمرة. سيتم استخدام الحراس لمراقبة الميكروبيوم بمرور الوقت. يتم إيواء كل من عامل الحماية من الشمس و "الفئران البرية" في نفس الظروف. يتم تربية الفئران والاحتفاظ بها بشكل تفضيلي في أقفاص ذات تهوية فردية (IVC) من النوع الثاني في مجموعات من خمسة فئران. درجة الحرارة داخل المنشأة 22 درجة مئوية ، ودورة الضوء / الظلام 12 ساعة. تتلقى الفئران طعاما قياسيا قائما على الحبوب وماء الصنبور. تعقيم الفراش وعناصر التخصيب غير ضروري ل "الفئران البرية". ومع ذلك ، فإن تعقيم هذه العناصر يمنع خلط المواد في المناطق التي توجد بها الفئران SPF.
في هذا البروتوكول ، يتم توضيح إجراءات التنميط المناعي لكل من عامل الحماية من الشمس و "الفئران البرية" ، مما يسلط الضوء على بروتوكولات الاحتواء الميكروبي الصارمة في منشأة "الفأر البري". تضمن هذه التدابير سلامة بيئات SPF مع توفير فوائد العمل مع الفئران التي تحمل ميكروبيوم طبيعي.
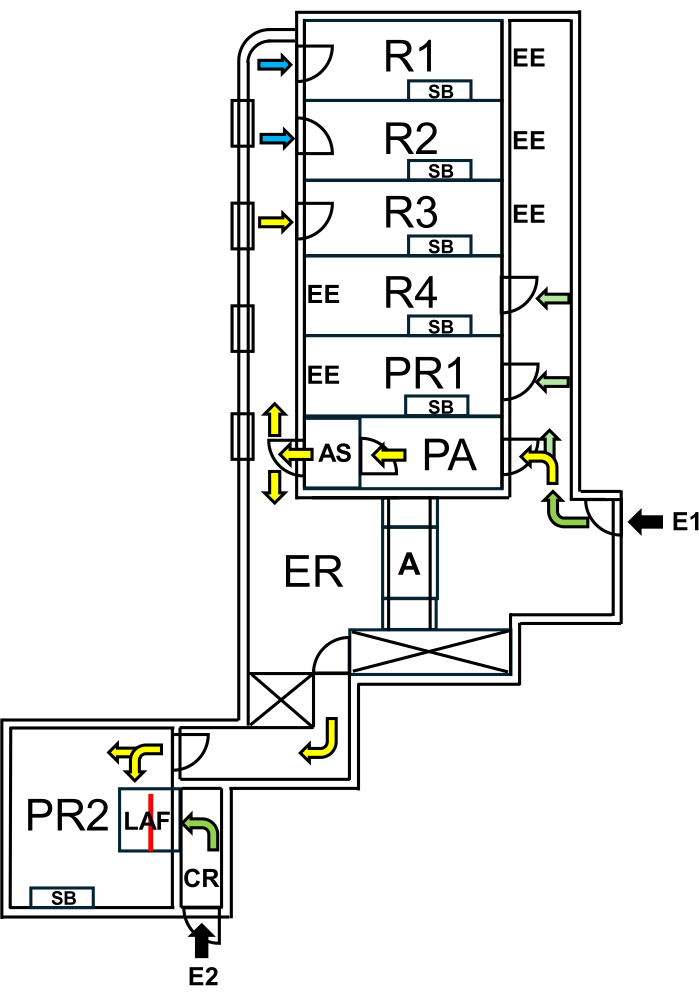
الشكل 1: تخطيط منشأة الفئران البرية. E1 = الوصول إلى المنشأة. تشير الأسهم إلى طريق الدخول إلى المنشأة. E2 = الوصول إلى كابينة تدفق الهواء الصفحي من خارج المنشأة. PA = غرفة معادلة الضغط للأفراد مع دش الهواء. AS = دش الهواء. R1 ، R2 = غرف لتربية الفئران البرية. R3 = مساحة لحفظ الفئران البرية. R4 = مساحة لحفظ الفئران SPF. PR1 = غرفة إجراء للفئران SPF. PR2 = غرفة إجراء للفئران البرية. SB = مقعد عمل معقم. EE = مخارج الطوارئ. CR = غرفة تغيير الملابس أمام مقصورة LAF. LAF = كابينة تدفق الهواء الصفحي للتدخلات تحت تدفق الهواء الواقي. أ = الأوتوكلاف. ER = غرفة المعدات. تمثل الأسهم الخضراء الطرق التي يمكن الوصول إليها عند العمل مع SPF ، وتشير الأسهم الصفراء إلى المسارات المتاحة للعمل مع الفئران البرية بعد الاستحمام بالهواء. تشير الأسهم الزرقاء إلى الوصول لموظفي التربية فقط. يشير الخط الأحمر إلى الجدار الزجاجي داخل مقصورة LAF ، والذي يقسم المساحة إلى قسمين يمكن الوصول إليهما إما من E1 عبر PR2 أو من E2 عبر CR. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
تمت الموافقة على مرفق "الفئران البرية" والإجراءات التي تنطوي على الحية من قبل مكتب الدولة المسؤول عن التجارب على ، "Landesamt für Gesundheit und Soziales Berlin" (LAGeSo). يتم تلخيص أهم خطوات البروتوكول في الشكل 2.
1. الوصول إلى منشأة Wilding
- احصل على مقدمة شخصية لإجراءات التشغيل والاحتواء الحيوي للمنشأة من مسؤول رعاية المسؤول.
- احصل على مفتاح جهاز الإرسال والاستقبال لدخول المنشأة ل "الفئران البرية" وحجز غرف الإجراءات عبر نظام الحجز عبر الإنترنت.
2. دخول منشأة "الفئران البرية"
- قم بإيداع الملابس في غرفة تغيير الملابس.
- قم بالتغيير إلى ملابس المنطقة: السراويل والكساك وأغطية الأحذية التي تستخدم لمرة واحدة (الشكل 3).
3. أخذ عينات من الدم من الفئران SPF في منطقة SPF
- انقل الفئران SPF (ذكور وإناث ، من 8 إلى 20 أسبوعا) من الغرفة التي يتم الاحتفاظ بها (R4) إلى غرفة الإجراءات لحيوانات SPF (PR1) في قفص IVC مغلق.
- قم بتشغيل مقعد التدفق الرقائقي وقم بتطهير سطح مساحة العمل بنسبة 70٪ Vol. العمل داخل المقعد.
- افحص الأنابيب الشعرية بحثا عن الأقسام المكسورة أو المتكسرة لتجنب زيادة خطر الكسر أو الضرر.
- تحت التخدير العام القصير مع الأيزوفلوران (الحث عند 5٪ من الأيزوفلوران في الهواء الطبي المخصب بالأكسجين ، متبوعا بنسبة 1.5٪ -2.0٪ للصيانة) ، بعد فقدان منعكس انسحاب الدواسة (كما هو موضح عن طريق قرصة إصبع القدم) ، قم بضغط أوردة عنق الفئران عن طريق الإمساك بقشرة الرقبة.
- باستخدام يد واحدة ، قم بتأمين رأس باستخدام الإبهام والسبابة. أدخل الشعيرات الدموية الجديدة في الكانثوس الإنسي للعين تحت الغشاء المزج بزاوية 45 درجة. تأكد من وضع الشعيرات الدموية بين مقلة العين والمدار العظمي للعين.
ملاحظة: لتجنب الصدمة ، لا تدع طرف الأنبوب الشعري يلمس سطح العين. - أدخل الشعيرات الدموية من خلال غشاء الجيوب الأنفية بحركة دوران محورية لطيفة. استمر في تدوير الأنبوب في الجزء الخلفي من المدار حتى يتدفق الدم. اجمع ما لا يقل عن 15 ميكرولتر من الدم في أنبوب جمع الدم الذي يحتوي على حمض الإيثيلين ديامين تترا أسيتيك (EDTA) (حوالي 1 قطرة).
- قبل إزالة الشعيرات الدموية ، قم بفك قبضة الرقبة للحفاظ على النزيف في الأنسجة إلى الحد الأدنى. لضمان الإرقاء الجيد ، استخدم وسادة شاش نظيفة أو مسحة لوقف النزيف.
- قم بتدوير الأنبوب قليلا لخلط الدم و EDTA. لا تهز الأنبوب. قم بتخزين عينة الدم على الثلج.
- تطهير سطح العمل وإيقاف تشغيل مقعد التدفق الصفحي. أعد الفئران SPF في IVC مغلق إلى غرفة الإسكان SPF (R4).
4. دخول المنطقة ل "الفئران البرية"
- قم بإزالة الأحذية والجوارب في غرفة انتظار الدش الهوائي (PA). ارتد جوارب المنطقة ومعدات الحماية الشخصية لكامل الجسم (PPE) التي تتكون من Tyvek بشكل عام ، وشبكة الشعر ، إذا لزم الأمر ، والقفازات القطنية ، وقفازات النتريل ، وأقنعة الوجه (الشكل 3).
- أدخل الدش الهوائي في الجوارب عبر غطاء الأرضية اللاصق. أثناء الاستحمام بالهواء ، ارفع الذراعين وقم بتدوير 360 درجة.
- اخرج من الدش الهوائي وارتد أحذية المنطقة على الجانب الآخر.
5. أخذ عينات من الدم من "الفئران البرية"
- نقل "الفئران البرية" (ذكر وإناث ، من 8 إلى 20 أسبوعا) من الغرفة التي يتم الاحتفاظ بها (R3) في قفص IVC مغلق إلى غرفة العمليات (PR2).
- قم بتشغيل مقعد التدفق الصفحي وتطهير سطح مساحة العمل.
- اتبع الإجراءات الموضحة لأخذ عينات من الفئران SPF في القسم 3 ، الخطوات 2-8.
- بعد الانتهاء من أخذ عينات الدم ، قم بتغيير القفازات. تطهير جميع المواد والأسطح. قم بإيقاف تشغيل مقعد التدفق الرقائقي.
6. تصدير عينات الدم من منطقة "الفئران البرية" عبر خزانة تدفق الهواء الصفحي (LAF)
ملاحظة: تحتوي غرفة الإجراءات (PR2) على خزانة LAF ، والتي تعمل كقفل للمواد وغرفة تدخل معقمة. يتم نقل العينات عبر مقصورة القوات المسلحة اللبنانية. يمكن الوصول إلى الداخل من الداخل (عبر E1 و PR2) والخارج (عبر E2 و CR) منطقة Wildling وينقسم في المنتصف بجدار زجاجي بباب منزلق (الشكل 1). مطلوب شخصين لتصدير المواد: الشخص 1 (داخل منطقة Wildling [عبر PR2]) سيقوم بتنفيذ الخطوتين 6.1 و 6.2. سيقوم الشخص 2 (خارج منطقة Wildling [عبر E2]) بتنفيذ الخطوات 6.3-6.5.
- تطهير حاويات العينات. قم بإزالة حاويات العينات عبر الباب المنزلق في الجدار الزجاجي لكابينة LAF.
- بعد اكتمال نقل حاويات العينة إلى الشخص 2 ، احصل على ملابس واقية من الشخص 2 (يرتدي ملابس واقية في قفل المقصورة) على الجانب الآخر من مقصورة LAF وتخلص منها. تطهير جميع الأسطح.
- ارتد ملابس واقية في LAF أمام مقصورة LAF (CR ، الشكل 1).
- استلم حاويات عينات مطهرة من منطقة Wildling دون ملامسة من خلال الباب المنزلق في الجدار الزجاجي لكابينة LAF.
- قم بإزالة الملابس الواقية وتمريرها عبر الباب المنزلق إلى المنطقة الداخلية من مقصورة LAF للتخلص منها.
7. الخروج من منشأة "الفئران البرية"
- اترك وزرة وأحذية منطقة يمكن التخلص منها داخل المنطقة. تخلص من شبكة الشعر والقفازات المطاطية وقناع الوجه.
ملاحظة: يمكن إعادة استخدام الأحذية وزرة. - أدخل الدش الهوائي على الفور في جوارب المنطقة. ارفع الذراعين وقم بتدوير 360 درجة أثناء الاستحمام بالهواء.
- اترك الدش الهوائي وضع جوارب المنطقة في مجمع الغسيل. ارتد الجوارب والأحذية وأغطية الأحذية التي تستخدم لمرة واحدة. إيداع ملابس المنطقة في غرفة تغيير الملابس في مجمع الغسيل. تغيير الملابس في غرفة تغيير الملابس
8. معالجة وتحليل عينات الدم
- إحضار عينات الدم إلى المختبر.
- تحضير كوكتيل تلطيخ الأجسام المضادة المترافقة بالفلوروفور: لكل عينة ، أضف 0.25 ميكرولتر من Alexa Fluor 700 CD45 المضاد للفأر ، 0.25 ميكرولتر من سلسلة TCR-β المضادة للفأر Brilliant Violet 605 ، 0.25 ميكرولتر من APC المضاد للفأر CD4 ، 0.25 ميكرولتر من Brilliant Violet 785 CD8 المضاد للفأر ، 0.25 ميكرولتر من FITC المضاد للفأر CD44 و 0.25 ميكرولتر من الجسم المضاد للفأر PerCP / Cyanine5.5 CD62L إلى 50 ميكرولتر من المخزن المؤقت لقياس التدفق الخلوي (محلول ملحي مخزن بالفوسفات ، 2 ملي EDTA ، 0.1٪ ألبومين مصل بقري ، 4 درجات مئوية). يحفظ في الظلام على الجليد حتى الخطوة 8.8.
ملاحظة: يمكن تكييف الفلوروفورات المستخدمة مع تكوين مقياس التدفق الخلوي الذي سيتم استخدامه للحصول على العينة.
- تحضير كوكتيل تلطيخ الأجسام المضادة المترافقة بالفلوروفور: لكل عينة ، أضف 0.25 ميكرولتر من Alexa Fluor 700 CD45 المضاد للفأر ، 0.25 ميكرولتر من سلسلة TCR-β المضادة للفأر Brilliant Violet 605 ، 0.25 ميكرولتر من APC المضاد للفأر CD4 ، 0.25 ميكرولتر من Brilliant Violet 785 CD8 المضاد للفأر ، 0.25 ميكرولتر من FITC المضاد للفأر CD44 و 0.25 ميكرولتر من الجسم المضاد للفأر PerCP / Cyanine5.5 CD62L إلى 50 ميكرولتر من المخزن المؤقت لقياس التدفق الخلوي (محلول ملحي مخزن بالفوسفات ، 2 ملي EDTA ، 0.1٪ ألبومين مصل بقري ، 4 درجات مئوية). يحفظ في الظلام على الجليد حتى الخطوة 8.8.
- تطهير أنابيب جمع الدم. أضف 2 مل من المخزن المؤقت لقياس التدفق الخلوي المثلج إلى أنبوب بوليسترين دائري القاع سعة 5 مل. ضع الأنبوب على الثلج.
- افتح أنبوب جمع الدم. أضف 10 ميكرولتر من الدم إلى الأنبوب الذي يحتوي على المخزن المؤقت لقياس التدفق الخلوي ودوامة النبض.
- قم بالدوران عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- شفط المادة الطافية. أضف 1 مل من المخزن المؤقت لتحلل خلايا الدم الحمراء (RBC) ، ودوامة النبض ، واحتضنه لمدة 3 دقائق في درجة حرارة الغرفة (RT).
- أضف 100 ميكرولتر من 10x PBS. قم بالدوران عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- كرر الخطوات 8.5-8.6.
- شفط المادة الطافية. أضف 50 ميكرولتر من كوكتيل تلطيخ الأجسام المضادة ، والدوامة ، واحتضن لمدة 20 دقيقة على الجليد في الظلام.
- أضف 1 مل من المخزن المؤقت لقياس التدفق الخلوي. قم بالدوران عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- شفط المادة الطافية. أضف 180 ميكرولتر من المخزن المؤقت لقياس التدفق الخلوي.
- أضف 20 ميكرولتر من صبغة الخلايا الميتة الزرقاء SYTOX (التركيز النهائي 1: 1000) للتمييز الحي / الميت.
- احصل على عينات على مقياس التدفق الخلوي وحلل البيانات باستخدام برنامج الحصول على مقياس التدفق الخلوي أو برنامج تحليل بيانات قياس التدفق الخلوي.
النتائج
من المحتمل أن تؤوي "الفئران البرية" كائنات دقيقة مستبعدة عادة من مرافق SPF ، مما يشكل تحديا لممارسات تربية داخل المؤسسات البحثية التي تلتزم بمعايير النظافة الصارمة. على مدى السنوات الأربع الماضية ، طور العلماء والأطباء البيطريون في Charité - Universitätsmedizin Berlin والمركز الألماني ?...
Discussion
تعد الفئران ذات الميكروبيوم الطبيعي أداة بحثية واعدة للعلوم الأساسية والتطبيقية بسبب تشابهها الوثيق مع الكائن الحي البشري الخارق3،9،10،11،12. أدت محاولات دمج التعقيد البيولوجي في نم...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من قبل Charité 3R | استبدال - تقليل - صقل. تم دعم S.P.R. من قبل Deutsche Forschungsgemeinschaft (DFG ، مؤسسة الأبحاث الألمانية) Emmy Noether-Programm RO 6247 / 1-1 (معرف المشروع 446316360) ، DFG SFB1160 IMPATH (معرف المشروع 256073931) ، و TRR 359 PILOT (معرف المشروع 491676693). S.J. تم دعمه من قبل Deutsche Forschungsgemeinschaft (DFG ، مؤسسة الأبحاث الألمانية) JO 1216 / 2-1 والجمعية الألمانية للتصلب المتعدد (DMSG e.V.).
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
References
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345 (2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119 (2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108 (2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069 (2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361 (2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143 (2018).
- . Premier Available from: https://premier-qms.org/ (2024)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved