تصور أحادي الجزيء في الوقت الحقيقي لفك الحمض النووي بواسطة CMG Helicase
In This Article
Summary
يوضح هذا البروتوكول إجراء اختبار أحادي الجزيء للتصور المباشر لفك الحمض النووي بواسطة CMG helicase. يصف (1) تحضير ركيزة الحمض النووي ، (2) تنقية ذبابة الفاكهة السوداء CMG helicase المسمى بالفلورسنت ، (3) إعداد خلية تدفق الموائع الدقيقة للفحص المجهري للانعكاس الداخلي الكلي (TIRF) ، و (4) مقايسة فك الحمض النووي أحادي الجزيء.
Abstract
يعد تكرار الجينوم المخلص ضروريا للحفاظ على الاستقرار الجيني للخلايا المنقسمة. يتم تكرار الحمض النووي خلال المرحلة S بواسطة مركب ديناميكي من البروتينات يسمى replisome. يوجد في قلب الملف الهليكياز CDC45-MCM2-7-GINS (CMG) ، الذي يفصل بين خيطين اللولب المزدوج للحمض النووي بحيث يمكن لبوليميرات الحمض النووي نسخ كل خيط. أثناء ازدواجية الجينوم ، يجب أن تتغلب replisomes على عدد كبير من العقبات والتحديات. كل من هذه يهدد استقرار الجينوم ، حيث يمكن أن يؤدي الفشل في تكرار الحمض النووي بشكل كامل ودقيق إلى طفرات أو أمراض أو موت الخلايا. لذلك ، من الأهمية بمكان فهم كيفية عمل CMG في التكرار أثناء كل من النسخ المتماثل العادي وإجهاد النسخ المتماثل. هنا ، نصف مقايسة الفحص المجهري الكلي للانعكاس الداخلي (TIRF) باستخدام البروتينات النقية المؤتلفة ، والتي تسمح بالتصور في الوقت الفعلي لجزيئات الحمض النووي الممتدة المربوطة بالسطح بواسطة مجمعات CMG الفردية. يوفر هذا الاختبار منصة قوية للتحقيق في سلوك CMG على مستوى الجزيء الفردي ، مما يسمح بمراقبة ديناميكيات الهليكاز مباشرة مع التحكم في الوقت الفعلي في ظروف التفاعل.
Introduction
يتم تنظيم تكرار الحمض النووي بإحكام ، حيث يجب على الخلية تكرار جينومها بدقة لمنع الطفرات أو المرض أو الموت. يتم تكرار الحمض النووي حقيقيات النواة بواسطة مركب replisome ، الذي يفك الحمض النووي الأبوي ويستخدم الحمض النووي أحادي الشريطة (ssDNA) كقالب لتصنيع الحمض النووي الجديد عليه. في المرحلة G1 ، يتم تحميل السداسيات المزدوجة غير النشطة تحفيزيا ل MCM2-7 على الحمض النووي المزدوج الشريطة (dsDNA) عند أصول النسخالمتماثل 1. في المرحلة S ، يتم تنشيط مجمعات MCM2-7 عن طريق ربط CDC45 و GINS2 لتشكيل مجمعات CMG مكونة من 11 وحدة فرعية (CDC45 ، MCM2-7 ، GINS). يبدأ كل CMG في فك الحمض النووي في اتجاهين متعاكسين ، مكونا الوحدة الأساسية التي يرتب الردبال نفسه حول3.
قبل عقدين من الزمن ، تم تحديد هيليكاز CMG لأول مرة على أنه مركب مكون من 11 وحدة فرعية ، وهو ضروري لتكرار الحمض النووي4. منذ ذلك الحين ، تقدم فهمنا ل CMG بشكل كبير ، من التحميل والتنشيط 5,6 ، إلى فك الحمض النوويوإنهائه 7. كانت تقنيات البيولوجيا الكيميائية الحيوية والهيكلية التقليدية حاسمة في العديد من هذه الاكتشافات. ومع ذلك ، كانت هذه الأساليب محدودة في كثير من الأحيان في قدرتها على دراسة الجوانب الأكثر ديناميكية ل CMG. تستخدم طرق الجزيء الفردي التلاعب الفيزيائي للجزيئات الحيوية الفردية لقياس أو تصور نشاطها جزيء واحد في كل مرة. يمكن استخدام هذا لتوفير نظرة ثاقبة لديناميكيات البروتينات في الوقت الفعلي التي غالبا ما يتم تفويتها أو عدم اكتشافها بواسطة تقنيات أخرى8،9.
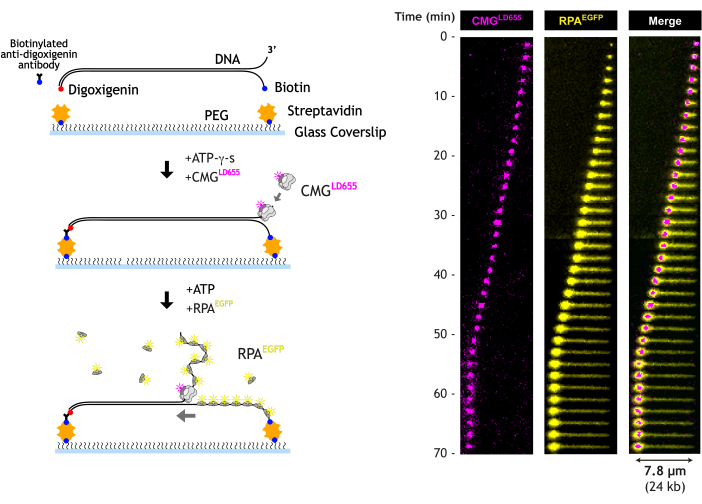
هنا ، نصف مقايسة المجهرية الفلورية الانعكاسية الداخلية الكلية (TIRF) لتصور فك الحمض النووي بواسطة CMG helicase في الوقت الفعلي. يتم تحميل CMG المنقى والمحمل بالفلورسنت على الطرف الحر 3 بوصات من الحمض النووي الطويل الذي يحتوي على هيكل شوكة DNA مسبقة الصنع. يمتد الحمض النووي الخطي على غطاء البيوتين-PEG في خلية تدفق الموائع الدقيقة عن طريق ربط كل طرف من طرفي الحمض النووي بالتتابع بالسطح. يسمح هذا النهج بربط الحمض النووي بشكل أكثر اتساقا ، مما يقلل بشكل كبير من التباين الذي يجب أخذه في الاعتبار أثناء تحليل البيانات. في وجود ATP-γ-s ، يتم تحميل CMG على الحمض النووي أحادي الشريطة في نهاية 3 'من الشوكة. ATP-γ-s هو تناظر ATP قابل للتحلل ببطء ، والذي يسمح بربط CMG بالحمض النووي ولكن لا يتم فكه. تؤدي الإضافة اللاحقة ل ATP ، جنبا إلى جنب مع RPA المنقى الذي يوضع علامة على الفلورسنت ، على تنشيط CMG وبدء فك الحمض النووي على نطاق واسع. بصريا ، ينتقل CMG على طول الحمض النووي ، تاركا وراءه مسارا متزايدا من ssDNA المرتبط ب RPA. ينتقل طرف الحمض النووي غير المربوط مع CMG ، مكونا "كرة ضيقة" بسبب الضغط الناجم عن ربط RPA. يسمح تصميم خلية التدفق بتبادل المخزن المؤقت في أي وقت أثناء الفك ، مما يمنح تحكما كبيرا أثناء كل تجربة وعليها.
ينقسم هذا البروتوكول إلى أربع طرق يمكن تنفيذها بشكل مستقل عن بعضها البعض. يصف القسم 1 تحضير ركيزة الحمض النووي المتشعبة الخطية بسعة 20 كيلو بايت للمقايسات أحادية الجزيء. يوضح القسم 2 التنقية ووضع العلامات الفلورية ل ذبابة الفاكهة السوداء CMG (DmCMG). يتم تضمين المعلومات الأساسية حول تعبير DmCMG في قسم الملاحظات. يغطي القسم 3 تحضير خلية تدفق الموائع الدقيقة التي يمكن استخدامها على مجهر TIRF. يصف القسم 4 كيفية إجراء مقايسة فك الحمض النووي أحادي الجزيء.
Protocol
1. تحضير الحمض النووي المتشعب الخطي 20 كيلو بايت المستخدم في فحوصات الجزيء الفردي (الشكل 1)
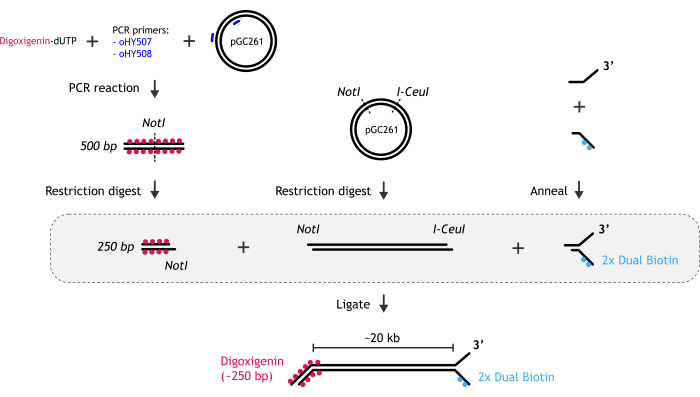
الشكل 1: التمثيل الرسومي لإعداد ركيزة الحمض النووي. (أ) يتم إنشاء نهاية شوكة الحمض النووي الحيوي عن طريق تلدين اثنين من قليل النوكليوتيدات التكميلية جزئيا: واحد بيوتينيل وغير حيوي. (ب) يتم إنشاء جزء dsDNA الرئيسي (~ 20 كيلو بايت) عن طريق هضم تقييد البلازميد pGC261 مع إنزيمين لإنشاء حمض نووي خطي مع نتوءات مختلفة في كل طرف. (ج) يتم الحصول على نهاية الحمض النووي المزدوج digoxigenin عن طريق تفاعل تفاعل تفاعل البوليميراز المتسلسل الذي يتم إجراؤه في وجود digoxigenin-dUTP ، متبوعا بملخص التقييد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- توليد نهاية شوكة الحمض النووي البيوتينيل.
- تلدين الحمض النووي للشوكة.
- امزج اثنين من قليل النوكليوتيدات (oHY502 و oHYbio85) في 1x مخزن STE (100 ملي كلوريد الصوديوم ، 10 ملي تريس ، درجة الحموضة 8.0 ؛ 1 ملي مولار حمض الإيثيلين ديامين تترا أسيتيك [EDTA]). تركيز قليل النوكليوتيدات النهائي هو 10 ميكرومتر، وحجم التفاعل النهائي هو 100 ميكرولتر.
- احتضان التفاعل عند 80 درجة مئوية لمدة 5 دقائق على كتلة حرارية. قم بإيقاف تشغيل كتلة الحرارة واترك التفاعل يبرد تدريجيا ، واتركه في كتلة الحرارة حتى تنخفض درجة الحرارة إلى أقل من 30 درجة مئوية.
- التحقق من كفاءة التلدين على جل Tris-Borate-EDTA (TBE) - الرحلان الكهربائي لجل بولي أكريلاميد (PAGE).
- تحضير 8٪ أكريلاميد - جل TBE (ل 4 مواد هلامية: 32.8 مل من H2O ؛ 4.8 مل من 10x TBE buffer (1 M Tris ، 1 M حمض البوريك ، 20 ملي EDTA) ، 9.6 مل من محلول 40٪ أكريلاميد / مكرر ، 37.5: 1 ؛ 0.8 مل من 10٪ بيرسلفات الأمونيوم [APS] ، 40 ميكرولتر من رباعي ميثيل إيثيلين ديامين [TEMED]).
تحذير: TBE ، أكريلاميد ، APS ، TEMED سامة / ضارة. - قم بتشغيل حجم صغير (1 ميكرولتر) من قليل النوكليوتيدات الملدنة جنبا إلى جنب مع قليل النوكليوتيدات الفردية المخففة بصبغة تحميل 6x على 8٪ من مادة الأكريلاميد - جل TBE عند 80 فولت ، لمدة ساعة واحدة في RT.
- انقع الجل في 1x TBE مع بقعة مناسبة من الحمض النووي لمدة 30 دقيقة على شاكر هزاز متأرجح ، ثم امسح الجل باستخدام نظام تصوير جل.
- تحضير 8٪ أكريلاميد - جل TBE (ل 4 مواد هلامية: 32.8 مل من H2O ؛ 4.8 مل من 10x TBE buffer (1 M Tris ، 1 M حمض البوريك ، 20 ملي EDTA) ، 9.6 مل من محلول 40٪ أكريلاميد / مكرر ، 37.5: 1 ؛ 0.8 مل من 10٪ بيرسلفات الأمونيوم [APS] ، 40 ميكرولتر من رباعي ميثيل إيثيلين ديامين [TEMED]).
- حل الحمض النووي الملدن على جل TBE-PAGE لاستئصال الجل.
- إذا تم تلدين قليل النوكليوتيدات بشكل صحيح ، فقم بحل باقي العينة في وجود BSA (~ 100 ميكرولتر من العينة الملدنة ، 25 ميكرولتر من صبغة التحميل 6x ، 2 ميكرولتر من 33 مجم / مل BSA). لتحميل الحجم الأكبر على الجل ، امزج عدة آبار مع مشرط معقم.
- اترك الجل في 1x TBE مكملا بصبغة الحمض النووي المناسبة لمدة 30 دقيقة على شاكر هزاز متأرجح.
- انقل الجل إلى صينية زجاجية وتصور الحمض النووي في غرفة مظلمة تحت الضوء الأزرق. استخدم شاشة واقية مناسبة أو نظارات واقية عند استخدام الضوء الأزرق.
- قطع الشريط المطلوب بمشرط معقم. تقليم الجل الزائد.
- تنقية الشوكة الملدنة عن طريق الشطف الكهربائي.
- قم بقص قطعة من أنبوب غسيل الكلى لفترة كافية لإدخال قطعة الجل ، وبللها في 1x TBE ، وأغلق أحد طرفيها.
- قم بتخفيف BSA إلى 0.3 ملغم/مل في 500 ميكرولتر من 1x TBE وقم بتحويل الحجم بالكامل إلى الأنبوب.
- استخدم الملعقة المعدنية لتحريك قطعة الجل بالداخل. انقل قطعة الهلام إلى جانب واحد من الأنبوب لإعطاء مساحة عازلة للحمض النووي للهجرة إليه أثناء الشطف الكهربائي.
- اضغط على المخزن المؤقت الزائد وقم بقص الطرف الثاني من الأنبوب.
ملاحظة: سيحدد الحجم المتبقي الحجم والتركيز النهائيين. - ضع أنبوب غسيل الكلى في خزان الرحلان الكهربائي للأغروز في عازلة TBE 1x ، مما يضمن غمر الأنبوب بالكامل.
ملاحظة: تأكد من وضع قطعة الجل على الجانب الأقرب إلى القطب السالب حتى يتمكن الحمض النووي من الانتقال من الجل إلى كيس غسيل الكلى. - قم بتشغيل الشطف الكهربائي عند 80 فولت لمدة 1-2 ساعة.
- غسيل الكلى الحمض النووي الكهربائي إلى 10 ملي مولار مخزن مؤقت تريس (الرقم الهيدروجيني 8).
- بعد الشطف الكهربائي ، أخرج كيس غسيل الكلى من الخزان وجفف أحد طرفيه بالأنسجة. تجنب لمس الجزء الأوسط من الأنبوب بالأنسجة، حيث يوجد الجل والعينة.
- قم بإزالة المشبك من الطرف المجفف وقم بسحب العينة برفق لأعلى ولأسفل داخل الأنبوب لخلط الحمض النووي في المخزن المؤقت.
- اغمس ملعقة نظيفة في 1x TBE المؤقت واستخرج قطعة الجل من الأنبوب.
ملاحظة: أثناء إزالة قطعة الجل ، قم بإزالة أقل قدر ممكن من المخزن المؤقت. - أغلق الطرف المفتوح لكيس غسيل الكلى مرة أخرى ، وقم بإزالة أي هواء من الداخل.
- ضع كيس غسيل الكلى في دورق سعة 2 لتر مملوء ب 1.5 لتر من 10 ملي مولار من المخزن المؤقت Tris (الرقم الهيدروجيني 8) و 20 ملي كلوريد الصوديوم و 2 ملي كلوريدالمغنيسيوم 2. لف المشابك بالبارافيلم لإلصاق الأنبوب بحافة الدورق أثناء غمر الأنبوب بالكامل في المخزن المؤقت.
ملاحظة: يعمل الملح على استقرار دوبلكس أوليغو القصير. - استخدم قضيبا مغناطيسيا لتقليب المخزن المؤقت برفق وغسيل العينة في درجة حرارة الغرفة (RT) لمدة 3-4 ساعات على الأقل أو عند 4 درجات مئوية طوال الليل.
- بعد غسيل الكلى ، جفف أحد طرفي كيس غسيل الكلى بمنديل (لتخفيف الحمض النووي) وفك هذه النهاية.
- قم بتمرير العينة برفق لأعلى ولأسفل داخل الأنبوب وانقلها إلى أنبوب نظيف سعة 1.5 مل.
- قم بقياس تركيز الحمض النووي باستخدام مقياس الطيف الضوئي الصغير.
- تلدين الحمض النووي للشوكة.
- توليد جزء 20 كيلو بايت
- قم بإجراء ملخص تقييد لبلازميد pGC26118 باستخدام إنزيمات NotI / I-CeuI.
- امزج برفق 8 ميكرولتر من NotI-HF (20,000 وحدة / مل) ، و 8 ميكرولتر من I-CeuI (5,000 وحدة / مل) ، وبلازميد pGC261 (تركيز البلازميد النهائي ~ 40 نانوغرام / ميكرولتر في تفاعل 200 ميكرولتر) في مخزن مؤقت موصى به من قبل منتجي إنزيمات التقييد.
- احتضان التفاعل عند 37 درجة مئوية بين عشية وضحاها.
- حل الحمض النووي المهضوم على هلام الاغاروز لاستئصال الجل.
- اختياري: قم بتشغيل كمية صغيرة من التفاعل على جل الاغاروز 0.6٪ أولا لاختبار كفاءة الهضم قبل تحميل التفاعل بالكامل.
- تحضير 0.6٪ جل الاغاروز باتباع الخطوات 1.2.2.3-1.2.2.4.
- امزج 0.48 جم من مسحوق الاغاروز مع 80 مل من 1x TBE العازلة. الميكروويف المحلول حتى يغلي. دوامة لضمان ذوبان الاغاروز بالكامل. اتركيه ليبرد لبضع دقائق ، ثم اسكبيه في الخزان المخصص.
- لدمج الآبار لاستيعاب الحجم الأكبر للعينة ، قم بلصق قطعة من الشريط عبر آبار متعددة من المشط مسبقا.
- بمجرد أن يتجمد الجل ، قم بإزالة المشط برفق وقم بتعبئة الخزان بمخزن مؤقت 1x TBE. امزج العينة برفق مع صبغة تحميل الحمض النووي وقم بتشغيل الجل عند 120 فولت لمدة 1 ساعة.
- اترك الجل في 1x TBE مع استكمال بقعة مناسبة من الحمض النووي على شاكر هزاز متأرجح حتى يتلطخ.
- انقل الجل الملون إلى صينية زجاجية وتصور الحمض النووي في غرفة مظلمة تحت الضوء الأزرق.
- قطع الشريط المطلوب بمشرط معقم. تقليم الجل الزائد.
- اختياري: قم بتنقية الجزء المطلوب عن طريق الشطف الكهربائي كما هو موضح في الخطوتين 1.1.4 و 1.1.5. احذف الملح من المخزن المؤقت لغسيل الكلى هنا ، لأن هذا ضروري فقط لتثبيت الازدواج القصير oligo.
- قم بإجراء ملخص تقييد لبلازميد pGC26118 باستخدام إنزيمات NotI / I-CeuI.
- توليد نهاية الحمض النووي المزدوج digoxigenin
- قم بإجراء تفاعل تفاعل البوليميراز المتسلسل باستخدام digoxigenin-dUTP (dig-dUTP) باستخدام pGC261 DNA كقالب.
- مزج: 400 ميكرولتر من الماء ، 8 ميكرولتر من pGC261 (0.8 نانوغرام / ميكرولتر) ، 3.5 ميكرولتر من التمهيدي oHY507 (100 ميكرومتر) ، 3.5 ميكرولتر من التمهيدي oHY508 (100 ميكرومتر) ، 8 ميكرولتر من dig-dUTP (1 مللي متر) ، 400 ميكرولتر من مزيج 2x PCR (محضر من بوليميراز الحمض النووي (20 ميكرولتر) ، 10 ملي مولار dNTPs (40 ميكرولتر) ، 5x عازلة عالية الدقة (HF) (400 ميكرولتر) وماء (540 ميكرولتر).
- قم بتشغيل التفاعل التالي في جهاز تدوير حراري:
98 درجة مئوية - 1 دقيقة
30x: 98 درجة مئوية - 20 ثانية ؛ 65 درجة مئوية - 20 ثانية ؛ 72 درجة مئوية - 30 ثانية ؛
72 درجة مئوية - 10 دقائق
4 درجات مئوية - عقد
- هضم وتنقية منتج PCR المسمى بالديجوكسيجينين
- قم بتنقية منتج تفاعل البوليميراز المتسلسل باستخدام مجموعة تنقية الحمض النووي التجارية.
- امزج 10 ميكرولتر NotI-HF (20,000 وحدة / مل) مع منتج PCR في مخزن مؤقت موصى به من قبل مورد الإنزيم (تركيز الحمض النووي النهائي ~ 50 نانوغرام / ميكرولتر في تفاعل ~ 200 ميكرولتر). احتضان التفاعل عند 37 درجة مئوية بين عشية وضحاها.
- قم بتنقية الحمض النووي المهضوم باستخدام مجموعة تنقية الحمض النووي التجارية.
- قم بإجراء تفاعل تفاعل البوليميراز المتسلسل باستخدام digoxigenin-dUTP (dig-dUTP) باستخدام pGC261 DNA كقالب.
- قم بتجميع المكونات لصنع ركيزة الحمض النووي.
- امزج برفق طرف الشوكة الحيوية ، وجزء الحمض النووي 20 كيلو بايت ، وجزء PCR المعالج بالديجوكسيجينين مع 5 ميكرولتر من T4 DNA ligase (400,000 U / mL) في مخزن مؤقت موصى به من قبل مورد الإنزيم في تفاعل 200 ميكرولتر. ومع ذلك ، بناء على جزء الحمض النووي المضاف 20 كيلو بايت (1-5 ميكروغرام) ، أضف ما يقرب من 100 مرة زائدة مولية لكل من نهاية الشوكة الحيوية وجزء PCR.
- اقتبس التفاعل في أنابيب تفاعل البوليميراز المتسلسل (50 ميكرولتر لكل منها) واحتضانه عند 16 درجة مئوية في جهاز تدوير حراري بين عشية وضحاها.
- قم بحل العينة المربوطة على جل الاغاروز بنسبة 0.6٪ وتنقية الحمض النووي المرتبط عن طريق الشطف الكهربائي كما هو موضح في الخطوتين 1.2.2 و 1.2.3.
- قم بتخزين الحمض النووي المجمد في -80 درجة مئوية.
2. تنقية ذبابة الفاكهة السوداء CMG (الشكل 2)

الشكل 2: تنقية ذبابة الفاكهة السوداء CMG من 4 لتر من خلايا Hi خمسة. تم حل البروتينات على 4٪ -12٪ من هلام بولي أكريلاميد Bis-Tris تحت 200 فولت في وجود مخزن مؤقت MOPS. تظهر العينة في كل مرحلة من مراحل التنقية (محللة الخلية - 2 ميكرولتر ، شطف FLAG - 10 ميكرولتر ، بعد عمود التبادل الأيوني الأول - 10 ميكرولتر ، وبعد وضع العلامات وعمود التبادل الأيوني الثاني - 1 ميكرولتر. (أ) يؤكد تلطيخ Coomassie وجود جميع الوحدات الفرعية ال 11 لمركب CMG قبل (10 ميكرولتر) ، وبعد (1 ميكرولتر) وضع العلامات الفلورية. (ب) تم التحقق من كفاءة وضع العلامات للوحدة الفرعية MCM3 عن طريق المسح الضوئي ل Cy5 باستخدام محلل صور الفلورسنت باستخدام مرشح أحمر طويل التمرير (LPR). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: لتحضير ذبابة الفاكهة السوداء CMG ذات العلامات الفلورية ، تم إدخال موقع انقسام TEV (ENLYFQG) متبوعا بأربعة بقايا Gly في اتجاه مجرى مجرى علامة FLAG الطرفية N على الوحدة الفرعية MCM3 (في متجه pFastBac1) 10. للتعبير عن المركب ، تم استخدام نظام تعبير الفيروس العصفي. بالنسبة للتعداء الأولي ، تم استخدام خلايا Sf21 بشكل منفصل لكل وحدة فرعية CMG (مرحلة فيروس P1). لزيادة تضخيم الفيروسات ، تم استخدام خلايا Sf9 (مرحلة فيروس P2). بعد ذلك ، أصيبت مزارع خلايا Sf9 (100 مل لكل وحدة فرعية CMG ؛ 0.5 × 106 خلايا / مل) ب 0.5 مل من فيروس P2 مكمل بمصل ربلة الساق الجنينية بنسبة 10٪ (مرحلة فيروس P3). للتعبير عن مركب CMG بأكمله في 4 لتر من خلايا Hi Five (1 × 106 خلايا / مل) ، تم استخدام 200 مل من فيروسات P3 لكل وحدة فرعية. بعد حصاد خلايا Hi Five التي تعبر عن مركب CMG ، يمكن تجميد حبيبات الخلية في النيتروجين السائل وتخزينها عند -80 درجة مئوية. قم بإجراء التنقية بالكامل على الجليد أو عند 4 درجات مئوية. يمكن تحضير المخازن المؤقتة مسبقا ، بشرط إضافة عوامل الاختزال (DTT أو 2-Mercaptoethanol) ومثبطات الإنزيم البروتيني (CAUTION) قبل الاستخدام مباشرة. تأكد من أن جميع المخازن المؤقتة قد تم تبريدها مسبقا وتصفيتها وتفريغها.
- قم بإعداد المخازن المؤقتة التالية.
- قم بإعداد المخزن المؤقت لإعادة التعليق A عن طريق خلط 25 ملي مولار 4- (2-هيدروكسي إيثيل) -1-بيبرازينيثان سلفونيك حمض الهيدروجيني (HEPES) الرقم الهيدروجيني 7.5 ، 0.02٪ توين -20 ، 10٪ جلسرين ، 15 ملي مولار KCl ، 2 ملي ملي MgCl2 ، 2 ملي مولار 2-ميركابتو إيثانول ، 1 ملي مولار EDTA ، و 1 ملي مولار إيثيلين جلايكول مكرر (β-أمينوإيثيل إيثر) -N ، N ، N ′ ، N ′ - حمض رباعي الأسيتيك (EGTA).
تنبيه: 2-ميركابتو إيثانول و DTT و EDTA سامة / ضارة - قم بإعداد محلول ملحي مخزن مؤقت من Tris-Buffer (TBS ؛ 0.1 M Glycine HCl ، درجة الحموضة 3.5) لتحضير جل التقارب ANTI-FLAG M2.
- قم بإعداد العازلة A-100 عن طريق خلط 25 ملي مولار من الهيبس درجة الحموضة 7.5 ، 0.02٪ توين -20 ، 10٪ جلسرين ، 100 ملي كلوريد كولوريدن ، 1 ملي مولار DTT ، 1 ملي مولار EDTA ، و 1 ملي مولار EGTA.
- قم بإعداد مخزن غسيل الكلى عن طريق إضافة 25 ملي مولار من درجة الحموضة 7.5 ، و 50 ملي أسيتات الصوديوم ، و 10 ملي أسيتات المغنيسيوم ، و 10٪ جلسرين ، و 1 ملي مولار DTT.
- قم بإعداد المخزن المؤقت TBS عن طريق خلط 50 ملي مولار من Tris-HCl pH 7.5 و 150 ملي كلوريد الصوديوم.
- قم بإعداد المخزن المؤقت لإعادة التعليق A عن طريق خلط 25 ملي مولار 4- (2-هيدروكسي إيثيل) -1-بيبرازينيثان سلفونيك حمض الهيدروجيني (HEPES) الرقم الهيدروجيني 7.5 ، 0.02٪ توين -20 ، 10٪ جلسرين ، 15 ملي مولار KCl ، 2 ملي ملي MgCl2 ، 2 ملي مولار 2-ميركابتو إيثانول ، 1 ملي مولار EDTA ، و 1 ملي مولار إيثيلين جلايكول مكرر (β-أمينوإيثيل إيثر) -N ، N ، N ′ ، N ′ - حمض رباعي الأسيتيك (EGTA).
- أعد تعليق الحبيبات من 4 لتر ثقافة Hi خمس خلايا في 200 مل من محلول إعادة التعليق البارد A مكمل بأقراص كوكتيل مثبطة للبروتين. امزج الأنابيب عن طريق الانعكاس حتى يتم تعليق الحبيبات بالكامل بالكامل.
- انقل الخلايا المعلقة إلى الخالط Dounce المبرد مسبقا سعة 40 مل. لاستعادة أكبر عدد ممكن من الخلايا ، اغسل الأنابيب المستخدمة لتجميد حبيبات الخلية بنفس النوع من المخزن المؤقت وأضفها إلى الخالط Dounce. تأكد من أن الحجم الإجمالي في الخالط لا يتجاوز الحد الموصى به. قم بعمل الخلايا على الجليد بمقدار 60-70 ضربة.
ملاحظة: تأكد من وصول المكبس إلى قاع الأنبوب ، ولكن لا تضغط كثيرا لأن الخالط قد ينكسر. احرص على عدم إخراج المكبس فوق مستوى السائل ، لأن ذلك سيؤدي إلى ظهور فقاعات. - كرر الخطوة السابقة حتى تتجانس العينة بأكملها واجمعها في الدورق المبرد مسبقا. تقييم الحجم النهائي للعينة. قطرة قطرة ، أضف KCl المصفى إلى التركيز النهائي البالغ 100 ملي مولار ، واخلطه برفق.
- قم بتبريد جهاز الطرد المركزي مسبقا إلى 4 درجات مئوية. صب العينة في أنابيب الطرد المركزي ، مما يضمن الوصول إلى الحجم الموصى به من قبل المنتج. موازنة الأنابيب على مقياس.
ملاحظة: قد تنكسر الأنابيب ذات الحجم الصغير جدا أثناء الطرد المركزي. - الطرد المركزي للخلايا المحللة عند 23,500 × جم لمدة 15-30 دقيقة عند 4 درجات مئوية. في غضون ذلك ، قم بإعداد جل التقارب ANTI-FLAG M2 بما يتماشى مع الخطوة التالية.
- امزج الزجاجة التي تحتوي على جل التقارب ANTI-FLAG M2 برفق (تعليق بنسبة 50٪). قم بقص نهاية طرف الماصة P-100 (لتوسيع الطرف) واستخدمه لنقل 4 مل من المعلق على الفور (2 مل من الخرز) إلى عمود كروماتوغرافيا متعدد التحضير سعة 20 مل. لاستعادة الخرزات العالقة في الطرف ، اغسل الطرف باستخدام TBS وأضفه إلى العمود. اسمح لجميع الخرزات بالاستقرار داخل العمود ، لكن احرص على عدم تجفيفها.
- اغسل الراتنج بحجم 3x من الخرز (إجمالي 6 مل) بمقدار 0.1 M Glycine HCl pH 3.5. بعد ذلك ، اغسل الخرزات بحجم 3-5 حبات TBS (6-10 مل). بعد ذلك ، اغسل الخرزات 3 مرات (6 مل) باستخدام Buffer A-100.
ملاحظة: لا تترك الخرزات في محلول 0.1 M Glycine HCl pH 3.5 لمدة تزيد عن 20 دقيقة. لزيادة ضغط التدفق وسرعة الغسيل ، قم بتغطية العمود بغطاء. لا تدع الراتنج يجف في أي وقت. - بعد تحضير الراتنج ، اترك 2 مل من Buffer A-100 فوق الراتنج وأغلق مخرج العمود.
- بعد الطرد المركزي ، اسكب المادة الطافية برفق في أنابيب 50 مل مبردة مسبقا. احرص على عدم تعطيل الحبيبات. خذ كمية صغيرة (~ 10 ميكرولتر) للتحقق من صحتها عن طريق الرحلان الكهربائي SDS-PAGE لاحقا.
- أضف كمية متساوية من حبات ANTI-FLAG M2 (المحضرة بما يتماشى مع الخطوة السابقة) في كل أنبوب من الأنابيب سعة 50 مل. حاول استعادة جميع الخرزات من العمود عن طريق تعليقها ببضعة ملليلترات إضافية من Buffer A-100 ونقل إعادة التعليق هذه إلى الأنابيب.
- احتضان العينة (طاف) براتنج ANTI-FLAG M2 ، مع الدوران لمدة 2.5 ساعة عند 4 درجات مئوية.
- بعد الحضانة ، قم بتدوير العينة عند 1,000 × جم لمدة 5 دقائق عند 4 درجات مئوية. باستخدام ماصة ، قم بإزالة غالبية المادة الطافية. باستخدام طرف مقطوع ، قم بتعليق الخرزات في بضعة ملليلترات من المادة الطافية المتبقية وانقلها إلى أنبوبين سعة 15 مل. لاستعادة أي حبات عالقة على جدران الأنابيب سعة 50 مل ، أضف بضعة ملليلترات من Buffer A-100 وانقلها إلى أنابيب سعة 15 مل أيضا.
- قم بتدوير الأنابيب سعة 15 مل عند 1,000 × جم لمدة 5 دقائق عند 4 درجات مئوية. قم بإزالة المادة الطافية.
- اغسل الخرزات بإضافة ~ 14 مل من Buffer A-100 إلى كل أنبوب ، متبوعا بدوران قصير ولطيف عند 4 درجات مئوية والدوران اللاحق عند 1000 × جم لمدة 5 دقائق عند 4 درجات مئوية. كرر الغسلات مرتين. خذ حصصا صغيرة من كل غسلة (~ 10 ميكرولتر) للتحقق من صحتها عن طريق الرحلان الكهربائي SDS-PAGE لاحقا.
- هذه الخطوة (2.16) هي إجراء بديل للخطوات السابقة (2.13-2.15).
- بعد الحضانة براتنج ANTI-FLAG M2 ، اسكب العينة في عمودين كروماتوغرافيا بولي التحضير سعة 20 مل.
- إذا اخترت هذه الطريقة ، دع الخرزات تستقر في أسفل العمود والعينة غير المنضمة تمر عبر العمود بواسطة تدفق الجاذبية. بعد ذلك ، أضف Buffer A-100 مباشرة إلى العمود واتركه يغسل العينة عن طريق تدفق الجاذبية.
- انقل الخرزات (المعلقة في Buffer A-100) إلى عمودين كروماتوغرافيا بولي الإعدادية سعة 10 مل.
- اسمح ل Buffer A-100 بالمرور عبر الراتنج ، وأغلق المخرج عندما يصل مستوى المخزن المؤقت إلى الجزء العلوي من الراتنج ، وقم بإزالة البروتين من الخرزات عن طريق إضافة Buffer A-100 مكمل ببتيد 200 ميكروغرام / مل (DYKDDDDK) (FLAG elution buffer).
- بالنسبة للشطف الأول ، أضف 3 مل من المخزن المؤقت للشطف FLAG وقم بتدوير العمود المغلق برفق لمدة 15 دقيقة عند RT. افتح المخرج لتجميع كسر الشطف الأول.
- أغلق المنفذ وأضف 2 مل من المخزن المؤقت للشطف FLAG إلى كل عمود. قم بالتدوير لمدة 10 دقائق أخرى واجمع جزء الشطف الثاني.
- امزج جميع الكسور المملوثة معا (~ 10 مل) واحتفظ بها عند 4 درجات مئوية. خذ حصة صغيرة من الكسر المغطى (~ 10 ميكرولتر) للتحقق من صحتها بواسطة الرحلان الكهربائي SDS-PAGE لاحقا.
- قم بتصفية العينة المملوءة باستخدام مرشحات حقنة 0.22 ميكرومتر.
- مسبقا ، قم بإعداد عمود CaptoHiRes Q (5/50) (عمود كروماتوغرافيا التبادل الأيوني عالي الدقة) المتصل بنظام تنقية البروتين ، بما يتماشى مع بروتوكول الشركة المصنعة. بعد ذلك ، قم بموازنة العمود باستخدام المخزن المؤقت A-100 وقم بتحميل العينة التي تمت تصفيتها على العمود المتوازن.
- اغسل العمود ب 20 وحدة تخزين عمود (CV) من Buffer A-100 (إجمالي ~ 20 مل حيث أن حجم العمود ~ 1 مل).
- لتصفية البروتين ، قم بإعداد مخزنين مؤقتين مسبقا: Buffer A-100 و Buffer B بنفس تركيبة Buffer A-100 ، ولكن مع 550 ملي مولار KCl بدلا من 100 ملي مولار KCl. قم بإعداد شطف التدرج ل 20 سيرة ذاتية (~ 20 مل) مع زيادة تركيز الملح من 100 ملي مولار إلى 550 ملي مولار KCl. اجمع 0.3-0.5 مل من الفتحات في مجمع الكسر.
ملاحظة: يجب أن يتخلص CMG عند حوالي 70٪ -75٪ من تركيز Buffer B. خذ حصصا صغيرة من الغسيل والكسور المملوءة للرحلان الكهربائي SDS-PAGE. - قم بإجراء الرحلان الكهربائي SDS-PAGE للتأكد من وجود CMG في الكسور المختارة. في غضون ذلك ، قم بتنظيف العمود ونظام التنقية وفقا لبروتوكول الشركة المصنعة.
- احتضان الكسور المختارة مع بروتياز TEV طوال الليل عن طريق خلط 50 ميكرولتر من بروتياز TEV (1 مجم / مل) لكل 1 مل من العينة.
- قم بتبليل أنبوب غسيل الكلى مسبقا وتأكد من عدم تلف الغشاء. أضف مزيج CMG / TEV إلى أنبوب غسيل الكلى وضعه في دورق سعة 2 لتر مع 1.5 لتر من Buffer A-100 المبرد مسبقا والشريط المغناطيسي بالداخل. غسيل الكلى مع التحريك اللطيف طوال الليل عند 4 درجات مئوية.
- امزج العينة مع 50 ميكرومتر من الببتيد المسمى LD655 و 10 ميكروغرام / مل إنزيم سورتيز في وجود 5 ملي مولار كلوريدالكالسيوم 2. احتضان التفاعل عند 4 درجات مئوية ، مع الدوران لمدة 30 دقيقة ، مع ضمان تغطية الأنبوب من الضوء. خذ كمية صغيرة قبل وبعد وضع العلامات على الرحلان الكهربائي SDS-PAGE.
- قم بتصفية العينة الملصقة باستخدام مرشحات الطرد المركزي 0.22 ميكرومتر قبل التحميل على نظام التنقية ، حيث قد يترسب الببتيد.
- قم بإعداد عمود كروماتوغرافيا التبادل الأيوني عالي الدقة مسبقا ، كما هو موضح من قبل (الخطوة 2.20). هذه المرة ، قم بتغطية العمود ونظام تجميع الكسور بورق الألمنيوم لحماية العينة من الضوء.
- لإزالة الببتيد الحر ، قم بتحميل العينة المفلترة على عمود كروماتوغرافيا التبادل الأيوني عالي الدقة. قم بإجراء التنقية بنفس الطريقة الموضحة سابقا (الخطوات 2.21-2.22). تأكد من أن CMG المسمى يميل بتركيز Buffer-B مشابه لما كان عليه سابقا.
- قم بإجراء الرحلان الكهربائي SDS-PAGE للتحقق من جودة الكسور المختارة. لتصوير التألق ، لا تغلي العينات قبل التحميل ، وتأكد من حماية خزان الرحلان الكهربائي من الضوء. تصور مضان البروتين باستخدام نظام تصوير الهلام أولا ، ثم قم بتلطيخ الجل بصبغة Coomassie وقم بتصويره مرة أخرى لتصور جميع البروتينات.
- غسيل الكلى للكسور المختارة بين عشية وضحاها عند 4 درجات مئوية ، مقابل 1.5 لتر من المخزن المؤقت لغسيل الكلى. إذا لزم الأمر ، ركز العينة.
- قم بتجميد البروتين في النيتروجين السائل وتخزينه في درجة حرارة -80 درجة مئوية حتى الاستخدام الآخر.
3. تحضير خلية التدفق (الشكل 3)
- قم بإعداد أغطية البيوتين PEG باتباع البروتوكول11 الموصوف سابقا ، مع حذف خطوة خبز الفرن. أغطية البيوتين PEG مستقرة لمدة شهر واحد على الأقل تحت الفراغ في RT. لتحضير خلية التدفق ، قم بقص غطاء البيوتين PEG (24 مم × 60 مم) إلى نصفين (حوالي 24 مم × 30 مم).
ملاحظة: احرص على عدم لمس المنطقة المركزية من الغطاء حيث ستكون قنوات التدفق. - قم بإعداد قطع زجاجية صغيرة عن طريق حفر شريحة زجاجية وقطعها إلى قطع بحجم 2.4 سم × 1 سم تقريبا.
- احفر فتحتين على بعد 1.4 مم باستخدام مثقاب مطلي بالماس مقاس 0.8 مم ، أحدهما أعرض قليلا من الآخر (0.043 بوصة = مدخل ، 0.048 بوصة = مخرج). اختبر أن الثقوب بالحجم الصحيح عن طريق محاولة إدخال قطعة من أنبوب المدخل / المخرج ، باستخدام نفس مثقاب لتوسيع الفتحة حتى يتناسب الأنبوب. تأكد من أن الأنبوب يناسب بإحكام بما يكفي حتى لا يسقط بسهولة.
ملاحظة: يتم استخدام أنابيب مدخل أضيق لتقليل الحجم الميت. - قطع شريط على الوجهين بنفس شكل القطع الزجاجية.
- قم بمحاذاة الشريحة على الشريط وطعن إبرة من خلال كل ثقب لتحديد مواقعها على الشريط. باستخدام شفرة حلاقة ، قم بقطع قناة تشمل كلا الفتحتين.
ملاحظة: لا تقطع القناة لفترة طويلة ، حيث قد تظل المساحة الزائدة على الجانب البعيد من كل ثقب جافة عند تدفق السائل ويمكن أن تؤدي إلى مشاكل في فقاعات الهواء أثناء التدفق. عند القطع ، حاول قص الحواف الطويلة في قطع نظيف واحد ، حيث يمكن أن تؤثر الحواف البالية من الجروح المتعددة على جودة قناة التدفق. لغاية مماثلة ، لا تقطع حواف قناة التدفق ، لأن القطع في القطعة القابلة للاستخدام يمكن أن تؤثر على تدفق السائل أو حتى التسرب في خلية التدفق المجمعة. - نظف القطعة الزجاجية بالأسيتون والمناديل حتى تجف ، ثم ضعها على سطح نظيف. قشر جانبا واحدا من الشريط اللاصق وألصقه على القطعة الزجاجية بحيث يكون كلا الفتحتين داخل القناة بالكامل.
- أغلق الشريط بالقطعة الزجاجية باستخدام طرف ماصة p1000 للتخلص من الفقاعات عن طريق الضغط على السطح بضغط ثابت ولكن معتدل. اذهب على السطح بالكامل لإغلاقه.
- انزع الحافة الثانية للشريط من القطعة الزجاجية وضعها على سطح نظيف مع الجانب اللاصق لأعلى. ضع الشرائح بالقرب من بعضها البعض ولكن لا تلمس في الموضع الذي سيتم توصيلها به بالغطاء (اترك مساحة كافية بينهما للإيبوكسي لإنشاء ختم كامل حول كل قطعة زجاجية).
- التقط غطاء نصف البيوتين PEG باستخدام ملاقط بلاستيكية ، مع الإمساك بالحافة فقط (لا تلمس المنطقة التي ستشكل قناة التدفق) ، وقم بخفض الجانب الوظيفي PEG على المادة اللاصقة. قم بتثبيته بالضغط بإصبعك لتثبيته في مكانه، ثم أكمل الختم عن طريق فرك السطح بإحكام معتدل باستخدام طرف ماصة لإزالة فقاعات الهواء (وليس في منطقة قناة التدفق حيث قد ينكسر) ، ثم اقلبه.
ملاحظة: تعامل مع الغطاء بعناية. - لكل خلية تدفق ، قم بقص ~ 10 سم من كل نوع من أنواع أنابيب البولي إيثيلين (PE20 و PE60). استخدم الأنبوب الأضيق كمدخل لغرفة التدفق لتقليل الحجم الميت.
- أدخل الأنابيب في الثقوب الموجودة في الشريحة يدويا. إذا كان قطر الثقوب صحيحا ، فتأكد من أن الأنبوب يقف في الحفرة من تلقاء نفسه بمجرد إدخاله. قم بقص طرف الأنبوب بزاوية طفيفة <45 درجة لتسهيل إدخال الأنبوب قليلا ومنع الأنبوب من تكوين ختم ضد الغطاء ، وهو ما قد يفعله إذا كانت النهاية مسطحة (قد يؤدي ذلك إلى إعاقة التدفق).
ملاحظة: إن التركيب الدقيق للأنبوب في القطعة الزجاجية يجعل بناء خلية التدفق أكثر موثوقية ويساعد على تجنب إدخال الفقاعات إلى خلية التدفق. - امزج مكونات الايبوكسي جيدا ، ثم استخدم طرفا p200 للربت على الإيبوكسي لإغلاق الأنبوب وإنشاء ختم حول كل قطعة زجاجية. أضف ما يكفي من الإيبوكسي بحيث يرتفع إلى حافة جولة الغطاء ، لأن هذا سيعزز أيضا الغطاء الدقيق. ومع ذلك ، تأكد من عدم وصول أي إيبوكسي إلى الجانب السفلي من الغطاء ، لأنه قد يمنعه من الاستلقاء على المسرح.
ملاحظة: إذا لزم الأمر ، يمكن كشط كميات صغيرة من الإيبوكسي الزائد من الجانب السفلي باستخدام شفرة حلاقة. - اتركيه لمدة 30-60 دقيقة على الأقل حتى يشفى الإيبوكسي تماما.
ملاحظة: إذا لم يتم استخدام خلية التدفق على الفور ، فقم بتخزينها تحت الفراغ في RT بعد المعالجة الكاملة. - بعد استخدام خلية التدفق ، استرجع القطع الزجاجية وأعد استخدامها إلى أجل غير مسمى. اسحب الأنبوب للخارج وضع خلية التدفق في وعاء منزلق يحتوي على الأسيتون لمدة 24 ساعة على الأقل لتليين الإيبوكسي والمادة اللاصقة على الوجهين ، مما يسمح بإزالة القطع الزجاجية بسهولة. قبل إعادة استخدامها لعمل خلية تدفق أخرى ، قم بتنظيف القطع الزجاجية عن طريق فركها بإسفنجة وماء بالصابون ، وجففها ، وفركها بالأسيتون والمناديل الورقية.

الشكل 3: تمثيل رسومي لإعداد خلية التدفق. (أ) قص الشريط على الوجهين ليتناسب مع حجم القطعة الزجاجية. قم بمحاذاة الشريحة أعلى الشريط وحدد موضع كل ثقب بإبرة. باستخدام شفرة حلاقة ، قم بقص كل تعليق لإنشاء قناة. (ب) قشر جانبا واحدا من الشريط وألصق الشريط على القطعة الزجاجية. تأكد من وجود كلا الفتحتين داخل القناة. قشر الطرف الثاني من الشريط وألصق غطاء البيوتين PEG في الأعلى. (ج) أدخل أنبوب البولي إيثيلين في كل ثقب وأغلق الأنبوب في مكانه بالإيبوكسي ، وختم كل قطعة زجاجية في الغطاء أيضا. (د) بعد استخدام كلتا القناتين ، اسحب الأنبوب وضع خلية التدفق في وعاء تلطيخ مملوء بالأسيتون. بعد حوالي 24 ساعة ، سيخفف الإيبوكسي والشريط ، ويمكن تقشير طبقات خلية التدفق. يمكن استرداد القطع الزجاجية وتخزينها في الأسيتون لإعادة استخدامها إلى أجل غير مسمى لصنع خلية التدفق التالية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. اختبار TIRF أحادي الجزيء لتصور فك الحمض النووي بوساطة CMG
- قم بإعداد المخازن المؤقتة التالية.
- تحضير المخزن المؤقت للحجب (20 ملي تريس، درجة الحموضة 8.0؛ 50 ملي كلوريد الصوديوم؛ 2 ملي EDTA؛ 0.2 ملغم/مل BSA). قم بتصفية المخزن المؤقت باستخدام مرشح حقنة 0.22 ميكرومتر وتخزينه عند 4 درجات مئوية.
- تحضير 10x عازلة تفاعل 1 (250 ملي مولار HEPES درجة الحموضة 7.5 ؛ 50 ملي كلوريد الصوديوم ؛ 100 ملي أسيتات المغنيسيوم). قم بتصفية المخزن المؤقت باستخدام مرشح حقنة 0.22 ميكرومتر وتخزينه عند 4 درجات مئوية.
- تحضير 10x Reaction Buffer 2 (250 ملي تريس ، درجة الحموضة 7.5 ؛ 100 ملي أسيتات المغنيسيوم ؛ 1.25 م غلوتامات البوتاسيوم ؛ 1 ملي مولار EDTA ؛ 0.025٪ توين -20). قم بتصفية المخزن المؤقت باستخدام مرشح حقنة 0.22 ميكرومتر وتخزينه عند 4 درجات مئوية.
- يزيل ما يقرب من 2.5 مل من المخزن المؤقت المانع و 5 مل من الماء عالي النقاء عن طريق وضع الأنابيب المفتوحة في مجفف وتركها تحت الفراغ لمدة 15 دقيقة.
ملاحظة: لا تملأ الأنابيب حتى أسنانها ، لأن الفقاعات أثناء التفريغ يمكن أن تتسبب في تناثر السائل. - ضع خلية التدفق على مرحلة المجهر وثبتها في مكانها باستخدام معجون لاصق في كل طرف. من المهم تأمين جيد لمنع خلية التدفق من التحرك لاحقا أثناء الاستحواذ.
- قم بتوصيل أنبوب مخرج خلية التدفق بمضخة الحقنة ، التي تحتوي على أنابيب متصلة بالمحقنة بإبرة في الطرف الآخر. أدخل هذه الإبرة في أنبوب المخرج لتوصيل خلية التدفق.
- قم بتشغيل السخان الموضوعي إلى 30 درجة مئوية.
- قم بتأمين 1-2 مل من الماء منزوع الغاز في أنبوب إلى قطعة منفصلة من المعجون اللاصق بالقرب من خلية التدفق بحيث يمكن إدخال أنبوب المدخل والوصول إلى قاع الأنبوب.
- قم بتدفق المياه عبر القناة ، ثم استخدم تدفقا أسرع لإزالة أي فقاعات محاصرة بالقرب من أنبوب المدخل ، مع إضافة المزيد من الماء إذا لزم الأمر. خلاف ذلك ، قد يتم إزاحة الفقاعات الكبيرة لاحقا في التجارب وتمر عبر القناة. اتركيه لبضع دقائق حتى يتوقف التدفق تماما ، حيث يمكن أن يتسبب التدفق السريع في سحب السائل المتبقي لفترة من الوقت بعد إيقافه ، حيث يستقر الضغط داخل المحقنة.
ملاحظة: أي حمض نووي يلامس الفقاعة يصبح غير صالح للاستعمال ، حتى بعد إعادة ترطيبه. - أضف 100 ميكرولتر من المخزن المؤقت المانع منزوع الغازات إلى 20 ميكرولتر من 1 ملغم/مل ستربتافيدين. قم بتوصيل الأنبوب المفتوح بالمعجون اللاصق وانقل أنبوب المدخل من الماء إلى الستربتافيدين. يتدفق بمعدل 40 ميكرولتر / دقيقة لمدة دقيقتين (إجمالي 80 ميكرولتر) ويحتضن لمدة 5 دقائق.
- اغسل الستربتافيدين الزائد باستخدام المخزن المؤقت المانع (50 ميكرولتر / دقيقة لمدة 100 ميكرولتر).
- التدفق في الحمض النووي الحيوي ، المخفف في المخزن المؤقت المانع مع 25 نانومتر برتقالي SYTOX. صورة باستخدام المنظر المباشر باستخدام ليزر 532 نانومتر لمشاهدة ربط الحمض النووي بالسطح في الوقت الفعلي.
- عندما يتم تحقيق الكثافة التقريبية للحمض النووي على السطح ، تتدفق في المخزن المؤقت المانع ، أيضا مع 25 نانومتر SYTOX (50 ميكرولتر / دقيقة لكل 100 ميكرولتر) ، لغسل الحمض النووي الحر.
- التدفق في الجسم المضاد المضاد للديجوكسجينين البيوتينيل (~ 10 ميكروغرام / مل) مخفف في مانع مانع يحتوي على 25 نانومتر برتقالي SYTOX (100 ميكرولتر / دقيقة لمدة 300 ميكرولتر).
ملاحظة: يتداخل برتقالي SYTOX بين أزواج قواعد الحمض النووي ، مما يمتد طول الكنتور. هذا يعني أن طول الحمض النووي من طرف إلى طرف يزداد في برتقالي SYTOX ، مما يسمح للحبل الثاني بالالتصاق بالسطح بعيدا عن الأول ، مما يعطي الحمض النووي الممتد بشكل أفضل عندما يتم غسل برتقالة SYTOX لاحقا. يسمح استخدام جزء مختلف في كل طرف من طرفي الحمض النووي بربط أكثر اتساقا للحمض النووي بسطح الغطاء (الشكل 4). عندما يتم إيوتينيل كلا الطرفين ، فإنهما يربطان في نفس الخطوة ، مما يؤدي إلى اختلاف كبير في مواضع التعلق بهما. يعطي استخدام digoxigenin في أحد طرفيه مزيدا من التحكم في تغطية الحمض النووي قبل ربط الطرف الثاني. يسمح هذا أيضا بزيادة تغطية الحمض النووي عن طريق الحضانة. - اغسل الجسم المضاد المضاد للديجوكسيجينين البيوتينيل وبرتقالي SYTOX مع مانع مانع (50 ميكرولتر / دقيقة لمدة 100 ميكرولتر).
- اصنع 120 ميكرولتر من "مزيج ATP-g-s" (1x عازلة تفاعل 1 ، 0.75 مجم / مل BSA ، 1.25 مجم / مل كازين ، 8 ملي DTT ، 0.33 ملي مولار ATP-g-s) ، أضف 30 ميكرولتر إلى أنبوب جديد ، ثم تدفق 50 ميكرولتر من الأنبوب الأصلي إلى خلية التدفق (50 ميكرولتر / دقيقة لمدة 50 ميكرولتر). يساعد هذا على تقليل تأثير الخلط العازل من خلال التدفق العكسي أو الانتشار من أنبوب المخرج.
- أضف CMG المنقى إلى ~ 100 نانومتر نهائي في 30 ميكرولتر من مزيج ATP-g-s ، ثم تدفق عند 20 ميكرولتر / دقيقة لمدة 20 ميكرولتر.
- اصنع 120 ميكرولتر من "مزيج ATP / RPA" (1x عازلة تفاعل 1 ، 0.75 مجم / مل BSA ، 8 ملي مولار DTT ، 3.3 ملي مولار ATP ، 20 نانومتر EGFP-hRPA) ، وتتدفق إلى خلية التدفق عند 40 ميكرولتر / دقيقة لمدة 80 ميكرولتر.
- ابدأ على الفور في الحصول على الصور. احصل على حقول رؤية 6 × 6 لكل إطار كل 30 ثانية (أو معدل إطارات مناسب للتجربة). يمكن أن تقلل معدلات الإطارات المنخفضة من التعرض لليزر والتبييض الضوئي بالفلوروفور. تصور EGFP-hRPA باستخدام ليزر 488 نانومتر بقوة 1٪. إذا تم تسمية CMG ، على سبيل المثال ، LD655 ، فقم بتصور CMG باستخدام ليزر 640 نانومتر (الطاقة القصوى = 30 ميجاوات) بقوة 10٪. تصور الحمض النووي الملون باللون البرتقالي SYTOX باستخدام ليزر 532 نانومتر بقوة 0.5٪. استخدم كل ليزر مع تعرض 50-100 مللي ثانية.
ملاحظة: في كل مرة يتم فيها نقل أنبوب مدخل خلية التدفق من أنبوب سائل إلى آخر ، ضع طرف الأنبوب في قاع الأنبوب عدة مرات قبل إزالته من السائل. هذا يساعد على منع الفقاعات من الدخول أثناء النقل. قلل من الوقت الذي يتم فيه إخراج طرف أنبوب المدخل من السائل ، ولا توجه الطرف لأعلى أو ترفع الطرف بشكل كبير ، لأن هذا يتسبب في تصريف السائل باتجاه القناة وسحب الهواء إلى الحافة. أثناء نقل أنبوب المدخل ، حاول ألا تضع توترا على الأنبوب لأن هذا يمكن أن يسحبه من الإيبوكسي ، ويثبته في خلية التدفق. لتصوير فك الحمض النووي ، في وجود برتقالي SYTOX لتصور الحمض النووي مزدوج الشريطة ، استبدل 10x Reaction buffer 1 ب 10x Reaction buffer 2 لمزيج ATP / RPA. يرتبط برتقال SYTOX بالحمض النووي بشكل أفضل في هذه الظروف. أفرغ مضخة الحقنة بالكامل في نهاية كل تجربة. اغسل من حين لآخر عن طريق الملء بالماء والتفريغ عدة مرات أو التفكيك والغسيل بالماء والصابون.

الشكل 4: ربط الحمض النووي بالسطح. (أ) عند ربط ركائز الحمض النووي بالبيوتين في كلا الطرفين ، يمكن أن تختلف المسافة بين الحبالين اعتمادا على كيفية ملامسة الأطراف للسطح (i). باستخدام digoxigenin في أحد طرفيه ، يمكن فصل ربط كل طرف مؤقتا لمسافات حبل أكثر اتساقا وحمض نووي ممتد بشكل أكثر اتساقا (ii). (ب) مثال على مجال الرؤية يوضح الحمض النووي المربوط بكلا الطرفين (المسمى بالديجوكسيجينين) وملطخ بصبغة الحمض النووي الفلورية. يظهر الحمض النووي ، المربوط بكلا الطرفين ، كخط ، بينما يظهر الحمض النووي المربوط بطرف واحد فقط كبقع. من الناحية المثالية ، يجب ربط الحمض النووي بأكبر قدر ممكن من الكثافة دون تداخل الحمض النووي الآخر. الصورة 512 × 512 بكسل (حجم البكسل = 154.6 نانومتر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
عندما يقوم CMG بفك الحمض النووي ، سينمو جهاز RPA المميز بمرور الوقت (الشكل 5). نهاية 5 'من الحمض النووي غير الملفوف مربوطة بالسطح; ومن ثم ، ينظر إليه على أنه امتداد خطي لإشارة RPA بين الحبل والشوكة. الطرف 3 'غير مربوط ، وبالتالي ، يتحرك مع الشوكة ويتم ملاحظته كإشارة EGFP-RPA مدمجة. يتوافق موضع خيط النقل المضغوط غير الملفوف تقريبا مع موضع شوكة النسخ المتماثل ، والتي تتحرك مع LD655-CMG التي يتم تصورها عبر ليزر 640 نانومتر.
من المهم تقليل الضرر الذي يلحق بركيزة الحمض النووي ، حيث أن الضرر مثل نكات الحمض النووي أحادية الشريطة يقلل من عدد أحداث الفك التي يمكن ملاحظتها ، مما يحد من كمية البيانات التي يمكن جمعها (الشكل 6).
الشكل 5: مقايسة فك الحمض النووي أحادي الجزيء. ركيزة الحمض النووي مربوطة بسطح غطاء. يتم تحضين CMG المنقى المسمى ب LD655 مع الحمض النووي لمدة 15 دقيقة في ATP-g-s. تمت إضافة ATP و RPA المنقى المسمى EGFP ، مما يؤدي إلى تفكيك الحمض النووي على نطاق واسع بواسطة CMG. يتم عرض رسم تخطيطي كرتوني (يسار) ورسم حركي للبيانات التمثيلية (يمين). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
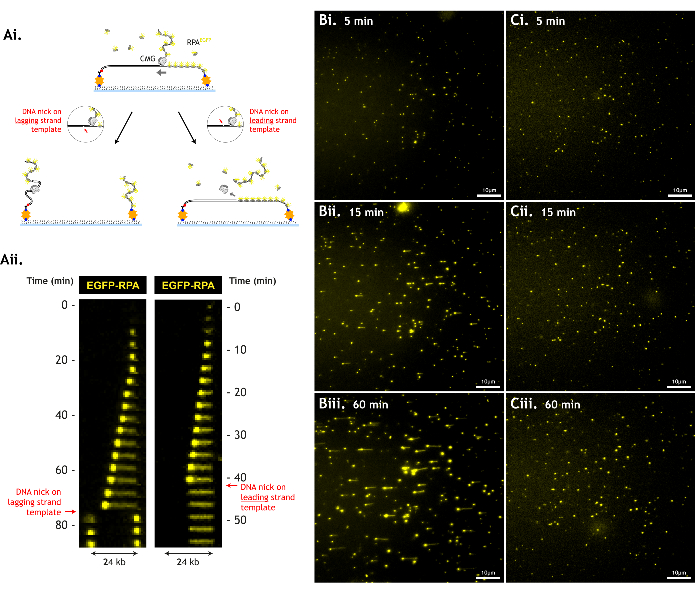
الشكل 6: يقلل تلف الحمض النووي من إنتاجية الفحص. (أ) لا يمكن ل CMG فك الحمض النووي بعد كسر العمود الفقري للحمض النووي (الحمض النووي). يتسبب الوجود في قالب الخيط الرائد في انزلاق CMG من الحمض النووي ، ويتم فقد كل من CMG وقالب الخيط الرائد. يتسبب الشق الموجود في قالب الخيط المتأخر في انفصال قالب الخيط المتأخر عن بقية الحمض النووي ، وتتراجع كل قطعة من الحمض النووي إلى الحبل الخاص بها. يتضح ذلك من خلال (1) مخططات الرسوم المتحركة و (2) الخطوط الكيموغرافية لهذه الأحداث (2). البيانات التمثيلية مع (ب) ركيزة الحمض النووي التالفة بشكل طفيف مقابل (ج) ركيزة الحمض النووي الأكثر تضررا في (1) 5 دقائق ، (2) 15 دقيقة ، و (3) 60 دقيقة في مجال رؤية واحد. لا تولد ركيزة الحمض النووي الأكثر تضررا مساحات طويلة من الفك ، حيث تواجه CMGs نكات في وقت سابق ، على الرغم من المستويات المماثلة لنشاط الفك (كثافة مماثلة لبقع RPA المتنامية في 5 دقائق ، مما يشير إلى كفاءة تحميل / فك CMG مماثلة). مجال الرؤية 512 × 512 بكسل (حجم البكسل = 154.6 نانومتر). 1٪ طاقة ليزر (488 نانومتر) تصوير EGFP-RPA. شريط مقياس يظهر 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يوفر هذا الاختبار منصة لمراقبة ديناميكيات CMGs الفردية والتحقيق فيها ، سواء بمعزل عن العوامل الإضافية المطلوبة. ومع ذلك ، كما هو الحال مع العديد من تقنيات التألق أحادي الجزيء ، هناك بعض التحديات الشائعة التي يمكن أن تتطلب التحسين للتغلب عليها. تتعلق هذه عادة بتصوير الفلوروفورات على مدى فترات طويلة من الزمن (التبييض الضوئي ، السطوع) ، وإعداد ركيزة الحمض النووي (تلف الحمض النووي) ، وجودة سطح خلية التدفق (ضوضاء الخلفية ، والتفاعلات غير المحددة) ، أو جودة تحضير البروتين المنقى (تلوث النوكلياز ، كفاءة وضع العلامات).
يختلف كل فلوروفور في الثبات الضوئي والسطوع ، لذلك من المهم اختيار جزيء مناسب. عند تصوير بروتينات قليلة القلة المصنفة بالفلورسنت ، مثل RPA ، يمكن استخدام طاقة ليزر أقل حيث سيتم إثارة العديد من الفلوروفورات على مقربة ، مما يولد إشارة مرئية. لتصوير الفلوروفورات المفردة ، على سبيل المثال ، CMG المسمى على وحدة فرعية واحدة ، هناك حاجة إلى طاقة ليزر أعلى لمراقبة الفلوروفور بوضوح. يمكن إطالة عمر الفلوروفور عن طريق تقليل التعرض لليزر، مثل تقليل تكرار التقاط الصور. بالإضافة إلى ذلك ، يولد الفلوروفور المثير أنواع الأكسجين التفاعلية (ROS) ، والتي يمكن أن تساهم في التبييض الضوئي. يمكن أن يؤدي تضمين نظام كسح الأكسجين في المخزن المؤقت للتصوير إلى إطالة عمر الفلوروفورات عن طريق القضاء على أنواع التفاعلات التفاعلية. ومع ذلك ، يمكن أن تؤثر بعض أنظمة كسح الأكسجين على الرقم الهيدروجيني12.
فيما يتعلق بإعداد ركيزة الحمض النووي ، من الضروري تقليل تلف الحمض النووي ، مثل النكات أو الفجوات أحادية الشريطة. يمنع الضرر المفرط فك الحمض النووي على نطاق واسع ، مما يحد من مقدار البيانات التي يمكن جمعها. يمكن أن ينشأ الضرر من القص الميكانيكي أو التسخين المفرط نتيجة لتلوث النوكلياز أو ROS المتولد أثناء التصوير. يمكن تقليل القص عن طريق التعامل مع عينة الحمض النووي بعناية باستخدام أطراف واسعة التجويف لسحب العينة وسحب العينة ببطء وتجنب نفض الغبار عن العينة. يمكن تقليل تأثير ROS إما عن طريق تقليل التعرض لليزر أو تضمين نظام مسح الأكسجين في المخزن المؤقت للتصوير. بعد تحضير ركيزة الحمض النووي ، من الممكن استخدام مجموعات إصلاح الحمض النووي التجارية لإصلاح الضرر قبل إجراء تفاعل الفك.
تعتمد كفاءة فك الحمض النووي أيضا على نقاء ونشاط CMG. من الممارسات الجيدة تقييم نقاء العينة بعد كل خطوة تنقية بواسطة الرحلان الكهربائي SDS-PAGE لتحديد مكان التحسين الضروري. إذا لوحظ وجود عدد كبير جدا من الملوثات بعد الخطوة الأخيرة ، فقد يساعد ذلك في تعديل أحجام تدرج الملح المستخدمة للشطف من عمود CaptoHiRes Q (5/50). من المهم أيضا إزالة أي ببتيد فلوري زائد يستخدم في وضع العلامات على البروتين ، حيث يمكن أن يخلق خلفية غير مرغوب فيها على سطح الغطاء. من الضروري أيضا تجنب تلوث النوكلياز ، لأن هذا يمكن أن يؤدي إلى تدهور ركيزة الحمض النووي. بعد التجربة ، يمكن أن يكون تلطيخ الحمض النووي المتبقي ببرتقالي SYTOX طريقة جيدة للتحقق مما إذا كان الحمض النووي قد تحلل بشكل كبير أم لا. لا مفر من مستوى معين من تلف الحمض النووي على مدار التجربة ، لكن الضرر الكبير غالبا ما يشير إلى تلوث نوكلياز إشكالي.
كما أن الاختبار محدود بطبيعته من خلال دقة البقع المحدودة الانعراج ، مما يتطلب أن تكون البروتينات الفلورية على بعد مئات الأزواج الأساسية (إن لم يكن أكثر) لتمييزها على أنها منفصلة. هذا يحد من التفاصيل التي يمكن من خلالها ملاحظة تقدم CMG والتفاعلات.
يختلف عدد أحداث الفك التي نلاحظها لكل تحليل. لتجربة ناجحة ، نتوقع أن نرى على الأقل العديد من مسارات RPA ذات الطول الكافي لكل مجال رؤية 512 × 512 بكسل (حجم البكسل = 154.6 نانومتر). يمكن تصوير حقول رؤية متعددة في نفس التجربة، مما يسمح بمزيد من جمع البيانات عند الضرورة. لا يلزم أن تكون المسالك بنفس الطول ولا تصل إلى نهاية الحمض النووي لتكون مفيدة. على سبيل المثال ، يمكن تحديد متوسط مسافة الحبل لكل تجربة عن طريق قياس طول الحمض النووي الملطخ ب SYTOX قبل إضافة CMG. يمكن استخدام هذا لتقدير مقدار الحمض النووي الذي تم فكه لأي جهاز RPA (طالما تم فك ما يكفي من الحمض النووي لتحريك الشوكة بشكل واضح) عن طريق تحويل المسافة من "μm المقطوعة" إلى "kb unwound".
يظهر CMG نشاط فك على مجموعة متنوعة من ركائز الحمض النووي ، ولكن من الضروري توفير نهاية حمض نووي مجانية 3 بوصات على رفرف بولي تي لا يقل عن 30 nt لاستيعاب بصمة CMG10. يضمن تضمين شقوق البيوتين المتعددة في الشوكة ربطا قويا للسطح. يمكن إعادة تصميم بقية ركيزة الحمض النووي بعدة طرق ، مثل تضمين تسلسلات مختلفة من الحمض النووي وأطوال وتعديلات كيميائية. يمكن تغيير شكل الحمض النووي باستخدام تركيزات مختلفة من أسيتات المغنيسيوم. عند تركيزات أعلى (≥10 ملليمتر) من أسيتات المغنيسيوم ، يتم ضغط خيوط ssDNA المطلية ب RPA ، مما يؤدي إلى سحب الحمض النووي الذي يتم تدريسه بواسطة ربط RPA أثناء الفك. يمكن أن يكون هذا مفيدا لأنه يمنع الحمض النووي من التحرك بشكل مفرط ، مما يسمح بقياس موضع CMG وتطور الفك بشكل أكثر دقة. عند تركيزات منخفضة (~ 3 مللي مولار) من أسيتات المغنيسيوم ، يظل RPA-ssDNA مسترخيا طوال الوقت.
يمثل الاختبار الموصوف أحادي الجزيء منصة يمكن البناء عليها وتعديلها للتحقيق في المزيد من جوانب تكرار الحمض النووي. أثناء تكرار الحمض النووي ، يعمل CMG كنواة يتجمع حولها الريبسولوم ومكوناته. لذلك ، يمكن إضافة بروتينات منقاة إضافية إلى هذا الاختبار ، بما في ذلك العوامل الملحقة مثل TIMELESS و TIPIN و CLASPIN ، لدراسة تأثيرها على ديناميكيات CMG. لقد ثبت أن هذه البروتينات تؤثر على معدل شوكات النسخالمتماثل 13 ، ولكن ليس من الواضح كيف تؤثر على معدل فك CMG. لذلك ، سيكون من المثير للاهتمام التحقيق في كيفية تأثير بروتينات الاستجابة المختلفة على CMG باستخدام هذا الفحص. قد تعطي إضافة بوليميرات الحمض النووي نظرة أفضل لتكرار الحمض النووي بما يتجاوز فك الحمض النووي وحده ، كما هو موضح سابقا مع بروتينات الخميرة14. علاوة على ذلك ، قد يوفر تنقية CMG المعدل فهما أفضل لكيفية تأثير بعض الطفرات أو تعديلات ما بعد الترجمة على نشاط الهليكاز15،16. بالإضافة إلى ذلك ، يمكن أن يسمح تصميم ركائز مختلفة للحمض النووي بدراسة فك الحمض النووي بواسطة CMG في ظل مجموعة متنوعة من الظروف التي تحاكي إجهاد النسخالمتماثل 17. تشمل هذه التعديلات عوائق الحمض النووي9،18 ، والروابط المتقاطعة بين الخيوط19،20،21 ، والانقطاعات في خيوط الحمض النووي22.
Disclosures
وليس لدى أصحاب البلاغ مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
نشكر Gheorghe Chistol على توفير البلازميد pGC261 ومرفق البيولوجيا الكيميائية في معهد فرانسيس كريك لتخليق الببتيد ووضع العلامات عليه. تم تمويل هذا العمل من قبل معهد فرانسيس كريك ، الذي يتلقى تمويلا أساسيا من أبحاث السرطان في المملكة المتحدة ، ومجلس البحوث الطبية في المملكة المتحدة ، و The Wellcome Trust (CC2133).
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M3148-25ML | |
| Acrylamide / Bis Solution 40% | BioRad | 1610148 | |
| Agarose UltraPure | Invitrogen | 16500-500 | Used to prepare Tris Buffer (pH 8) |
| ÄKTA Pure | GE Healthcare | - | Used with Fraction Collector F9-C; protein purification system |
| ANTI-FLAG M2 affinity gel | Sigma-Aldrich | A2220 | |
| APS 10% | Sigma-Aldrich | A3678-25G | |
| ATP (200 mM) | Sigma-Aldrich | A7699-5G | |
| ATP-g-s (100 mM) | Sigma-Aldrich | 11162306001 | |
| Biotin-PEG coverslip | N/A | N/A | Prepared as described: https://doi.org/10.1016/j.ymeth.2012.03.033 |
| Biotinylated anti-digoxigenin antibody | Perkin Elmer | N/A | |
| Blu Tack | Bostik | N/A | Adhesive putty |
| Boric acid | Thermo Fisher Scientific | B/3800/53 | |
| BSA; 33 mg/mL | SIGMA-ALDRICH | A3858-10G | Diluted from the stock |
| CaCl2 | Sigma-Aldrich | C7902 | |
| CaptoHiRes Q (5/50) | Cytiva | 29275878 | Connected to the AKTA protein purification system; high-resolution ion exchange chromatography column |
| Casein (5% in water, 50 mg/mL) | Sigma-Aldrich | C4765-10ML | |
| ChemiDoc system | Bio-Rad | N/A | |
| Clips | N/A | N/A | |
| Cutting board | N/A | N/A | |
| Dialysis tubing (3.5 kDa) | Fisher Scientific | 11425859 | |
| digoxigenin-11-dUTP | Roche | 11209256910 | |
| DNA loading dye 6x | NEB | B7024S | |
| dNTP 10 mM | NEB | N0447S | |
| Double-sided tape (0.14 mm thick) | N/A | N/A | |
| DTT | Fluorochem Limited | M02712-10G | |
| DYKDDDDK peptide | N/A | N/A | Synthetised by chemical biology STP of The Francis Crick Institute |
| EDTA | Thermo Fisher Scientific | D/0700/68 | |
| EGFP-RPA | N/A | N/A | Purified as desribed in ‘Single Molecule Analysis’, Series Methods in Molecular Biology, Vol. 783 (2011), Peterman, E. J. G. and Wuite G. J. L. editors, Humana Press. Protein information: 2 mM, human, expressed in E. coli. |
| EGTA | Sigma-Aldrich | 03779-10G | |
| Epoxy - 5 minute | Devcon | 20845 | |
| Fujifilm FLA-5000 | Fujifilm | FLA-5000 | Fluorescent image analyzer |
| GelRed Nucleic Acid Stain; 10000x | Cambridge Bioscience | 41003-BT | Example of nucleic acid stain which is a safer alternative to ethidium bromide. |
| Glass or quartz slide with holes for tubing | Dremel Model 395 | 1 mm thick slide, cut to 2.4 cm x 1cm, two holes drilled 1.4 mm apart. The holes should be drilled to different sizes to accommodate different tubing at each end. | |
| Glycerol | Fisher Scientific | G/0650/17 | |
| Glycine HCl, pH 3.5 | Sigma-Aldrich | G8898 | |
| Hamilton syringe, 1000 series GASTIGHT, PTFE luer lock 1010TLL, PTFE Luer lock (with slots), volume 10 mL | Merck | 26211-U | |
| HEPES pH 7.5 | Sigma-Aldrich | H4034 | |
| I-CeuI | NEB | R0699L | |
| KCl | Fisher Scientific | P/4280/53 | |
| Magnesium acetate | Sigma-Aldrich | M2545 | |
| Maxi GeBaFlex-tube Dialysis Kit; MWCO 14 kDa | Generon | D055 | |
| Metal spatula | N/A | N/A | |
| Metal tweezers | N/A | N/A | |
| MgCl2 | Sigma-Aldrich | M2393 | |
| Millex-GP (Syringe filters) 0.22 µm | Merck | SLGP033RS | |
| NaCl | Sigma-Aldrich | S7653 | |
| Needle | N/A | N/A | |
| NotI-HF | NEB | R3189L | |
| NuPAGE 4%–12% Bis-Tris Protein Gels | Thermo Fisher Scientific | 10247002; | |
| NuPAGE MOPS SDS Running Buffer | Thermo Fisher Scientific | NP0001 | |
| Objective heater | Okolab | N/A | |
| PCR mix - 2x | Prepared from Phusion DNA polymerase (20 µL), 10 mM dNTPs (40 µL), 5x Phusion HF buffer (400 µL) and water (540 µL). | ||
| Peptide NH2-CHHHHHHHHHHLPETGG-COOH, labelled with LD655-MAL | N/A | N/A | peptide NH2-CHHHHHHHHHHLPETGG-COOH, labeled with LD655-MAL (Lumidyne Technologies) on the cysteine residue, was synthetised and purified by the peptide chemistry STP of The Francis Crick Institute |
| pGC261 plasmid | N/A | N/A | https://doi.org/10.1016/j.cell.2018.10.053 |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530L | |
| Plastic tweezers | N/A | N/A | |
| Polyethylene tubing PE20 (inner diameter 0.015”, outer diameter 0.043”) | Becton Dickinson | 427406 | |
| Polyethylene tubing PE60 (inner diameter 0.03”, outer diameter 0.048”) | Becton Dickinson | 427416 | |
| Poly-Prep Chromatography Columns; 10 ml and 20 ml | Bio-Rad | 7311550 | |
| Potassium Glutamate (L-glutamic acid potassium salt monohydrate) | Sigma | G1501-1KG | |
| Protease inhibitor cocktail (cOmplete, EDTA free) | Roche | 5056489001 | |
| Pump 11 Elite Infusion/Withdrawal Programmable Single Syringe | Harvard Apparatus | 70-4504 | |
| QIAquick PCR Purification Kit | QIAGEN | 28104 | |
| Razor blade | VWR International Ltd | 233-0156 | |
| rCutSmart Buffer; 10x | NEB | B6004S | |
| Sodium acetate | Thermo Fisher Scientific | S/2120/53 | |
| Sortase (pentamutant) | N/A | N/A | Purified based on: https://doi.org/10.1073/pnas.1101046108 |
| Spin-X Centrifuge Tube Filters; 0.22 µm cellulose acetate | Fisher Scientific | 10310361 | |
| Sterile scalpel | N/A | N/A | |
| Steritop Vacuum Driven Disposable Filtration System; 0.22 um; PES; | Millipore | S2GPT05RE | |
| Streptavidin (1 mg/mL) in 1x PBS buffer | Sigma | S4762-10MG | 20 µL aliquotes |
| SYBR Gold | Thermo Fisher Scientific | S11494 | Highly sensitive nucleic acid stain we used to visualise DNA fork substrate. |
| SYTOX orange; 5 µM in DMSO | Thermo Fisher Scientific | S11368 | |
| T4 DNA ligase | NEB | M0202M | |
| T4 DNA Ligase Reaction Buffer | NEB | B0202S | |
| TEMED | Sigma-Aldrich | T9281-25ML | |
| TEV protease (1 mg/mL); EZCut | Biovision | 7847-10000 | |
| Tissue grinders, Dounce type (40 mL, Wheaton) | DWK Life Sciences | 432-1273 | |
| Tris base | Sigma-Aldrich | T1503 | Used to prepare Tris Buffer (pH 8) |
| Tris HCl | Sigma-Aldrich | T3253 | |
| Tween-20 | Promega UK Ltd | H5152 |
References
- Bell, S. P., Labib, K. Chromosome Duplication in Saccharomyces cerevisiae. Genetics. 203 (3), 1027-1067 (2016).
- Costa, A., et al. The structural basis for MCM2-7 helicase activation by GINS and Cdc45. Nat Struct Mol Biol. 18 (4), 471-477 (2011).
- Jones, M. L., Baris, Y., Taylor, M. R. G., Yeeles, J. T. P. Structure of a human replisome shows the organisation and interactions of a DNA replication machine. EMBO J. 40 (23), e108819 (2021).
- Moyer, S. E., Lewis, P. W., Botchan, M. R. Isolation of the Cdc45/Mcm2-7/GINS (CMG) complex, a candidate for the eukaryotic DNA replication fork helicase. Proc Natl Acad Sci U S A. 103 (27), 10236-10241 (2006).
- Douglas, M. E., Ali, F. A., Costa, A., Diffley, J. F. X. The mechanism of eukaryotic CMG helicase activation. Nature. 555 (7695), 265-268 (2018).
- Ilves, I., Petojevic, T., Pesavento, J. J., Botchan, M. R. Activation of the MCM2-7 helicase by association with Cdc45 and GINS proteins. Mol Cell. 37 (2), 247-258 (2010).
- Dewar, J. M., Walter, J. C. Mechanisms of DNA replication termination. Nat Rev Mol Cell Biol. 18 (8), 507-516 (2017).
- Burnham, D. R., Kose, H. B., Hoyle, R. B., Yardimci, H. The mechanism of DNA unwinding by the eukaryotic replicative helicase. Nat Commun. 10 (1), 2159 (2019).
- Kose, H. B., Larsen, N. B., Duxin, J. P., Yardimci, H. Dynamics of the eukaryotic replicative helicase at lagging-strand protein barriers support the steric exclusion model. Cell Rep. 26 (8), 2113-2125.e6 (2019).
- Kose, H. B., Xie, S., Cameron, G., Strycharska, M. S., Yardimci, H. Duplex DNA engagement and RPA oppositely regulate the DNA-unwinding rate of CMG helicase. Nat Commun. 11 (1), 3713 (2020).
- Tanner, N. A., Van Oijen, A. M. Visualizing DNA replication at the single-molecule level. Methods Enzymol. 475, 259-278 (2010).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without ph drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
- Baris, Y., Taylor, M. R. G., Aria, V., Yeeles, J. T. P. Fast and efficient DNA replication with purified human proteins. Nature. 606, 204-210 (2022).
- Lewis, J. S., et al. Tunability of DNA polymerase stability during eukaryotic DNA replication. Mol Cell. 77 (1), 17-25.e5 (2020).
- Li, Z., Xu, X. Post-translational modifications of the mini-chromosome maintenance proteins in DNA replication. Genes. 10 (5), 331 (2019).
- Lewis, J. S., et al. Mechanism of replication origin melting nucleated by CMG helicase assembly. Nature. 606 (7916), 1007-1014 (2022).
- Zeman, M. K., Cimprich, K. A. Causes and consequences of replication stress. Nat Cell Biol. 16 (1), 2-9 (2014).
- Sparks, J. L., et al. The CMG helicase bypasses DNA-protein cross-links to facilitate their repair. Cell. 176 (1-2), 167-181.e21 (2019).
- Taylor, M. R. G., Yeeles, J. T. P. The initial response of a eukaryotic replisome to DNA damage. Mol Cell. 70 (6), 1067-1080.e12 (2018).
- Amunugama, R., et al. Replication fork reversal during DNA interstrand crosslink repair requires CMG unloading. Cell Rep. 23 (12), 3419-3428 (2018).
- Wu, R. A., et al. TRAIP is a master regulator of DNA interstrand crosslink repair. Nature. 567 (7747), 267-272 (2019).
- Vrtis, K. B., Dewar, J. M., Chistol, G., Wu, R. A., Graham, T. G. W., Walter, J. C. Single-strand DNA breaks cause replisome disassembly. Mol Cell. 81 (6), 1309-1318.e6 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved