反应的理论产率是基于平衡化学方程式的化学计量估计形成的产物的量。理论产率假设限量反应物完全转化为所需产物。通过反应获得的产物量称为实际产率,它可能小于或(很少)等于理论产率。
百分比产率
在化学反应的情况下,产物的实际产率通常小于基于反应化学计量法预测的理论产率。当在给定的一组条件下进行反应时,由于多种原因,预计不可避免的质量损失。有些反应自然效率低下,通过副反应生成其他不良产物。其他的由于其可逆的性质而不完整,并伴随着反应物和产物之间的平衡状态。有时,产物质量的损失是由于在纯化技术(例如结晶,蒸馏,过滤和色谱分离)过程中从反应混合物中回收的所需产物得不到充分的吸收。在遇到产品损失的情况下,使用百分比产率来衡量达到反应理论收率的程度。
 实际和理论产率可以表示为质量或摩尔量(或如果产物是气体,则为任何其他合适的性质,例如体积)。只要两个收益都使用相同的单位表示,则在计算收益百分比时,这些单位就会取消。
实际和理论产率可以表示为质量或摩尔量(或如果产物是气体,则为任何其他合适的性质,例如体积)。只要两个收益都使用相同的单位表示,则在计算收益百分比时,这些单位就会取消。
计算百分比产率
考虑将一氧化氮燃烧成二氧化氮。
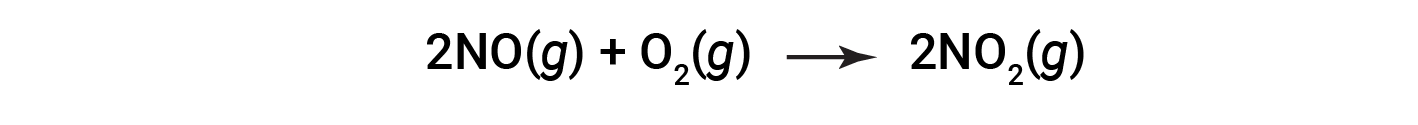
反应的实际产率为180克。知道一氧化氮是限量反应物,基于NO和NO 2 的化学计量,可获得理论产率的摩尔数。首先,NO的质量转换为NO的摩尔数。然后,采用NO:NO 2 的化学计量比(1:1),这表明5摩尔NO将形成5摩尔NO 2 。第三,NO 2 的摩尔转化为质量。
最后一步,将根据实际产率与理论产率之比计算百分比产率。


版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。