氧化还原反应
地球大气中约有20%的分子氧O 2 ,一种化学反应性气体,在有氧生物的代谢以及许多塑造世界的环境过程中起着至关重要的作用。氧化一词最初用于描述涉及O 2 的化学反应,但其含义已演变为涉及广泛而重要的反应类别,称为氧化还原(redox)反应。 >
某些氧化还原反应涉及电子在反应物之间的转移以产生离子产物,例如钠和氯之间的反应以产生氯化钠:
查看有关每种单独反应物的过程非常有帮助,也就是说,以称为半反应的方程式的形式表示每种反应物的命运:
这些等式表明,Na原子失去电子,而Cl原子(在Cl 2 分子中)获得电子,即 s 。所得离子的下标表示它们以固体离子化合物的形式存在。对于这种氧化还原反应,电子的损失和增益定义了发生的互补过程:
氧化=电子损失
还原=电子增益
在该反应中,钠被氧化,氯被还原。从更活跃的角度来看,钠起还原剂(还原剂)的作用,因为它为氯提供电子(或还原氯)。同样,氯也起氧化剂(氧化剂)的作用,因为它可以有效地去除钠中的电子(氧化)。
还原剂=被氧化的物种
氧化剂=被还原的物种
通常,氧化剂从还原剂获得电子,其自身被还原。氧化剂的电荷变得更负。类似地,还原剂使电子失去氧化剂,而自身被氧化。还原剂的电荷变得更正。
但是,某些氧化还原过程不涉及电子转移。例如,考虑一种类似于生成NaCl的反应:
该反应的产物是共价化合物,因此不涉及明确意义上的电子转移。为了阐明该反应与上一个反应的相似性并明确定义氧化还原反应,已定义了一种称为氧化数的性质。


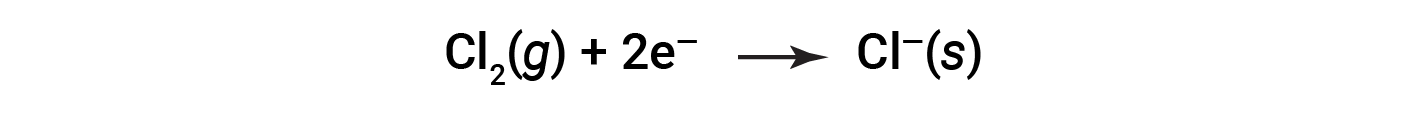
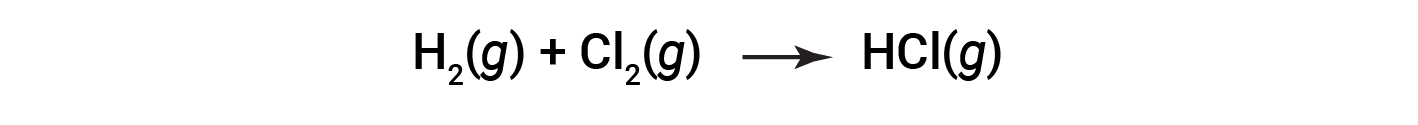
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。