5.4 : 气体混合物-道尔顿分压定律
除非个别气体彼此发生化学反应,否则混合气体中的个别气体不会相互影响压力。混合物中的每种气体所施加的压力与单独存在于容器中时所施加的压力相同。每种气体在混合物中施加的压力称为其分压。
这意味着在包含三种不同气体A,B和C的混合物中,如果 P A 是气体A的分压; P B 是气体B的分压; P C 是气体C的分压;则总压力由公式1给出:
这是道尔顿分压定律:理想气体混合物的总压力等于组成气体分压的总和。
让 n A , n B 和 n C 是混合物中每种气体的摩尔数。如果每种气体都遵循理想气体方程,则分压可以写为:
由于所有气体处于相同的温度且占据相同的体积,因此代入等式1可得出:
该方程式表明,在恒定温度和恒定体积下,气体样品的总压力取决于存在的气体的总摩尔数。
对于气体混合物,引入一个称为摩尔分数的量是很方便的,它的定义是混合物中特定物质的摩尔数除以存在的所有物质的摩尔数。数学上,物质A与B和C的混合物中的摩尔分数表示为
类似地,B和C的摩尔分数是;
结合A的摩尔分数方程和分压方程得出:
气体A的分压通过其摩尔分数与混合气体的总压力相关。
换句话说,气体在气体混合物中的压力是其摩尔分数与混合物总压力的乘积。
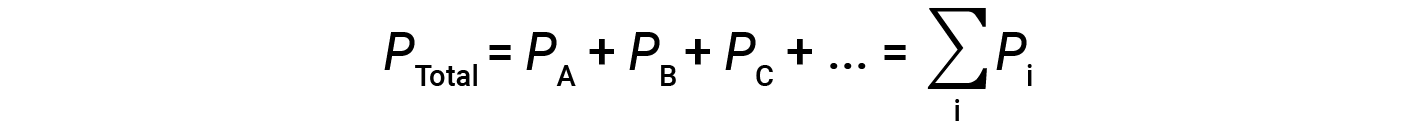
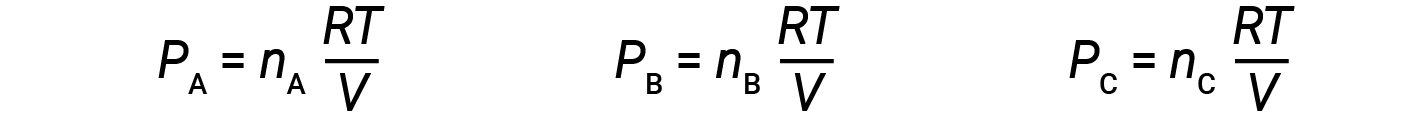
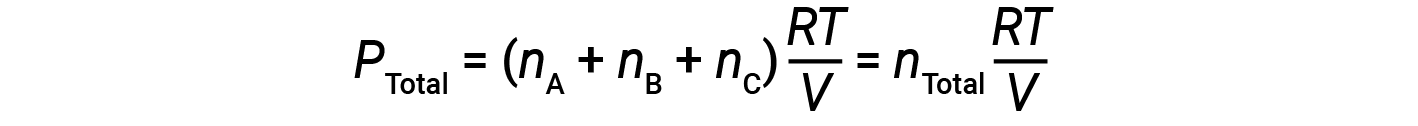
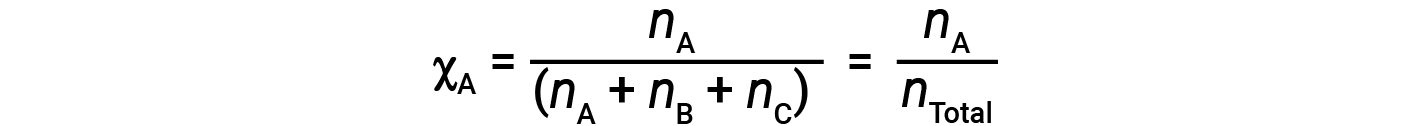
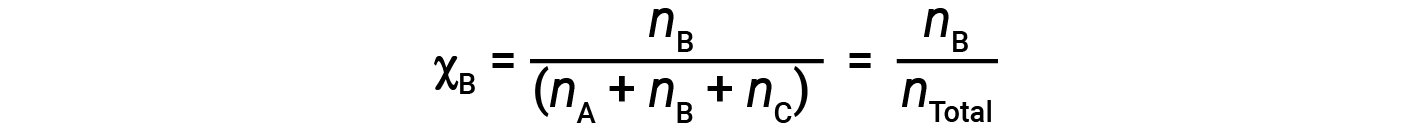
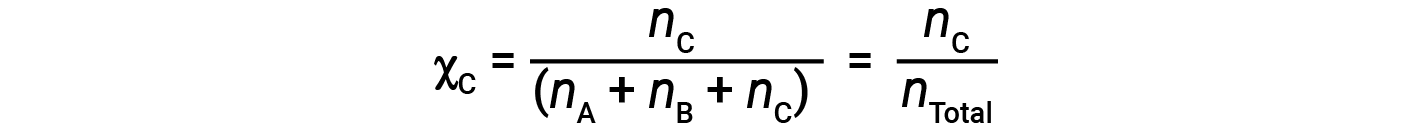
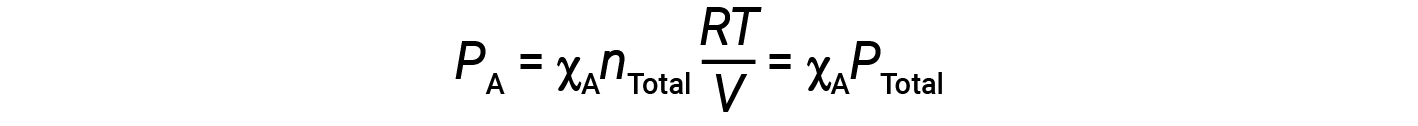
Tags
Mixtures Of GasesDalton s Law Of Partial PressuresMole FractionsPressure Of A Pure GasMolecular CollisionsGas SampleParticlesVolumeMulticomponent Gas MixtureCollisions From All Gas MoleculesPartial PressureTotal PressureIdeal Gas MixtureDalton s Law Of Partial PressuresIdeal Gas LawMeasurable VariablesMoles Of The Individual ComponentsTotal Number Of MolesGas ComponentsConstant RT Over VMole Fraction
来自章节 5:

Now Playing
5.4 : 气体混合物-道尔顿分压定律
热化学
39.0K Views

5.1 : 压力和测量压力
热化学
35.9K Views

5.2 : 气体定律
热化学
65.9K Views

5.3 : 理想气体定律的应用:摩尔质量、密度和体积
热化学
56.3K Views

5.5 : 化学计量学和气体
热化学
24.5K Views

5.6 : 动力学分子理论:基本假设
热化学
33.7K Views

5.7 : 动力学分子理论与气体定律
热化学
32.5K Views

5.8 : 分子速度和动能
热化学
27.4K Views

5.9 : 渗出和扩散
热化学
28.6K Views

5.10 : 真实气体-偏离理想气体定律
热化学
34.4K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。