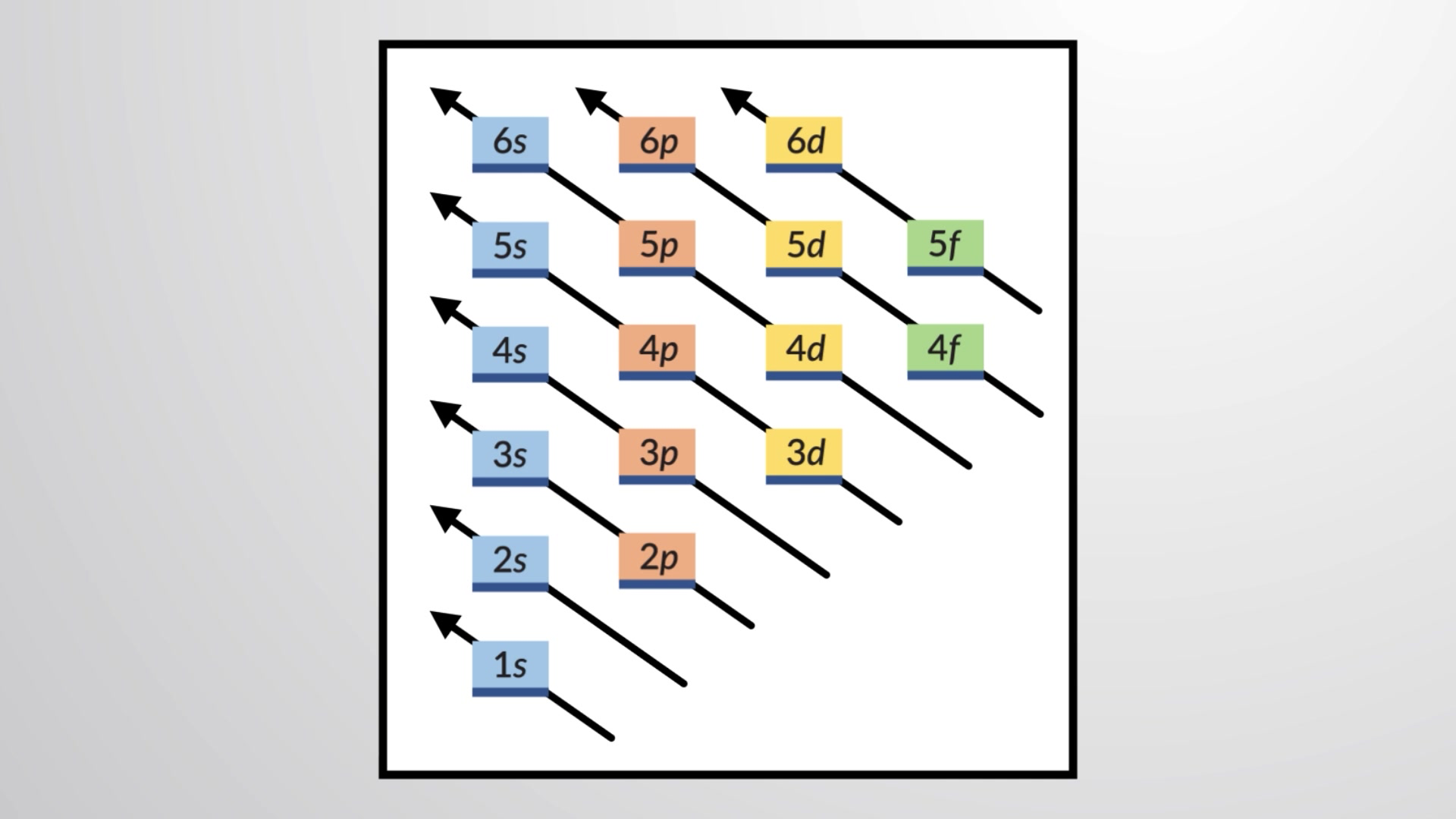
要确定任何特定原子的电子构型,我们可以按原子序数顺序构建结构。从氢开始,一直到整个周期表的周期,我们一次向原子核添加一个质子,向适当的子壳添加一个电子,直到我们描述了所有元素的电子构型。此程序被称为构造原理,源于德语单词 aufbau ("以构建")。根据保利排除原则(PEP),受允许的量子数所施加的限制会导致每个添加的电子占据最低可用能量的子壳。电子只有在低能子壳被充满后才进入高能子壳。图1说明了记住原子轨道填充顺序的传统方法。
图1 该图描述了原子轨道的能级,对推导基态电子构型很有用。
考虑编写碳的电子构图-原子序数为6的元素。四个电子充满1 s 和2 s 轨道。其余两个电子占据2 p 子壳。现在,我们可以选择填充2个 p 轨道之一,并使电子成对,或者使电子在两个不同但退化的 p 轨道中不成对。如洪德法则所述填充轨道:对于在一组简并轨道内具有电子的原子而言,最低能量构型是具有最大数量的未成对电子的构型。因此,碳2 p 轨道中的两个电子具有相同的 n , l 和 m s量子数并且它们的 m l 量子数不同(符合保利排除原理)。电子构型为1 s 2 2 s 2 1 p的碳的轨道图 2 是:
 氮(原子序数7)填充1 s 和2 s 子壳,并且在三个2 p 轨道中的每个轨道中都有一个电子,按照洪德(Rund)的规则。这三个电子具有不成对的自旋。氧(原子序数8)在2 p 个轨道中的任何一个中都有一对电子(电子具有相反的自旋),而在其他两个中每个都有一个电子。氟(原子序数9)只有一个2 p 轨道,其中含有不成对的电子。稀有气体氖(原子序数为10)中的所有电子都配对,并且 n = 1和 n = 2壳中的所有轨道都被填充。  
氮(原子序数7)填充1 s 和2 s 子壳,并且在三个2 p 轨道中的每个轨道中都有一个电子,按照洪德(Rund)的规则。这三个电子具有不成对的自旋。氧(原子序数8)在2 p 个轨道中的任何一个中都有一对电子(电子具有相反的自旋),而在其他两个中每个都有一个电子。氟(原子序数9)只有一个2 p 轨道,其中含有不成对的电子。稀有气体氖(原子序数为10)中的所有电子都配对,并且 n = 1和 n = 2壳中的所有轨道都被填充。  
来自章节 7:

Now Playing
7.14 : 构造原理与洪德规则
元素的周期律
42.0K Views

7.1 : 光的波动本质
元素的周期律
47.9K Views

7.2 : 电磁频谱
元素的周期律
52.1K Views

7.3 : 干涉和衍射
元素的周期律
29.7K Views

7.4 : 光电效应
元素的周期律
29.0K Views

7.5 : 玻尔模型
元素的周期律
49.1K Views

7.6 : 发射光谱
元素的周期律
48.6K Views

7.7 : 德布罗意波长
元素的周期律
25.1K Views

7.8 : 不确定性原则
元素的周期律
22.7K Views

7.9 : 原子的量子力学模型
元素的周期律
41.4K Views

7.10 : 量子数
元素的周期律
34.0K Views

7.11 : 原子轨道
元素的周期律
32.7K Views

7.12 : 保利排除原则(PEP)亦称:泡利不相容原理
元素的周期律
32.9K Views

7.13 : 原子轨道的能量
元素的周期律
23.5K Views

7.15 : 多电子原子的电子构型
元素的周期律
36.9K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。