元素周期表根据原子序数的增加排列原子,从而使具有相同化学性质的元素周期性地重复出现。当将其电子构型添加到表中时,会观察到这些元素的外壳中类似电子构型的周期性重复出现。由于价电子在原子的外壳中,因此它们在化学反应中起着最重要的作用。外部电子具有原子中电子的最高能量,比核心电子更容易丢失或共享。价电子也是元素某些物理性质的决定因素。
水平行称为句点。在整个周期中,每个连续的元素在原子核中都有一个附加的质子,并且在价态壳中具有一个附加的电子。垂直列是组。任何一组(或一列)中的元素具有相同数量的价电子(图1);碱金属的锂和钠仅具有一个价电子,碱土金属的铍和镁均具有两个价电子,卤素的氟和氯分别具有七个价电子。价电子的损失,获得或共享决定了元素的反应方式。同一族元素之间的化学性质相似,是因为它们具有相同数量的价电子。
重要的是要记住,周期表是在元素的原子结构尚未得到任何了解之前就根据元素的化学行为而开发的。现在可以理解元素周期表的排列;原子中具有相同价电子数量的元素在同一组中。图1的彩色部分显示了按填充的轨道分类的三类元素。
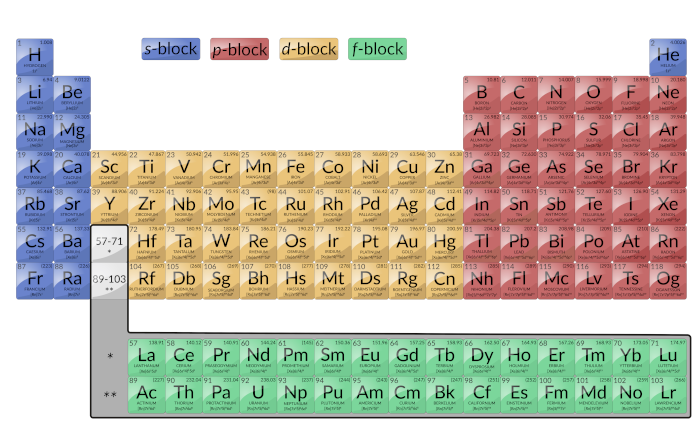
图1:此版本的周期表显示了每个元素的配置。请注意,在每个组中,配置通常是相似的。
主要组元素有时称为代表元素。这些元素是最后添加的电子进入最外层外壳中的 s 或 p 轨道的元素,在图1中以蓝色和红色显示。该类别包括所有非金属元素,以及准金属和许多金属。主族元素的价电子是 n 能级最高的那些。例如,镓(Ga,原子序数为31)具有电子构型[Ar] 4 s 2 3 d 10 4 p 1 ,其中包含三个价电子(带下划线)。完全填充的 d 轨道算作核心电子,而不是价电子。
两个最左列构成 s 块,六个最右列构成 p 块。稀有气体是 p 嵌段的一部分,除了氦气中有两个电子外,它们都具有八个价电子。这些元素高度稳定且无反应。
过渡元素或过渡金属:这些是最后添加的电子进入 d 轨道的金属元素。这些元素中的价电子(在最后一种惰性气体构型后添加的价电子)包括 ns 和( n – 1) d 电子。 IUPAC对过渡元素的正式定义指定了部分填充了 d 轨道的元素。因此,具有完全填充的轨道的元素(图1中的Zn,Cd,Hg以及Cu,Ag和Au)在技术上不是过渡元素。但是,该术语经常用于指代整个 d 块(图1中为黄色)。
d 块由10列组成。填满每一行的 d 轨道的主要量子数等于行数减一。在第四行中,填充3 d 个轨道,在第五行中,填充4 d 个轨道,依此类推。
内部过渡元素:它们在图1中以绿色显示。内部过渡元素的化合价壳由( n – 2)组成。 f ,( n – 1) d 和 ns 子外壳。当最后一个电子进入 f 轨道时,内部过渡元素构成 f 嵌段。填满每一行的 f 轨道的主要量子数等于行数减去2。在第六行中,填充了4 f 个轨道,在第七行中,填充了5 f 个轨道。内部有两个过渡系列:
由于镧和锕与该系列的其他成员相似,因此被包括在内并用于命名该系列,即使它们是不含 f 电子的过渡金属。
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。







