反应速率受反应物浓度的影响。 速率定律 (差分速率定律) 或率方程式是描述化学反应速率与其反应物的浓度之间关系的数学表达式。
例如,在一般反应aA + bB ⟶ 生成物,其中 a 和 b 是化学计量系数,速率定律可写为:
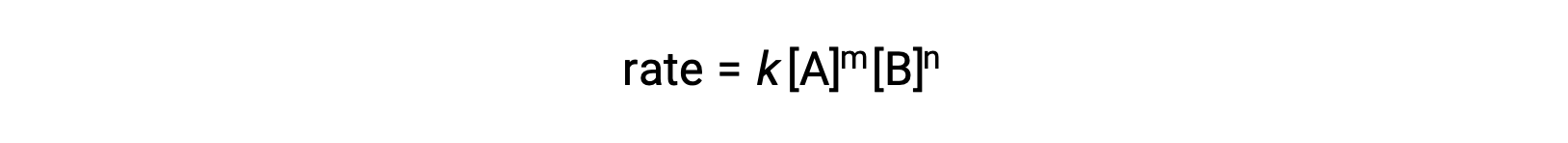
[A] 和 [B] 代表反应物的摩尔浓度,k 是速率常数,它是特定温度下特定反应的特异性。
指数m 和n 是反应顺序,通常是正整数,尽管它们可以是分数,负数或零。
速率常数k 和反应顺序m 和n 是通过观察反应速率如何随反应物浓度的变化而变化的实验确定的。 速率常数k 与反应物浓度无关,但随温度而变化。
速率定律中的反应顺序描述了速率对反应物浓度的数学依赖性。 参照通用速率定律 (速率 k[A]m[B]n)) ,反应对A 是m 顺序而对 B是n顺序。 例如,如果m = 1 , n = 2 , 反应的第一顺序为A,第二顺序为B。 整体反应顺序只是每个反应物的顺序总和。 对于此处的速率定律示例,反应是整体第三顺序 (1 + 2 = 3)。
确定速率定律的一个常见实验方法是初始速率方法。 这种方法包括测量使用不同初始反应物浓度进行的多项实验试验的反应率。 通过比较这些试验的测量速率,可以确定反应命令,以及随后的速率常数,这些常量一起被用于制定速率定律。
速率定律可能会显示某些反应物的分次医嘱,当一种反应物浓度的增加导致反应率下降时,有时会观察到负反应配方。 必须注意的是,速率定律只能通过实验确定,而不能通过反应化学计量法可靠地预测。
反应顺序决定反应速率与浓度或生成物的反应物之间的关系。
•在零阶反应中,反应物的浓度不会对反应速度产生任何影响,而整个反应速度保持不变。
•在一级反应中,反应速率与反应物浓度的变化成直接和线性的比例。 随着反应物浓度的下降,反应率也会按比例下降。
•在二级或更高级别的反应中,反应速率与反应物指数值成正比。 因此,随着反应的进展和反应物的浓度的下降,反应率呈指数级下降。
本文改编自 Openstax, 化学 2e, 第12.3节:速率定律。
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。