化学反应通常是循序渐进发生的,涉及两种或多种不同的反应依次发生。 平衡的方程指示反应物种和生成物物种,但它没有显示反应在分子级别的发生方式的详细信息。 反应机理 (或反应路径) 提供了有关发生反应的精确,分步过程的详细信息。
例如,臭氧分解似乎遵循机理,并执行两个步骤:
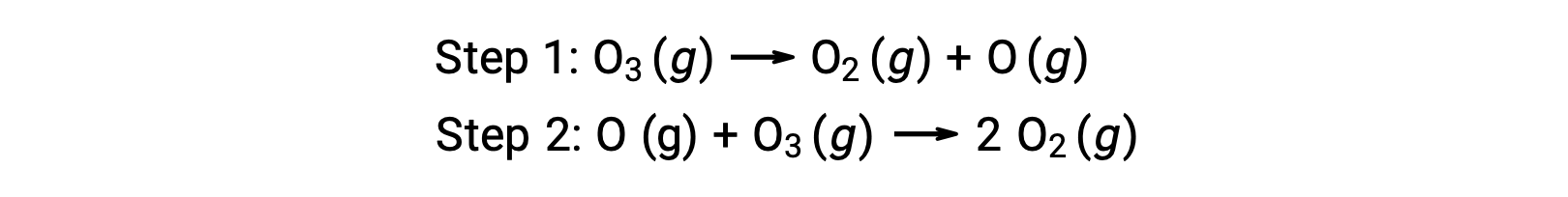
反应机理中的每个步骤都称为基本反应。 这些基本反应按步骤方程式中所示的顺序发生,并与产率描述总体反应的平衡化学方程相加:
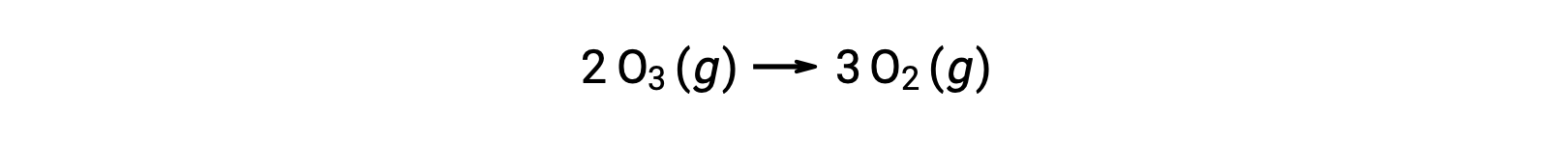
请注意,第一步产生的氧原子在第二步中被消耗,在整体反应中不会显示为生成物。 这种一步生产并在随后一步中消费的物种被称为反应中间体。
虽然整体反应方程表明两个臭氧分子会做出反应以产生三个氧分子,但实际的反应机理并不涉及两个臭氧分子的直接碰撞和反应。 相反,一个 O3 分解为产率 O2 和一个氧原子,另一个 O3 分子随后与氧原子反应为产率两个额外的氧分子。
与代表整体反应的平衡方程式不同,基本反应方程式是化学变化的明确表示。 一个基本的反应等式描述了正在进行键拆分 / 制作的实际反应物,以及形成的产品。 因此,一种基本反应的速率定律可以直接从其平衡的化学方程中导出。 但是,典型化学反应的情况并非如此,只有通过实验才能可靠地确定速率定律。
单分子基本反应
基本反应的分子性是反应物物种 (原子、分子或离子) 的数量。 例如,分子反应涉及单个反应物产生一个或多个生成物分子的反应:

单分子反应的速率定律为第一级;率值 = k [A]。
分子反应可能是复杂反应机理中的几种基本反应之一。 例如,该反应 (O3 (g) → O2 (g) + O) 说明了作为两级反应机理的一部分发生的单分子基本反应。 但是,一些分子反应可能是单步反应机理的唯一一步。 (换言之,在某些情况下,"整体"反应也可能是基本反应。) 例如,环丁烷 C4H8 至乙烯 C2H4 的气相分解由化学品方程表示:
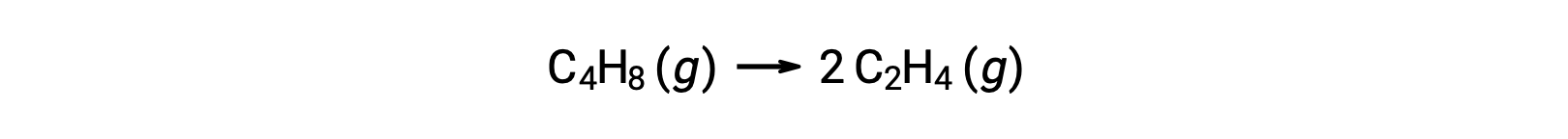
此方程代表整体反应,描述了单分子基本过程。 速率定律根据这一方程预测,假设这是一种基本反应,结果与速率定律得出的总体反应实验结果相同,显示出第一级行为:
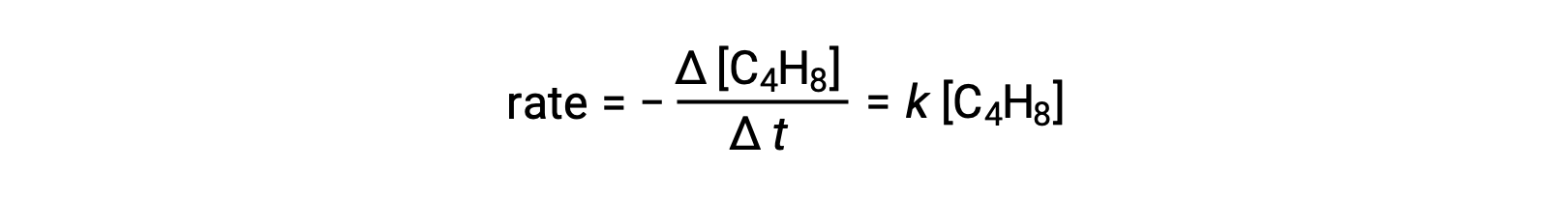
观察到的和预测的速率定律之间达成的这一协议表明,提议的单步单步单步单分子过程是丁二烯反应的合理机理。
双分子的初级反应
双分子的反应涉及两种反应物物种。 例如:
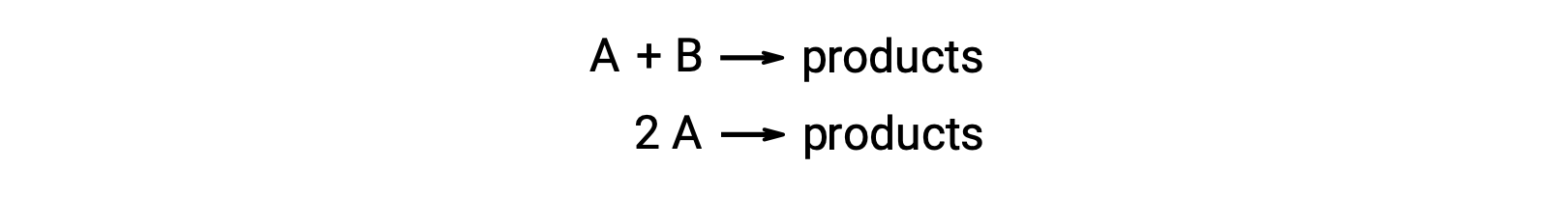
在第一种类型 (两个反应物分子不同) 中,速率定律是 A 级和 B 级 (总体二级)
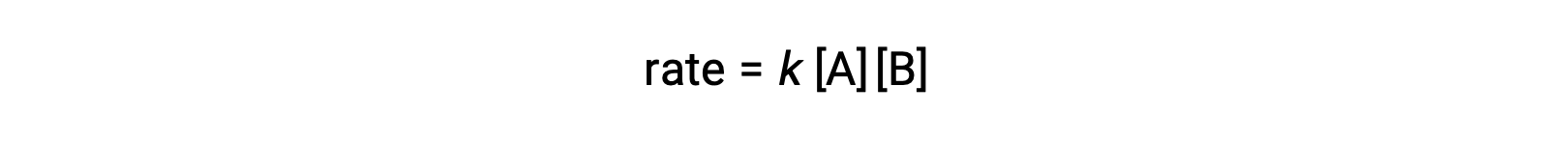
在第二种类型中,两个相同的分子发生碰撞并作出反应,速率定律是 A 中的第二个顺序:
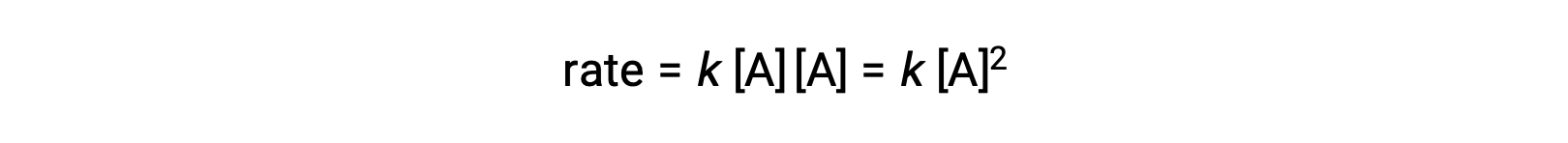
一些化学反应是由机理引起的,该双分子的由单个 基本反应组成。 一个例子是二氧化氮与一氧化碳的反应:
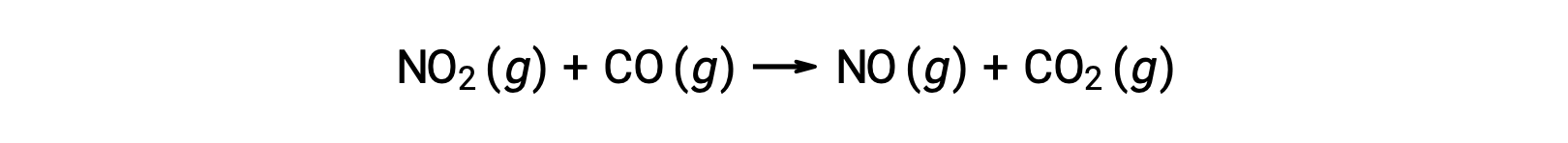
双分子的基本反应也可能作为多步反应机理中的步骤进行。 原子氧与臭氧的反应是臭氧分解两步机理的第二步:
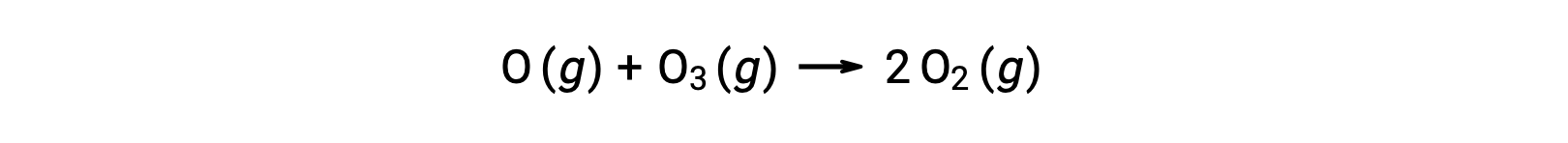
分子初级反应
初级特分子反应涉及三个原子,分子或离子同时发生碰撞。 由于三个粒子同时发生碰撞的概率非常低,所以极分子的基本反应非常少见。 但是,有几种既定的特分子基本反应。 氮氧化物与氧气的反应似乎涉及到特分子步骤:
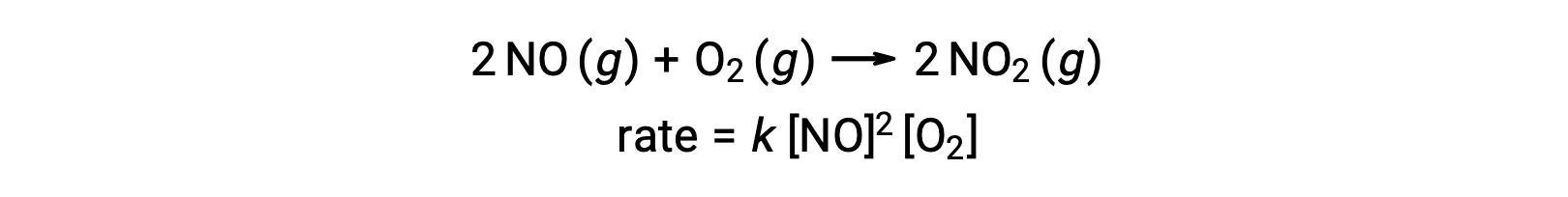
同样,一氧化氮与氯的反应似乎涉及到三分子步骤:
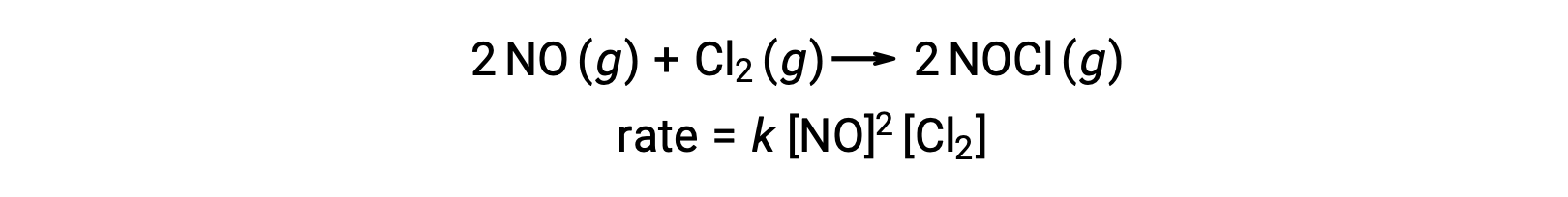
多步反应机理中的一个基本步骤通常比其他步骤慢得多。 由于反应的进行速度不能超过其最慢的步骤,因此此步骤将限制总体反应发生的率值。 因此,最慢的基本步骤被称为反应的速率限制步骤 (或速率确定步骤)。
来自章节 13:

Now Playing
13.9 : 反应机理
化学动力学
24.4K Views

13.1 : 反应速率
化学动力学
49.4K Views

13.2 : 测量反应速率
化学动力学
23.4K Views

13.3 : 浓度和速率定律
化学动力学
28.9K Views

13.4 : 确定反应顺序
化学动力学
53.7K Views

13.5 : 积分速率定律:浓度对时间的依赖
化学动力学
33.2K Views

13.6 : 反应半衰期
化学动力学
33.1K Views

13.7 : 反应速率的温度依赖性
化学动力学
80.0K Views

13.8 : 阿伦尼乌斯图
化学动力学
36.8K Views

13.10 : 速率确定步骤
化学动力学
30.8K Views

13.11 : 催化
化学动力学
25.9K Views

13.12 : 酶
化学动力学
79.6K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。