催化剂的存在会影响化学反应的率值。 催化剂是一种物质,可以在过程中不消耗而增加反应率值。 从反应机理和能量图表的概念可以理解催化剂在化学反应过程中的作用。
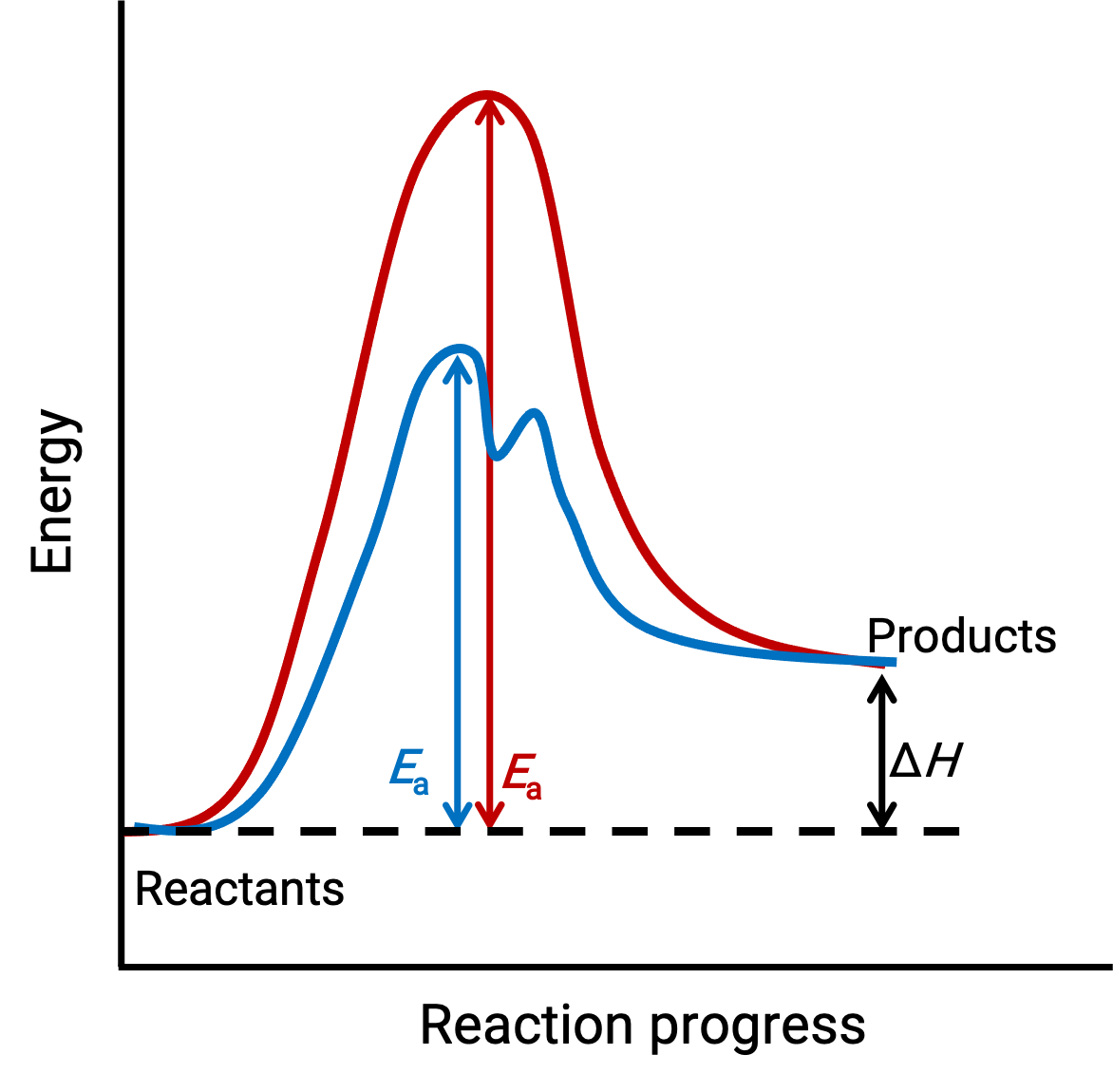
图中所示的图像代表了在催化剂缺失 (红色曲线) 和存在 (蓝色曲线) 的情况下进行的吸热化学过程的反应图。
两条曲线代表相同的整体反应–它们以相同的能量开始和结束。 (在这种情况下,生成物的能量多于反应物。 因此,反应是吸热)。 但是,他们的反应机理有所不同。 未催化的反应通过一步式机理进行 (仅观察到一个过渡状态)。 相比之下,催化反应遵循两步机理 (观察到两个过渡状态) ,激活能量明显较少。 反应途径的这一差异说明了催化剂在提供具有较低启动能量的替代反应机理方面的作用,从而加速反应。
催化反应机理不需要涉及比未催化机理更多的基本步骤。 但是,它必须提供一个替代反应路径,其速率确定步骤更快 (EA或激活能量更低)。
根据催化过程中存在催化剂和反应物的物理状态,催化反应可以归类为均匀或异构。
均相催化
在均相催化中,催化剂与反应物处于相同的相位 - 固体,液体或气体。 在此过程中,催化剂与反应物相互作用,形成一种中间物质,然后通过一个或多个步骤分解另一个反应物或与之作出反应,以再生原催化剂并形成最终的生成物。
均相催化的一个例子是涉及臭氧分解的化学过程,该过程发生在地球的上层大气中。 臭氧是一种相对不稳定的分子,分解成产率二原子氧。 这种分解反应与以下两步式机理一致:
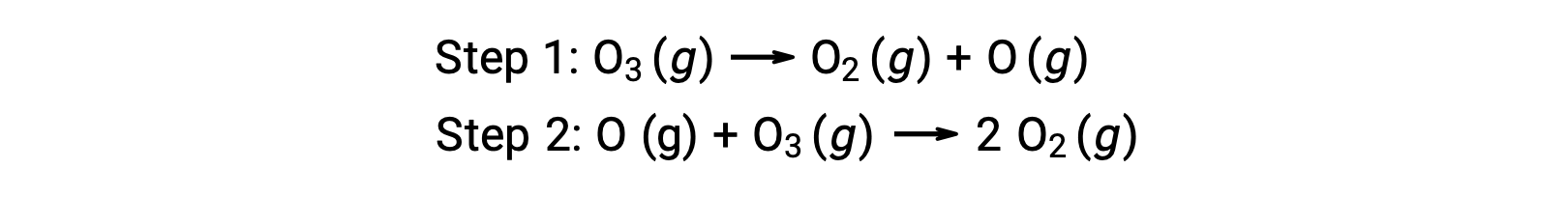
许多物质可以催化臭氧的分解。 例如,据认为,通过以下三步式机理,会发生一氧化氮催化的臭氧分解:
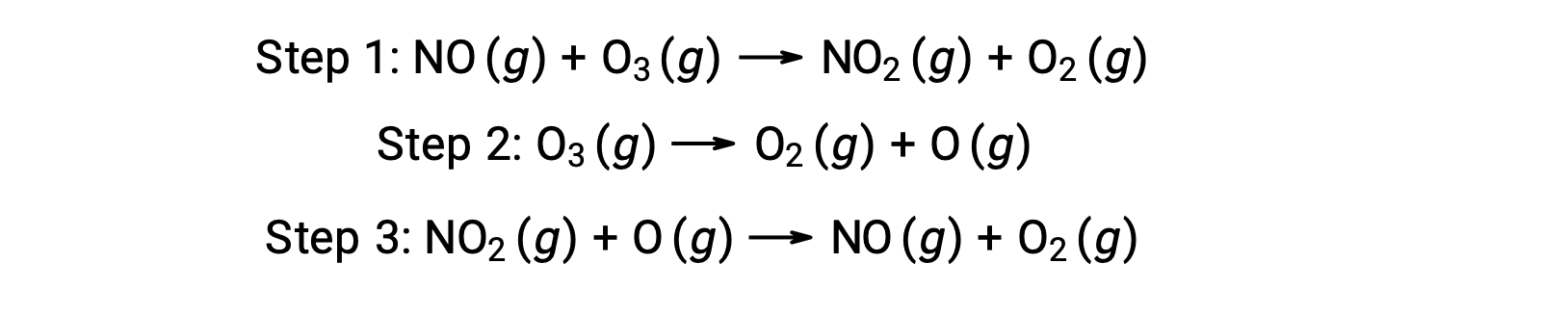
但是,两步未催化机理和三步无催化机理的整体反应相同:
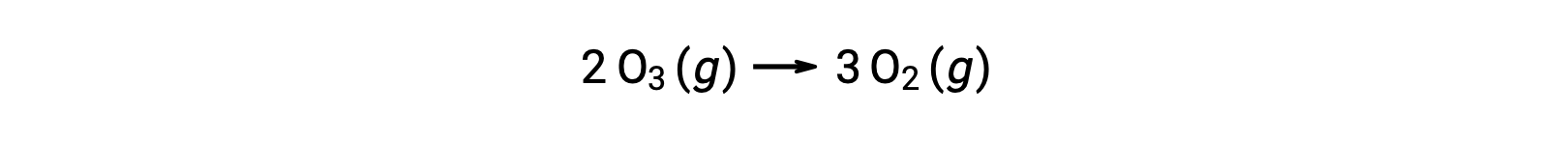
在催化反应中,请注意,在机理的第一步中没有反应物,在最后一步中是生成物。 这是催化剂的另一个特征:尽管它参与化学反应,但它不会被反应所消耗。 此外,在该均相催化中,反应物和催化剂都存在于气态阶段。
异构分析
在异构催化中,催化剂的存在阶段与反应物不同 (通常为固体)。 此类催化剂通常通过提供一个可发生反应的活性表面来发挥作用。 混合催化剂催化的气体和液体相反应发生在催化剂表面,而不是气体或液体相内。
异构催化通常涉及以下过程:
- 催化剂表面的反应剂吸附
- 激活吸附剂
- 吸附剂的反应
- 从催化剂表面对产品进行解吸
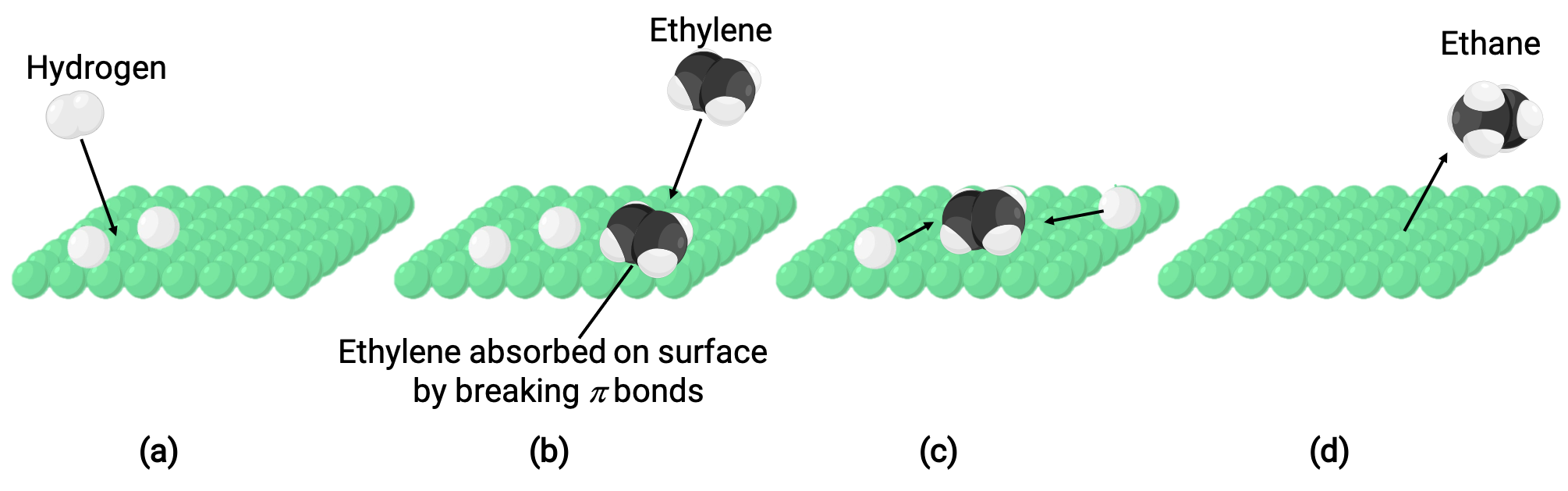
图中所示的图像代表了反应机理,它涉及在固体镍表面上形成乙烷气体 (C2H4 + H2 ⟶ C2H6) 的乙醇和氢气混合催化:
(a) 氢气吸附在镍表面上。 在此过程中,氢键是破损,形成镍氢键。
乙烯还通过分解碳 - 碳 Pi-键和形成镍 - 碳键在镍表面上吸附。
(c) 氢原子在撞击形成乙烷时会扩散到地表并形成新的碳氢键 (C2H6)。
(d) 镍表面的甲烷分子脱粒。
异构催化作用用于工业生产化学生成物,如氨,硝酸,硫酸和甲醇。 在大多数汽油驱动汽车上的催化转化器中也使用了混合型催化剂。
本文改编自 Openstax, 化学 2e, 第12.7节:催化。
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。