18.1 : 平衡氧化还原方程
电化学是电气和化学反应相互转换的科学。 这种反应称为还原氧化或氧化还原反应。 这些重要反应是通过一个或多个反应物元素的氧化状态变化来定义的,其中包括一组反应,涉及反应物物种之间的电子传输。 电化学作为一个领域已发展到产率对氧化还原化学的基本原理有了充分的了解,并采用了多种技术,从工业规模的冶金工艺到用于电动车的坚固的可充电电池。 由于涉及电子传输的反应对电化学研究至关重要,因此对氧化还原化学的简要回顾包括以下内容。
氧化数值
根据定义,氧化还原反应涉及一个或多个反应物的氧化数值或氧化状态的变化。 元素的氧化数量是对原子的电子环境与纯原子的电子环境的差异的评估。 根据这一定义,元素中的原子的氧化值为零。 对于原子,如果化合物是离子,氧化数值等于化合物中原子的电荷。 因此,分子中所有原子的氧化数值之和等于该分子的电荷。
离子化合物
简单离子化合物是这种形式主义的最简单例子,因为元素的氧化值等于其离子电荷。 氯化钠 NaCl 由 Na+ 阳离子和 CL− 阴离子组成,钠和氯的氧化数值分别为 +1 和 −1。 氟化钙 CaF2 由 Ca2+ 阳离子和 F− 阴离子组成,钙和氟的氧化数值为 +2 和 −1。
共价化合物
共价化合物在使用形式主义方面更具挑战性。 水是一种共价化合物,由两个通过极性共价 O−H 键将键合原子与 O 原子组成。 制造 O−H 键的共享电子更受电子原子的强烈吸引。 因此,与元素氧中的 O 原子相比,氧会获得部分负电荷。 因此,与氢气中的氢原子相比,水分子中的 H 原子具有部分正电荷。 每个水分子的部分负荷和正荷总和为零,使水分子处于中性状态。
如果水的 O−H 键中共享电子的极化已完成—结果将是电子从 H 完全传输到 O ,而水将是由 O2− 阴离子和 H+ 阳离子组成的离子化合物。 因此,水中氧气和氢的氧化物分别为 −2 和 +1。 对四氯化碳 (CCl4) 应用同样的逻辑后,二氧化碳的氧化数值为 +4 ,氯的氧化数值为 −1。 在硝酸盐− 中,氮的氧化值为 +5 ,氧气的氧化值为 −2 ,等于分子上的 −1 电荷:
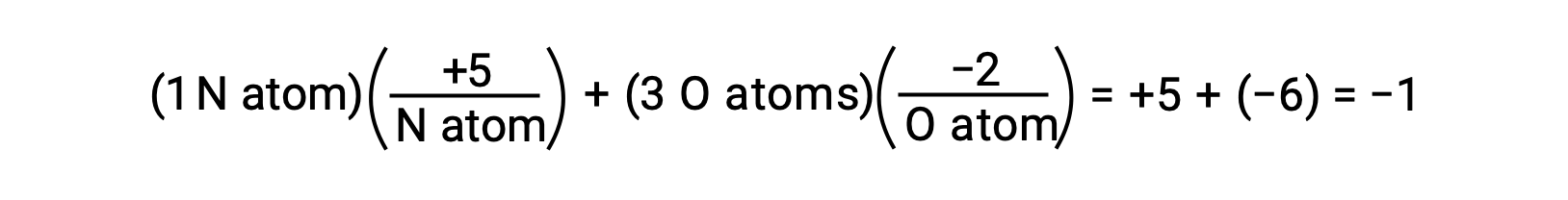
平衡氧化还原方程
下图所示的非平衡方程描述了氯化钠的分解:
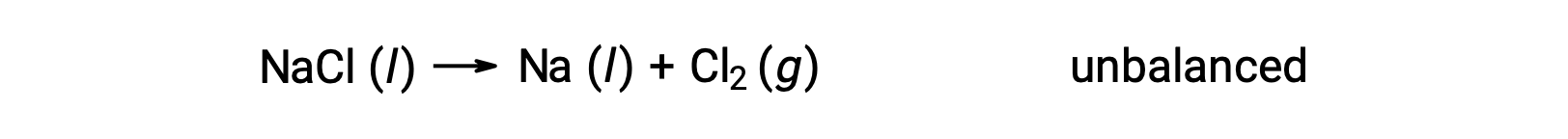
这种反应符合氧化还原反应的标准,因为 Na 的氧化数值从 +1 下降到 0 (通过进行还原) ,而 CL 的氧化数值从 −1 上升到 0 (通过氧化)。 通过为 NaCl 和 Na 添加 2 的化学化学式化学式 (方程) 壳体,可以轻松实现平衡:
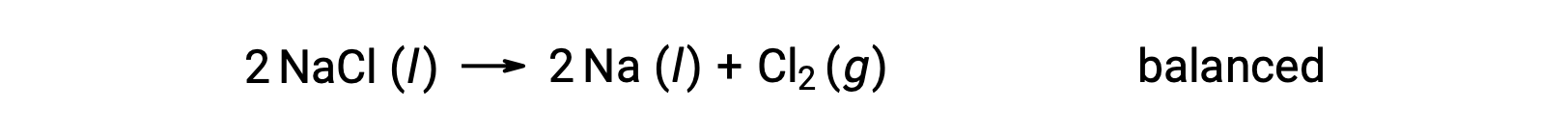
水溶液中发生的氧化还原反应通常发生在电化学中,许多反应涉及水或其离子 H+ (AQ) 和 OH− (AQ) ,可以是反应物或生成物。
在这种情况下,代表氧化还原反应的方程式很难仅仅通过检查来平衡,使用一种称为半反应方法的系统方法很有帮助。 这种方法包括以下步骤:
- 将方程分解为其成分骨架氧化并减少半反应。
- 平衡 O 和 H 以外的所有元素的每个半反应
- 根据需要在方程中添加水分子,平衡 O 原子的每半反应。
- 根据方程的要求添加质子,平衡 H 原子的每半反应。
- 最后,通过根据需要添加电子来平衡元素上的电荷。
- 将半反应乘以所需的任何整数,以使氧化半反应中丢失的电子数与半反应减少中获得的电子数相等。
- 通过消除方程两侧的常见物种,添加半反应并进一步简化。
- 如果反应发生在碱性介质中,请将 OH− 离子添加到步骤 7 中获得的方程中,以中和质子 (在方程两侧以相等数量添加) 并简化。
- 检查方程以确保原子上的电荷平衡。
本文改编自 Openstax, Chemistry 2e, Chapter 17: Introduction , and Openstax, 化学 2e, 第 17.2 节:氧化还原化学的回顾。
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
