需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
TIRF显微镜视网膜双极细胞的影像胞外分泌
摘要
在这个视频中,我们演示了如何标记和可视化单突触囊泡的胞吐贩卖和使用总内部反射荧光(TIRF)显微镜在金鱼视网膜双极细胞。
摘要
共有内部反射荧光(TIRF)显微镜是一种技术,使细胞膜发生的事件的研究是最接近高折射指数物质,如玻璃的荧光分子的选择性成像,
研究方案
第1部分:夹层和双极细胞的分离
- 准备在表2中列出的解决方案;铃声“(外部)解决方案的pH值应调整到7.4用NaOH和内部解决方案的pH值应调整至7.2与CsOH。光用铝箔保护内部的解决方案,并保持在4 °,直到使用C;
- 暗适应至少30分钟前清扫金鱼;
- 而动物黑暗的适应,准备5毫升的透明质酸酶(V型透明质酸酶1100单位/毫升在低Ca 2 +林格;西格玛,圣路易斯,密苏里州)和10毫升的L -半胱氨酸(0.5毫克/毫升在低Ca 2 +林格)的解决方案,并权衡木瓜蛋白酶(冻干粉,40个单位/毫升;消化溶液5毫升,圣路易斯,密苏里州) ;
- 安乐死手术剪刀快速断头金鱼,破坏大脑和脊髓#11手术刀刀片;
- 删除摧毁#7弯曲杜蒙钳的帮助下,眼外肌和虹膜剪刀切割视神经眼睛;
- 一块滤纸和穿刺#11手术刀刀片的一角巩膜角膜缘上放置一个灯泡眼;
- 介绍了一双内刺破整体vannas剪刀的刀片和削减整个眼前段路程;
- 其余的视杯上放置一个小块滤纸,并施加一定的压力,以纸浸泡玻璃体;
- 电梯与视网膜连接到它的滤纸和削减vannas剪刀一样的视神经;
- 将滤纸含有35毫米的塑料培养皿用透明质酸酶溶液和关闭#7杜蒙镊子帮助滤纸的视网膜剥离的视网膜;
- 视网膜一半的工业碳素钢单刃刀片切成4-6块,让它坐在在20分钟的透明质酸解决方案;
- 虽然等待透明质酸生效,添加5毫升的L -半胱氨酸的解决方案,以木瓜,让坐下,直到液体变成透明(约5-10分钟);
- 在较低的Ca 2 +林格洗净视网膜3X件,并让他们坐30-35分钟,在木瓜蛋白酶的解决方案;
- 洗净低的Ca 2 +林格视网膜3X件和存储,直到4 ° 35毫米的塑料培养含有低Ca 2盘的C +林格;
- 游离的细胞,把一块视网膜中含有微量低的Ca 2 +林格氏液500毫升管,并慢慢地磨碎用玻璃离解吸管吹打向上和向下的视网膜上,仔细不产生任何气泡。本生灯加热的玻璃巴斯德吸管尖,稍微弯曲解剖钳的帮助下解离吸液管制造;
- 板分离出的细胞,加入了视网膜悬挂下降一个自制的录音室,以前用2 毫升低 Ca 2 +林格充满。分庭由在中间的圆形整个一个35毫米的塑料培养皿和1.78折射率玻璃底部粘用硅橡胶(Sylgard 184(德国PlanOptik,)的圆形盖玻片的下半部分;道康宁米德兰,MI)。
第2部分:双极细胞装载和洗出
TIRF成像的突触小泡是最好的开展具有非常高的NA目标和敏感的相机使用客观型TIRFM显微镜。对于我们的实验中,我们选择使用一个1.65 NA目标(APO X100 Ø人力资源,不适用1.65,奥林巴斯,日本)与EMCCD(级联512B,罗珀科学,图森,AZ)。使用非常高NA的目标,就必须使用高折射玻璃盖玻片和浸入液(含硫量DI -甲基碘)。在我们的条件,激发光指数衰减的领域是有限的,长度约50 nm的不断。
- 添加高折射率液体(M系列,折射率= 1.7800,Cargille实验室,雪松树丛,新泽西州)的下降显微镜物镜;
- 仔细将录音室,显微镜物镜上,精心安装接地电极和灌流出口管道,以室;
- 让室坐10-20分钟,显微镜,让细胞下沉和坚持的底部;
- 在此期间,准备为1mm Trolox的® ((±)- 6 -羟基- 2 ,5,7,8 - tetramethylchromane - 2 -羧基酸5毫升; Sigma公司,圣路易斯,密苏里州)的解决方案在高K +林格。超声,直至溶解;
- 准备15毫升ADVASEP - 7洗涤液:1毫米ADVASEP - 7(Sigma公司,圣路易斯,密苏里州)在低Ca 2 +林格。请注意,ADVASEP - 7的使用是可选的,如果需要的话,可以省略;
- 清除的灌流李NES,并添加ADVASEP - 7洗涤液,低Ca 2 +林格和控制振铃的灌流系统;
- 拉加载薄壁硼硅玻璃(佳- FIL ® TW150 - 3; WPI的,萨拉索塔,佛罗里达州)移液器。河豚吸管电阻均在1.5-2.5MΩ范围;
- 准备FM1 - 43 ®(N -(3 triethylammoniumpropyl)-4 - (4 - (dibutylamino)苯乙烯)吡啶溴化物,“特殊包装”; Invitrogen公司,卡尔斯巴德,加利福尼亚州)的解决方案。首先,加入160μL蒸馏水,一小瓶FM1 - 43(100毫克)® 1毫米的股票。长达一个星期,这股可保持在4 ° C。然后,添加5μLFM1 - 43 ® 1毫升高K +林格+ 1MM Trolox的®。用铝箔保护解决方案,并保持在4 °,直到使用C;
- 打开明亮的场光显微镜和搜索完好双极细胞。稍微挖掘显微镜,以确保该神经元牢固地附着在箱体底部;
- 灌流笔感兴趣的细胞接近的位置,不断灌注与低Ca 2 +林格准备;
- 关闭室内灯光,并添加一个红色的长通滤波器(即RG630;肖特,德国)的光路,以最大限度地减少了FM染料激发;
- 填写FM染料溶液10μL装载吸管,安装在显微吸管和吸管上的准备没有超压降低,直到它是你要加载的双极细胞在同一焦平面。确保你至少有两个电极持有:一个用于调频染料不能用于膜片钳,否则它可能污染的细胞内的解决方案;
- 在约10微米的轴突终端的距离,位置河豚开放,转动灌流系统和粉扑吸管超压10秒染料溶液;
- 关闭超压,无需移动吸管,等待30秒;
- 转动灌流和沐浴室ADVASEP - 7的溶液中5分钟。在此期间,从浴缸中删除河豚吸管;
- 5分钟后,切换到低Ca 2 +林格和灌注室25-30分钟,以便清除多余的染料。
第3部分:膜片钳和TIRFM成像
- 虽然准备洗出,拉补丁的吸液管,厚壁硼硅玻璃(B150 - 86 - 10;萨特仪器公司,诺瓦托,CA)。补丁吸管电阻8-10MΩ范围;
- 洗出后,放置在视野的中心轴突的终端;
- 填充内部解决方案7μL的一个补丁吸管,挖掘移液器除去气泡,大衣与熔融的牙科用蜡(粘粘的蜡;克尔公司,橙,CA)的吸管,并安装在显微;
- 打开移液器的超压和吸管慢慢降低到准备。检查吸液管电阻在放大器和正确的吸管偏移,并与各自的放大器控制电容;
- 切换灌流控制振铃的。为了创建一个吸管和细胞之间gigaseal,稍微触摸电极对细胞体内的一角,打开吸管超压,一边轻轻地运用负压电极;
- 虽然密封,在放大器的选择“全细胞”模式,并设置单元格的控股潜力-60毫伏;
- 选择一个感兴趣的区域,涵盖整个轴突终端与成像软件,打开明亮的领域轻客,并简要地暴露(30毫秒)终端488 nm激光,找到合适的TIRF成像焦平面;
- 打破使用“ZAP”放大器的命令,而采用微负压吸管进入细胞;
- 纠正细胞电容和串联电阻,然后应用的利益的电压协议,同时成像的突触小泡的运动。正是在这个阶段,重要的是要有电压协议同步摄像头的帧速率。在我们的例子中,每帧30毫秒长,所以电压的变化发生在该值的倍数(即每300毫秒或10帧);
- 试验之间至少等待40秒,以便恢复;
- 要检查突触丝带的位置,拍照,同时转动561 nm的激光。
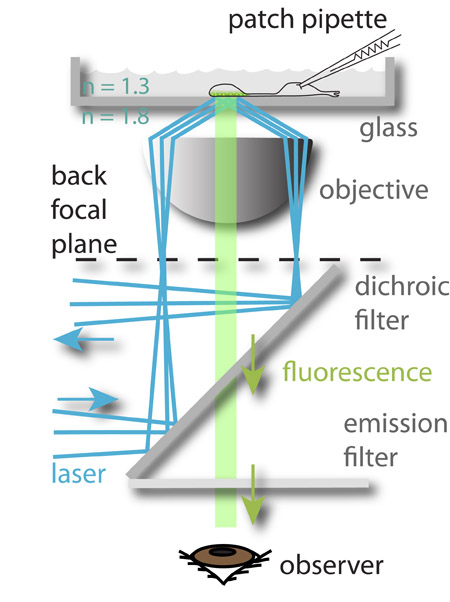
图1:实验装置。 488 nm激光(蓝色)的重点是向外围的客观焦平面和遭受内部全反射,当它到达的玻璃水介质界面。反射的激光束所产生的电磁场激发加载到最接近的博特的突触小泡的荧光OM的玻璃容器中,然后发出荧光(绿色)。荧光灯,然后引导到观察者的眼睛(描绘)或CCD相机。成像细胞的膜电位控制,同时通过补丁夹紧。这种方法允许传入的信号(膜电压)和神经元的输出(胞吐)之间的关系的研究。

图2:典型的结果。左:明场像一个孤立的金鱼双极细胞。右上:TIRF双极细胞的轴突终端突触囊泡形象加载带有FM 1-43 ®和488 nm激光(调频染料)成像。右下:修补细胞和轴突终端与561 nm激光成像后的同一个终端的形象。突触带标记的罗丹明基于肉眼结合肽(Rpep_rhod)。
表1:特定的试剂和仪器。
名称 | 类型 | 制造商 | 目录 | 评论 |
| - | 空气球台 | Newport公司 | - | - |
| IX70 | 倒置显微镜 | 奥林巴斯 | - | 配有一个钨灯亮场和横向开放港口为TIRF |
| TH4 - 100 | 灯泡电源 | 奥林巴斯 | - | - |
| FF498_581 - DI01 | 分色过滤器 | Semrock | - | - |
| NF01 - 405_488_568 | 发射滤光片 | Semrock | - | - |
| 阿婆X100 Ø人力资源 | 目的 | 奥林巴斯 | - | 不适用1.65 |
| RG630 | 红色玻璃过滤器 | 肖特 | - | - |
| - | 488 nm激光 | 连贯 | - | 使用最小的功耗 |
| - | 快门 | Uniblitz | - | - |
| VMM - D1 | 快门驱动 | Uniblitz | - | - |
| - | 561 nm激光 | 梅勒斯Griot | - | - |
| - | 快门 | Uniblitz | - | - |
| VMM - D3 | 快门驱动 | Uniblitz | - | - |
| 灌注压力套件 | 灌流系统 | 自动化科学 | 09-04 | - |
| 灌注笔 | 灌流系统 | 自动化科学 | - | - |
| Valvelink 8 | 灌流系统控制器 | 自动化科学 | - | - |
| 级联512B | EM CCD相机 | 罗珀科学 | - | - |
| Metamorph 7.1 | 图像处理软件 | 分子器件 | - | - |
| EPC - 9 | 膜片钳放大器 | HEKA Elektronik公司 | - | - |
| 脉冲 | 放大器软件 | HEKA Elektronik公司 | - | - |
| MP - 285 | 微操作机器人 | 萨特仪器 | - | - |
| - | 电极支架 | HEKA Elektronik公司 | - | 外径为1.5毫米玻璃,2个单位 |
| 佳- FIL ® TW150 - 3 | 高硼硅毛细管玻璃 | WPI | - | 没有灯丝 |
| B150 - 86 - 10 | 高硼硅毛细管玻璃 | 萨特仪器 | - | 随着长丝 |
| P - 97 | 微电极拖轮 | 萨特仪器 | - | 配备的3x3方块长丝和环境试验箱 |
| - | 压力真空气泵 | 托马斯科学 | 7893B05 | 创建真空去除液体的移液器商会和超压 |
| MatLab的R2008a | 分析软件 | MathWorks公司 | - | - |
| 353001 | 35 mm塑料培养皿 | 鹘 | - | - |
| - | 高折射率玻璃 | PlanOptik | - | 折射率为488 nm = 1.78 |
| M系列 | 高折射率液体 | Cargille实验室 | - | 折射率= 1.78 |
| Sylgard 184 | 硅弹性体套件 | 道康宁 | - | - |
| 谷胱甘肽 | 三肽 | 电解二氧化锰化学品 | 免费雷克升清道夫 | |
| 透明质酸 | 酶 | 西格玛 | H6254 | V型 |
| L -半胱氨酸 | 氨基酸 | Fluka公司 | 30090 | 激活木瓜 |
| 木瓜蛋白酶 | 酶 | Fluka公司 | 76220 | 从番木瓜 |
| Trolox的® | 可溶性维生素E | 西格玛 | 56510 | 自由基清除剂 |
| ADVASEP - 7 | 磺化 β-环糊精衍生物 | 西格玛 | A3723 | 减少调频1-43 ®背景荧光 |
| FM 1-43 ® | 荧光染料 | Invitrogen公司 | T35356 | “特别包装” |
| 粘粘的蜡 | 移液器涂料代理 | 科尔公司 | - | 减少移液器电容 |
表2:本研究采用的生理的解决方案。
物质 | 低Ca 2 +林格 | 控制林格 | 高K +林格 | 内部解决方案 |
| 氯化钠 | 120毫米 | 120毫米 | 97.5 mM的 | - |
| 氯化钾 | 2.5毫米 | 2.5毫米 | 25毫米 | - |
| MgCl 2的 | 1毫米 | 1毫米 | 1毫米 | 4毫米 |
| 氯化钙 | 0.5毫米 | 2.5毫米 | 2.5毫米 | - |
| HEPES | 10毫米 | 10毫米 | 10毫米 | 10毫米 |
| EGTA | 0.75毫米 | - | - | 0.5毫米 |
| 血糖 | 10毫米 | 10毫米 | - | - |
| 谷胱甘肽 | 2毫米 | 2毫米 | - | 1毫米 |
| CH 3 CSO 3 S * | - | - | - | 100毫米 |
| TEACl | - | - | - | 10毫米 |
| ATP镁 | - | - | - | 10毫米 |
| GTP李 | - | - | - | 1毫米 |
| RPEP - rhod ** | - | - | - | 5毫米 |
| 卷 | 200毫升 | 100毫升 | 5微升 | 100μL, |
*铯磺酸。
**肉眼结合肽:罗丹明+ EQTVPVDLSVARDR - COOH(兆瓦1997.75)。
讨论
客观型TIRF显微镜的优点是:1)激发光在焦平面的客观限制在一个狭小的区域提供优良的光学切片,从而最大限度地减少了集中光线; 2)由于光线与距离成指数下降荧光强度的变化,可以在垂直方向的运动进行监测; 3)通过高数值孔径的目标1,5的高效率的光收集。
该技术的主要缺点是,它是有限的成像事件发生在100纳米的细胞表面,这是大致相当于一个在电子显微镜超薄切片。因此,坚持以玻璃的?...
致谢
这项工作是由美国国立卫生研究院批准安永14990支持。
参考文献
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。