需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
渗透避免IN线虫:突触功能的两个基因,人类同源 NRXN1 NLGN1,作为候选人自闭症
摘要
Neurexins和neuroligins执行突触分化和传输中的重要作用的神经元膜的粘附蛋白。缺乏突变体的neuroligin C。线虫检测渗透强度的缺陷,但它们也包含在编码neurexin基因的突变时,他们恢复野生型表型。
摘要
Neurexins和neuroligins目前在兴奋和抑制性突触细胞粘附分子,他们需要正确的神经网络功能 1 。这些蛋白在突触前和突触后膜2。在小鼠的研究表明,neurexins和neurologins在突触传递 1中的重要作用。最近的报告表明,改变神经元连接在人体神经系统的的发展可能构成的自闭症谱系障碍的许多案件3的病因的基础上。
线虫可以用来作为实验工具,方便的突触组成部分的运作的研究,因为它简单实验室试验,并得到了充分的特点,其神经系统和突触接线。 在 C 线虫NRX - 1和NLG - 1基因是同源NRXN1和NLGN1人类基因编码α- neurexin - 1和的neuroligin - 1蛋白,分别的。在人类与线虫,组织neurexins和neuroligins是类似的功能域。
线虫的头部包含amphid,线虫,介导的反应不同的刺激,包括渗透强度的感觉器官。 amphid 12纤毛树突和突触前终端轴突4感官双极神经元。这些神经元命名ASHR和ASHL,两个特别重要的渗透的感觉功能,检测与高渗透压实力 5水溶性的驱虫剂。这两种神经元的树突延长到嘴的尖端和轴突延伸到神经环,在那里他们作出决定的行为反应 6的其他神经元突触连接。
为了评估在高渗透压的力量避免neurexin和的neuroligin的影响,我们展示了不同的反应NRX - 1和NLG - 1基因缺陷的线虫突变体,使用一个4M的果糖环7一种方法。行为表型被证实使用特定的RNAi 克隆 8 。 在 C 线虫 ,触发的RNAi的dsRNA可管理喂养9。通过食物传递的dsRNA诱导的利益,从而使遗传组件和网络途径的识别基因的RNAi干扰。
研究方案
1:渗透避免检测。
- 检测前约16-24小时,挑到一个新的NGM板含有OP50 大肠杆菌 L4各基因型的幼虫阶段动物大肠杆菌 andincubate在20 ° C第二天,开始实验青壮年。
- 建议开展“盲目”的检测。每个被检测的应变板应relabelled第二个实验者,使用的实验已经完成时,将东窗事发relabelled板进行检测。
- 检测的一天,准备与4M原液的果糖,1%的刚果红溶液在室温下完全溶解。我们建议检查的解决方案之前,每个检测以来,染料可能随着时间的沉淀。
- NGM板的环形圈(直径为1厘米的)概述了固体培养基的中心,红色4M果糖溶液与15μL。让果糖溶液浸泡成的琼脂,这通常需要2至5分钟。
- 广场内的每个环的应变个人年轻的成年动物,并在随后的10分钟,以确定渗透屏障的响应。避免了环比在连续的6倍多的动物被列为正常;尝试在不到半年的退出环被认为是在渗透压的敏感性缺陷。
注意 :必须在每个检测控制应变。 N2年轻的成年动物作为阳性对照,因为他们果断地避免环屏障。已饿死,通过的dauer幼虫或过于干燥的板未来的动物,不应该使用。在开始的时候,控制动物应重复进行评估,以确认检测板和解决方案是正确的。
2:产生击倒蠕虫通过RNAi喂养。
- RNAi的板块:NGM的RNA干扰喂养板每公升含有17克琼脂,2.5克蛋白胨,1毫升5毫克毫升-1胆固醇3.0 g氯化钠;填补烧瓶与H 2 O和高压灭菌器,以1公升。后琼脂冷却到约65℃,加入25毫升1个M KPO 4,pH值6.0,1毫升的1 M 氯化钙 ,1毫升1M硫酸镁4,0,5毫升羧(50毫克毫升-1)和1毫升1M IPTG的。如果您正在准备扎实NGM开始,由微波熔化固体培养基,随后放置在板凳上冷却,然后添加如前所述,羧KPO 4,pH值6.0, 氯化钙 , 硫酸镁和IPTG液体NGM。
每60毫米的培养皿中加入10毫升NGM。允许冷却,并保持在室温下过夜,使用前翻转板。板可以储存在4 ° C,约4-5天,在一个塑料袋。 - 细菌的制备及诱导: 大肠杆菌 HT115(DE3)菌株分离的殖民地,L4440包含一个相应的靶基因片段的载体转化到卢里亚Bertani(LB)琼脂平板(17克琼脂,蛋白胨10克,5克,酵母提取物,每公升10克氯化钠)含有氨苄青霉素(50微克/毫升)和四环素(15微克/毫升)。
选择一个细菌菌落和50μg/ mL氨苄青霉素的LB接种,并成长为6 8 H晃动在37 ° C,种子上的准备NGM板这种文化的下降,并彻底晾干后方可被孵化过夜板( 12月24日H)在室温下,让细菌的生长,并开始上岗。在黑暗中孵化,因为四环素对光敏感,可能会影响板之间的RNAi实验的可变性。
它是需要使用一个积极的和一个用于RNAi喂养实验阴性对照。阳性对照是大肠杆菌 HT115细胞转化与L4440包含UNC - 22的基因序列的载体。 UNC - 22基因敲除产生“抽搐表型”。阴性对照与L4440空载体转化的大肠杆菌HT115细胞。 - L4从接种到NGM板OP50无细菌,并培育与20 NGM板阶段蠕虫蠕虫的处理和计分:第一天,地点° 12小时C(空腹)。
第二天,转移到与特定目标基因的RNAi表达的细菌seedded板年轻的禁食成人雌雄同体。保留40-48小时,在20 ° C至产生F1子代。
到与相同的细菌接种另一盘,然后把几个F1成虫。 24-48小时后,选择和隔离从F2代,年轻的成年人(完全形成突起外阴几个鸡蛋)和表型的得分。
注 :在神经细胞的RNAi诱导有一定的局限性,因为在C线虫的神经系统难治性属性的 RNAi。为了克服这种低效率的问题,在神经元,它是推荐使用的RRF - 3 株神经元10,过敏背景的RNAi的影响。在我们的实验没有differencES之间的布里斯托尔N2和RRF - 3株被发现的基因和表型分析。
3:使用菌株。
c. 在在这项工作中使用的线虫株见表1。突变株,越过对N2的野生 -至少四次,以去除不受欢迎的可能已在诱变协议产生的随机突变类型。
OP50 发送菌株 suppliied 线虫遗传中心,美国明尼苏达大学,HT115(DE3) 大肠杆菌质粒携带NRX - 1 pL4440(JA:C29A12.5)和NLG - 1(JA:C40C9.5彼得Askjaer博士,炫酷Andaluz Biología DEL Desarrollo(公共天线),中船重工大学巴勃罗Olavide,塞维利亚,西班牙)的基因片段。
4:代表结果。
说明性的结果表示在图1和2。十大动物,每一株和最低的三个副本实验进行。
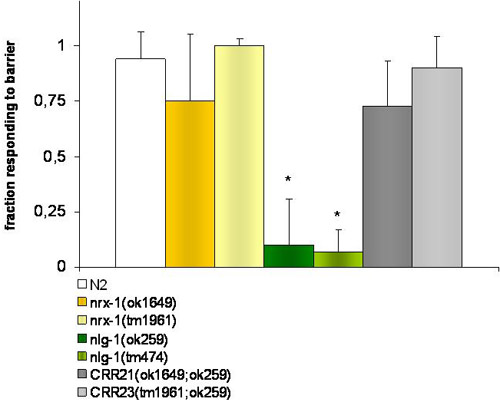
图1。实验渗透避税行为。
对照菌株和NRX - 1(ok1649和tm1961)V缺乏mutantworms回应向后倒车时,他们遇到一个渗透屏障(4M果糖)。NLG - 1(ok259和tm474)X突变体无法检测到这一障碍。在缺乏NLG - 1和NRX - 1菌株CRR21(ok259 ok1649)VX和CRR23(tm1961; ok259);双突变体VX恢复野生型表型。 *表示由T -学生测试的显着性差异(P≤0.001),在每个应变的响应布里斯托尔N2的野生型,T -学生的考试
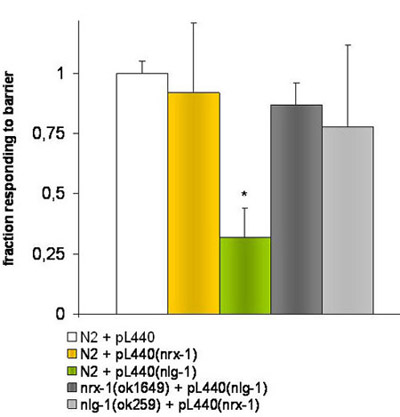
图2。实验通过RNAi喂养击倒蠕虫。
HT115(DE3) 大肠杆菌转化空pL4440载体或含有相应的目标NRX - 1或NLG - 1被用来喂不同的蠕虫病毒株的基因片段。 *表示T -学生的考试空pL4440载体美联储的N2应变比较pL4440载体携带一个目标NLG - 1基因片段的细菌美联储的N2应变响应的显着性差异(P≤0.001 ), 。
讨论
Neurexins和neuroligins执行突触传递的11和12个突触连接的分化中的重要作用。两种分子已被确定为自闭症13,14的候选基因。
在这个视频中,我们展示一个简单的方法,它可以让我们研究的影响渗透在C回避反应的基因的作用线虫 。的neuroligin缺陷的突变体缺陷检测渗透强度,但缺乏突变体在neurexin显示野生型菌株类似的响应,避免一个4M的果糖?...
致谢
我们想感谢他的宝贵帮助医生安东尼米兰达Vizuete。我们也想表达我们的宝贵的技术援助表示感谢萨尔玛Boulayoune和伊莎贝尔卡瓦列罗。这项工作是由军政府安达卢西亚(BIO - 272)的赠款资助。目前在欧洲的遗传实验的法律协议,这项研究已经进行了。
材料
表1。C.线虫株。
| Name | Company | Catalog Number | Comments |
| 应变 | 基因 | 等位基因 | 来源 |
| 布里斯托尔氮气 | - | - | ACGC |
| VC228 | NLG - 1 | ok259 | 政府总部大楼 |
| FX00474 | NLG - 1 | tm474 | bNBP - JAPAN |
| VC1416 | NRX - 1 | ok1649 | 政府总部大楼 |
| FX1961 | NRX - 1 | tm1961 | NBP - JAPAN |
| NL2099 | RRF - 3 | pk1436 | 政府总部大楼 |
| CRR21 | NRX - 1 NLG - 1; | ok1649; ok259 | 这项工作 |
| CRR22 | NRX - 1 NLG - 1; | tm1961; ok259 | 这项工作 |
A. 线虫遗传中心,美国明尼苏达大学。
B.国家实验动物“的线虫C. elegans的 ”生物资源项目。 日本东京女子医科大学。
参考文献
- Sudhof, T. C. . Nature. 455 (7215), 903-903 (2008).
- Fabrichny, I. P., Leone, P., Sulzenbacher, G. . Neuron. 56 (6), 979-979 (2007).
- Garber, K. . Science. 317 (5835), 190-190 (2007).
- Wang, K., Zhang, H., Ma, D. . Nature. 459 (7246), 528-528 (2009).
- Ward, S., Thomson, N., White, J. G. . The Journal of comparative neurology. 160 (3), 313-313 (1975).
- Bargmann, C. I., Thomas, J. H., Horvitz, H. R. Cold Spring Harbor symposia on quantitative biology. 55, 529-529 (1990).
- White, J. G., Southgate, E., Thomsom, J. N., Brenner, S. . Philos. Trans. R. Soc. Lond. B Biol. Sci. 314, 1-1 (1986).
- Culotti, J. G., Russell, R. L. . Genetics. 90 (2), 243-243 (1978).
- Fire, A., Xu, S., Montgomery, M. K. . Nature. 391 (6669), 806-806 (1998).
- Timmons, L., Fire, A. . Nature. 395 (6705), 854-854 (1998).
- Simmer, F., Tijsterman, M., Parrish, S., Koushika, S. P., Nonet, M. L., Fire, A., Ahringer, J., Plasterk, R. H. . Curr Biol. 12, 1317-1317 (2002).
- Missler, M., Zhang, W., Rohlmann, A. . Nature. 423 (6943), 939-939 (2003).
- Varoqueaux, F., Aramuni, G., Rawson, R. L. . Neuron. 51 (6), 741-741 (2006).
- Graf, E. R., Zhang, X., Jin, S. X., Scheiffele, P., Fan, J., Choih, J. . Cell. 119 (7), 1013-1013 (2004).
- Scheiffele, P., Fan, J., Choih, J. . Cell. 101 (6), 657-657 (2000).
- Jamain, S., Quach, H., Betancur, C. . Nature genetics. 34 (1), 27-27 (2003).
- Szatmari, P., Paterson, A. D., Zwaigenbaum , L. . Nature genetics. 39 (3), 319-319 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。