需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一个可逆的,非侵入性方法,气道阻力测量和支气管肺泡灌洗小鼠流体取样
摘要
重复测量的啮齿类动物的呼吸生理学和呼吸道炎症细胞取样是可取的,但一般并不可行。在这里,我们描述了一种可重复的方法,口头插管的小鼠气道高反应和呼吸道炎症细胞取样的反复测量,允许。
摘要
实验性哮喘模型气道高反应(AHR)的测量和支气管肺泡灌洗(BAL)流体取样是必不可少的,但重复的程序,以获取这样的测量,在相同的动物一般都是不可行的。在这里,我们展示了用于从小鼠中获得的AHR的反复测量和支气管肺泡灌洗液标本的协议。小鼠超过14天的挑战滴鼻,一个强有力的过敏原或治疗深水七倍。之前最初的挑战,并在24小时内,每个鼻内挑战,相同的动物麻醉后,经口头插管和机械通气。 AHR,通过增加乙酰胆碱(Ach)深水和过敏原的挑战动物之间的氯化的静脉注射引起的呼吸道系统阻力(RRS)的剂量反应曲线比较评估,进行了测定。之后,通过相同的插管,左肺灌洗,使气道细胞的差枚举可以执行。这些研究显示,反复测量,AHR的BAL液收集可能来自同一动物,在7-10天开始过敏原的挑战实现,最大的气道高反应性气道嗜酸性粒细胞增多。这种新颖的技术,大大减少了纵向实验所需的老鼠的数量,并适用于各种啮齿类动物,疾病模型气道生理仪器。
研究方案
过敏原的挑战:
- C57BL / 6小鼠,年龄4-8周,是在一个密闭的有机玻璃清除氧蒸汽混合物在3.2%异氟醚10分钟,以实现深全身麻醉室麻醉。
- 鼻腔过敏原的挑战(45μLOVA(22.5微克)和7μLA.水稻(7微克),在PBS)的管理,每星期二,星期四和星期日,共连续七年申请。
麻醉:
- 管理之前,每个过敏原的挑战,并按照第七挑战,小鼠腹腔注射48毫克/公斤的依托咪酯(2毫克/毫升)的,事先安置在轻不含插座。
- 主题仍然缺乏观察到的神经反应,直到压力后爪(5-10分钟)的应用程序时检测到插座。
插管:
- 一个辐射热灯,保持距离,以确保维护〜37 ° C程序体的核心温度,应重点课题的整个过程,以防止低温。至少在最初阶段应该用直肠温度计确认euthermia不管使用的热源。
实验动物所获得的所有的液体和文书的关键步骤应该是无菌的;程序应严格无菌条件下进行。长时间的低温,而在麻醉状态下会导致异常的数据和/或死亡的动物。使用之前试图在活的动物工作的动物尸体,应制定与所有侵入性的程序的能力。眼科润滑剂应采用全身麻醉下,以防止动物的角膜擦伤。 - 麻醉小鼠从容器和卧位(腹朝上),体积描记表,放置,调整到45度角。
- 橡皮筋包围表插入后面的门牙顶行,所以要确保主体到位。镊子的右手,握,延长,并解除从之前确保它与金属左手抑制剂的嘴舌,从而使一个畅通的气管插管。
- 连接到一个光源,直径0.8毫米的纤维线程,通过angiocatheter插入,并延长至超过10毫米的提示。由于降压药是用左手走稳,纤维线程照明指导,通过口腔和咽右手,直到声带的可视化。线程,然后通过移动的声带和进气管,直视下超时发生时,线是最大限度地开放。
- angiocatheter是通过在进气管的纤维线程,直到中旬部分气管内导管尖端所在。对于17-22克的老鼠,这相当于10毫米的导管段其余之间的连接器和主体小号下颌颅极端可见。是通过导管的实际数额应确定直接检查气管插管有关的大小和遗传背景的小鼠2-3。
- 纤维的线程将被删除,插管成功证实,通过观察经常深呼吸(胸部和腹部有节奏的游览)立即终止连接器,用拇指以下闭塞。窒息的响应,不论拇指闭塞,不规则呼吸,或呼吸困难等症状angiocatheter malpositioning和平时表示食管插管
关键的一步未能迅速扭转食管插管可致死。如果怀疑有食管插管,导管应迅速取出并重新插入一次动物已经恢复了正常的呼吸模式。依托咪酯是,所有可用的啮齿类动物麻醉剂麻醉的选择,这剂引起的心血管毒性(低血压,心律失常,心脏骤停)。 - 较低的体积描记表,直到在工作台上,并面临着空气呼吸器端口开启,直到受180 °的平行。打开连接呼吸机之前,在其一侧的动物。
- 胸腹游览时,安全的气密连接和激活的呼吸(在150次/分钟,9毫升/克潮气量,100%的氧气运作)后,被认为是与呼吸机的步伐,进一步证实了一个成功的插管。
静脉行:
- 27ga针10毫米,是由熔化的自由,和弯曲的中点,用无菌镊子和止血钳针90 °的方式去除,使成角的斜面面临的注射器连接器。 PE10管材,导致静脉注射端口连接到非斜面结束。
- 为了防止潜在的致命的空气栓塞,油管和针清除37 ° C,0.9%氯化钠1 ml注射器通过。注射口由一个27ga针,通过推,到第一个15ml离心管中钻出一个洞。上限是充满了盐水针不断被淹没,从而降低空气夹带针和静脉注射的可能性。
- 其余鼠标下的热灯,对准尾部平行的尾部极端外侧静脉针。针是运行稍下方的皮肤,而颅沿静脉的长度和推皮下弯曲。确认成功的第四的位置是通过观察血液回流到四管轻微拉动注射器的柱塞。此外,应不受阻碍地通过四线50-100μL生理盐水到尾静脉注射后的流量。偶尔的尾静脉不能稳定空心。在这些情况下,鼠标可以旋转180度四,通常毫无困难地访问到另一边和其他的尾巴。
- 取出后安装加热灯,主题是封闭的体积描记,此后4个夹子的应用与气密性担保。
关键的一步 ,使加热灯留在将热空气体积描记室,并可能改变后续测量的 R RS四针和解决方案的无菌,必须保持。完成IV插入之前,用无菌生理盐水溶液冲洗和冲洗70%乙醇浸泡和冲洗针头消毒。此外,尾部用70%乙醇或异丙醇IV插入前应清洗。
气道阻力测量:
- 山顶阻力是由连续定量的商DPT / V(DPT是在气管压力的变化和V空气流动)在平等的肺容积点(70%潮气量)。 DPT是由压力传感器连接到气管angiocatheter。为了确定V,体积描记压力变化的校准研究的生理范围,在量的变化。体积描记量随着时间的推移,由前置放大器模块计算,差,五是建立一个稳定的基线后ř RS(超过3分钟的变化<5%),连续五个剂量增加(体积= 2μL/ g体重)氯化乙酰胆碱(0.058,0.18,0.59,1.58和5.8毫克/公斤体重,在pH 7.4的0.9%生理盐水,冰和手,温暖每次注射前维护)的浓度在1秒内通过静脉注射,每个后续剂量的R RS回到基线后,直到基线电阻的三倍(约12厘米H 2 O X毫升-1 X秒,即200%以上,在气道阻力增加约4厘米的典型基线, H 2 O X毫升-1 X秒)的实现。 ACh的挑衅浓度,毫克/克的体重,导致在R RS从基线值(被称为电脑 200)增加200%,计算数学插值的ACH - R RS剂量反应曲线。
- 一旦PC 200个值已达到,释放紧固件,并拆除体积描记。是一个最大的5个增加乙酰胆碱的剂量。上面给出的ACH浓度范围是适用于实现PC最天真的小鼠品系200个值。
当约4厘米高2 O X毫升-1 X秒的基准是30秒的电阻监测建立的关键一步,生理盐水60μL注入四确认,已取得适当的麻醉平面。完成麻醉,将有显着的变化没有阻力,增加电阻或四肢或尾巴的运动物理窘迫的标志,并表示需要额外的麻醉。 - 删除从尾部静脉第四,然后断开动物脱离呼吸机,维持专利的气道,保持气管插管到位。偶尔的动物不能立即恢复自主呼吸。在这些情况下,呼吸可以鼓励轻轻按摩胸部。
关键的一步自主呼吸,必须建立之前转移到恢复室,否则会发生死亡。 - 恢复自主呼吸后,老鼠被转移,气管插管到位,一腔清除100%O 2和保持在37℃用热灯。在15-20分钟内,小鼠呼吸强烈,都开始将他们的四肢,在这一点可以去除气管导管和动物小号afely转移到他们的定期笼。
关键的一步是很容易呼吸道受阻在无意识的鼠标由于乙酰胆碱诱导的过度流涎和窒息有关的死亡是在以下呼吸道的生理测量麻醉小鼠的主要原因。出于这个原因,气管插管必须留在原地,甚至不接受小鼠支气管肺泡灌洗,直到它们arousable的和不应该被删除,直到超salivaton已停止。
支气管肺泡灌洗:
- 收集支气管肺泡灌洗液是安全的,当老鼠恢复足够的咽反射(约20分钟后,安置在恢复室)。轻轻滑动angiocatheter抵港及离港的咽反射是评估;明显的咳嗽或挣扎表明,咽反射已恢复。
关键的一步允许过多长时间的恢复时间将大大减少从单个小鼠BAL返回的效率;因此,咽反射必须进行监测,每隔几分钟,以下建议的20分钟休息时间。如果老鼠是无法忍受灌洗过程,由于部分觉醒的,3.2%异氟醚蒸气麻醉都可以使用。 - 一个金属插管导丝(0.5MM外径)与一个连续弯的〜30 °,左叶肺,是插入到angiocatheter。先进的导丝和angiocatheter一起到左叶肺导管(枢纽排除),这样仅1mm的门牙以外延伸。
关键的一步故障隔离左肺将大大降低产量,同时加强了动物死亡的可能性。必须小心,以确保导丝的尖端不通过angiocatheter开放。推进与金属凸出尖端angiocathether可能导致气管裂伤,因气管破裂而死亡。 - 到位angiocatheter,导丝和300μL的PBS(pH值7.4,无菌)冲入左肺通过1 ml注射器。紧随之后,同时制定创建负压注射器的柱塞,angiocatheter是慢慢(3)删除,而强烈的按摩肺。一个100-200μLBAL回报预期。
- 立即返回灌洗小鼠37℃,100%O 2室,同时不断按摩胸部。在其左侧的地方小鼠,直到完全康复(约20分钟)。然后动物被放回笼子。
时序:
每鼠,整个过程应采取不再超过1个小时来完成:步骤3-4,5-10分钟;步骤5-21,10分钟;步骤22,20-30分钟;步骤23-24。 10分钟。随着越来越多的能力和惊人的科目在协议中,3小鼠/小时可以处理。
代表性的成果:
在小鼠气道高反应,确定PC的200个值的措施,是激活和招聘的结果T细胞和分泌细胞因子IL - 135 - 7的肺部。因此,气道高反应是呼吸道与过敏原的挑战的必然后果,而是取决于一个完整的T细胞免疫舱和T细胞反应所需的时间,反复过敏原暴露的设置发展。如图所示。 2A,气道高反应性,定义为PC 200个值,明显低于基准值,后5第六挑战后,没有进一步的显着增加的过敏原挑战开发。对于不完全了解的原因,气道反应性下降(PC 200值增加)后的第一个过敏原的挑战(图2a) 。类似的趋势是比较相同的小鼠(图2b)ACH的剂量反应曲线明显。然而,很明显,在这里,充分的气道高反应突然后发展的第五个过敏原挑战,这样的小鼠成为超过30倍之间的第四和第六的挑战更加敏感,以乙酰胆碱。总之,这些研究结果表明,AHR的最可靠的测量六个过敏原的挑战(12天)后获得的,在较早的时间点的测量可能会产生高度可变数据。多次与车辆滴鼻(生理盐水)小鼠气道高反应不发展,并在所有给予剂量的乙酰胆碱,R RS测量不从基线值显着变化(图3和数据未显示) 。
强大的AHR的出现之前,由过敏原引起呼吸道的主要细胞类型是中性粒细胞(图4)。 AHR的趋势相似,然而,嗜酸性粒细胞逐渐加强了与反复过敏原的挑战和嗜酸性粒细胞在BAL液自动对焦成为在数量上占主导地位的细胞类型进入第六个挑战,在neutrophis数字显着下降(图4)重合。巨噬细胞的最初增加的数量与前几个过敏原的挑战,并在此后忽高忽低丰度。淋巴细胞丰没有不管的过敏原的挑战数量显着变化,矛盾的是他们的首要模型,通常是在BAL液中至少有无数的细胞。
在接受既不过敏原的挑战也不BAL取样小鼠的气道阻力测量没有差异超过17天的实验。 BAL流体取样反复呼吸道生理测量或过敏原挑战的情况下还进行,并呈现出只有一个增强中性粒细胞和巨噬细胞招聘呼吸道没有坚持超过5天(数据未显示)。这些研究结果表明,突出的中性粒细胞在过敏原的挑战小鼠观察是主要的程序,而不是抗原的结果。
控制,PBS挑战小鼠,气道阻力的测量也没有很大差异随着时间的推移。增强巨噬细胞和中性粒细胞,但不包括嗜酸性粒细胞,招聘BAL液中也看到了在这些小鼠,在接受只BAL液反复采样(图4 B,D)的小鼠中观察到的变化类似。总之,这些数据强调了过敏原的重要性,而不是呼吸道不同的操作,诱导过敏(嗜酸性粒细胞)的气道炎症和AHR。
类似的结果可以预料,使用类似的,我们这里使用的蛋白酶的鼻腔过敏原。然而,许多研究者利用卵清蛋白诱发过敏性肺部疾病。皮内或腹腔内吸与卵清蛋白(1-2周)后的适当时期在铝盐,一个强大的哮喘表型,包括气道高反应沉淀,可以预期后24小时内一个单一的可溶性卵清蛋白鼻腔挑战。
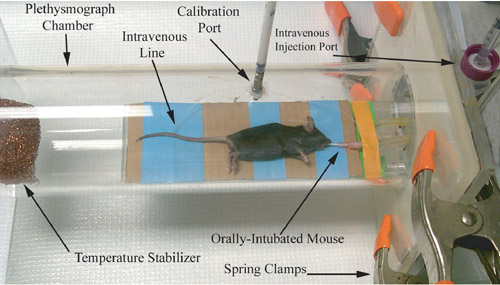
图1。啮齿类动物的体积描记,摄影代表紧接呼吸道生理测量记录。

图2气道阻力的测量。 A)对于统计的目的,反对数电脑200值。请注意大量增加的反对数PC 200后的第一个挑战和随后的减少,经过进一步的挑战。二)呼吸系统阻力(Rrs):注意:第六和第七的挑战后的ACH - RRS的剂量 - 反应曲线的陡度。误差棒代表教统局局长。
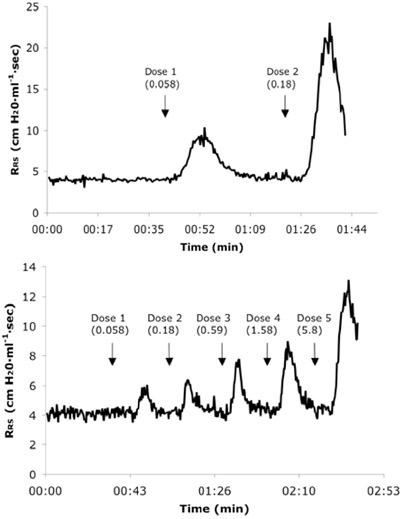
图3。代表实时呼吸道系统电阻(RS)挑战鼠标一个天真的(A)和6X过敏原(b)接受乙酰胆碱剂量连续第四描。剂量值以毫克/公斤为单位。

图4。差分免疫细胞计数在连续7鼻内挑战治疗小鼠左肺部的支气管肺泡灌洗样本。百分比(%)过敏原(A)或PBS(二)处理小鼠免疫细胞丰。过敏原(C)或PBS(四)处理的小鼠的免疫细胞的总数。值表示为平均值+ / - SEM。
讨论
哮喘的研究,以及其他各种气道阻塞性疾病,构成一个生物医学研究的活跃和扩大的领域。与哮喘有关的实验研究的一个重要组成部分,是衡量不同条件下的气道大小的变化的能力。过多的气道狭窄回应挑衅性的挑战,哮喘和相关的肺部疾病的一个典型特征,称为气道高反应性呼吸道财产,是一个有临床意义的攻击导致气短,呼吸困难等症状,其中包括死亡的重要组成部分。
致谢
我们感谢W。Mintzer博士的建议,执行纤维气管插管。支持的赠款U19AI070973,R01AI057696,K02HL75243,并从美国国立卫生研究院R01HL082487。
材料
呼吸道生理测量软件(Rescomp)是自定义的准备(千年总理集团; 415-519-4371)。
使用一台PC运行Windows XP的工作站,配备Pentium III的CPU(英特尔)公司,美国加州圣克拉拉,和一个17针的模拟数字信号转换器(美国国家仪器,#PC - LPM16)的数据进行分析。
小动物的呼吸道生理工作站自定义组装(千年总理集团)使用市售压力传感器(#TRD5700和TRD4510),前置放大器模块(部件编号:MAX2270),底盘(部分#MAX1320; Buxco,北卡罗莱纳州威尔明顿)和一个定制的小动物体积描记。
0.5毫米螺纹外径光纤连接到光源(科尔帕尔默照明灯,41722系列)
呼吸机(美国哈佛大学器械鼠标风机,#687)
10毫米,27ga针(BD公司,猫没有。309602)
散热灯
1 ml注射器(BD公司,猫没有。305109)
4个夹子(小马3200弹簧夹)
0.5毫米的外部插管导丝
Hemacytometer
Superfrost / PLUS显微镜载玻片(费舍尔猫。12-550-15)
Shandon过滤卡(热猫没有。5991022)
差分细胞幻灯片染色(费舍尔猫。。122911)
光显微镜(Leica)
Cytospin 3(Shandon)
20 GA,1.25英寸ProtectIV(史密斯医疗)静脉导管
0.5毫米聚合物光纤(埃德蒙光学#NT02 - 532)。
参考文献
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。