需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在活细胞荧光蛋白的双探头光学突出纯净的光转化的
摘要
这个协议描述的一般方法执行在激光共聚焦显微镜,荧光蛋白的光转化。我们描述puried蛋白质样品的光转化,以及与mOrange2和Dronpa活细胞的双探头光学突出的程序。
摘要
Photoconvertible荧光蛋白(PC - FPS)是一种荧光蛋白类的“光学荧光笔”的能力,这意味着暴露于一个特定波长的光可以通过改变颜色的荧光。光突出允许非侵入性标记的荧光分子亚群,因此跟踪单个细胞或细胞器的理想选择。
高效光转化的关键参数的光转化光的强度和曝光时间。如果强度太低,将光转化缓慢或不发生在所有。另一方面,强度太大或太长时间曝光可以光漂白的蛋白质,从而减少了光转化效率。
本协议描述了如何设置PC - FP光转化应用激光共聚焦扫描显微镜的一般方法。首先,我们描述准备纯化蛋白液滴样本的一个过程。此样本格式是非常方便的在显微镜下研究荧光蛋白的光物理行为。其次,我们将使用蛋白质液滴示例显示如何配置的光转化显微镜。最后,我们将展示如何执行在活细胞,包括mOrange2和Dronpa双探头光学突出中的光学突出。
研究方案
1。荧光蛋白滴样品制备
一种荧光蛋白液滴样本包括与居住在水相中的荧光蛋白质1-octanol/water乳液。这个乳液是夹在显微镜幻灯片和一个22平方毫米的玻璃盖显微镜应用。
- 需要清理,并具有疏水性剂涂在荧光蛋白液滴样本的显微镜载玻片和盖玻片。
- 5分钟,用丙酮洗涤清洁的玻璃器皿和离开干燥空气。 (可选,清洗玻璃器皿后,可以被视为在等离子体清洁30秒,以获得最佳的涂层结果)。
- 2分钟,在这个解决方案孵化期间,准备在2%的丙酮和大衣的玻璃器皿methyltrimethoxysilane解决方案。涂后,从溶液中取出玻璃器皿,离开干燥空气。然后用70%乙醇喷雾瓶,再次留下来干。 (或者,在这一点上的玻璃器皿可烤1小时在80 ° C共价键链接涂层玻璃器皿)。镀膜玻璃制品可以保存至少一个月。
- 他的6标记的大肠杆菌的蛋白质纯化荧光蛋白大肠杆菌 1。测量纯化的蛋白质的吸收光谱,并准备在STE缓冲液(150 mM氯化钠,10毫米的Tris - HCl pH值8,1毫米EDTA)〜0.1光密度的股票稀释,含0.1%牛血清白蛋白(BSA) 。另外准备10毫升1:1混合的1 - 辛醇和STE缓冲液15 ml锥形管,并大力混合。相分离混合后离开,直到完成。最高阶段是1 - 辛醇。 (注意:由于1 - 辛醇,具有很强的气味是很重要的一个封闭的废弃物容器,1 - 辛醇接触的一切。)
- 为了使1 - 辛醇和5μL离心管中的荧光蛋白的乳化吸液管45μL。用手指轻按管几次,开始形成乳液,然后管超声在超声浴30秒。在同时得到涂层的显微镜载玻片和盖玻片的准备。超声乳化液后应完全阴天。超声吸管从管中的4μL乳液到涂显微镜幻灯片后立即覆盖涂层的玻璃盖。
- 如果过程是正确的乳液应均匀地分布之间的显微镜幻灯片和对象的玻璃。样品在几分钟之内应该是稳定的,不同直径〜10微米厚的荧光液滴组成。最大的水滴接近试样的中心,位于较小对边缘进一步。
2。建立一个光转化实验
下面的过程是一个总体战略,设立一种荧光蛋白的光转化实验。此过程可对活细胞中的蛋白质纯化以及应用。
- 以下参数设置你的光转化实验提供了一个一般的起点:
40X 1.3NA油浸物镜
图像尺寸为512 × 512像素
扫描变焦= 4
像素停留时间= 6微秒。
Z轴分辨率(针孔大小)= 3微米 - 配置初始photoconverted荧光检测通道,以及“光转化通道”。在这个例子中,我们将使用,纯化的mOrange2蛋白质,这是一个橙红色photoconvertible的荧光蛋白。橙色的物种是检测用561 nm激发和荧光收集的570纳米和630纳米之间。 photoconverted红色物种检测用633 nm激发和荧光收集的640纳米和700纳米之间。对于“光转化通道”,选择488 nm激发,并收集490 nm和540 nm处的荧光。 (注:不是绝对必要的成像光转化渠道。)
- 使用连续扫描调整激光功率和探测器获得最佳的图像质量与初始荧光成像通道。
- 激活光转化渠道,并选择一个较低的激光功率。开始成像时间的推移系列,并逐步提高激光的光转化,直到观察到了显着的初始荧光漂白。继续扫描,直到初始荧光漂白约75%。
- 停用的光转化渠道和激活的photoconverted荧光检测通道。开始与高探测器的增益和低激光功率成像,并逐步提高激光功率,直到photoconverted荧光检测。一旦你发现photoconverted的荧光,您可以调整激光功率和探测器获得最佳的图像质量。
- 最后,激光功率使用以及光转化的光转化的时间需要优化。提高光转化激光功率将加速光转化率,但是过多的激光功率,光漂白的蛋白质。
- 一旦最佳的光转化的激光功率和持续时间已经确定,这些参数可用于配置一个标准的漂白或FRAP模块和不再需要的“光转化通道”。
3。 mOrange2和Dronpa双探头光学突出
由于红移光谱特性,mOrange2可以用来photoswitchable双探头光学突出绿色荧光蛋白Dronpa,允许4个独立的细胞(细胞器)人口的选择性突出的组合。
- 细胞是生长在玻璃底部MatTek菜和转染24小时前成像标准Lipofectamine2000转染 1 。
- 设置第2条所述mOrange2光转化的显微镜。
- 配置Dronpa photoswitching显微镜。 Dronpa荧光成像使用mOrange2“光转化通道”(见第2.2步)。 (注:用于成像Dronpa的激光功率最小化,因为太多的激光功率会导致Dronpa灭活)。Dronpa photoactivation添加频道。我们用800 nm的双光子激发photoactivation,但另外可以做到这一点使用405 nm激发。确定的成像所需的激光功率,photoactivation,Dronpa荧光photoinactivation。
- 注意:光转化的mOrange2 Dronpa灭活发生后,488 nm激发。由于mOrange2光转化所需的激光功率高,这也将灭活Dronpa荧光。另一方面,Dronpa灭活发生已经在激光功率要低得多,可以不执行重大mOrange2光转化。
- 一旦mOrange2光转化和Dronpa photoswitching的参数设置,双探头光学突出的是通过以下步骤。首先,在整场与低功耗488 nm激发荧光Dronpa灭活。其次,选择一个地区的利益,并具有高功率488 nm激发photoconvert mOrange2。最后,选择一个感兴趣的激活Dronpa荧光的区域。
4。代表性的成果
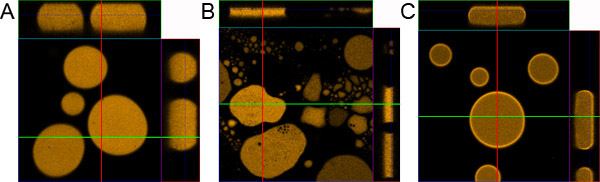
图1。液滴的样品制备。一个正确的准备)液滴样本。 b)样品准备,无涂层的显微镜载玻片和盖玻片。 c)样品准备而增加0.1%BSA。
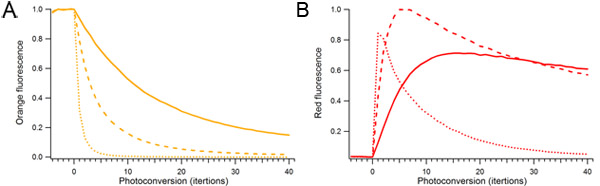
图2。光转化mOrange2光转化的激光功率和持续时间的影响,含有mOrange2蛋白质的单液滴不断photoconverted使用不同金额的488 nm激光功率。相对激光功率为光转化为为10%(固体),25%(虚线),和100%(虚线)。一)橙色荧光物种。二)Photoconverted红色荧光物种。
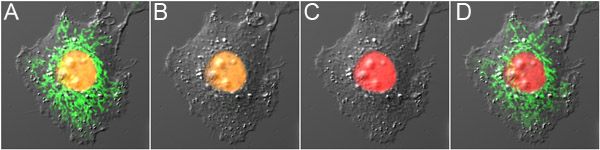
图3。双探头光学突出mOrange2和Dronpa)前光转化细胞表达mOrange2组蛋白H2B和Dronpa三刀,在线粒体在细胞核和绿色荧光的橙色荧光。二)Dronpa荧光切断与低功耗488 nm激发,造成的mOrange2最小光转化。三)mOrange2 photoconverted以红色高功率488 nm激发。四)Dronpa接通再次使用800 nm的双光子激发荧光。该小组的荧光图像叠加在一起的微分干涉对比图像。
讨论
纯化的荧光蛋白液滴样本的荧光蛋白的光物理特性是非常方便的样本格式,例如漂白动力学和光转化动力学研究。液滴体积非常小(〜20皮升)促进漂白和光转化实验,它可以比色皿的系统难以执行。此外,如图所示,这里液滴样本非常适合设立了光转化应用共聚焦显微镜。疏水性涂层和BSA的存在是重要的,获得均匀的液滴。无涂层的液滴往往是对玻璃表面的挤压和缺乏对BSA的荧光蛋白容易聚积?...
披露声明
致谢
我们感谢迈克W.戴维森(佛罗里达州立大学)提供荧光蛋白的质粒DNA编码。这项工作是由国家卫生授予GM72048(DWP)研究院的支持。
材料
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
参考文献
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。