Method Article
PAR剪辑 - 一个方法来确定全转录组学,RNA结合蛋白的结合位点
摘要
RNA转录受到广泛的是由众多的反式作用的RNA结合蛋白(限制性商业惯例)介导的转录后调控。在这里,我们提出了一个普及的方法,准确地确定和一个转录大规模RNA结合位点的限制性商业惯例。
摘要
通过数百个RNA结合蛋白(限制性商业惯例)和microRNA往往是在一个细胞类型依赖性表达的核蛋白复合物(miRNPs)。的相互作用,RNA转录,转录后基因调控要了解这些RNA结合因素的相互作用影响个人成绩单,在体内蛋白质的RNA的相互作用是必要的1的高分辨率地图的监管。
遗传,生化和计算方法相结合的典型应用,识别RNA - RBP的或RNA - RNP的相互作用。芯片分析immunopurified限制性商业惯例的RNA(RIP - Chip)的定义在转录水平的目标,但其应用受到限制的表征动力学稳定的相互作用和3,4只在极少数情况下可以识别的限制性商业惯例的识别元素( RRE )内的长期目标RNA。更直接的RBP的目标网站的信息是通过在体内的紫外光交联的交联的RNA片段和基因测序(CLIP)10隔离与免疫 7-9 5,6结合。剪辑是用来识别一个限制性商业惯例的11-17的目标。然而,剪辑是有限的紫外线254纳米RNA -蛋白质交联效率低,交联的位置是不容易识别的内交联的序列片段,使其难以从背景中分离非交联紫外光交联的靶RNA片段RNA片段也存在于样品中。
我们制定了一个强大的细胞为基础的交联的方法,以确定在高分辨率和转录的全细胞限制性商业惯例和miRNPs的结合位点,我们长期的PAR -剪辑(Photoactivatable -核苷增强的交联和免疫)(见大纲图1a的方法)。该方法通过活细胞的光反应的核苷类似物,如4 - thiouridine(4 - SU)和6 thioguanosine(6 - SG),纳入到新生RNA转录依赖。 365纳米的紫外线光照射诱导细胞光反应核苷标记细胞的RNA相互作用的限制性商业惯例的有效交联。其次是隔离交联和coimmunoprecipitated RNA免疫沉淀的限制性商业惯例的利益。分离出的RNA转换成cDNA文库和使用深测序公司Solexa技术。 PAR剪辑编写的cDNA文库的一个特点是,可以由居住在序列的cDNA突变确定的交联的精确位置。当使用4 -苏交联序列胸苷胞苷过渡,而使用6 - SG的鸟苷腺苷基因突变的结果。交联序列的突变,使人们有可能分开他们从丰富的细胞分子RNA的序列的背景。
据报道方法应用到一个多样化的RNA结合蛋白的数量在哈夫纳等 18
研究方案
该协议说明HEK293细胞表达的标志/标记后,用强力霉素诱导的HA - IGF2BP1的PAR -剪辑过程。我们将使用免疫抗旗的抗体。
PAR -剪辑将与任何细胞表达内源性的检测水平,未标记的RNA结合蛋白(RBP)的利益,如果一个高效的免疫抗体。
扩大细胞
- 展开FlpIn-HEK293/TO/FLAG/HA-IGF2BP1细胞生长的培养基。我们建议使用100-400 x 10 6个细胞(约10-40 15厘米细胞培养板)之间为出发点。种植约80%汇合。
- 交联前14 h 添加)4 thiouridine直接向细胞培养液中的终浓度为100微米(1米4 thiouridine原液1:1000 V / V) 和b)诱导表达的旗帜/医管局标签增加1微克/毫升强力霉素(10毫克/毫升强力霉素原液1:10,000 V / V)IGF2BP1。注意:你可以代替4 - thiouridine还可以使用6 thioguanosine 100微米。
紫外光交联
- 10毫升每盘冰冷的PBS洗涤细胞一次,并完全删除PBS。
- 与0.15焦耳/平方厘米 365纳米的紫外线光在Stratalinker 2400(Stratagene公司)或类似的设备发现的冰和照射托盘板。
- 刮取细胞,每1毫升PBS橡胶板,转移至50 ml离心管警察和500 XG在4 ° C 5分钟,离心收集上清液。 100 × 10 6 HEK293细胞(10 15厘米的板),将产生约。 1毫升的湿颗粒细胞。
- (可选),除非你想继续直接与细胞裂解,休克冻结在液态氮和存储细胞沉淀于-80 ° C。细胞沉淀,可存储至少12个月。
细胞裂解和消化RNaseT1
- 在3卷1X NP40裂解液交联细胞的颗粒细胞,并在冰上孵育10分钟。
- 清除细胞裂解液通过离心13,000 15分钟XG在4 ° C。
- 进一步清除裂解液过滤0.2微米膜注射器过滤器(PALL Acrodisc或同等学历)。
- 核糖核酸酶T1(Fermentas公司,万U /μL)添加到终浓度为1 U /μL,在15分钟的水浴孵育在22 ° C。随后冰在出发前5分钟的冷却反应。
免疫沉淀和交联的目标RNA片段恢复
利用磁选
整个样品制备按照这些指引,以防止干燥磁珠。
- 将管内含有1 2分钟的磁立场上的珠子。
- 添加缓冲管,而管磁选。
- 第磁选管,删除,重悬珠。您可以重悬,用手指轻弹管珠或使用设置在5月6日vortexer。
- 短暂离心收集任何可能留在管帽珠。
- 重复步骤1到4,根据需要。
磁性微球的制备
- 转移10μL磁珠G蛋白的磁性粒子(Invitrogen)的每毫升细胞裂解液(一个典型的实验应该约40 50μL珠)到1.5毫升离心管。柠檬酸磷酸盐缓冲液1毫升,两次清洗珠。
- 悬浮在柠檬酸 - 磷酸盐缓冲液相对原始卷珠悬浮量的两倍。
- 新增反旗M2单克隆抗体(Sigma公司)的0.25微克每毫升悬浮和旋转的轮子上在室温下40分钟的孵育。
- 1毫升柠檬酸磷酸盐缓冲液洗珠两次,以除去未结合的抗体。
- 在柠檬酸 - 磷酸盐缓冲液相对原始卷珠悬浮量的两倍重悬珠。
免疫沉淀(IP),第二个核糖核酸酶T1消化,和去磷酸化
- 添加20μL新鲜配制每毫升含部分核糖核酸酶T1处理过的细胞裂解液抗体偶联的磁珠孵育1小时旋转的轮子上在15毫升离心管4 ° C。
- 15日和50毫升离心管(Invitrogen)的磁珠上的磁性粒子收集器收集,并转移到1.5 ml离心管。
- 洗净珠在1毫升IP缓冲液洗3次。
- 添加RNaseT1(Fermentas公司,万U /μL)至终浓度为100 U /μL和珠悬浮在一个15分钟的水浴孵育22 ° C。随后对冰酷5分钟。
- 洗净珠在1毫升高盐缓冲液洗3次。
- 1体积的去磷酸化缓冲液中的悬浮珠
- 小牛肠碱性磷酸酶(CIAP,NEB)添加到终浓度为0.5 U /μL,并暂停10分钟在37 ° C。
- 1毫升磷酸缓冲液洗两次洗珠
- 洗两次多聚核苷酸激酶(PNK)缓冲无DTT(酶反应所必需的数码地面电视浓度高到足以破坏磁珠)珠。
- 在一个原珠PNK缓冲量悬浮珠
放射性标记的交联免疫沉淀蛋白质的RNA片段
- 上文所述珠悬浮,添加Υ- 32 P - ATP到0.5μCi/μL和T4 PNK的最终浓度(NEB)一个原珠卷1 U /μL 。孵育30分钟暂停在37 ° C。
- 添加非放射性ATP获得终浓度为100μm,另有5分钟,在37 ° C。
- 800 PNK没有数码地面电视的缓冲液洗磁珠5倍。
- 在70 SDS - PAGE上样缓冲液重悬珠。
SDS - PAGE和RNA -蛋白质复合物的交联电泳凝胶片
- 孵育放射性标记的悬浮在加热块5分钟在95 ° C变性和交联的RNA和旋涡释放免疫沉淀RBP的。
- 删除磁珠上的分隔,将上清转移到一个干净的1.5 ml离心管。
- 负载40μL上清,每孔一个NOVEX双三4-12%(Invitrogen)的预制聚丙烯酰胺凝胶和凝胶运行55分钟,在200 V。
- 拆开凝胶室和拆除凝胶,离开它装在一个盘子。为了方便phosphorimager纸打印输出凝胶对齐,我们建议三个微小的放射性凝胶片植入凝胶的四个角中的三个不对称。放射性凝胶片可以收集从以前用来净化放射性标记的合成寡核苷酸凝胶。包裹在塑料薄膜(如保鲜膜)的凝胶,以避免污染。
- 凝胶暴露一个空白phosphorimager 1小时的屏幕和可视化上phosphorimager。
- 将phosphorimager定向使用植入的凝胶块的打印输出上的凝胶。切出的条带,符合预期大小的RBP(IGF2BP1,约75 kDa的),并转移到一个D -管透析MIDI管,并添加800μL1X SDS的运行缓冲。
- Electroelute在1X SDS交联RNA - RBP的复杂运行在100 V 2小时的缓冲从凝胶切除和electroeluted 800μLSDS电泳缓冲液中的一个D -管透析MIDI(Novagen公司)根据制造商的指示。
蛋白酶K消化
- 加入等体积的2倍蛋白酶K缓冲的electroeluate,蛋白酶K(罗氏)除了到终浓度为1.2毫克/毫升。孵育30分钟,在55 ° C。
- 恢复酸性酚/氯仿/ IAA的提取(25:24:1,pH值4.0)由氯仿萃取的RNA。加入1μL的糖原(10毫克/毫升的股票)的RNA沉淀加入乙醇3卷。 10.5μl水溶解的沉淀。
cDNA文库的准备和深度测序
回收的RNA进行通过一个标准的最初19监管的小分子RNA的克隆的cDNA文库制备协议。第一步,3'适配器结扎,进行了使用10.5μL回收的RNA在20μL规模。使用公司Solexa测序适配器设置描述。根据回收的RNA量,5' - 3'适配器适配器没有插入的产品可作为额外的PCR带的cDNA扩增后检测。在这种情况下,消费预期大小较长的PCR产品从3%NuSieve低熔点琼脂糖凝胶,洗脱从胶件使用的GelElute试剂盒(Qiagen)和序列使用公司Solexa技术的PCR产物。一个公司Solexa测序运行通常给予读取一个转录的RNA结合蛋白的结合位点的覆盖面广,足够6和10万之间的序列。
生物信息学分析
仔细序列的生物信息学分析的内容需要做的研究RBP的RNA结合位点,如RNA识别的元素,首选的限制性商业惯例的结合区域(外显子与内含子,获得有意义的见解,编码序列与非翻译序列)。需要对基因组和EST数据库对齐的序列读取。我们通常使用读取mappi吴独特的基因组与一个不匹配,插入或删除序列构建的集群读取,然后可以进一步分析。在集群测序的特征突变的频率读取,T到C转换采用4苏和G A转换时使用6 - SG的,成功交联的序列指示。根据我们的经验与4 -苏标记uncrosslinked RNA的一个背景的突变率约20%。这个比率是增加至约。后交联的50-80%。
一个生物信息学分析的详细描述,可以发现在该出版物的补充材料,哈夫纳等18。
可选步骤
测定总RNA到4 thiouridine纳入各级
从细胞株中分离的总RNA,稳定表达后,在100微米4SU 16小时收获前培养基生长的限制性商业惯例的兴趣。作为对照,收获细胞生长无4SU此外。另外3卷Trizol试剂(Sigma公司)洗细胞颗粒制造商的指示隔离的总RNA。进一步净化,用Qiagen公司的RNeasy根据制造商的协议的总RNA。为了防止在RNA提取和分析4SU氧化,添加0.1毫米二硫苏糖醇(DTT)洗缓冲区和随后的酶步骤。精华和去磷酸化的高效液相色谱分析的单核苷的总RNA作为描述的前 20名。简单地说,在30μL体积,孵育16小时40微克纯化的总RNA在37 °与0.4 ü细菌碱性磷酸酶(顿生化)和0.09 ü蛇毒磷酸二酯酶(顿生化)。作为参考标准,使用一个4SU标记合成的RNA(标准,我们使用CGUACGCGGAAUACUUCGA(4SU)美国),并受到完整的酶消化。一个Supelco公司发现C18(保税相硅胶5微米的颗粒,250 × 4.6毫米)反相柱(贝尔丰特PA,USA),高效液相色谱法分离核糖产生的混合物。高效液相色谱缓冲区0.1 M的TEAA在3%乙腈(A)和90%乙腈(二)在水中。 15分钟,0到10%B级为20分钟,30分钟10至100%B级,使用等度梯度:0%B级。应用5分钟100%B级洗应用之间运行清洁HPLC柱。
代表性的成果
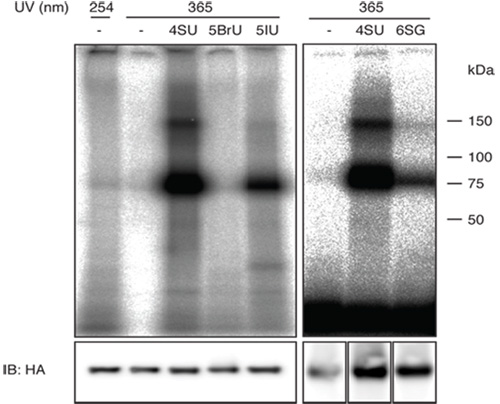
图1(右面板)显示了一个细胞系中表达的HA - 4 - SU和6 - SG标签IGF2BP1旗/执行PAR剪辑的代表性的结果。需要注意的是6 - SG的IGF2BP1的交联效率低于4苏交联效率。交联效率低,会导致在一个较高的背景丰富的细胞的RNA片段所得的序列,因此,你应该考虑扩大实验时,使用效率较低的光反应核苷。
图1的左侧面板中显示了使用不同的光反应尿嘧啶核苷类似物,可能是潜在的PAR剪辑使用,比传统的紫外线254纳米交联的比较。
正确长度的放射性波段的强度洞剪辑实验是否曾通过一个小RNA测序协议(小cDNA文库制备的说明一步一步您已经分离出了足够的RNA进行的给你一个好主意19),可以发现的RNA测序。当使用4 -苏和G A转换时使用6 - SG的特征突变测序读取,T到彗星转换,频率是成功交联的序列指示。根据我们的经验与4 -苏标记uncrosslinked RNA的一个背景的突变率约20%。这个比率是增加至约。后交联的50-80%。
披露声明
致谢
我们感谢有益的讨论Tuschl实验室成员。氢是由德国学术Austauschdienst(DAAD)的支持。这项工作是支持由瑞士国家基金拨款#3100A0 - 114001锰锌; TT是霍华德休斯医学研究所研究员,并在他的实验室的工作是由美国国立卫生研究院拨款GM073047和MH08442和斯塔尔基金会的支持。
材料
缓冲液和试剂
HEK293细胞生长培养基
- DMEM培养液
- 10%FBS
- 2毫米L -谷氨酰胺
- 100 U / ml青霉素
- 100 U / ml链霉素
- 100微克/毫升潮霉素
- 15微克/毫升杀稻瘟
4 thiouridine股票的解决方案(1米)
- 260.27毫克4 thiouridine
- 1毫升DMSO
Doxycyclin股票(10毫克/毫升)
- 10毫克doxycyclin
- 1毫升DMSO
1X NP40裂解液
准备好没有DTT和蛋白酶抑制剂股票的5倍缓冲。实验前直接加入DTT和蛋白酶抑制剂。
- 50毫米的HEPES,pH值7.5
- 150 mM的氯化钾
- 2毫米EDTA
- 1 mM的氟化钠
- 0.5%(V / V)NP40
- 0.5 mM的数码地面电视
- 完整的EDTA无蛋白酶抑制剂的鸡尾酒(罗氏)
柠檬酸 - 磷酸盐缓冲液
- 4.7克/升柠檬酸
- 9.2克/升的NA 2 HPO 4
- pH值5.0
IP缓冲液洗
- 50毫米的HEPES - KOH,pH值7.5
- 300 mM的氯化钾
- 0.05%(V / V)NP40
- 0.5毫米DTT(实验前直接添加)
- 完成EDTA无蛋白酶抑制剂的鸡尾酒(罗氏)(实验之前,直接添加)
高盐缓冲液洗
- 50毫米的HEPES - KOH,pH值7.5
- 500 mM的氯化钾
- 0.05%(V / V)NP40
- 0.5毫米DTT(实验前直接添加)
- 完成EDTA无蛋白酶抑制剂的鸡尾酒(罗氏)(实验前直接添加)
去磷酸化缓冲
- 50毫米的Tris - HCl,pH值7.9
- 100毫米氯化钠
- 10毫米氯化镁2
- 1 mM的数码地面电视
磷酸酶清洗液
- 50毫米的Tris - HCl,pH值7.5
- 20 mM的EGTA
- 0.5%(V / V)NP40
多聚核苷酸激酶(PNK)没有数码地面电视的缓冲区
- 50毫米的Tris - HCl,pH值7.5
- 50 mM氯化钠
- 10毫米氯化镁2
PNK缓冲
- 50毫米的Tris - HCl,pH值7.5
- 50 mM氯化钠
- 10毫米氯化镁2
- 5 mM的数码地面电视
SDS - PAGE上样缓冲液
- 10%甘油(V / V)
- 50毫米的Tris - HCl,pH值6.8
- 2毫米EDTA
- 2%SDS(W / V)
- 100 mM的数码地面电视
- 0.1%溴酚蓝
2X蛋白酶K缓冲
- 100毫米的Tris - HCl,pH值7.5
- 150 mM氯化钠
- 12.5毫米EDTA
- 2%(W / V)SDS
参考文献
- Keene, J. D. RNA regulons: coordination of post-transcriptional events. Nat. Rev. Genet. 8 (7), 533-533 (2007).
- Tenenbaum, S. A. Identifying mRNA subsets in messenger ribonucleoprotein complexes by using cDNA arrays. Proc. Nat. Acad. Sci. 97 (26), 14085-14085 (2000).
- Gerber, A. P. Genome-wide identification of mRNAs associated with the translational regulator PUMILIO in Drosophila melanogaster. Proc. Nat. Acad. Sci. 103 (12), 4487-4487 (2006).
- Lopez de Silanes, I. Identification of a target RNA motif for RNA-binding protein HuR. Proc. Nat. Acad. Sci. 101 (9), 2987-2987 (2004).
- Greenberg, J. R. Ultraviolet light-induced crosslinking of mRNA to proteins. Nucl. Acids Res. 6 (2), 715-715 (1979).
- Wagenmakers, A. J. Cross-linking of mRNA to proteins by irradiation of intact cells with ultraviolet light. Eur. J. Biochem. 112 (2), 323-323 (1980).
- Mayrand, S. Structure of nuclear ribonucleoprotein: identification of proteins in contact with poly(A)+ heterogeneous nuclear RNA in living HeLa cells. The Journal of Cell Biology. 90 (2), 380-380 (1981).
- Dreyfuss, G. Characterization of heterogeneous nuclear RNA-protein complexes in vivo with monoclonal antibodies. Mol. Cell. Biol. 4 (6), 1104-11 (1984).
- Adam, S. A., Dreyfuss, G. Adenovirus proteins associated with mRNA and hnRNA in infected HeLa cells. J. Virol. 61 (10), 3276-3276 (1987).
- Ule, J. CLIP identifies Nova-regulated RNA networks in the brain. Science. 302 (5648), 1212-1212 (2003).
- Licatalosi, D. D. HITS-CLIP yields genome-wide insights into brain alternative RNA processing. Nature. 456 (7221), 464-464 (2008).
- Yeo, G. W. An RNA code for the FOX2 splicing regulator revealed by mapping RNA-protein interactions in stem cells. Nat. Struct. Mol. Biol. 16 (2), 130-130 (2009).
- Sanford, J. R. Splicing factor SFRS1 recognizes a functionally diverse landscape of RNA transcripts. Genome Res. 19 (3), 381-381 (2009).
- Granneman, S. Identification of protein binding sites on U3 snoRNA and pre-rRNA by UV cross-linking and high-throughput analysis of cDNAs. Proc. Nat. Acad. Sci. , (2009).
- Guil, S., Caceres, J. F. The multifunctional RNA-binding protein hnRNP A1 is required for processing of miR-18a. Nat. Struct. Mol. Biol. 14 (7), 591-591 (2007).
- Chi, S. W. Argonaute HITS-CLIP decodes microRNA-mRNA interaction maps. Nature. 460 (7254), 479-479 (2009).
- Zisoulis, D. G. Comprehensive discovery of endogenous Argonaute binding sites in Caenorhabditis elegans. Nat. Struct. Mol. Biol. , (2010).
- Hafner, M. Transcriptome-wide identification of RNA-binding protein and microRNA target sites by PAR-CLIP. Cell. , (2010).
- Hafner, M. Identification of microRNAs and other small regulatory RNAs using cDNA library sequencing. Methods. 44 (1), 3-3 (2008).
- Andrus, A., Kuimelis, R. G. Base composition analysis of nucleosides using HPLC. Current Protocols in Nucleic Acid Chemistry. Chapter 10 (Unit 10.6), (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。