Method Article
成人和胚胎骨骼的肌肉Microexplant文化和骨骼肌肉干细胞的分离
摘要
微解剖植技术是一个强大而可靠的隔离,从少年,成年或胚胎骨骼肌干细胞的来源肌肉增生骨骼肌细胞的方法。与众不同的是,这些细胞已被克隆派生的骨骼肌干细胞体内移植使用的线。
摘要
培养的胚胎和成年骨骼肌细胞具有不同用途。微解剖植技术本章描述的是一个相对隔离的骨骼肌骨骼肌干细胞的来源从少年,成年或胚胎肌肉细胞增生的大量强大的和可靠的方法。作者们用微解剖植文化分析骨骼肌细胞的生长特性,在野生型和营养不良的肌肉。组织生长的每个组件,即细胞的存活,增殖,衰老和分化,可单独使用这里描述的方法进行分析。增长的所有组成部分的净效应可以建立由外植体生长率的测量手段。微植体的方法可用于建立小学文化,从不同的肌肉类型和年龄的广泛,这里描述的,已经由作者改编,使胚胎骨骼肌前体的隔离。
与众不同的是,微植文化已用于派生克隆(单细胞起源)骨骼肌干细胞(SMSC) 体内移植,可扩展和使用的线路。行为功能,组织特异性,卫星细胞在体内移植SMSC这有助于骨骼肌纤维再生,但也保留一个未分化的干细胞可到文化重新使用微植方法分离的小水池(卫星细胞小生境)。
研究方案
有两种方法可以采用隔离增生的骨骼肌细胞。在第一肌肉组织酶消化,隔离单细胞的前镀出1。第二种方法是,植成文化块肌肉组织,使细胞生长孵化过程中2,3 。第二种方法是在本议定书。在植体培养组织文化本身有其根源。 2007年是哈里森的经典实验中,他获得孵化神经外植体,在悬滴淋巴结 4,神经元副产物诞辰100周年。在随后的100多年外植体培养技术已被用于和完善成人和胚胎干细胞4,第 5的增殖原代培养的一种手段,在各种不同的背景下。然而,后面的外植体技术的原则,保持不变,以尽量减少维持细胞生长的关键早期阶段的家长组织的三维结构,同时提供营养丰富的媒体outgrowing细胞基层细胞分离的创伤在其中繁殖。在骨骼肌中有使用外植体的文化,因为切割的肌肉组织的行为模仿肌纤维创伤,通常触发卫星细胞的活化,迁移和增殖3,6是一个额外的好处。成人骨骼肌卫星细胞(也称为成肌细胞)增殖的干细胞群负责肌纤维的修复和增长7。
骨骼肌植从而模拟体内环境的再生肌,刺激干细胞迁移和分化。在胚胎中,大多数脊椎动物骨骼肌(躯干,四肢肌肉)来自体节,虽然somitomeres和鳃弓会引起头8,9肌肉。肌节,可确定为两个不同的群体MYF - 5表达干细胞与众不同的体节背侧,内侧和外侧边缘,分别位于。分别时,这些细胞产生的背影, 在原地区分epaxial肌肉,并腹侧和外侧hypaxial的肌肉(四肢,腹部和呼吸肌)的肌肉干细胞从体节 10移植。胚胎肌肉干细胞移植的大同3月11日的控制下。 MYF - 5的表达是必不可少的胚胎肌肉组织的建立和这一点的重要性,一直持续到产后肌肉卫星细胞激活超过98%表示MYF - 5 12。因此MYF - 5是一个可靠的和具体的标记,在成人和胚胎组织中增殖骨骼肌肉干细胞群体。可以分离出胚胎的肌肉干细胞(又称肌肉细胞祖细胞,骨骼肌的前体,成肌细胞或胚胎卫星细胞)从早期阶段的小鼠,鸡和青蛙胚胎13体节。为了隔离从老年人的胚胎的胚胎骨骼肌生肌文化已经适应了胚胎组织的显微切割外植体技术。类似的方法是使用Cossu等14,生成的胚胎体节 14克隆的细胞群。
1,骨骼肌肉干细胞在体外细胞培养(SMSC)
SMSC已克隆原发性骨骼肌植体文化派生的单细胞起源的细胞系。它们可以使用标准的组织培养方法培养,如果采取足够的照顾。加热到37 ° C水浴中,使用前请注意,除非另有说明,所有操作描述是在无菌条件下,使用层流罩(1级或2级无菌柜)和所有文化试剂。
- 为了实现从液氮保存(冻结下来的方法,请参阅第1.2节)SMSC解冻冷冻管应被迅速和内容转移到5 mL的预热(37℃)DF10培养基立即离心3分钟(1000克),以消除二甲基亚砜。解冻细胞的最佳方法是通过少量重复预热的培养基吹打成小瓶,然后转移到离心管。解冻细胞的过程中应进行得非常迅速,因为冻存细胞含有10%二甲基亚砜,这是在室温下的细胞毒性(LD50约2分钟)。
- 离心后的上清液和细胞重新悬浮细胞沉淀在进一步的5毫升DF10洗净,然后离心前。
- 颗粒混合细胞,然后用5 mL的DF10以及由此产生的细胞悬液的第二次转移到一个小25 厘米,2个塑料的文化已经SSEL。
- 文化是保持在37 °在培养箱彗星含有5%,在空气中的CO 2。除非用于筛选的第船只,烧瓶中的第必须稍微放松了几个小时,允许的培养容器中的空气平衡与孵化器和酸化培养基。介质的pH值监测纳入培养液中苯酚的红色染料的pH值指标。
- 解冻细胞必须始终监控电镀后与新鲜的DF10培养基重新,24小时,以确保去除细胞碎片和残留的毒素(见注1和 2) 。
1.1。继代培养
建立SMSC线,当细胞达到约95%汇合,他们应该从他们的培养容器,稀释和放置到一个新的船只,使进一步增长。这种亚文化的过程,可以实现许多不同的酶程序,胰蛋白酶/ EDTA是最经常使用的(见注3) 。它通常和良好的做法,种植密度,要求他们要对经济增长的第三天传代细胞。对于大多数SMS细胞株,可以实现在每个亚文化分裂的细胞的1 / 10。这使得仔细监测,使细胞进行组织培养,要立即查明的不寻常的增长行为(例如更快的增长),这可能表明表型变化的细胞系,如改造或在适应培养条件所造成的细胞凋亡减少。此外,一个一致的和细致的传代常规大大降低此类事件的发生。
- 使用胰蛋白酶(trypsinisation)亚文化的船只是从孵化器和他们的中型吸丢弃。
- 细胞,然后洗两次,用无菌的钙和镁的磷酸盐缓冲液(PBS),10毫升,每洗免去每次吸。
- 游离细胞单层的25毫米(2瓶)1毫升1胰蛋白酶/ EDTA是2 3分钟,在室温下的细胞上,待细胞开始分离(见注 4 )。这可以看出,由有经验的用户烧瓶时举行的光线(见注5)在稍微不透明的单层形成的小孔。虽然,一个单细胞悬液,以确保有足够的时间应trypsinised,细胞,应注意不要曝光过度,SMSC到trypsinisation,因为这会导致细胞死亡和贫困的附件,当细胞重新镀高水平。
- 要停止添加胰蛋白酶反应,含血清培养基(DF10)至少2卷(即胰蛋白酶液量的两倍)。传代25毫米2烧瓶时很方便,在这个阶段添加10毫升DF10 。 1 / 10的细胞分裂可以很容易地与另外9毫升新鲜的DF10培养基稀释到一个新的25毫米2培养瓶中,由此产生的细胞悬液1毫升。剩下的细胞可用于冻存细胞扩张转移到一个更大的船只,(见1.2节 )或计算,并在实验菜,水井或检测增殖和存活,分化,生长因子治疗或其他用途的钢板镀(见下文)。
1.2。细胞株和原代培养的冷冻保存
- 对于冻存细胞脱离了他们的亚文化单层(第3.1.1节 ),离心(3分钟在1000克)的颗粒。
- 上清拆除愿望和细胞仔细,并迅速冻结下来混合在10毫升(10%二甲基亚砜DF10)重悬之前,他们是通过离心重新颗粒。
- 这一次沉淀重新悬浮在足够冻结组合下来,让每离心管0.5 ml的细胞悬液(见表1),并立即到80 ° C过夜。
- 离心管转移到液氮翌日长期储存(见注6)。细胞解冻,这与冷冻保存过程必须迅速进行。虽然二甲基亚砜是保护细胞膜期间冻结,它是在不结冰的温度下的细胞毒性很大。
1.3。确定手机号码
- 要确定一个单细胞悬液(以下亚文化)的细胞浓度,可以使用一个纽鲍尔血球。为了确保计算盖玻片的准确性,必须牢固地安装到血球基地(见注 7 )。
- 一个小滴细胞悬液,然后放置在靠近盖玻片边缘,将采取通过毛细作用。
- 计数细胞,然后使用倒置显微镜相衬照明。为了提高最终细胞浓度,在C的准确性在计数室的英语学习者不应重叠,如果他们这样做的原始细胞悬液应稀释和细胞重新计算。应避免彻底分解细胞聚集在trypsinisation 100-200细胞在一个已知的表面积应该算获得的细胞数量的准确估计。一个方便的方法,使用纽鲍尔血球计数细胞在2个或更多的16万套。细胞密度为每毫升,然后通过除以计算套的数量(如2),占总数乘以10 4 。例如,100个细胞计数超过2 × 16 = 100 / 2 = 5 × 10 5细胞/毫升平方米套。
2。建立原发性骨骼肌Microexplant文化
主微植的文化,可以用来隔离从任何可访问的脱颖而出和后肢个别肌肉,膈肌,背部和腹部肌肉骨骼肌,包括SMSC。 microexplant文化源于青少年和成人的肌肉的方法中详细介绍了由史密斯菲尔德3,随后被广泛地用于派生短信从少年,成年和老年小鼠肌肉细胞。该方法也可以用来推导骨骼肌细胞,培养出 24鱼和人类的骨骼肌(饶和史密斯,未发表)。从小鼠肌肉microexplant SMSC的产物,是在图1A,B所示。该方法已被修改,胚胎肌肉前体细胞(见第3节 )的隔离。基本方法如下:
- 无菌剥离肌肉从刚宰杀的鼠标(S)目标是通过使用消毒,清洁的工作区和自由使用70%的乙醇喷雾。
- 隔离肌肉是通过两个变化的DF20培养基洗涤,并放置到60 毫米的2道菜的新鲜DF20中等。使用立体解剖镜下肌肉仔细显微切割无菌条件下,排除脂肪,结缔组织和骨骼。
- 清理的肌肉块,然后切成400微米的多维数据集使用珠宝商小号镊子,被放在单独进入中心的96孔盘含有50μL,DF20( 见注8)60井。在显微镜下检查井,并放置在孵化器。充满生理盐水,以防止干燥含有植(3)井外井。
- Microexplant附件和产物,是进球后24-48小时培养后,随后在48-72 h的时间间隔(取决于培养肌肉的增长速度)。
- 短信细胞扩张和隔离,应单独监控的产物文化与SMSC为主的形态,即球形的单核细胞聚集集群的增长 (见图3.1B)具有高折射率的细胞。
- 一旦外植体生长建立单井美联储除了50μL介质的增量(见注9)当介质酸化由于细胞密度增加。当井是充分和细胞培养几乎融合,井美联储50%的中型每次更换,以确保维护“空调”,由细胞分泌的因素(参见下克隆的条件培养基的意见 ; 2.1节)。为了抑制分化,在60-70%汇合小学外植体的副产物转为钙耗尽介质DF20培养基喂养细胞3代钙耗尽的DMEM/F12(所有补品保持不变)。
- 植条件培养基可以在这个阶段,准备从文化,存储在扩大和克隆的主要SMSC(克隆的方法, 请参阅第2.1节,图 1c f)使用。文化传代使用dispase方法(见3.5节 )。
- 克隆衍生SMSC可以分析体内肌肉注射( 图3.1 GK)19。
- 核型分析,可以进行克隆的SMSC线确认二倍体状态(见2.2节,图3.1升 )25。
- 这种方法可以适用于培养胚胎肌肉( 第3)。
2.1。克隆推导
小学外植体成肌细胞培养( 图1A,B)是建立在野生型和突变体骨骼肌的各种不同的生长参数的一个有用的和准确的工具。克隆推导,从一个单细胞的细胞系的隔离,是在骨骼肌干细胞分离的重要一步,也可用于亚克隆SMSC的RNAi构造或转基因的转线。 SMSC和小学外植体培养高密度依赖,将“信贷评级机构H“(从盘分离和死亡),如果镀在细胞密度太低,这是因为SMSC释放可溶性要维持经济增长和细胞生存的因素。为了模拟高密度养殖和供应在这些因素克隆过程中,SMSC是克隆的自我调节的介质中。条件培养基除了被认为是必须允许单个细胞,在一个孤立的环境中增殖。
- 准备条件培养基培养48小时33和75%汇合之间的增殖SMSC。
- 这些细胞生长的媒体是48小时后取出,并使用0.2微米的注射器过滤器过滤,这可确保无菌的条件培养基,并删除所有剩余的细胞和碎片。
- 这个条件培养液混合与新鲜培养液按1:1的比例(克隆介质;见注10)和单细胞克隆的文化传媒使用。
- 要实现单细胞稀释细胞分离到一个单细胞悬液,通过仔细trypsinisation(建立SMSC)或dispase治疗(小学外植体培养),并稀释至浓度100μL克隆中型每一个单元格。
- 这种细胞悬液50μL,然后可以镀到每个中心60井一个96孔板。
- 允许细胞孵化重视,在37 ° C,5%,为6小时,每口井的CO 2然后小心地取得细胞的存在。井包含0或超过一个细胞都在这个阶段贴现。
- 井含有一个单一的连接的细胞,仔细地注意到,仔细监测从这个单细胞衍生的殖民地(在最初几天每天),以确保只有一个殖民地,从一个单细胞产生,是目前。细胞株来自含有1细胞井。 图1C - E说明了这样一个单一的细胞派生的殖民地的扩张。
- 一旦殖民地达到在96孔板的汇合点,它可以传代到48孔板。
- 克隆的细胞株,然后仔细地扩大到24 - 6孔板,直到有足够的电池板成 25厘米2烧瓶。
- 骨骼肌这些文化的起源可以证明MYF - 5的表达( 图1F)或其他骨骼肌肉特异性标记物,如MyoD与大同7。
- 在这个阶段行被冻结之前,进一步扩大(见表1)。
2.2。核型分析
核型分析是监测细胞表型的重要方法。克隆推导而得的细胞株应karyotyped,以确保他们有保留无毛的染色体重排,这可能会影响其表型的二倍体染色体补充。
- 对于染色体的细胞是生长在25厘米2培养容器(80%合流)的指数期后期(传代后第2天),最大限度地发挥文化在有丝分裂细胞的比例。
- 染色体的细胞前二十四小时喂10毫升的新鲜培养液。然后加入0.2 mL的10 mg / mL的秋水仙素(见注 11)的细胞,这是为进一步的1小时在37 ° C。
- 1 h后,细胞受标准trypsinisation除亚文化的过程,无论是培养基和PBS洗涤保留,以最大限度地收获有丝分裂细胞的数量。
- 游离的细胞,保留中期和PBS洗涤纺在1000克3分钟沉淀细胞,并删除和丢弃到漂白的上清。
- 细胞沉淀,然后再在0.0075中号氯化钾5毫升暂停了整整4分钟前,细胞再次离心沉淀。
- 上清大部分吸气,留下少量(〜50-100μL)在管重悬。重悬轻弹的Falcon管的基础,直到取得一个细胞浆细胞。细胞,然后放置在冰上和固定在新鲜的冰冷的固定液(甲醇:冰乙酸在3:1的比例)如下:10毫升固定液缓慢滴加细胞,使用一个小玻璃巴斯德吸管(这样可以防止细胞聚集)。
- 细胞被置于冰上30分钟,然后沉淀,离心后的细胞沉淀重悬在0.5毫升的新鲜固定液。
- 幻灯片是由拖放到固定的细胞悬液,在45 °角举行的预备片(见3.2.2.1节)。为了确保良好的间隔中期利差应至少30厘米以上的幻灯片举行的吸管。
- 为了形象化染色体,幻灯片染色在利什曼氏染色为2分钟,3卷Gurr缓冲液的pH值6.8,在使用前稀释。
- 幻灯片是在室温下干燥,并安装在DePex安装介质。
2.2.1。幻灯片准备为核型分析
- 玻片(VWR International的高级显微镜载玻片,英国)都准备在染色体协议,由他们过夜放置在一个大容器(玻璃)的硫酸。
- 幻灯片,然后放置下运行8小时的自来水,和70%的乙醇,然后在需要保存,直到。
- 在使用之前,幻灯片应冲洗下运行,另有30分钟的自来水,并在室温1-2小时风干
3。从胚胎中建立主微植文化
三小鼠品系都是用来验证这种方法,野生型(C57BL/10)MDX和CAV3KO(包括营养不良的突变体)。 C57BL/10的dystrophin缺乏mdx小鼠起源于自发的,此行获得了从Bullfield实验室于1991年,并一直持续保持在我们的自交系殖民地26。 CAV3KO营养不良小鼠,其中包含一个小窝- 3基因的突变,繁殖到10代C57BL/10背景前,在这项研究中 27使用。每个鼠标线产生了强劲重现的生长,增殖和生存状况,这是萌芽阶段,具体的,每一株不同。胚胎从史密斯菲尔德PN(1994)3,基本上是在梅里克21以下协议进行了调整。
3.1。胚胎收集
- 为了取得上演的胚胎,对设立自然(1:1)交配和女性每天早晨检查阴道塞。在一天插件检测,胚胎算作E0.5天(受精后12小时)。
- 一旦被检测阴道塞的男性是从笼中删除,以确保胚胎分期的准确性。
- 当达到所需的萌芽阶段(E11.5到E17.5)的母亲是由颈椎脱位处死,剃腹部,皮肤及周边地区,用70%酒精擦洗,并通过横向腹部切口移除子宫使用无菌解剖仪器。
- 然后洗净子宫是在小学外植体培养基(PECM)前被放置到一个小的菜含有新鲜PECM前清扫一次。
- E11.5到E17.5胚胎从使用解剖显微镜的子宫解剖,并单独放入的Petri PECM菜,准备详细的显微解剖。
3.2。胚胎显微切割
- 个别胚胎进一步解剖隔离地区丰富的骨骼肌( 见图2a)。后肢和前肢(hypaxial骨骼肌)是解剖,以及上部和更低的体壁(主要是epaxial骨骼肌)。为了做到这一点切口,沿胸部的长度,腹部和盆腔创建,让内部器官的胚胎被删除。
- 为了丰富胚胎骨骼肌干细胞(eSMSc),头部,脊髓和所有的内部器官,然后删除。
- 在旧的胚胎(E15.5 - E17.5胚胎),它也可以清除皮肤和软骨/骨,再增加在文化肌肉细胞的比例。
3.3。设置胚胎Microexplant文化
- 一旦前肢,后肢和上下身体墙壁已被解剖出他们放置到新鲜PECM进一步显微切割产生大小相等(〜0.5毫米3; 图2a)组织的小立方体。
- 这些microexplants然后放入中心60口井的一个96孔板,每孔含50μLPECM(每口井植体)。建立至少60含1外植体井每口井,每胚胎研究。
- 为培养胚胎中心60口井可分为表示外植体( 图2b)派生的地区。这样的设计让每片含15口井,分别上身墙,前肢,后肢和较低的体壁植 21 。
3.4。监测的产物
生长率,是一个可靠的胚胎骨骼肌植增长率措施,并在这里所描述的精心控制的条件下是高度重复性。
- 外植体在37℃孵育° C和5%CO 2,连续3周和第三,第七,第14和第21天的培养,使用倒置显微镜评分。植得分根据细胞汇合在每一个人( 图3A,E)的水平。
- 可以采取的摄影作品的文化,例如,使用单反相机连接到显微镜和100 ASA富士(彩色)或柯达TMAX(黑色和白色)专业电影( 图3F)。
- 骨架肌肉特异性抗体MYF - 5具体可用于演示的eSMSc骨骼肌起源,取决于MYF - 5积极应变80 95%的细胞隔离使用这种方法。其他标志物,如MyoD与大同7也可以用来证明这些细胞群的骨骼肌的起源。虽然这些细胞中含有一个胚胎骨骼肌它不能假设(尤其是年轻的胚胎),他们是所有骨骼肌的起源,他们都干细胞的干细胞的比例非常高。为了分离出纯的干细胞群,它是必要的克隆派生小学外植体培养,如2.1节中所述。
3.5。传代培养初级胚胎植
一旦融合,显示SMSC( 图3F)的形态特征植文化可以传代,21如下3:
- 从选定的井,采用0.2微米Acrodisc R_注射器过滤器过滤培养基中删除,并保留使用条件培养基。存储介质可以在4 ° C,1个星期。
- 100μLPECM dispase稀释1:10,每孔加入和板块,然后返回为20分钟到37℃培养箱。
- 一个枪头,然后轻轻刮去以及表面的细胞松动。
- 然后将细胞悬液离心3分钟沉淀细胞,并删除和丢弃上清液1000克。
- 细胞重新悬浮于200μL的条件培养基和PECM 1:1混合。
- 细胞结构转移到48孔板为进一步扩大。
- 对于在体外的分析细胞,可镀密度5 × 10 3细胞/ 厘米 2无论是在48孔板(每片含9 毫米 2无菌玻璃盖玻片),或在8玻璃玻片。分化分析细胞过夜50-60%汇合,然后他们被转移到分化宽容的介质(在体外方法的详细信息, 请参阅第4节)3天前,固定。
在骨骼的肌肉干细胞和原代培养的体外分析4。
4.1。单元的制备
- 镀PECM /空调中型Dispase传代(3.3节 )主胚胎植体培养到48孔板中的盖玻片在3 × 10 3细胞/平方厘米的密度和允许连接。
- 对于评估细胞凋亡和增殖盖玻片用PBS洗两次,固定在4%多聚甲醛的PBS( 见4.2节)在室温下20分钟,通过进一步的10分钟PBS洗。
- 盖玻片准备PBS或PBS /甘氨酸1周,这样可以保存在4 ° C。
4.2。多聚甲醛固色剂的制备
- 在通风橱中,重4克多聚甲醛(PFA; Sigma - Aldrich公司,英国),并添加一个玻璃瓶100毫升无菌PBS,用磁力搅拌器。应戴口罩和手套进行保护。
- 在通风橱中,该解决方案是一个磁电磁炉上加热,不断搅拌,直到粉末溶解。这需要花费约5-10分钟在65 ° C必须小心,以防止温度上升超过70℃,在高温下发生爆炸的解决方案是有风险。
4.3。细胞凋亡和增殖实验
- 固定盖玻片(在4.1节准备)与10μg/ mL的3分钟的DAPI染色。
- 盖玻片在PBS(5至10分钟)洗一次,到vectashield固定在玻片上17,18中等当场倒。
- 盖玻片的边缘密封指甲油(见注12)。
- 储存,幻灯片在铝箔包裹,放置在20 ° C
- 用于计数,幻灯片被视为一个堂堂正正的显微镜下荧光(紫外线过滤器)和计分使用目镜刻度的细胞凋亡和有丝分裂。二十随机分布的网格计算(相当于〜1000细胞),细胞形态特点非凋亡,凋亡或有丝分裂(图3克) 。
- 有丝分裂和细胞凋亡指数计算细胞总数的比例。
4.4。免疫组织化学
将盖玻片固定细胞也可用于免疫组化。抗原使用检索压力锅盖玻片必须牢固地附着在玻片上,用标准的回形针。免疫染色可用于识别增殖细胞,使用一种抗体,Ki67的(1 / 1,000稀释),确定身份,使用一种抗体MYF - 5(1 / 1,000稀释),或以研究基因表达(见第4.5节 )。免疫染色可以实现用了许多方法,下面的(在(28,29)描述)是用于常规作者:
- 柠檬酸钠缓冲液预先加热的压力锅。抗原检索,包含切片组织的幻灯片放入加热缓冲区和2分的压力下加热。压力是通过牢牢锁定压力锅上的盖子和配售的重量。检索时间已经过去了2分钟后,高压锅,然后小心地放在运行冷的自来水,以减少压力下。为了防止缓冲区沸腾起来,应小心不要取下盖子,直到压力与大气压力均衡。压力是足够的重量时可以轻松地删除(力)和盖子去掉减少。幻灯片,然后从缓冲区中删除,并在室温下PBS冲洗10分钟。
- 幻灯片前阻止沉浸在3%的双氧水/自来水水5分钟,然后洗净PBS洗3次+ 0.05%吐温20(每洗10分钟)。
- 阻塞是通过在TNB的封闭液室温孵育30分钟(TSA的套件提供)。
- 主要抗体是TNB的缓冲稀释到适当稀释(抵达滴定,见注12)在4℃孵育过夜° C(或在室温下或者1至2小时) 。
- 经过3个10分钟的PBS洗+ 0.05%吐温20,幻灯片1在适当的生物素标记的第二抗体稀释缓冲国能在室温下孵育。
- 进一步三个10分钟的PBS洗+ 0.05%吐温20,幻灯片孵育30分钟,在TNB的缓冲液1:100稀释的链霉亲和素- HRP(在TSA试剂盒提供),然后洗3次(每10分钟)在PBS + 0.05%吐温20。
- Biotinyl酪胺(扩增试剂; TSA的套件),然后添加到每节为8至15分钟(应通过优化实验获得精确的时间)。
- 扩增后,洗幻灯片三次(10分钟)在PBS + 0.05%吐温20,然后孵育30分钟的SA - HRP。
- 以下三个进一步清洗(10分钟)在PBS + 0.05%吐温20,可视化使用3,3 - 二氨基tetrahydrochloride显色(DAB)5至10分钟。 counterstaining苏木幻灯片和coverslipping之前,然后进行最后两个水清洗。民建联是一种已知的致癌物质,应谨慎处理(如秋水仙碱, 第3.2.2节 )。
4.5。分化
- 镀到盖玻片或玻片(见注13)SMSC也可以分化为肌管分析前固定。
- 对于这些实验中,细胞接种于10 4 / cm 2的密度,并允许连接为6至8小时。
- 细胞,然后切换到宽松的条件下分化为3天(见注14)。
- 分化培养基组成的DMEM + 0.5%FCS的2%马血清,1%谷氨酰胺的补充。这种差异的宽容的文化媒介取代在48小时的间隔。
- 盖玻片,然后固定在4%多聚甲醛为上述(第3.4.1和3.4.2 )。
4.6。 SMSC:转的转基因表达和shRNAi构造
干细胞和原代培养转染耐火材料和SMSC和小学的骨骼肌细胞的转染率与广大的方法是非常低(<10%),防止利用瞬时转染方法。为了克服这种隔离转基因转染的文化(见3.2.1节 )以下磷酸钙或脂质体转染克隆的衍生物,它已经在我们的实验室标准的做法。另外,细胞可以有效地转用感染病毒包装结构。图1米显示了稳定的β-半乳糖苷酶的表达,在PD50A,克隆SMSC衍生G418筛选的感染与pIRV,复制下隔离有缺陷的逆转录病毒携带的基因neo/G418抵抗和β-半乳糖苷酶(19)。该细胞系是用于正式证明,SMSC功能的干细胞在体内的行为(参见图3.1)。虽然产生一个稳定的克隆细胞表达一个标记基因在体内的干细胞移植实验可取的, 它是一种在体外基因功能分析的耗时和不理想的方法。由于这些原因,作者最近开发出一种脂质体2000转染试剂,是能够提供60%至70%的转染率的优化修改。这允许使用外源基因或RNAi的瞬时转染的基因功能分析的构造成SMSC或小学外植体培养( 图3H,I)。作者用一个短发夹RNAi载体(pSHAG RNAi)技术(30)产生shRNAi结构能够在SMSC mRNA表达的基因特异性针对的。 shRNAi技术的成功取决于两个因素:(一)一个有效的转染法及(b)一个明确承认的靶基因的短发夹序列的设计。一个shRNAi的eGFP可以用来验证的RNAi敲除方法( 图3J,M)的构造。
4.7。优化LipofectamineTM 2000转SMSC协议
- 细胞是镀在5至10 4细胞/厘米到玻片2 250μL的DF10培养基培养18小时,达到95%汇合时(每个细胞系的最佳汇合,成立评估在不同密度的转染率)。
- 每口井,0.5微克的DNA(shRNAi载体,转基因)被添加到33μL无血清DMEM 2毫米谷氨酰胺和补充,在无菌Eppendorf管中轻轻混合。
- 每口井,1.25μL脂质体2000分别在33μL无血清培养基DMEM培养液+谷氨酰胺稀释,轻轻混合,在室温下保留5分钟
- DNA和脂质体混合,然后迅速加在一起,混合60秒轻轻吹打,然后在常温下为19分钟培养,让2000年的DNA脂质体复合物形成。
- 转染,66μL复杂的混合添加到每个室和幻灯片轻轻摇晃10秒,以确保复合物的平等分配。
- 细胞培养24至72小时,在37 ° C和5%的CO 2 。首次发现在8和24 h后转染不同的构造,功能基因的表达或shRNAi击倒。
5。代表性的成果
当植仔细explanted从成人骨骼肌或从胚胎植将开始产生细胞在几个小时内,在37至72小时的孵化° C(5%CO 2 /空气)( 图3A) 。出现这种情况所采取的时间取决于植源:胚胎植会比年长的成人骨骼肌植长大了更快速。根据我们的经验生长的时机是高度重复性3,29 。细胞群的扩大会发生在一个时期(胚胎植)天或数周(旧的骨骼肌肉植),聚合短信原代培养细胞产生高密度(见图 3B - F说明这些文化)。图 1和3显示成功推导和骨骼肌和胚胎植,克隆推导和在体内的骨骼肌移植的成人干细胞,β-半乳糖苷酶标记,染色体和免疫组织化学胚胎SMSC MYF - 5的说明骨骼肌起源文化的代表的结果的细胞群图3显示了一个代表性的产物得分结果(使用MYF - 5免疫组化,可视化SMSC)的胚胎肌肉的主要细胞的形态; DAPI染色细胞凋亡和shRNAi转协议。进一步的细节,可以发现图中的这两个数字有关的传说。图2显示了从胚胎微解剖过程生成的胚胎骨骼肌干细胞的丰富的人口。
表1:计算表,估算下来的协议最大的细胞活力细胞冻结期间所需的冷冻管数量
| 板/瓶/腔幻灯片 | 培养液的体积 | PBS洗 | 胰蛋白酶的体积 | 冻结下来小瓶(3.1.2) |
| 96孔 | 50微升 | 2 × 100μL | 25μL | N / A |
| 48 | 150μL | 2 × 200μL | 50微升 | N / A |
| 24 | 500μL, | 2 × 700μL | 200微升 | N / A |
| 6 | 3 MLS | 2 × 3 MLS | 500μL, | 1 |
| 小(25厘米2) | 10毫升 | 2 × 10 MLS | 1毫升 | 2 |
| 中等(80厘米2) | 10毫升 | 2 × 10 MLS | 3 MLS | 4 |
| 大(175厘米2) | 10毫升 | 2 × 10 MLS | 5 MLS | 8 |
| 商会以及 | 500μL, | 2 × 500μL | 100μL, | N / A |
N / A =不适用;细胞数量过低冻结下来,除非多口井被冻结了一起。
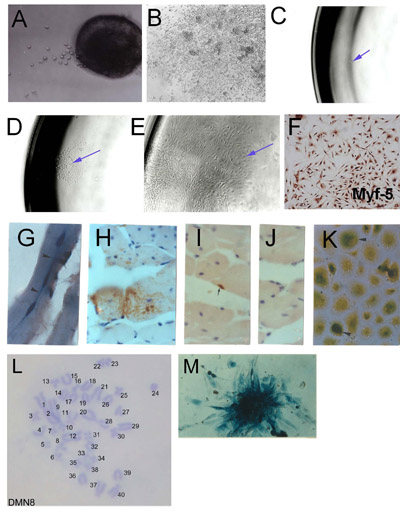
图1。 microexplants(SMSC)的骨骼肌干细胞的分离:(一)早期生长explanted成人骨骼肌(2天)(b)规定的外植体生长聚集的文化和高密度。 SMSC克隆推导。(三)单细胞分离成96孔板(四)单细胞起源的殖民地。(五)(六 )建立无性系种群。SMSC使用MYF - 5免疫组化的身份验证。从克隆PD50A SMSC(表达β-半乳糖苷酶)在3个月的主机小鼠(G)和(HJ)源性细胞2000 PD50A细胞到小鼠胫前肌,注射后14 个月(七)最近三个融合(位于市中心核)β-半乳糖苷酶阳性细胞(蓝染色)在肌纤维(纵切面)(H)广泛的贡献,β-半乳糖苷酶阳性细胞在肌纤维(棕色染色,抗β-半乳糖苷酶抗体检测)(横截面)(I)β-半乳糖苷酶阳性的卫星细胞(棕色染色,抗β-半乳糖苷酶抗体检测)(J)第二抗体控制(无染色)(K)的β-半乳糖苷酶阳性细胞(蓝染色)文化增殖注入宿主肌肉中分离时,注射后12个月(L)鼠标克隆SMSC线,显示正常的二倍体染色体补充(M)组织化学显示PD50A细胞的殖民地中的β-半乳糖苷酶的表达( DMN8)的染色体核型( 图3.1 G,K,按美国癌症研究学会,史密斯和斯科菲尔德,1997年)的许可转载。
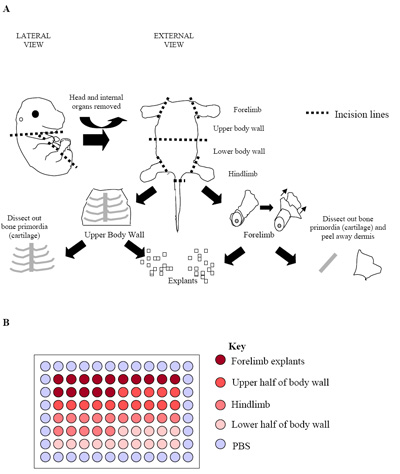
图2。 (一)胚胎清扫过程中的插图。数字代表一个E15.5胚胎骨的原始(软骨)可以很容易地被识别,周围的骨骼肌肉组织解剖。 (二)在这个阶段,并在以后阶段的胚胎(E15.5 E17.5),真皮也删除,以最大限度地提高骨骼肌细胞的比例。的小学外植体培养在96孔板的安装。每个胚胎被用来产生一个盘子,上面看到的。通常的做法是三个独立的胚胎(三大板块= 180井)复制建立生长率的板。
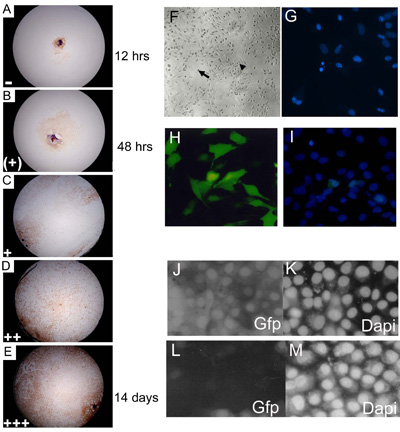
图3。 3,7,14和21天的文化取得初级胚胎植体培养和分配水平汇合的产物水平的代表 。 15 24%(+); 25 49%(+),50 74%(++); 75 100%((AE)的 C57BL10 E15.5初级胚胎植体文化MYF - 5染色说明0 14%() + +)水平汇合。整理数据之前显示每个产物的水平井(每一天的得分)比例乘以一个任意数量(= 1(+)= 2; + = 3; + + = 4和+ + = 5)给予最终的产物价值。大约85%的野生型(C57BL/10)小学eSMSc染色骨骼肌细胞标记MYF - 5。放大倍数为10, 水平高(F)的成人SMSC,双极细胞(小箭头)和球面(大箭头)单形细胞,建立胚胎文化的形态特征(G)使用DAPI染色的凋亡细胞核碎片的鉴定(您好) (〜75%)到SMS使用优化脂质体2000转染法(一)细胞总数计数的细胞线构建表达GFP的转染资助的DAPI染液。 RNAi的使用pSHAGshRNAigfp(JM)取消(看到这个构造控制使用的一个例子(29))SMSC GFP的表达。(J)的控制(模拟转)显示绿色荧光蛋白表达的 GFP SMSC(K)的DAPI控制(L)的 shRNAiGfp 24 h后转染(M)的DAPI控制shRNAiGfp转染细胞(L)。
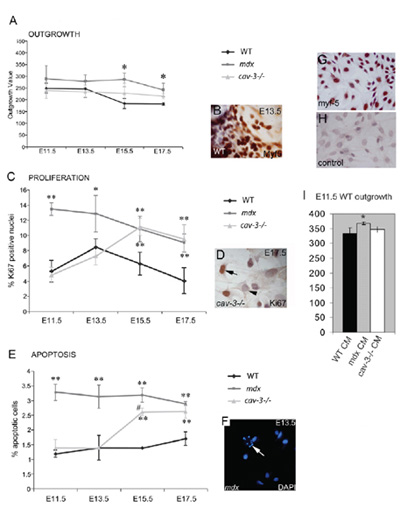
图4。营养不良,胚胎Myf5阳性的成肌细胞凋亡hyperproliferative和容易发生 。 (一)从肌肉外植体培养的胚胎成肌细胞的生长率,我(三)小号与并行培养野生型植相比,增加E11.5 MDX CAV - 3 (-/-) E15.5和E17.5突变体的突变体,并在(B)一个Myf5免疫染色外植体。 Ki67的阳性免疫反应(四 )决定从E15.5,E11.5 MDX CAV - 3 (-/-)突变体的突变体,并在胚胎成肌细胞过度增殖(E)从E11.5高架凋亡MDX胚胎E15.5 CAV - 3 (-/-)胚胎,DAPI染色(六)所示,在F点的箭头细胞凋亡。 * P <0.05相比,与WT; ** P <0.01与WT相比,* P <0.05时比较CAV - 3 (-/-)(G,H)MDX E15.5原代培养的WT Myf5染色胚胎成肌细胞。 (G)和第二抗体(H)(一)E11.5野生型外植体的生长率提高(* P <0.05)E11.5 MDX植条件培养基(CM),但不CAV - 3 (-/-)或WT厘米。误差线显示SD这个数字是根据作者的版权复制和梅里克等人,2009年的生物学家公司首次公布。
6。注:关键步骤和可能的修改
- 解冻时细胞附着在细胞密度非常低,它是审慎的做法,以取代只有一半的介质,以防止文化崩溃。
- SMSC是从营养不良的肌肉中分离容易凋亡,必须特别小心处理。营养不良性SMSC(如DFD - 13细胞系,这是从5周龄营养不良(MDX)小鼠骨骼肌获得)应成长为成肌细胞较正常细胞密度较高。这种凋亡敏感的细胞株也冻存在更高的密度(见第1.1和1.2)(19)。
- 一种替代方法去除细胞单层dispase,它提供了一个温和的方法,细胞分解,它可以在FCS和钙(目前都在DF10)存在的优势与利用。 Dispase因此可以用于亚文化,扩大骨骼肌外植体的主要文化和earlystage SMSC克隆(见第2和第3)。
- 对于较大的烧瓶中的胰蛋白酶/ EDTA的使用量应扩大如下:75毫米2瓶(3毫升胰蛋白酶)和175毫米2瓶(5毫升胰蛋白酶)。较小的表面区域,同样减少胰蛋白酶的使用量(见表1)。
- 另外,离解可以监控使用倒置显微镜,这是建议初学者。
- 超低温冷冻保存的细胞株是通常使用一个融合的大(175 毫米 2)塑料容器进行。 7和9之间的离心管,可从一个这样的大型船只,根据被冷冻保存的细胞株的生存状况。小学文化和新建立的细胞系往往是非常顽固性冻结程序。为了提高复苏和成功地冻结了这种细胞可以使用两种方法(单独或合并)。 (一)的冻结下来的混合物FCS含量可提高10%(最多50%)。 (二)冻结下跌过程中,放置12-24 h的离心管中的N2的气相液相转移小瓶之前可以放慢。
- 一个方便的方法来检查公司haemacytometer盖玻片附件是看牛顿环(彩虹在玻璃反射)盖玻片,或者持有一个开放的haemacytometer倒挂。
- 块法的变化,可以采用短期使用免疫组织化学,细胞增殖或凋亡检测的文化。显微切割外植体放置在玻璃使用8玻片。另一种方法是使用9毫米2盖玻片,放置在24孔板。两个植在这两种情况下被转移到每口井在150μLDF20培养基。另外,小学文化,可传代dispase方法镀上盖玻片放入24孔板或直接进入8玻片。
- 生长率的定量分析至少60含有1个外植体,每井成立,每肌肉/小鼠品系。建立一个至少有三个单独的动物必须使用的应变生长参数。板和个别井而被砍下的产物,是不喂。
- 克隆SMSC线就足够了文化的单细胞在条件培养基和DF10培养基1:1混合。对于小学外植体,它是必要的培养基中的血清含量增加20%。
- 秋水仙素是剧毒和已知的致癌物质,并应适当照顾处理。双gloving和在指定的纸盘内工作是必不可少的。所有的一次性(即吉尔森提示)放置在烧杯中的漂白剂(5%次氯酸钠)隔夜出售大量的水以下翼天前。
- 我们目前使用的每一个特定Ki67和MYF - 5的主要抗体在1 / 1,000稀释。初级抗体的最佳稀释需要凭经验建立每个要使用不同批次相同的抗体的理想也的抗体,即使来自同一来源获得。
- 玻片也可以用于这种检测。之前在4%PFA固定细胞,培养基中被删除,细胞37◦彗星无菌PBS洗两次。以及商会,垫片和胶水将被删除,玻片置于50 mL玻璃Coplin中含有新鲜配制的4%多聚甲醛在室温下,然后轻轻地震撼25分钟的一个陀螺仪跷R_摇床JAR。幻灯片,然后洗两次在PBS(室温),要么立即使用或存储在PBS在4◦C(短期1-2周),免疫组织化学(IHC)分析。
- 如果需要更广泛的肌管的形成是原发性骨骼肌细胞可长达8天的区别。
讨论
可用于显微切割外植文化,可靠和可重复隔离含有相当高的比例(〜85%)的增殖MYF - 5积极的骨骼肌干细胞(SMSC)的细胞群。严格控制培养条件下小学外植体培养,可以用来描述基因突变的小鼠SMSC的生长行为,并可以作为手段在体外分化过程的分析详细的肌管使用。精心维护和操纵这些文化,使长期培养和扩张。使用这里介绍的方法也可以推导出由单细胞稀释克隆骨骼肌干细胞株,植文化。要达到的孤立的单细胞的增殖,在克隆过程中的“条件培养基”是用来模拟这些细胞的高密度养殖的正常要求。该方法适用(修改),胚胎,成年和老年成人组织,除了鼠标可以用来隔离来自其他物种的骨骼肌肉细胞,包括人类(饶和史密斯,未发表),鸡胚和鱼(鲑鱼)24。克隆衍生SMSC可以通过肌肉注射移植在体内进行分析,并在这些条件下注入SMSC将与主机肌管结合起来,形成混合肌纤维。肌肉注射SMSC不形成肿瘤,并已发现主机肌肉在注射后一年多的卫星单元格的位置,这表明它们是卫星干细胞niche.These的细胞内对照可从注入隔离主机超过12个月后增生SMSC主机注射19。
披露声明
致谢
我们感谢他shRNAi穿梭载体的天赋帕特里克Paddison。安吉拉斯隆产生GFP RNA干扰图像, 如图 3 。我们也感谢下面的供资机构的支持:
肌肉萎缩症运动授予RA2/592/2;火花授予02BHM04,英国皇家学会授予数量574006.G503/1948./JE和BBSRC授予数量6/SAG10077。
材料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
参考文献
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。