需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
无标签原位成像在植物细胞壁的木质化
摘要
基于共焦显微拉曼光谱方法是给予无标签的可视化在植物细胞壁的木质素和木质化比较在不同的组织,样品或物种。
摘要
满足日益增长的能源需求安全,高效,是一项紧迫的全球性挑战。因此,为生产生物燃料的研究,力求找到符合成本效益和可持续的解决方案已经成为一个局部和关键任务。将木质纤维素生物质的液体生物燃料1-6转换成为生物质的主要来源。然而,这些植物细胞壁材料的顽抗,以成本效益和高效率的降解,在生物燃料和化学品4的生产供其使用的一个主要障碍。特别是,木质素,聚苯丙heteropolymer一个复杂和不规则,成为问题的木质纤维素生物质的采后解构。例如,在生物质转化为生物燃料,它能够抑制糖化,目的是简单的糖发酵7生产的进程。用于工业用途的植物生物量的有效利用,其实在很大程度上依赖,植物细胞壁的木质化程度。去除木质素是昂贵的和限制因素和木质素,因此成为一个重要的植物育种和基因工程的目标,以改善细胞壁的转换。
评估大量的繁殖种群,允许植物细胞壁的木质化的快速准确的表征的分析工具变得越来越重要。本机组件,如木质素的分离提取过程是不可避免的破坏性,带来显着的化学和结构修改9-11。分析化学原位方法,因此木质纤维材料的成分和结构表征的宝贵工具。拉曼光谱是一种技术,依赖于无弹性或拉曼散射的单色光,如激光,在激光光子能量转变为分子振动,并提出一种内在的无标记分子的“指纹”的样本。拉曼显微镜可以承受最小的样品制备和相对低廉的非破坏性测量,给人以接近原生状态转化为化学成分和分子结构的见解。化学共焦显微拉曼光谱成像先前已用于可视化的空间分布在木材细胞墙壁12-14中的纤维素和木质素。基于这些早期的结果,我们最近通过这种方法比较野生型和木质素缺陷的转基因杨树毛果(黑三角叶)干木材 15木质化。分析木质素拉曼带在1600和1700 cm - 1处,木质素的信号强度和本地化之间的光谱区域 16,17 映射到原位。我们的方法可视化木质素含量的差异,本地化和化学成分。最近,我们展示了在拟南芥细胞壁聚合物的拉曼成像横向分辨率,亚微米 18 。在这里,这种方法是在植物细胞壁的木质素的可视化和木质化比较在不同的组织,样品或物种affording无染色或组织标签。
研究方案
1。样品制备
- 摩水合植物样品,如杨树干木, 拟南芥干,在切片机。
- 从本地组织切薄片(一般为20微米厚)。
- 工厂部分转移到玻璃显微镜幻灯片。
- 浸泡在D 2 O的植物部分,并盖上玻璃盖滑,这是在显微镜玻片上,密封,以防止蒸发的D 2 O现在,该厂部分成像,也可以保存供日后使用。
2。样品测定
- 应用浸油,显微镜物镜和/或盖玻片。
- 地点和安全显微镜幻灯片上的压电扫描显微镜阶段,面临的显微镜物镜盖滑。
- 查看通过使用高数值孔径的浸入式显微镜的物镜盖滑(100X,NA = 1.40)的样品,并找到感兴趣的的样本区域。
- 关闭所有其他实验室和显微镜的光源后,位置解决microspectroscopic测量带通过滤单色绿光(λ= 532 nm)的10至30兆瓦的一个典型的功率从CW激光聚焦到样品(设置示意图见图1)。自体荧光可以在一些样品中出现,这可能会禁止有用的测量,在这种情况下激发波长更长的激光灯可能是明智的。
- 斯托克斯位移的背散射的喇曼光显微镜物镜收集,经过分色镜,针孔,作为一个空间滤波器在共聚焦设置,和一个长通滤波器,并集中到一个光栅狭缝光谱仪,光频谱分散和检测冷却CCD相机,给人一种拉曼光谱。一个杨木的拉曼光谱如图2所示,在1600和1700 cm - 1处的谱区的特征木质素乐队。
- 化学成像和可视化的空间木质素分布,二维光谱图获得通过光栅扫描的样品通过激光聚焦压电扫描阶段和记录了每个样品位置的拉曼光谱。三维光谱图,可能会产生堆叠二维激光连续沿z方向的重点是加强地图。
3。数据分析
- 化学成像和木质素的可视化,分析收集到的数据是用MATLAB(MathWorks公司,7.7版)。数据被安排在一个三维的光谱立方体,这是两个空间尺寸和光谱信号的第三维组成。
- 木质素的分析,1550和1700 cm - 1处的谱区(见图2) 。木质素的空间分布是由可视化相结合的力度,从1550到1700厘米-1的基线校正光谱(见图3 )。作为替代基线校正,可能是计算二阶导数光谱用于分析的二阶导数峰。
- 木质素本地化和化学,特别是关于coniferaldehyde和松柏醇基团,可进一步分析评估下安装高斯峰之间的1600和1700 cm -1处发现了三个波段的区域(参见图2和文献15的插图。 - 17)。
- 强度不同的光谱图之间的正常化是外在外径伸缩振动峰高约2500 厘米 -1平均流明的光谱,这是获得通过的K - means聚类分类作为参考使用。这是至关重要的,允许一个比较不同的测量方法,组织,样品和物种之间的木质素信号强度。
4。代表性的成果
杨树( 胡杨沙枣 )干木材的有代表性的拉曼光谱如图2所示。特色木质素带发现在1600和1700 cm - 1处的谱区。作为一个例子,木质素在杨树木材的横截面的空间分布图3。与可见光图像相比,形态不同的细胞壁地区变得清晰可辨,这是由于不同的木质素信号强度。高木质素的信号强度在细胞内的角落(CC)的观察,少了几分,在大院中间的片状(CML)。数额较低,但不单薄,木质素纤维的S2墙层内观察。木质素信号强度变异被发现在一定程度上,特别是从光纤到光纤内消委会,慢性粒细胞白血病和S2。在我们的测量横向空间分辨率为〜300纳米。数据质量非常适用之间比较木质化样品和进一步剖析木质素化学15。
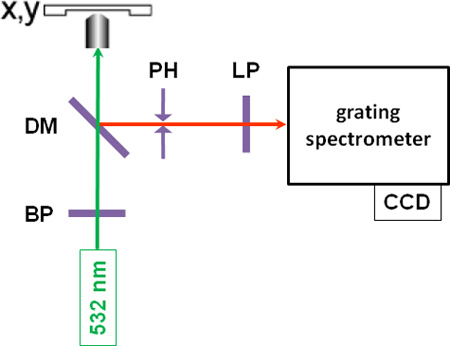
图1:血压的仪器设置的一个原理 :带通滤波器;马克:分色镜,PH值:针孔; LP:长通滤波器。
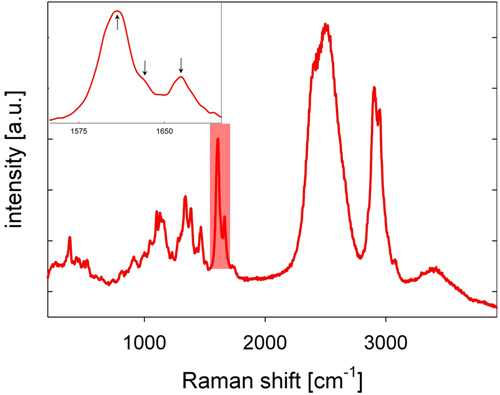
图2:杨树干( 胡杨沙枣 )在D 2 O的木材有代表性的拉曼光谱。突出显示的光谱区(另见插图),标志着有三个峰的归属,以木质素的光谱区域。

图3:一个杨木截面的拉曼木质素形象(下)(顶:可见光图像),通过整合从1550到1700 cm - 1处的拉曼信号强度获得 。
讨论
木质纤维素材料的层次和异构的结构和组成方面。在深入刻画的分析工具,化学灵敏度,空间分辨率,而且这些材料在本地范围内的见解是可取的。所描述的方法,让该可视化与空间分辨率,是亚微米无染色或以接近原生状态的样品标签木质纤维植物生物量的木质化,木质素和比较。它需要最少的样品制备和测量都是非破坏性和相对低廉。该方法可在评估大量的繁殖种群的木质化的有用。此外,?...
披露声明
致谢
我们感谢安德鲁卡罗尔,明亮Chaibang,Purbasha萨卡(伯克利分校能源生物科学研究所),巴赫拉姆Parvin(劳伦斯伯克利国家实验室)和Vincent L.蒋(北卡罗莱纳州立大学)进行富有成效的合作和有益的讨论。这项工作是支持的能源生物科学研究所。在分子铸造的工作是支持由美国能源部科学办公室基础能源科学办公室的,根据合同号DE - AC02 - 05CH1123。
材料
| Name | Company | Catalog Number | Comments |
| microscope slides | |||
| cover slips | |||
| D2O | |||
| nail polish | |||
| immersion oil | |||
| tweezers | |||
| pointed brush | |||
| microtome | |||
| confocal Raman microscope |
参考文献
- Herrera, S. Bonkers about biofuels. Nat Biotechnol. 24, 755-760 (2006).
- Himmel, M. E. Biomass recalcitrance: Engineering plants and enzymes for biofuels production. Science. 315, 804-807 (2007).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54, 559-568 (2008).
- Pauly, M., Keegstra, K. Physiology and metabolism 'Tear down this wall. Curr Opin Plant Biol. 11, 233-235 (2008).
- Ragauskas, A. J. The path forward for biofuels and biomaterials. Science. 311, 484-489 (2006).
- Somerville, C. Biofuels. Curr Biol. 17, R115-R119 (2007).
- Ralph, J., Brunow, G., Boerjan, W. . Lignins in Encyclopedia of Life Sciences. , (2007).
- Chiang, V. L. From rags to riches. Nat Biotechnol. 20, 557-558 (2002).
- Atalla, R. H., Agarwal, U. P. Raman microprobe evidence for lignin orientation in the cell walls of native woody tissue. Science. 227, 636-638 (1985).
- Atalla, R. H., Agarwal, U. P. Recording Raman spectra from plant cell walls. J Raman Spectrosc. 17, 229-231 (1986).
- Fukushima, K. Regulation of syringyl to guaiacyl ratio in lignin biosynthesis. J Plant Res. 114, 499-508 (2001).
- Agarwal, U. P. Raman imaging to investigate ultrastructure and composition of plant cell walls: distribution of lignin and cellulose in black spruce wood (Picea mariana). Planta. 224, 1141-1153 (2006).
- Gierlinger, N., Schwanninger, M. Chemical imaging of poplar wood cell walls by confocal Raman microscopy. Plant Physiol. 140, 1246-1254 (2006).
- Gierlinger, N., Schwanninger, M. The potential of Raman microscopy and Raman imaging in plant research. Spectrosc Int J. 21, 69-89 (2007).
- Schmidt, M. Label-free in situ imaging of lignification in the cell wall of low lignin transgenic Populus trichocarpa. Planta. 230, 589-597 (2009).
- Agarwal, U. P., Argyropoulos, D. S. An Overview of Raman Spectroscopy as Applied to Lignocellulosic Materials. Advances in Lignocellulosics Characterization. , 201-225 (1999).
- Agarwal, U. P., Ralph, S. A. Determination of ethylenic residues in wood and TMP of spruce by FT-Raman spectroscopy. Holzforschung. 62, 667-675 (2008).
- Schmidt, M. Raman imaging of cell wall polymers in Arabidopsis thaliana. Biochem Biophys Res Comm. 395, 521-523 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。