需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用丙烯酰胺水凝胶的细胞功能的研究矩阵刚度的影响
摘要
可以仿照下层刚度对细胞功能的影响在体外使用不同的符合标准的聚丙烯酰胺凝胶。
摘要
组织刚度,是一个重要的细胞功能因素,并组织刚度的变化通常与纤维化,癌症和心血管疾病的1-11的关联。传统的细胞研究细胞功能的生物方法涉及一个刚性基质上培养细胞(塑料餐具或盖玻片),它可以不考虑弹性ECM或流脑组织之间的刚度变化的影响。 在体内组织遵守的条件,在体外模型,我们和其他人使用ECM涂水凝胶。在我们的实验室,是基于水凝胶聚丙烯酰胺可以模仿生物12见过的组织符合。除了3 APTMS孵化用NaOH产生“反应”的盖玻片。戊二醛是用于交叉连接的3 APTMS和聚丙烯酰胺凝胶。用于水凝胶的聚合丙烯酰胺(AC),双丙烯酰胺(BIS - AC),过硫酸铵溶液。 N -羟基琥珀酰亚胺(NHS)是纳入交联的ECM蛋白凝胶交流解决方案。聚合凝胶,凝胶表面涂有流脑的首选,如纤维连接蛋白,vitronectin,胶原蛋白等蛋白质
水凝胶的硬度,可以由流变或原子力显微镜(AFM)和由不同的解决方案中的12的交流和/或双AC百分比调整。在这种方式下,下层刚度可以匹配生物组织的刚度,也可使用流变或AFM量化。细胞可以接种这些水凝胶和培养根据所需的实验条件。成像的细胞和分子生物学分析他们的恢复很简单。在这篇文章中,我们定义为那些有<3000帕斯卡与E和僵硬的组织下层/> 20,000帕斯卡的弹性模量(E)软下层。
研究方案
制备
- 盖玻片应高压灭菌。
- 应使用无菌蒸馏水或去离子水,准备解决方案和洗涤盖玻片。
- AC(40%W / V)和双AC(1%W / V)的解决方案是0.2微米的过滤消毒。不久之前使用无菌过滤,准备10%过硫酸铵(APS;100μg/ml水)。每月更换的APS解决方案。
- 不能进行高压灭菌,如3 APTMS,氯仿,戊二醛,NHS的,并SurfaSil化学试剂均保存在分配瓶仅用于水凝胶的制备。
- 凝胶为了达到最佳效果,应利用适当的ECM蛋白孵育过夜后一两天内。
- 在氯仿(10毫升通常足以供20个顶级盖玻片)的10%SurfaSil解决方案之前准备在50毫升聚丙烯猎鹰管的水凝胶的浇筑。 (我们的实验室通常siliconizes在0.5%戊二醛孵化步骤盖玻片)。添加盖玻片猎鹰管和岩石至少10分钟。倒出SurfaSil解决方案和空气干燥凝胶将准备在生物安全柜的盖玻片上Kimwipes。
- 准备热灭活的BSA溶液如下:PBS中的自由脂肪酸的牛血清白蛋白20毫克/毫升的解决方案是在一个68℃水浴30分钟孵育。解决的办法是无菌过滤,并保存在4 ° C
程序
- 广场上的一个150毫米的培养皿底部的半层的封口膜。
- 广场9 25毫米的封口膜顶部盖玻片覆盖1毫升0.1 M的氢氧化钠。孵育3分钟,然后吸真空线。
- 在化学罩,放置0.5毫升3 APTMS每个盖玻片工作。孵育3分钟,然后吸APTMS。如果等待时间过长,会形成泡沫。
- 在同一盘菜用20 ml去离子水冲洗盖玻片一次。菜用弯钳取出盖玻片和转移,其治疗面朝上,一个新的150毫米盘。盖玻片,摇杆去离子水清洗三次,每次洗10分钟。如果你不能消除所有的APTMS,它会在下一步与戊二醛反应,留下白色阴天的沉淀物(图1)。
- 解冻后的戊二醛(约10分钟),使用前。
- 用弯钳,转移到一个干净的菜用封口膜分层的盖玻片和吸任何剩余的液体。剩余的水,需要使用真空线或Kimwipe印迹。
- 完全相互覆盖盖玻片,用0.5毫升0.5%戊二醛灭菌去离子水孵育30分钟在化学罩。吸戊二醛。冲洗和洗的盖玻片,在第4步。完全干的盖玻片,[你可以停在这里,在干燥的地方离家数周的盖玻片 ] 。
- 当你准备准备的水凝胶,用弯钳,盖玻片,无朝上,转移到一个表的封口膜生物安全柜的表面,一直到录音。确保在盖玻片上的封口膜表面的平坦。
- 准备在甲苯饱和NHS的解决方案。 (在特定的实验足够甲苯溶解少量的NHS的不断增加位NHS位直到NHS的就不再溶解。饱和溶液通常是阴天和粉红色。)
- 下一步,准备丙烯酰胺,双丙烯酰胺,水和APS,以达到所需的丙烯酰胺的百分比。在离心管中添加如下所述总量的0.8毫升试剂。
- 然后,一次一个等份,加入NHS和TEMED 0.8毫升交流解决方案,涡简要立即倒入3-5凝胶在生物安全罩的使用140μL盖玻片。只要有可能,这一点从所有步骤应在生物安全柜。 [注:根据需要,可以利用不同大小的盖玻片。如果使用18毫米盖玻片,用〜33μL每盖玻片AC解决方案和一个18毫米的顶级硅化盖玻片的。]
双AC(%)0.3(僵硬) 0.15 0.06 0.03(软) μL μL μL μL 水 402 522 594 618 交流 150 150 150 150 双AC 240 120 48 24 APS 8 8 8 8 TEMED 1 1 1 1 NHS的 228 228 228 228 - 快速放置硅化25毫米盖玻片每个凝胶的顶部,然后才开始聚合。顶部盖玻片除应允许交流完全覆盖底部的盖玻片。在室温下孵育这种“三明治”,直到AC聚合。 (检查的离心管中残余的交流解决方案,以确定何时发生聚合。僵硬凝胶通常几分钟,一个柔软的长一点就足够了。)
- 小心地拿起三明治(无菌手套)和滑落,直到它出挑的聚合凝胶的顶端盖玻片。然后,您可以撬起它的凝胶。如果等待时间太长才卸下顶盖盖玻片,凝胶将RIP盖玻片被删除。
- 丢弃顶部盖玻片。放入2毫升PBS / 6孔板底部凝胶盖玻片(以下简称水凝胶)。 PBS可以添加之前或之后凝胶盖玻片每口井。 PBS洗3次冲洗水凝胶,摇杆,每洗5分钟。
- 重复步骤11-14,已准备,直到所需数量的水凝胶。
- 覆盖每一个纤维连接蛋白的解决方案(3微克/毫升的PBS)或其他ECM蛋白(Klein等详细信息,13。)2毫升水凝胶。 ECM蛋白成为在4 ° C共价键结合在孵育过夜水凝胶
- 吸的ECM解决方案和块1mg/ml的热灭活脂肪酸免费BSA的无血清培养基与未反应的NHS的至少30分钟,在37 ° C在细胞培养孵化器。一次冲洗水凝胶,用无菌PBS或细胞培养液中。
- 板细胞在适当的文化含有胎牛血清的介质。应由用户根据细胞扩散和进行实验所需的汇合程度的凝胶种子细胞的数量。约10 5个细胞通常是足够的免疫印迹和定量PCR分析。
- 潜伏期后,细胞蛋白或mRNA可以被提取。小心取出的盖玻片的井,用弯钳和100μL裂解液已间距沿实验室的长椅上的封口膜表(2 - 3cm的)的液滴上放置(细胞面朝下)。 (我们使用标准的SDS样品缓冲液和TRIZOL,分别准备样本免疫印迹和RNA的定量PCR隔离。)用了整整一分钟的裂解液培养的细胞。取出盖玻片和裂解液转移到离心管。或者仅适用于RNA的提取,用户可以转移到一个新的6孔板每个凝胶,并添加TRIZOL /1毫升。孵育3分钟,并删除存储在离心管TRIZOL解决方案。
如免疫程序的附加信息,BrdU染色,染等,对水凝胶的种子细胞是在克莱因等。 2007 13。
代表性的成果
彻底清洗的盖玻片APTMS除了产生“反应”的盖玻片的重要一步。如果一个人不能完全消除的APTMS,它会在下面的步骤与戊二醛反应和产生的白色阴天沉淀物,如在图1A所示。图1B显示正确的洗涤,干燥,盖玻片。如果沉淀物的发展,整个过程必须从头开始重新盖玻片不再可用。
水凝胶的形成及与ECM蛋白一夜之间涂层,种子细胞可翌日。如图2所示,硬与软凝胶的细胞扩散之间有一个明显的区别。可以看出,在小鼠胚胎成纤维细胞(MEFs)由鬼笔环肽染色细胞的扩散就僵在更大程度上较软凝胶。事实上,大多数细胞附着的软凝胶会保持紧凑,重视效率较低。
虽然只有MEF的形态,如图2所示,在细胞扩散的差异是一致的其他几个细胞株测试 11-12,14 。
成功的秘诀
- 一旦程序启动时,它是非常重要的,保持与“功”的一面的盖玻片,并记住哪一方被涂。
- 手套应戴在任何时间,在手术过程中提供的工作环境,也就是尽可能无菌。
- 大多数的最初步骤执行之间的化学通风柜,实验台。所有步骤,随后从盖玻片删除多余的戊二醛应执行下一个生物安全柜。
- 由于细胞中的差异蔓延(图2),我们建议僵硬的水凝胶相比,播种软凝胶的细胞数量的两倍。
- 交流聚合过程是非常快。对于首次用户,可以减少量的APS或TEMED的解决方案,以延长聚合过程中。不要尝试一次准备多几个盖玻片。
- 在G0同步需要在细胞周期研究中,我们通常血清饿死在塑料培养皿中的细胞,trypsinize细胞和补种不同符合水凝胶中存在的有丝分裂原(FBS和/或生长因子)。这个过程可以确保人口的G0同步细胞开始在所有样品相同。然而,对于许多信号转导的研究,所需要的有丝分裂原刺激期间可能没有足够长的时间,让细胞附着和传播。在这种情况下,我们血清饿死上的水凝胶的细胞,然后直接与有丝分裂原刺激。

图1A。不当洗涤盖玻片。APTMS此外,盖玻片洗涤1-2分钟,除了之前的戊二醛溶液。沉淀形式尚未洗净根据在程序中所述的步骤盖玻片。

图1b。洗净的盖玻片 。APTMS以下此外,盖玻片前三次,每次10分钟另外的戊二醛溶液冲洗。无沉淀形成的盖玻片上。
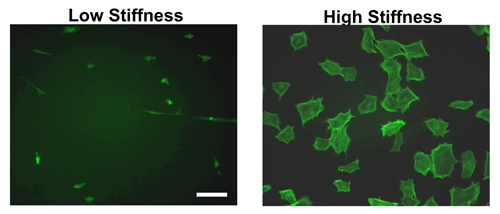
图2。不同刚度。凝胶细胞形态成立MEFs 9个小时的高或低刚度的纤维连接蛋白涂层凝胶种子。潜伏期后,细胞固定,透和F -肌动蛋白结合的FITC -鬼笔环肽染色。高刚度凝胶MEFs表现出应力纤维相比,低刚度凝胶种子的传播。比例尺为50μm。
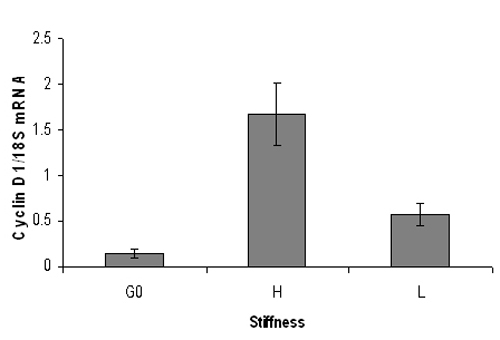
图3。代表鼠标cyclin D1的mRNA水平的定量PCR结果血清饥饿小鼠胚胎成纤维细胞接种到高(3%丙烯酰胺)或低(0.3%丙烯酰胺)刚度凝胶和10%的FBS为9小时刺激。实时定量PCR分析RNA的提取,cyclin D1的mRNA水平(标准化18S核糖核酸)。 G0代表从静止细胞的细胞周期蛋白D1的表达。 Cyclin D1的mRNA水平显着增加,僵硬的水凝胶,但不软凝胶。数据以均数+ / - SD重复的PCR反应。
讨论
凝胶聚合过程的一个关键因素是,以避免气泡的形成,这将使细胞绑定到ECM涂层凝胶本身,而不是玻璃盖玻片。这是可以预防的仔细吹打后震荡和可视化,确保无气泡已成为被困在凝胶的聚合解决方案。我们始终建议准备额外的“反应”盖玻片和凝胶,以确保有足够的实验。
凝胶用PBS冲洗时,应特别注意支付。吸痰过程中必须避免与水凝胶本身,因为它可能被抓住,撕裂的?...
披露声明
致谢
工作是我们的实验室是由美国国立卫生研究院的赞助支持。
材料
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde, 70% | Sigma-Aldrich | G7776 | Store at -20°C |
| 3-APTMS (3-Aminopropyltrimethosysilane 97%) | Sigma-Aldrich | 281778 | Store at room temperature |
| SurfaSil Siliconizing Fluid | Thermo Fisher Scientific, Inc. | 42800 | Store at room temperature |
| NHS (N-hydroxysucinimide Ester) | Sigma-Aldrich | A-8060 | Store at 4°C Replace monthly |
| Albumin, bovine serum, essentially fatty acid free | Sigma-Aldrich | A6003-100G | Store at 4°C |
| Coverslips (25mm) | Fisher Scientific | 12-545-86 25 Cir 1D | |
| Coverslips (18mm) | Fisher Scientific | 12-545-84 18 Cir 1D |
参考文献
- Beattie, D., Xu, C., Vito, R., Glagov, S., Whang, M. C. Mechanical analysis of heterogeneous, atherosclerotic human aorta. J Biomech Eng. 120, 602-607 (1998).
- Bernini, G. Arterial stiffness, intima-media thickness and carotid artery fibrosis in patients with primary aldosteronism. J Hypertens. 26, 2399-2405 (2008).
- Boonyasirinant, T. Aortic stiffness is increased in hypertrophic cardiomyopathy with myocardial fibrosis: novel insights in vascular function from magnetic resonance imaging. J Am Coll Cardiol. 54, 255-2562 (2009).
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Lee, R. T. Prediction of mechanical properties of human atherosclerotic tissue by high-frequency intravascular ultrasound imaging. An in vitro study. Arterioscler Thromb. 12, 1-5 (1992).
- Levental, K. R. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Paszek, M. J. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8, 241-254 (2005).
- Samani, A., Zubovits, J., Plewes, D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Phys Med Biol. 52, 1565-1576 (2007).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47, 1394-1400 (2008).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad Sci USA. 94, 13661-13665 (1997).
- Klein, E. A., Yung, Y., Castagnino, P., Kothapalli, D., Assoian, R. K. Cell adhesion, cellular tension, and cell cycle control. Methods Enzymol. 426, 155-175 (2007).
- Klein, E. A. Cell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Current Biology. 19, 1511-1518 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。