Method Article
多色成像定时转基因斑马鱼:可视化由针对性的神经细胞消融激活视网膜干细胞
摘要
在这个视频,多色共焦成像时间推移和有针对性的细胞消融技术。定时成像是用来监测多种细胞类型的利益的行为在体内。有针对性的细胞消融有利于研究神经回路的功能和细胞特异性神经再生范例。
摘要
高分辨率时间推移斑马鱼幼虫生活的成像可以利用可视化的生物过程如何展开(审查见 1) 。复合转基因鱼在邻近的细胞类型表达不同的荧光记者提供的细胞相互作用2和/或组织水平反应随着时间的推移实验操作的一种手段。在这段视频中,我们证明成像transgenically多个标记的细胞类型,可用于在个别鱼随着时间的推移的课程,可以跨越从几分钟至数天连续的方法。描述的技术适用于任何研究,寻求相关邻近的细胞类型的“行为”随着时间的推移,包括:1)串行“抓了又放”的成像方法大量的鱼,连续几天,2)分离的简化方法重叠的激发/发射的配置文件(如GFP和YFP),3)使用的色素减退突变线延长的时间窗口,可用于高分辨率成像到后期幼体阶段的发展,4)使用有针对性荧光记者透露的膜的荧光基团与罚款形态详细的单个细胞,以及在人口较多的细胞的细胞细节,和5)先前所描述的方法诱导化学消融transgenically有针对性的细胞类型,即nitroreductase(NTR)介导的药物前体基板的转换,如甲硝唑(MTZ),3,5细胞毒素衍生物。
由于这些方法的一个例子,我们将可视化的数天在个别鱼类的视网膜双极神经元亚型的消融和再生。同时,我们会密切留意其他几个视网膜细胞类型,包括邻近的非针对性的双极细胞和潜在的变性刺激视网膜干细胞(即,Mϋller神经胶质细胞)。这一战略被应用在我们的实验室来表征细胞和组织水平(例如,干细胞小生境)的反应选择性的损失和有针对性的神经细胞类型的再生。
研究方案
1。转基因和突变系
- 建立/学习兴趣差异与荧光记者变种标记的细胞类型的转基因斑马鱼线。优化,激发/发射选定的记者的个人资料应该有最小重叠(例如,ECFP和EYFP),但是这不是绝对必要的。对于我们的目的,使用膜拴罚款细胞的细节,如神经炎进程,极大地方便了成像,解决单个细胞的数量和/或在大comingled群体形态,并以“突出”膜含量高的地区,如荧光记者,突触neuropils。
- 对于成像后期幼虫阶段,它是有益的,派生/交叉突变背景的转基因株系,从而减少色素沉着[例如,洛伊奥比森(罗伊)或洛伊奥比森;白化(罗伊; ALB) ; 4]。在我们的经验,iridiphores减少(例如,罗伊)是最关键的问题,黑色素的,可以使用1 - 苯基-2 - 硫脲嘧啶(PTU)或“白化”突变体缺乏melanophores处理化学。但是请注意,仁等 4,已经证明了视觉赤字和温和的鱼缺乏melanaphores视网膜的形态学变化,强烈的光线可以在“白化”突变体诱导感光细胞死亡。因此,这些问题都需要成像实验设计和/或解释数据时,要考虑到的。
- 对于本演示,使用转基因和突变的鱼线分别为:
- TG(NYX:GAL4 - VP16的)q16a / + TG(无人机:GAP43 - YFP)q16b / + TG(UAS - E1B:NfsB - mCherry)C264 / + TG(PAX6 DF4型:GAP43 - CFP)Q01 / +;罗伊a9/a9
- 注意:鱼“1”,NYX发起人亚群定义视网膜双极细胞表达了YFP的膜标签和/或NTR - mCherry融合记者(大部分同时表达),和几乎所有的视网膜细胞表达的膜标签的CFP 。鱼“2”,上面除了米勒胶质细胞表达胞浆的GFP和全球视网膜CFP表达已被淘汰。 NTR - mCherry融合表达呈现NYX定义的双极细胞的易受前体药物诱导消融 3,5 。
2。实时成像的胚胎/幼虫的选择和准备
- 队友转/突变品系的兴趣,收集鸡蛋孵育/维持在28.5 ° 0.3X Danieau的解决方案中的C(或“胚胎媒介”的选择)。
- 如果不是在“白化”的背景,警察机动部队应加任何色素沉着,在利益的组织(例如,眼睛〜16 HPF,最终200μM)的证据之前,抑制酪氨酸酶的活性。请注意,在浓度超过75微米的治疗与机动部队可能会导致毒性和/或致畸作用。然而,因为映入眼帘的是高色素,低于200μM的治疗是不足够的高分辨率共聚焦成像,在这些条件下,重要的是要选择健康的成像鱼。对于其他组织成像,75微米机动部队可能是可取的。此外,如上所述,使用“白化”突变线,省却了需要处理与机动部队的胚胎和成像是在后期幼体阶段的首选策略。
- 一旦荧光灯记者是显而易见的,排序根据使用的荧光立体声变焦显微镜或类似的转基因表达和一般健康的鱼。
- 成像的第一天之前,胚胎培养基溶于低熔点琼脂糖(LMA)的终浓度为0.5%,热量和混合成溶液,储存在40 ° C。
- 在第一天的成像,准备安装的解决方案:在胚胎培养基中添加tricaine(麻醉,最后的756μM)及警察机动部队(如有必要)到0.5%LMA,轻轻混匀,并返回到40 ° C。
- 麻醉鱼转移到胚胎中型载机动部队和/或tricaine,使鱼类的时间,成为无响应触摸(〜3分钟)。
- 个别鱼转移到安装的解决方案,照顾不来稀释,因此,它可重复使用的琼脂糖的。我们使用微量传输与修剪提示,这也有助于保持受控量(〜30μL)。收购后,反转吸管,让鱼定居的底部,使触摸安装解决方案的提示允许重心转移,而不需要消除任何液体。
- 转让后,开除微量麻醉的解决方案,并用它来转移了〜30μL,液滴安装解决方案培养皿中的鱼。
注意:这种安装方法只适用于直立显微镜长工作距离水浸泡的目标将被用于有关。对于我来说thods有关倒置显微镜,盖玻片需要,Andersen 等人 ,2010年。奥布莱恩等 ,2009;。Graeden和Sive,2009年。 - 返回至40 ° C加热块的安装解决方案。
- 使用睫毛刷或类似的鱼轻轻转动到所需的方向和位置的琼脂糖液滴中心的兴趣的区域。
- 重复步骤6至10个,安装所需的每道菜的胚胎数量。对于串行时间推移实验(见下文),我们通常安装在时间六个鱼和尝试限制成像会议每组以1小时。
- 虽然安装其他鱼类检查,以确保以前的科目保持琼脂糖凝固(〜3分钟),直到所需的方向。
- 琼脂糖已经凝固后,运输鱼共聚焦显微镜阶段,轻轻地添加胚胎培养基含机动部队和/或tricaine菜,直到所有的鱼儿都是完全淹没。
3。 “多色” 体内共焦成像
请注意:我们试图概括出下面这样的,它提供了其他显微镜配置的相关信息的协议。奥林巴斯和ImageJ软件应用的具体提到在引号。我们的成像系统是奥林巴斯FV1000直立共聚焦显微镜配备有405,440,488,515,559和635 nm的激光器,两个变量的屏障过滤器检测通道(允许发射波长设置在1纳米为单位进行调整),一个标准的屏障滤波器通道(红色和远红外成像),和一个透射光通道。
- 打开成像软件(“FV10屈臣氏集团”),并使用传输或荧光灯的光源,找到感兴趣的区域。细胞和/或分子的详细使用高数值孔径(例如,60X,1.2NA)长工作距离目标的最佳成像。
- 如果收集透射光图像,重点科勒照明领域的隔膜。
- 从“染料名单”中选择适当的fluorphores或从以前保存的图像文件加载采集参数。使排放范围的调整(“光谱设置”)记者信号和/或最大信噪比的清洁分离所必需的。这些设置,将需要凭经验每一个实验,以减少串扰,但最大限度地信号的定义,这里提供的例子的设置如下:
Flourphores 激光器(纳米) 无障碍设置/排放过滤器(NM) 1)ECFP,EYFP,mCherry * 440,515,559 * 460-500,530-545,575-675 2)EGFP的**,EYFP的**,mCherry 488,515,559 500-515,530-545,575-675
* mCherry成像可以改善使用波长的激光(例如,568或594纳米)
**需要一个连续的成像模式,使分色镜和障碍更换过滤器(“虚拟通道”)由于排放/ GFP和YFP激发重叠。 GFP和mCherry可以被分配到一个通道,YFP的一个单独的通道。注意:GFP和YFP图像之间的串扰图像减法(第6部分)之前便可见一斑。 - 确保正在使用的目标是在下拉菜单中选择,以确保任何软件定义的预设适当调整。
- 要重点激光器和设置功率水平,选择一个查表(LUT),揭示了每个通道的像素饱和度(“河洛”)。设置检测器灵敏度(“高压”,PMT电压)所需的图像质量(定义凭经验),并逐步提高激光器的输出,直到图像的亮度是可以接受的避免像素饱和值一致。
- 检查通道间的串扰,确保每一个激光生产线只能在相应的渠道的检测信号,通过手动转动激光器的开启和关闭,同时监控所有的成像通道。要消除串扰降低激光功率。如果没有串扰是显而易见的,所有通道可以同时提供节省大量的时间的收购。
- 在无可避免串扰的情况下,使用“连续”的单独开关激光器/渠道之间的成像模式。极端情况下(如成像GFP和YFP)需要使用的顺序切换分色反射镜和/或屏障过滤器(“虚拟通道”)的模式,。注:此选项的图像采集过程中引入显着的时间延误和可能不是鸭propriate捕捉高动态过程。
- “放大”和“旋转”功能可以被用来进一步帧感兴趣的领域。变焦也可以被用来提高图像分辨率,最高的目标和扫描格式的使用限制(例如,512 × 512;有关这些问题的信息看到,http://corefacilities.systemsbiology.net/imaging/documents/app_note_image_res PDF)。
- 对于一般在体内成像,特别重要的时间推移成像,技术,最大限度地减少光毒性问题(即自由基的积累)需要强调的,快速的扫描速度(例如,2微秒/像素)和激光输出低水平(如1%),应尽可能地使用,以及最低的分辨率扫描格式足以捕捉重要资料。
- 为了提高图像分辨率,扫描平均(“卡尔曼”),可以在收购过程中使用。较慢的扫描速度也提高了分辨率,但增加激光的停留时间,这将加剧光毒性和漂白问题。请注意,这两种方法都是不理想的时间推移,由于无法捕捉到跨Z系列,这种现象我们称之为“时间模糊”的快速变化的潜力。需要注意的是平均线与一帧可以帮助消除“时间模糊”的问题,在一个单一的平面,但不能跨Z -深度。
- 如果信号强度低,最大图像分辨率不是必需的(例如,简单的计数细胞数),增加焦光圈(针孔的直径),可用于提高信号。这有助于保持较低的激光强度,减少光毒性和漂白,但是调整光圈值大于1,通风单位在图像质量的快速损失。
- 定义Z -深度尺寸,使用的是快速扫描模式(“焦点访谈X4”)。由于信号强度一般Z -深度最好是最低的深度和结束在最肤浅的的Z - Stack的收购开始下降,这使得被收购前发生显着的漂白比较困难的信号。
- 检查整个图像的深度足够的信号检测。如果需要,Z -维亮度校正功能(“光明Z”)的可用于在指定的深度调整图像采集参数。
- Z -维步长,根据实验需要设置。例如,在我们的第一个例子(图1),我们简单地把个人的视网膜连续几天,一个“细胞普查”,因此我们设置z -深度为15微米,每视网膜五至七年的图像。这一战略使我们能够样本与每个视网膜细胞图像之间没有重叠。在我们的第二个例子(图2),我们进行了快速4D电影的时间推移,其中GFP和mCherry信号需要空间相关,因此,我们设置的步骤大小的三倍理论横向分辨率的一个折衷办法,允许Z - Stack的图像要采取每隔5-10分钟,但仍担任,以解决个别细胞的细节。
- 获取图像(“XYLZt”),并保存。移动上到下的鱼,如果执行串行时间推移实验(见下面#4)。对于时间推移快速成像看到下面的#5。
4。串行“渔获物和发行的成像跟踪,连续几天的鱼个体的细胞变化的方法
- 捕捉和发布的“协议,以尽量减少时间鱼的数量是固定,以增加鱼的数量,每个实验成像。这项技术的作用是有限的多天展开(例如, 玛姆等,2006 2)生物过程。这种方法的一个好处是,它允许任何观察到的变化,内部控制,即不同国家的个人之间,而不是整个人群进行比较。例如,跟踪标记的细胞数量的变化,在给定的组织可以准确地执行,即使最初标记的细胞数鱼个体之间的差异很大。这里提供内一种前体药物诱导的细胞消融测定3,5的情况下使用此协议的方法。
- 为可视化消融和有针对性的细胞类型,随着时间的推移,个别鱼类的再生,共聚焦图像是收购之前的前体药物管理局(治疗前),紧随前体药物,清除(处理后)恢复期间(恢复映像)。
- 治疗前影像学检查:鱼装及以上的影像。一旦鱼已经成像,他们被释放到胚胎中期(+前体药物)和培养在28.5 ° C,直到治疗后的成像会议。在两个队的工作,安装和释放的鱼,其他成像是一个很好的方法,最大限度地提高鱼的数量,可以每天成像。
- 后成像在一个单一的菜鱼代替胚胎培养基中含有tricaine与胚胎中仅(+ / - 机动部队)。
- 要释放的鱼,使用珠宝商钳穿过琼脂糖上双方的幼虫,然后轻轻挑逗琼脂糖,直到鱼在胚胎中期自由浮动。
- 前体药物诱导消融:幼虫转移到个人以及含有胚胎培养基(+ / - 机动部队)的一个多孔板+前体药物(如10mm的甲硝唑,明斯克拖拉机厂)。为了确保精确的最终的前体药物浓度,我们通常等分的胚胎培养基中定义的音量(+ / - 机动部队),其中包含2倍浓度的前体药物(例如,20毫米),每口井。鱼胚胎培养基中的平等的音量(+ / - 机动部队),然后添加到井把最终的前体药物浓度为1X。
- 孵育在28.5 ° C直到有针对性的细胞消融可以验证。
注:消融成功实现所需的前体药物治疗方案根据不同的细胞类型的针对性;前体药物浓度和治疗时间需要凭经验确定,要知道,高浓度会导致一般毒性,如> 10毫米明斯克拖拉机厂。此外,零散记者信号perdurance复杂消融成功的评估,在一些实例共聚焦显微镜是需要足够的可视化细胞的损失。 - 治疗后的成像:鱼是安装在同一组织优化导向,上述成像。一旦所有在给定的板鱼已成像,它们释放到胚胎培养基(+ / - 机动部队)到个别井(如上述)和培养在28.5 ° C至允许消融的细胞类型再生。
- 根据鱼的年龄和恢复所需的时间,可能有必要在这个阶段的检测鱼饲料。我们使用活的食物,如草履虫或轮虫,以确保最佳的生存。这也是最好每天提供新鲜的媒体,尤其是当鱼保持在低量(例如,96孔板)。
- 恢复成像:为了记录细胞替代的动力学,鱼可以在经济复苏期间每天成像。一旦已经建立了动力学检测可以简化收购,只有在感兴趣的时间点(例如,完全恢复)恢复映像。图1这种方式从我们的视网膜细胞再生的研究提供了一个例子。
- 在实验鱼的结论应安乐死浸泡在20X tricaine(15.3μM)对冰的解决方案。
5。快速定时成像。
- 对于快速时间推移多个fluorphores成像(即,“电影”),技术,最大限度地减少光毒性问题是关键(见上文)。如上所述,这种技术是最适合fluorphores可以同时,而不是顺序,成像
- 保持鱼在28.5 ° C使用了激烈的阶段,ITO导电玻璃的加热元件,或类似的。
- 使用方法,减少水分蒸发,以帮助稳定温度和渗透压(如O型环密封,倒置显微镜盖玻片)。
- 如果在更长的时间使用自动获取一定要设置堆栈大小,以便为增长和/或在z维漂移。
- 设定的时间间隔和扫描次数(“TimeScan”或“TimeController”)。采集速率将需要建立经验,根据成像和/或光毒性的敏感性属性的细胞群体的利益调整的生物过程的动态。
- 获取图像(“XYLZt”按钮)并保存。
- 为了构建“电影”,感兴趣的领域将需要加以界定,并在X,Y,Z尺寸一致。全过程本议定书审查的范围之外,但一些软件程序,这也有利于在4D图像大会(Volocity,阿米拉等)缩放,旋转和平移功能。
6。光谱分离图像处理使用Imagej免费
- 理想情况下,执行多记者成像实验时,最好是使用很好的分离光谱fluorphores。然而,这并不总是可行的和/或可能的。在这里,我们提供了一个分离fluorphores有重叠在这种情况下,GFP和YFP的激发和发射型材,简化的方法。在所提供的例子,我们使用上文所述的时间推移成像技术追踪GFP标记的视网膜“干细胞”,米勒的神经胶质细胞的行为,在有针对性的消融和视网膜双极细胞的再生与YFP和NTR - mCherry标记, (图2)。
- 使用顺序成像模式和可变屏障过滤器,允许重叠的荧光基团被收购的独立和部分分开,分别为(见上述GFP / YFP的设置,例如)采集图像。要删除串扰,我们使用的一个简单的图像减法策略,删除一个信号从另一个渠道。
- 图像减法过程:安装升的ImageJ的最新版本(http://rsb.info.nih.gov/ij/notes.html),位点的生物格式的工具(http://www.loci.wisc.edu/bio-formats/imagej) ,并对齐堆栈插件(http://www.med.harvard.edu/JPNM/ij/plugins/Align3TP.html)。
- 使用生物格式导入插件的轨迹,打开图像文件;根本利益的文件拖到ImageJ窗口将开始导入工具。分割成个别栈使用“分离通道”复选框,在导入窗口或“分割通道”选项卡下的“通道工具”(SHIFT + CTRL + Z)加载后的渠道。
- 启动对齐3 TP插件(插件>对齐栈>对齐3 TP)。栈需要对齐,以确保适当的加减。选择在第一个下拉框,并在第二MIS对齐堆栈的参考堆栈。检查“使用XY相对起源”和“使用Z相对起源”框,并点击“OK”。
- 要启动校准过程中,单击“音量注册”按钮。包含对齐参数,会出现一个新的窗口。这部分已经由经销商的插件优化,没有修改是必要的,只要按一下“确定”。
- 完成后,“不结盟堆栈”窗口就会出现。选择“对齐”窗口的“输出”和“输出”窗口应该出现。这个窗口也进行了优化,并需要任何修改。点击“OK”。一个新的堆栈应该出现在工作空间中与“不结盟”追加到文件的标题年底。
- 串扰使用“图像计算器”(流程>图像计算器)将被删除。选择要在Image1的下拉框堆栈中较受欢迎的下拉框,并在减法减去堆栈。在操作下拉框中选择“减法”,并点击“OK”。 ImageJ会问过程堆栈,选择“是”。应该出现一个新的堆栈已取消重叠的信道之间的串扰。
- 要重新创建相同的图像结构对齐和减法堆栈之前,需要合并。在通道工具“窗口中选择”合并通道“。该工具将允许你合并成一个hyperstack四个堆栈。
注:要合并所需使用的串连工具(图像>栈>工具>串连)为了超过4栈,栈串连。转换串联堆叠一个hyperstack(图像> hyperstack>堆栈hyperstack)。栈的串联变化的深度,时间,通道(ZCT)为了,这需要在出现的下拉框,复位; xyztc设置“命令”,设置“渠道”,“切片”和“框架”,根据堆栈,堆栈的深度,和时间点的数量,分别.. - 最后,所有通道都需要彩色,亮度和对比度调整,并保存为TIFF文件。从这里出发,转换到RGB,蒙太奇,Z -投影,或时间序列是相同的过程,作为原始文件。
7。代表性的成果
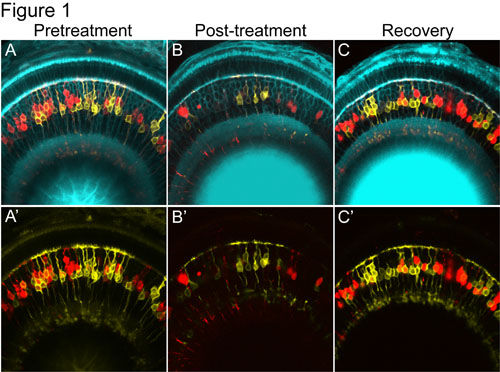
图1。一个时间推移系列展示有针对性的损失和再生的NTR - mCherry表达视网膜双极细胞(红细胞)的共聚焦图像。 A&A)治疗前有镶嵌膜标签YFP的记者在“控制”双极细胞显示为黄色,和nitroreductase樱桃显示为红色的“针对性”双极融合蛋白的表达。 B&B)治疗后,用甲硝唑,红色nitroreductase表达双极细胞,丢失,而黄色的“控制”双极细胞,都未能幸免。这表明本消融方法的具体性质。 C&C“)被删除,当甲硝唑NTR的表达细胞(红色)返回。

图2提供了一个形象减法的过程,使GFP和YFP干净分离以下的收购的例子。 A&A“)之前,减法,GFP(绿色)和YFP(pseudocolored紫色)图像是对齐的。 B&B)减法的过程,允许YFP标记的双极细胞GFP的形象,使GFP标记的米勒胶质细胞更容易被检测到。 C&C“)共表达GFP(绿色)和mCherry(红色)是显而易见的,在单元格中的箭头表示。因为米勒的神经胶质细胞标记和双极细胞标记共表达表明,双极细胞消融触发米勒的神经胶质细胞,以取代失去的细胞。这种解释是在最近的研究牵连作为米勒的神经胶质细胞损伤引起的“干细胞”在哺乳动物和鱼类的视网膜再生。
讨论
在这段视频中,我们多色共焦成像时间推移和有针对性的细胞消融技术的概述。我们聘请的时间推移成像监测的多种类型的细胞在体内的兴趣行 为,而有针对性的细胞消融是用来研究神经电路功能和细胞特异性的神经再生的范例。这些例子所示突出,可以从这些方法中收集的几个优点。也许最显着,时移成像提供了内部控制的范式;任何及所有现象的观察,可以恢复到以前的状态有关。这使得在实验时间点,直接,而不是推断比较相对变化比较容易量化和减少实验的“噪音”内人口的变化相关。多色成像的优势是可视化交互和/或邻近的细胞类型的变化的能力。例如,使用一个标签米勒的神经胶质细胞的转基因株系,我们现在这些潜在的伤害诱导干细胞特征的离散的视网膜细胞亚群的损失。我们还用这种方法来定义新机制的神经回路的形成2。最后,除了细胞再生的研究,我们最近开始使用消融系统的正常贸易关系为基础的调查从而使用各种行为模式和电生理检测的离散神经回路神经元亚型的职能作用。采用这样的研究斑马鱼的独特优势在于,由于其再生能力,诱导赤字是暂时的。因此,通过时间推移成像检测相关,我们可以典型的神经再支配的机制,导致,以及神经再支配的程度,功能恢复所需。
提供的方法可以适应许多不同的问题。例如,消融和再生的类似分析,可以应用到任何transgenically自定义的细胞亚型。总的来说,这些研究潜力,扩大在单个细胞类型的水平,并在离散的干细胞龛的再生的认识。
披露声明
致谢
我们要感谢博士。米拉Saxena先生和乔纳森有益的意见对稿件恩威。我们感谢博士。迈克尔帕森斯,东区雷蒙德,汪楚萍提供转基因株系。根据批准的协议07-12-003由MCG的IACUC规定的准则和法规进行动物实验* B。这项工作是由美国国立卫生研究院R21 MH083614和3月角钱罗勒Ø康纳入门学者奖的JSM支持
材料
1。试剂:
Danieau的解决方案:
- 氯化钠(费舍尔,S271 1)
- 氯化钾(费舍尔,P217 500)
- HEPES(费舍尔,BP310500)
- 硫酸镁(费舍尔,M65的500)
- 硝酸钙(费舍尔,C109500)
- 青霉素,链霉素(费舍尔ICN1670049)
其它试剂:
- 低熔点琼脂糖(费舍尔,BP165 - 25)
- Tricane磺酸(费舍尔NC9435281)
- N -苯基(费舍尔NC9968868)
- 甲硝唑(费舍尔,AC21034 - 1000)
2。耗材:
- 深培养皿菜(费舍尔科学/康宁,08-772-32)
- 杜蒙#5级罚款钳(费舍尔,NC9404145)
3。设备:
- 变焦体视镜(奥林巴斯,SZ51)
- 荧光放大立体(奥林巴斯,SZX16)
- 共聚焦显微镜(奥林巴斯FV1000)
- 数字块加热器 - Isotemp(费舍尔,11 - 715 - 125DQ)
- Barnstead / Thermolyne台式培养箱(费舍尔,11-702-4)。
参考文献
- Köster, R. W., Fraser, S. E. Time-lapse microscopy of brain development. Methods Cell Biol. 76, 207-235 (2004).
- Mumm, J. S., Williams, P. R., Godinho, L., Koerber, A., Pittman, A. J., Roeser, T., Chien, C. B., Baier, H., Wong, R. O. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52, 609-621 (2006).
- Curado, S., Anderson, R. M., Jungblut, B., Mumm, J., Schroeter, E., Stainier, D. Y. Conditional targeted cell ablation in zebrafish: a new tool for regeneration studies. Dev Dyn. 236, 1025-1035 (2007).
- Ren, J. Q., McCarthy, W. R., Zhang, H., Adolph, A. R., Li, L. Behavioral visual responses of wild-type and hypopigmented zebrafish. Vision Res. 42, 293-299 (2002).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. Coli nitroreductase. Mech Dev. 124, 218-229 (2007).
- Andersen, E., Asuri, N., Clay, M., Halloran, M. . J Vis Exp. , (2010).
- O'Brien, G. S., Rieger, S., Martin, S. M., Cavanaugh, A. M., Portera-Cailliau, C., Sagasti, A. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. , (2009).
- Graeden, E., Sive, H. . J Vis Exp. , (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。