需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
颅内注射腺相关病毒载体
摘要
在这里,我们目前颅内注射AAV载体在视觉皮层神经元和神经胶质细胞的荧光标记。
摘要
颅内的设计,以表达荧光蛋白的病毒载体注射液是一种在体内和不同脑区的脑切片中特定的细胞亚群的可视化的通用标签技术。与荧光染料注射,病毒标签提供针对个别的细胞类型和更便宜和时间消耗比建立转基因小鼠系。在这种技术中,腺相关病毒(AAV)载体注入颅内使用与周围组织的损伤最小立体坐标,一个微管和一个精准投放的AAV的自动泵所需的区域。注射参数,可以根据个人的实验,通过调整注射,注射部位,注射量,注射率,腺相关病毒血清型和基因表达的启动子驾驶的动物年龄。根据选择的条件,可以让病毒诱导的基因表达组细胞,单个细胞或精细胞的过程中,可视化的树突棘水平。这里显示的实验中,描绘了一个双链标签在鼠标的初级视觉皮层的神经元和神经胶质细胞表达绿色荧光蛋白的腺相关病毒注射。
研究方案
1。病毒处理和存储
- 要使用的病毒的生物安全水平的基础上,应选择适当的保护和处理技术。这些做法,可以发现在生物安全微生物和生物医学实验室第 5版,疾病预防控制中心网站上提供
( http://www.cdc.gov/od/OHS/biosfty/bmbl5/bmbl5toc.htm )。 AAV载体的使用已被批准用于1级生物安全(BSL - 1)。实验显示,一个白大褂和手套将处理病毒时穿的,按照BSL - 1代理处理程序。 - 为了保存病毒的活性,最好分成小等分,以避免反复冻融。
- 准备aliquoting病毒清除任何不必要的对象BSC和表面消毒用70%乙醇,生物安全柜(BSC)II类。将AAV污染废物的收集罩在一个烧杯中含有10%的漂白粉溶液。还摆放在BSC无菌0.5ML管和干冰的容器。
- 病毒的股票外BSC冰解冻。
- 涡病毒和开放管内BSC。
- 移液器成0.5ML管所需的等分卷(如5微升),关闭管,并放置在干冰它闪光冻结病毒。
- 当所有病毒已被分装,处置的废物容器中含有10%的漂白粉的病毒管和枪头。
- 从罩中取出废物的容器和添加额外的10%漂白粉,然后倒入水槽的漂白剂。研究所的生物安全官员的指示,处置中的生物危害容器的塑料垃圾。
- 清洁与用10%漂白粉的病毒,在接触到任何设备或表面。丢弃的手套。
- 在-80 ° C冰箱的商店等分。
2。外科
- 包括实验室工作台上用吸水纸的手术区域。手术工具应消毒,并按照您的机构的生物安全和动物使用的指导方针中的无菌条件下手术做。
- 选择地区毗邻手术区将专门用于装载与病毒的微量,并与吸水实验室工作台纸覆盖。将冰在这方面的容器分装病毒,使病毒得以解冻的冰正在执行手术。
- 枪头等处置,在与病毒接触来安装在专用的病毒处理区的10%漂白废液容器。
- 拉玻璃Wiretrol微量的尖端直径约20微米。广场上的微钝年底矿物油的小水滴,并插入导线柱塞微量提供。
- 安全的微型泵臂夹中的微量。
- 在0.5毫克/公斤的剂量丁丙诺啡皮下注入一个鼠标。 Avertin鼠标,通过腹腔注射麻醉剂量为200毫克/公斤,除去手术剪头顶部的头发,一定要留下足够大,以防止头发进入切口的利润率。
- 附加加热毯的一个stereotax基地,保持体温37 ° C整个手术和安全stereotax鼠标。
- 乙醇和优碘消毒的面积有三个交替磨砂沐浴头。
- 每只眼睛以保持眼睛湿润了,在手术过程中放置一个典必殊眼膏下降。
- 下来的头部中线切口和拉背部的皮肤暴露的头骨。
- 头骨用细尖镊子小心取出筋膜。
- 注射用立体坐标找到该地区,并标记用手术笔的头骨。
- 一个1.4毫米毛刺,薄直到头骨裂缝直径约2毫米的头骨领域的一个使用的牙钻,变薄的区域划分成若干段。
- 在整个过程中,保持头骨与应用无菌生理盐水湿润。
- 薄头骨段使用特细尖镊子轻轻去除进行了开颅手术。
3。注射液
- 随着在盖子放在一个KimWipe,打开上的封口膜的小片(一1uL注射)病毒的病毒和吸管1.5uL管。
- 病毒的股票放入微量的一角和手动撤回柱塞。如果困难是经验丰富的绘图病毒的股票进入微,提示可以被放大,稍微被打破玻璃的一小部分与微量刺入一个KimWipe。
- 柱塞微量泵,直到下到少量的病毒的手臂被驱散的微尖。用棉花尖端涂药和废弃撒施删除这个小降发送容器。
- 应用矿物油的微管,以防止堵塞的微量降低到大脑的一角下降。
4。病毒注射
- 使用X和Y立体坐标,位置在注入区域的微管。在这个实验中,使用立体座标定位初级视觉皮层2.7毫米后,前囟和2.5mm外侧向中线。非常缓慢降低到适当的Z位置的微量(1mm/1minute近似率)。
- 进入SYS Micro4微泵控制箱所需的注射参数,并开始注射。在这个实验中,将使用1微升超过10分钟的注射率。
- 当注射完毕后,离开移液器休息一两分钟,以防止在清除病毒流出。这一时期后,非常缓慢地从大脑(如上相同的速率)的微量删除。
- 缝合头皮和组织胶密封。在未来72小时内的剂量在0.1毫克/公斤,每8-12小时,与丁丙诺啡皮下注入动物或动物只要是表现出疼痛的迹象。让动物恢复,直到它走动,并准备要返回到笼子里的下一个热灯。成像实验所需的孵化时间(几天到数周后病毒注射)后可以启动。
5。净化
- 用10%漂白粉冲洗微量,并丢弃在一个锐器容器。
- 处置废物的容器相同的方式为第1。
- 丢弃到实验室生物危害斌台纸,擦拭所有表面和仪器可能在接触与10%的漂白粉病毒来。
- 未使用的病毒可能会再次被冻结,牢记反复冻结/解冻循环导致病毒的退化。
6。代表性的成果
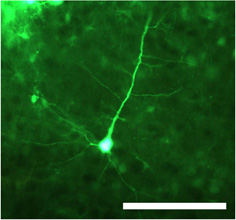
图1转双链腺相关病毒血清1型携带绿色荧光蛋白(GFP)的CMV启动子的控制下(dsAAV S1)注射后的神经元。使用啶显微镜成像的细胞体,以及近端和远端树突中的固定部分清晰可见。比例尺= 100微米。
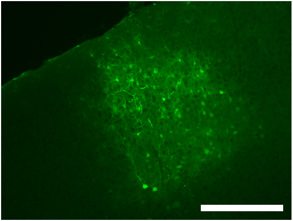
图2典型的初级视觉皮层使用dsAAV S1的病毒蔓延的程度,以及标记的神经元,神经胶质细胞和流程的颅内病毒注射的标签。比例尺= 250微米。
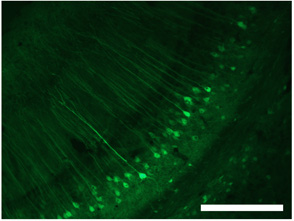
图3标签使用dsAAV S1海马细胞。比例尺= 250微米。这些数字是2009年1改编自洛厄等。
讨论
维拉利介导的基因传递持有神经过程的研究和治疗脑部疾病1,2,3的巨大潜力。这项技术的伟大的通用性,也可以利用荧光标记细胞在体外和体内 4成像。在这里,我们展示了一个使用双链的表达增强型绿色荧光蛋白的腺协会病毒在小鼠的视觉皮层的神经元和神经胶质细胞的转导的详细过程。
虽然这项技术是比较直截了当的,也有一些需要考虑的技...
披露声明
致谢
这项工作成为可能,从美国国立卫生研究院(EY012977),在宝来惠康基金,白厅基金会,和斯隆基金会(AKM)的生物医学科学事业奖助学金。
材料
| Name | Company | Catalog Number | Comments |
| St–lting Mouse and Neonatal Rat Adaptor | Stoelting Co. | 51625 | Regular stereotax for securing animals for surgery may be substituted |
| Extra Fine Bonn Scissors, 8.5cm, straight tip, cutting edge 13mm | Fine Science Tools | 14084-08 | |
| Eye Dressing Forceps, 10cm, tip width 0.5mm, curved | Fine Science Tools | 11152-10 | |
| Dumont #5/45 Forceps- Dumoxel Standard Tip, 11cm, angled | Fine Science Tools | 11251-35 | Extra-fine tipped forceps for performing craniotomy |
| Standard Pattern Forceps, straight, 2.5mmx1.35mmtip, 12cm | Fine Science Tools | 11000-12 | |
| Microtorque Control Box and Tech2000 handpiece | Ram Products, Inc. | TECH2000ON/OFF | Dental drill |
| Micro Drill Stainless Steel Burrs 1.4mm tip diameter | Fine Science Tools | 19008-14 | |
| Wiretrol micropipettes, to deliver 1-5 Ul | VWR international | 5-000-1001 or 53480-287 | |
| Mineral oil | VWR international | 29447-338 | |
| Manual Micromanipulator and Tilting Base (right-handed) | World Precision Instruments, Inc. | M3301-M3-R | Used for determining stereotaxic co-ordinates |
| UltraMicroPump (UMP3) (one) with SYS-Micro4 Controller | World Precision Instruments, Inc. | UMP3-1 | |
| Sutures | VWR international | 95056-952 | |
| P-97 Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Tobradex | Available from your institution’s veterinary services |
参考文献
- Kaplitt, M. G., Leone, P., Samulski, R. J., Xiao, X., Pfaff, D. W., O'Malley, K. L., During, M. J. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian brain. Nat Genet. 8, 148-154 (1994).
- Harding, T. C., Dickinson, P. J., Roberts, B. N., Yendluri, S., Gonzalez-Edick, M., Lecouteur, R. A., Jooss, K. U. Enhanced gene transfer efficiency in the murine striatum and an orthotopic glioblastoma tumor model, using AAV-7- and AAV-8-pseudotyped vectors. Hum Gene Ther. 17, 807-820 (2006).
- Lo, W. D., Qu, G., Sferra, T. J., Clark, R., Chen, R., Johnson, P. R. Adeno-associated virus-mediated gene transfer to the brain: duration and modulation of expression. Hum Gene Ther. 10, 201-213 (1999).
- Lowery, R. L., Zhang, Y., Kelly, E. A., Lamantia, C. E., Harvey, B. K., Majewska, A. K. Rapid long-term labeling of cells in the developing and adult rodent visual cortex using double-stranded adeno-associated viral vectors. Dev Neurobiol. 69, 674-688 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。