需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
适配器,网格蛋白相互作用在体内和体外研究
摘要
网格蛋白介导的内吞作用取决于适配器的蛋白质,协调货物选择和网格蛋白外衣大会。在这里,我们描述的程序来研究网格蛋白适配器的物理互动和活细胞成像的方法,作为一种模式使用酵母吞适配器蛋白Sla1p。
摘要
一个主要的内吞途径启动,形成网格蛋白包被小泡(CCVS),从细胞表面到内涵体运输货物1-6。 CCVS的区别在于一个多面体的笼形蛋白,大衣囊膜的晶格,并担任机械支架。从个别网格蛋白triskelia,三个重型和轻链亚基7,8组成的笼形蛋白的可溶形式在囊泡形成网格蛋白大衣组装。由于triskelion没有直接绑定到膜的能力,网格蛋白结合适配器协会通过与血脂和/或膜蛋白9的链接,形成网格蛋白晶格膜的关键。适配器还包跨膜蛋白的货物,如受体,而且可以互相交流,与其他组件的CCV形成机械 9 。
有超过20个网格蛋白适配器,一些参与网格蛋白介导的内吞作用和其他本地化跨高尔基网络或内涵体 9 。 HIP1R(酵母Sla2p)的异常,所有已知的网格蛋白适配器绑定到网格蛋白重链 9 N -末端螺旋桨域。网格蛋白适配器非结构化灵活的连接器连接的折叠域组成的模块化的蛋白质。在这些连接器的地区中,短期结合基序调解的网格蛋白的N端结构域或其他组件的囊泡形成机械9 的交互。两个不同的网格蛋白结合的图案已被定义:网格蛋白框和框的W - 9 。的共识网格蛋白- box序列的最初定义为L [L / I] [D / E / L / F],[D / E] 10,但变种已被后来发现11。符合的W - box序列PWxxW(其中x是任何残留物)。
Sla1p(与肌动蛋白结合蛋白1合成致命的)最初确定为一个肌动蛋白相关蛋白在酵母细胞的12内吞网站是正常的肌动蛋白细胞骨架的结构和动力学的必要。 Sla1p还结合NPFxD吞分拣信号NPFxD信号13,14轴承货物的内吞作用的关键。最近,Sla1p被证明绑定通过类似网格蛋白中,LLDLQ的一个Motif网格蛋白,被称为网格蛋白盒(VCB)的一个变种,和功能吞网格蛋白适配器15。此外,Sla1p已成为广泛使用的标记为在活细胞荧光显微镜研究 16的内吞大衣。这里我们使用Sla1p作为一个模型来描述适配器网格蛋白的相互作用研究方法。我们重点对活细胞的荧光显微镜,消费税拔下来,和免疫共沉淀方法。
研究方案
1。 SLA1基因选择标记的GFP标记和团
以融合的GFP标记直接SLA1基因的开放阅读框3'(Sla1p彗星端),同时标记基因与大肠杆菌应用Longtine方法17 大肠杆菌根R基因,允许G418筛选。
- 生成一个用PCR的DNA片段作为模板使用的pFA6a - GFP的质粒(S65T)kanMX6 18及以下的引物:正向,5' - CA AGG民航局海湾合作委员会的AAC阿拉木图TTC亚洲空运中心GCT公司的ACT GCA TCA的学能测验CCG TTT GGA TTC CGG ATC CCC GGG TTA ATT的AA - 3'和反向,5' - CA达AGC TTG TTT豪TTA TTA台泥达AAA级ATC TTA AAA级交咨会ATT亚洲空运中心 GAA TTC聚糖反恐委员会GTT TAA的AC - 3“。下划线序列对应的SLA1紧接(正向引物)和终止密码子(反向引物)的基因的特定部分。隔离的DNA纯化的PCR产物经琼脂糖凝胶电泳。
- 准备50毫升文化南 。在早期对数生长期(OD 600 = 0.2-0.6) 的酵母SEY6210应变(MAΤαURA3 - 52,LEU2 - 3,112 HIS3Δ200,TRP1Δ901,lys2 - 801,suc2Δ9的GAL - MEL)19日 ,在YPD增长。在室温下的附带在2000 XG 3分钟,用无菌水洗两次。
- 变换使用醋酸锂程序20细胞在步骤1中获得的PCR片段。用1 ml无菌水清洗细胞,加入1毫升YPD和孵育4小时,30 °,一个摇床中的C。
- 传播YPD - G418的板细胞选择G418抗性的转化,在30 ° C孵育2-3天。 YPD - G418的板挑上的殖民地和他们连胜。
- 使用殖民地- PCR检测,确定其中GFP根模块集成与SLA1基因序列同源重组转化。使用正向引物,内GFP根模块内的SLA1开放阅读框和反向引物退火的退火。确定殖民地PCR产物预期大小,并通过测序验证。
- 屏幕荧光显微镜下的殖民地,以确认他们有绿色荧光。
2。在SLA1基因突变变异网格蛋白盒(VCB)
- 介绍AAALQ在以下两个步骤的方法15 SLA1基因(2407至2415年个核苷酸)突变LLDLQ。
- 首先,健全SLA1核苷酸的PCR扩增1407至10年和2427年至2589年,克隆的片段,分别到pBluescriptKS通知/酶BamHI和EcoRI /贝网站。
- 亚克隆到的酶BamHI / EcoRI位点的PCR片段含有URA3。
- 切割与NotI /贝重组质粒,隔离凝胶净化URA3片段,并引进锂醋酸转化成Sla1 - GFP株产生的第1部分中,或到TVY614(MATA URA3 - 52 LEU2 - 3112 HIS3Δ200TRP1 Δ901- 801 lys2 suc2 -Δ9pep4:LEU2 prb1:HISG PRC1:HIS3)21。
- 传播辅以缺乏尿嘧啶的SD板的细胞。确认菌落PCR和测序,市建局+殖民地包含适当的综合URA3取代VCB片段。
- 在第二个步骤,亚克隆SLA1核苷酸1207年至2589年,到pBluescriptKS NotI /贝网站。使用快速转换- XL站点定向诱变试剂盒(Stratagene公司),变异的VCB残留LLDLQ AAALQ。通过测序验证。
- 切割与BSGI /阿给的建设,并隔离含有凝胶净化片段突变VCB。 Cotransform到2.3部分所获得的应变pRS313(HIS3)22 BSGI /阿给的片段。
- 传播为辅的SD板缺乏组氨酸的细胞。他副本板+克隆到琼脂含5 fluorotic酸,以确定细胞突变的序列中,取代URA3,从而再生sla1基因包含LLDLQ AAALQ突变(sla1 AAA级 )的媒介。菌落PCR和测序确认。
3。荧光显微镜
- 成长的酵母菌株,直至到达一个外径600 = 0.1-0.4 Sla1 - GFP和sla1 AAA - GFP的4毫升补充SD媒体1和2在30 ° C在黑暗中转子中产生。旋转离心于4000在室温下1分钟XG文化1毫升。丢弃〜950μL上清。在剩余的液体(〜50μL),重悬细胞。
- 存款3μL的细胞悬液到显微镜幻灯片,并与玻璃盖玻片覆盖。轻保护样品。
- 登上一个100X油浸目标的一个旋转盘共聚焦显微镜幻灯片。
- 找到正确的使用适当的过滤器明照明或488 nm激光激发和检测从GFP荧光的细胞焦平面。
- 捕捉时间推移图像Sla1 - GFP和sla1 AAA - GFP的细胞在500毫秒的曝光时间(或适当的值)ñ的时间间隔为150秒每秒一个形象。预期结果:绿色荧光蛋白标记punctae限制细胞膜的内表面上会出现,持续几秒钟,向细胞中心的移动信号很快消失(表明外套拆卸)。
- 选择部分在这点看到的形象出现,停留几秒钟,并消失。剪裁的图像,每帧的时间推移图像。
- 表示此节在每150秒的时间推移图像沿轴对应的时间过去了,通过调整帧帧的图像生成kymograph。
- 计算基于多少秒(时间推移帧)的斑点在kymograph每个点的时间。注意每个点应该向细胞内部的“曲线”正在消失,反映了内吞作用和拆卸的外衣。
- 比较sla1 AAA - GFP的野生型Sla1 - GFP。重复结果,以确定是否有统计学意义。预期结果:sla1 AAA - GFP的点仍然存在明显长于野生型,表明在大衣形成 15的缺陷(〜30秒)(〜80秒)。
4。酵母细胞质提取物和总细胞提取物的制备
- 接种用适当的酵母菌株,如TVY614 21 3公升的YPD,增长30 ° C,直到到达一个外径 600 = 1-2,在摇床孵化器。
- 酵母培养物在室温下离心20分钟3,700 X克。弃上清,加无菌水3-5毫升,吸管向上和向下,直到沉淀完全重悬。
- 倒入液氮150毫升250毫升塑料烧杯中。闪存冻结逐滴加入到液态氮中的圆形图案,以避免冷冻颗粒凝集酵母。不要让颗粒解冻,如有必要,添加更多的液氮。
- 浇在液氮冷藏一个不锈钢搅拌器容器。允许液氮几乎完全蒸发。添加冷冻酵母颗粒冷搅拌器容器。冷橡皮塞关闭搅拌器容器和酵母颗粒研磨10秒。反转容器的3-4倍混合内容和重复两次研磨的步骤。地面冻结酵母将有粉末状的外观。
- 用液氮冷藏一个漏斗和一个50毫升的锥形管。使用冷漏斗,地面酵母转移到管。冻土酵母可存放于-80 ° C或立即使用。
- 为了获得GST融合蛋白的亲和力检测(第五部分),重3克冻土TVY614酵母在15毫升的锥形管,并在室温缓冲区3毫升悬浮的胞质提取一(10毫米HEPES,pH值7.0, 150 mM氯化钠,1 mM的EDTA,1毫米的数码地面电视)含有蛋白酶抑制剂的鸡尾酒(Sigma公司)。
- 第反转管几次,直到完全解冻,然后在冰上。
- 超速离心机的提取物在4 ° C为20分钟30万小工小心转移上清液(细胞质提取物),一个锥形管,用吸管,而不会干扰颗粒。保持在冰上的细胞质中提取。
- 加入100μL50%(V / V),谷胱甘肽琼脂糖凝胶缓冲液A中的水泥浆,很方便削减提示结束,以便pipeting珠。旋转4 ° C下15分钟,2分钟,1000 XG,转移上清液(细胞质提取)到一个新的管降速4离心珠° C。储备50μL提取输入控制。
- 要获得免疫共沉淀实验的总细胞提取物(6),使用TVY614株(WT SLA1),AAALQ TVY614背景中的第2部分中产生的突变携带 LLDLQ sla1 AAA级应变,和一个背着删除sla1应变SLA1基因,如GPY3130 23。相应的锥形管冻土酵母和重量2克重悬在2毫升室温缓冲区,含有蛋白酶抑制剂的鸡尾酒(Sigma)和2%的Triton X - 100的。
- 第和反转管几次,直到完全解冻,然后在冰上孵育10分钟,定期反演混合。
- 传输材料的离心管和旋转4 ° C下15分钟在16000 XG(微量的最高速度)。小心将上清转移(总细胞提取物)使用冰吸管一个锥形管,而不会干扰颗粒。
- 添加100μL50%(V / V)的蛋白质在缓冲液A -琼脂糖凝胶浆旋转4 ° C下15分钟,降速离心珠在4 ° C为2分钟在1000 XG和转让上清液(总提取物)到一个新的管。储备50μL提取输入控制。
5。 GST融合蛋白的亲和力检测
- 健全由PCR扩增一个片段containi吴Sla1p变种网格蛋白盒(VCB)(残基803-807),克隆到PGEX - 5X获得PGEX - 5X - VCB。通过测序验证。
- 使用PGEX - 5X - VCB作为模板的快速转换- XL网站,定向诱变试剂盒(Stratagene公司),变异VCB残留LLDLQ AAALQ获得PGEX - 5X - vCBmut。通过测序验证。
- 快速消费税和融合蛋白GST - VCB,并在大肠杆菌中的GST - vCBmut 大肠杆菌 (BL21 DE3),净化珠谷胱甘肽谷胱甘肽琼脂糖凝胶,洗脱,透析对PBS,并确定蛋白浓度。
- 标签3离心管:商品及服务税,消费税,VCB,GST - vCBmut,并加入1 ml的PBS缓冲液中谷胱甘肽琼脂糖浆50%(V / V)30μL,和50微克的dialized商品及服务税,消费税VCB或GST - vCBmut融合蛋白。
- 在室温为30分钟,旋转,让有约束力的。
- 珠洗净,用PBS缓冲液A的2倍和1次加入1毫升酵母细胞质提取物 - 准备在第4部分所述 - 每管。
- 旋转管,在5000 XG颗粒的珠子1小时在4 ° C,旋转10秒,弃上清,并迅速用缓冲液洗珠子的3倍缓冲液A含0.1%Triton X - 100的的,1时间
- 离心更多的时间和使用的凝胶加载提示消除尽可能多的液体珠。此时样品可以储存在-20 ° C,继续在以后的时间。
- 2X Laemmli样品缓冲液加入15μL每管孵化,在96℃5分钟,并在5000旋转10秒小工
- 使用网格蛋白重链抗体免疫印迹分析的样品。预期结果:网格蛋白GST - VCB结合,但不GST或GST - vCBmut。还通过SDS - PAGE分析的样本,以确认GST融合蛋白的类似加载。
6。共免疫实验
- 标签3离心管:WT(野生型SLA1),sla1 AAA级 ,并sla1Δ,并添加1毫升的PBS,30μL,和2微克的50%(V / V)缓冲液中蛋白质A -琼脂糖凝胶浆兔抗Sla1p抗体。
- 在室温为30分钟旋转。
- 洗磁珠用PBS和1次用缓冲液含1%TRITON X - 100的两倍。
- 加入1毫升相应的总酵母提取准备在第4部分:SLA1,sla1 AAA级 ,并sla1Δ。旋转1小时在4 ° C
- 旋转10秒在5000 XG颗粒珠,弃上清液,并迅速用缓冲液洗珠子的3倍,含0.1%TRITON X - 100,并用缓冲液A 1次
- 离心更多的时间和使用的凝胶加载提示消除尽可能多的液体珠。此时样品可以储存在-20 ° C,继续在以后的时间。
- 2X Laemmli样品缓冲液加入15μL每管孵化,在96℃5分钟,并在5000旋转10秒小工
- 使用网格蛋白重链抗体免疫印迹分析的样品。预期结果:网格蛋白联合免疫与野生型Sla1p sla1 AAA,或在sla1Δ样品,但没有到。
7。代表性的成果
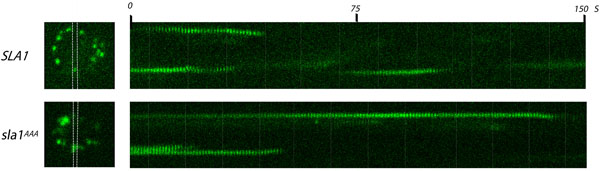
图1。Sla1p网格蛋白适配器吞网站由活细胞荧光显微镜分析。一帧(左)从视频和相应的kymographs表达Sla1 - GFP或sla1 AAA级 GFP携带LLDLQ AAALQ突变的酵母细胞(右) 。野生型和突变Sla1 - GFP的表达从内源性SLA1轨迹。吞站点观察到分布在细胞周边(左图像)的亮点。白线之间的区域对应的kymographs从产生区域。电影在1帧/秒的帧速率。请注意在AAALQ突变(sla1 AAA级)LLDLQ Sla1 - GFP相比,野生型(SLA1)的寿命更长。
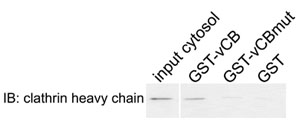
图2网格蛋白和Sla1p变网格蛋白框之间的物理相互作用。 GST融合Sla1p势必谷胱甘肽- Sepharose树脂和培养一个从野生的细胞质中提取片段aa798 - 813包含序列LLDLQ(GST - VCB),相应的AAALQ突变(GST - vCBmut),或单独商品及服务税(消费税)型酵母细胞。洗脱和分析相关蛋白免疫印迹(IB),网格蛋白重链。
讨论
网格蛋白包被小泡(CCV)参与内吞作用和跨高尔基网络运输和内涵体,保守的途径是真核细胞生物学的基础。此方法文件中所描述的方法是有用的负责CCV的形成,特别是适配器蛋白和网格蛋白之间的相互作用的分子机制研究。 GST融合蛋白的亲和力和免疫共沉淀实验,让测试适配器(候选人)和网格蛋白之间的物理协会。绿色荧光蛋白标记和荧光显微镜成像允许在活细胞的动态研究。尤其是...
披露声明
致谢
DF是由美国国家科学基金会桥梁博士奖学金的支持。在这项工作中所使用的显微镜是由科罗拉多州立大学的显微镜成像网络核心基础设施授予部分支持。在作者的实验室的网格蛋白适配器的工作是支持CSU的启动资金和美国心脏协会奖09SDG2280525到SD
材料
| 材料 | 公司 | ||
|---|---|---|---|
| Name | Company | Catalog Number | Comments |
| 快速转换- XL定点突变试剂盒 | Stratagene公司 | ||
| 蛋白酶抑制剂的鸡尾酒 | 西格玛 |
参考文献
- Mellman, I., Warren, G. The road taken: past and future foundations of membrane traffic. Cell. 100, 99-112 (2000).
- Engqvist-Goldstein, A. E., Drubin, D. G. Actin assembly and endocytosis: from yeast to mammals. Annu Rev Cell Dev Biol. 19, 287-332 (2003).
- Conner, S. D., Schmid, S. L. Regulated portals of entry into the cell. Nature. 422, 37-44 (2003).
- Bonifacino, J. S., Traub, L. M. Signals for sorting of transmembrane proteins to endosomes and lysosomes. Annu Rev Biochem. 72, 395-447 (2003).
- Ungewickell, E. J., Hinrichsen, L. Endocytosis: clathrin-mediated membrane budding. Curr Opin Cell Biol. 19, 417-425 (2007).
- Doherty, G. J., McMahon, H. T. Mechanisms of endocytosis. Annu Rev Biochem. 78, 857-902 (2009).
- Kirchhausen, T. Clathrin. Annu Rev Biochem. 69, 699-727 (2000).
- Brodsky, F. M., Chen, C. Y., Knuehl, C., Towler, M. C., Wakeham, D. E. Biological basket weaving: formation and function of clathrin-coated vesicles. Annu Rev Cell Dev Biol. 17, 517-568 (2001).
- Owen, D. J., Collins, B. M., Evans, P. R. Adaptors for clathrin coats: structure and function. Annu Rev Cell Dev Biol. 20, 153-191 (2004).
- Dell'Angelica, E. C., Klumperman, J., Stoorvogel, W., Bonifacino, J. S. Association of the AP-3 adaptor complex with clathrin. Science. 280, 431-434 (1998).
- Dell'Angelica, E. C. Clathrin-binding proteins: got a motif? Join the network!. Trends Cell Biol. 11, 315-318 (2001).
- Holtzman, D. A., Yang, S., Drubin, D. G. Synthetic-lethal interactions identify two novel genes, SLA1 and SLA2, that control membrane cytoskeleton assembly in Saccharomyces cerevisiae. J Cell Biol. 122, 635-644 (1993).
- Howard, J. P., Hutton, J. L., Olson, J. M., Payne, G. S. Sla1p serves as the targeting signal recognition factor for NPFX(1,2)D-mediated endocytosis. J. Cell. Biol. 157, 315-326 (2002).
- Mahadev, R. K., Pietro, S. M. D. i., Olson, J. M., Piao, H. L., Payne, G. S., Overduin, M. Structure of Sla1p homology domain 1 and interaction with the NPFxD endocytic internalization motif. EMBO J. 26, 1963-1971 (2007).
- Pietro, S. M. D. i., Cascio, D., Feliciano, D., Bowie, J. U., Payne, G. S. Regulation of clathrin adaptor function in endocytosis: A novel role for the SAM domain. EMBO J. 29, 1033-1044 (2010).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123, 305-320 (2005).
- Longtine, M. S., McKenzie, A., Demarini, D. J., Shah, N. G., Wach, A., Brachat, A., Philippsen, P., Pringle, J. R. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14, 953-9561 (1998).
- Wach, A., Brachat, A., Alberti-Segui, C., Rebischung, C., Philippsen, P. Heterologous HIS3 marker and GFP reporter modules for PCR-targeting in Saccharomyces cerevisiae. Yeast. 13, 1065-1075 (1997).
- Robinson, J. S., Klionsky, D. J., Banta, L. M., Emr, S. D. Protein sorting in Saccharomyces cerevisiae: isolation of mutants defective in the delivery and processing of multiple vacuolar hydrolases. Mol Cell Biol. 8, 4936-4948 (1988).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J. Bacteriology. 153, 163-168 (1983).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128, 779-792 (1995).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122, 19-27 (1989).
- Piao, H. L., Machado, I. M., Payne, G. S. NPFXD-mediated endocytosis is required for polarity and function of a yeast cell wall stress sensor. Mol Biol Cell. 18, 57-65 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。