Method Article
Nucleofection和胚胎小鼠海马和皮层神经元的原代培养
摘要
该协议概述解剖所需的步骤,通过电穿孔和文化小鼠海马和皮层神经元的转染。短期可用于文化研究轴突的生长和指导,而长期的文化可以为研究突触和树突棘分析。
摘要
海马和皮层神经元已被广泛地用于研究中枢神经系统(CNS)神经细胞极化,轴突/枝晶生长,突触的形成和功能。培养这些神经元的一个优点是,他们很容易分化,形成独特的轴突和树突,在非常低的密度上的两个立体基板。此属性,使他们非常确定神经元发育的许多方面作出了有益的。此外,通过提供这些神经元的神经胶质空调,他们将继续发展,形成功能性突触连接,尚存在几个月文化。在这个协议中,我们勾勒出一种技术,解剖,文化和转染小鼠胚胎海马和皮层神经元。转染是通过电穿孔进入神经元的DNA,然后通过nucleofection电镀。此协议已经表达荧光标记的融合蛋白的早期发展(〜4 8小时后镀),在两极分化,轴突的生长和分支研究的动态与蛋白质的功能优势。我们还发现,这在电镀前的单转保持在适当的水平,整个一生的神经元(> 2个月的文化)成像荧光标记的融合蛋白的表达。因此,这种方法是研究神经元功能很少或根本没有中断蛋白定位和整个中枢神经系统发育的功能非常有用。
研究方案
1。盖玻片和分庭的制备
- 干净的盖玻片和商会的制备是健康的文化所必需的。快捷键不应该采取任何这些步骤。
- 洗净的盖玻片(12mm或22毫米轮,德国玻璃 - 卡罗来纳州助理品牌)集中在一个专用的玻璃瓶或烧杯中的硝酸(HNO3)过夜。
- 从硝酸中删除的盖玻片,在去离子水冲洗广泛(5 7X)。
- 在层流罩或生物安全柜的盖玻片和干分开。干燥时,消毒30分钟的紫外线光。消毒的无菌培养皿储存菜盖玻片。如果12毫米盖玻片电镀神经元直接放置在无菌的35mm盘的盖玻片,进行第2节。
- 影像室,钻一个孔(删除所有毛刺)的35mm培养皿的底部15毫米和附加清洁盖玻片,用3:1的石蜡和凡士林混合构造。
- 熔体在锥管内沸水浴的石蜡/凡士林混合物。使用一个小的油漆刷和大衣盘周围的15毫米洞下方。请一定要保持石蜡/凡士林混合搅拌,因为它会分开。这通常会导致与凡士林的浓度较高,这将成为粘稠的菜肴放置在孵化器,在盖玻片支队粘在一起商会。其余石蜡/凡士林可以在室温下保存。
- 将菜倒放在一个平面托盘,并将其放置在孔盖玻片。 80 ° C烘箱中加热,直到石蜡混合物融化(大约10分钟)。取出一个平坦的表面上的菜肴,让石蜡混合物集。
- 打开菜,消毒的紫外灯盖和底部商会内部。
- 大衣盖玻片或地区的商会,1.0mg/mL聚- D -赖氨酸在硼酸盐缓冲液(0.1M硼酸钠,pH值8.5)(30kDa)一小时的玻璃。丰富的组织文化品位去离子水冲洗3-5次。确保删除所有的硼酸盐缓冲的痕迹。干燥和使用即时或存储商会/盖玻片,以供日后使用。我们通常使用的准备工作后一个月内清洗盖玻片。
2。神经解剖和培养基的制备
- 准备组织文化品位水通过添加适当数量的10倍HBSS和100倍的HEPES的夹层介质(DM)。保存在4 ° C。在冰上保持在清扫。
- 解剖前一天准备电镀液(下午)和无血清培养基(SFM)。下午由Neurobasal中等,B27的补充,2毫米谷氨酰胺,0.3%的葡萄糖,氯化钠37.5毫米和5%胎牛血清(FBS),。 SFM Neurobasal中等,B27的补充,谷氨酰胺2毫米,0.3%葡萄糖和37.5毫米氯化钠。
- 只在组织文化的清扫和存储足够的孵化器与盖隔夜稍微虚掩着,使温度和CO 2的介质达到平衡的内容。我们增加了额外的葡萄糖和渗透压增加,氯化钠约310mOsm。我们找到的文化做一个更生理的渗透压(Neurobasal渗透压一般为205 - 245mOsm)更好。
3。长期培养的皮层神经胶质直属层的制备
- 如果要准备长期的文化,执行这部分的协议的两至三个星期,然后再继续与皮质或海马解剖。
- 准备胶质培养基与MEM(GM)0.3%的葡萄糖,青霉素/链霉素和10%马血清。
- 安乐死P1 - P3的小鼠的幼崽在冰上冷却5分钟。从冰和喷用70%乙醇中删除每个小狗。用剪刀快速斩首。整个大脑取出一盘冷DM(步骤2.1)。
- 移除大脑两半球和脑膜。海关新皮层,并转移到一个新的菜,不包含任何媒体。准备共4大脑皮质。
- 尽可能细切碎,用干净,无菌刀片皮层,并取出用塑料吸管50 mL锥形管,含有12毫升的冷DM切碎组织。添加胰蛋白酶和DNase 0.25%(1.5毫升)和0.1%(1.5毫升),终浓度。在37℃水浴孵育10分钟间歇纷飞。
- 取出试管中皮层组织,用70%乙醇引入到组织培养罩前要彻底清洁。吸取皮质组织与一个10毫升吸管最块约10-15次,或直至消失。
- 返回管至37 ° C,在水浴10分钟间歇纷飞。
- 彻底清洁,用70%乙醇管,并把它带回去的组织文化罩。吸取的皮层组织和5米大号吸管约10-15次,或直至块消失。
- 添加15毫升的温暖通用和200xg(1000RPM)离心10分钟。
- 弃上清,重悬在20毫升的新鲜GM颗粒细胞,并与一个血球计数。板5 - 7.5x10 6细胞15毫升每75厘米2烧瓶总经理。
- 一天后,每2-3在随后的日子里文化,打跑松散的细胞,对你的手敲烧瓶。删除任何脱落细胞中,并与15毫升的新鲜GM替换。
- 神经胶质细胞可以收获后1-2周在烧瓶增长,当他们约70-100%融合。为了准备与神经胶质涂层的个人盖玻片,放置6硝酸清洗和消毒,在10厘米菜25毫米圆形盖玻片,并将其放置在一个三角形图案用小油漆刷到每个盖玻片3点3:1混合石蜡/凡士林。 30分钟的紫外线光对开放的菜肴。大衣与0.1 mg / mL的聚- D -赖氨酸在硼酸盐缓冲液(30kDa)一小时,然后洗净广泛用无菌组织的文化品位去离子水(3 - 5倍),并让干燥的盖玻片。
- 从孵化器中取出含有胶质烧瓶,弃培养基预热胰蛋白酶/ EDTA溶液5毫升冲洗。从烧瓶中取出的胰蛋白酶/ EDTA溶液和3毫升新鲜预热胰蛋白酶/ EDTA吸管入烧瓶。在37℃前加入5毫升的GM停止胰蛋白酶为1分钟瓶。
- 从烧瓶中取出的神经胶质细胞,反复吹打10-15次,然后媒体转移到15 mL锥形管。 200xg(1000RPM)离心8分钟。去除上清液,并添加12.5毫升每10厘米菜含有盖玻片的GM通用汽车的10毫升,计数细胞, 板 5X10 5细胞。
- 每2-3天在新鲜预热GM交换介质。神经清扫的前一天,通用汽车公司和与SFM(2.2节)更换。皮质或海马文化水浸时,使用在步骤4.12胶质空调的可持续森林管理。
4。皮层和/或海马解剖和电穿孔
- 删除适当数额的nucleofection解决方案(龙沙),结合起来,温暖的室温开始剥离之前。由于Nucleofection解决方案的有限生命周期相结合时,我们只有结合每个准备(100μL每转)所需的金额。
- 安乐死在E15.5怀孕的老鼠与CO 2(插件一天E0.5)和一个10cm的培养皿中取出子宫。取出胎儿和斩首,到寒冷的DM(2.1节)。
- 取出到一个单独菜冷DM的整个大脑和弯曲的钨针,同时删除neocortices。删除新菜冷DM microforceps和地方皮层脑膜。虹膜或老爷车用小剪刀,删除在1.5毫升的Eppendorf管充满了1.0毫升的冷DM皮质或海马和地点。此管置于冰上。
- 所有皮质或海马解剖后,加110μL2.5%胰蛋白酶的Eppendorf管中,包含在37℃培养箱20分钟的组织和地方管。
- 轻轻颠倒Eppendorf管中上清,洗皮质或海马取出1.0毫升下午(2.2节)。重复洗两次澡,留在管1毫升的PM。
- 磨碎的块15倍,与P1000的吸管,除去上清液/细胞到一个新的15 mL锥形管中含有4毫升的PM,留在Eppendorf管中仍然存在的任何块。
- 7分钟关闭制动20xg(350rpm)旋转15毫升管。弃上清,每转增加100μL预混,室温nucleofection解决方案(龙沙)。磨碎的P1000的吸管轻轻向上和向下运动的5倍。
- 每一个新的Eppendorf管中取出100μLnucleofection解决方案/细胞混合,并添加适量的DNA。对于长期的文化,我们一般采用1 -2μg每转染的DNA。然而,这一个小的文化中的神经元的比例<10%的标签。我们一般使用每转5 -10μg的DNA,如果想短期文化的转染效率更高。我们使用的40μg的DNA的总时与两个不同的质粒转染。质粒存储在1μg/μLTE缓冲液。
- 加入细胞悬液/ DNA的比色皿(龙沙)和electroporate Nucleofector(龙沙)的细胞,使用程序O - 005(小鼠中枢神经系统的神经元)。
- 工作快速,加500μL预热和平衡下午试管和删除的解决方案/一个新的1.5 mL Eppendorf管的细胞。补充足够的下午带来的每转的体积为1.0 mL。一个血细胞计数板计数细胞在3 - 5X10 3细胞/长期文化对青少年的文化,或5 - 10 × 10 3细胞/ 厘米2厘米2 。/ LI>
- 对于短期文化,洪水2.0毫升的温暖,CO 2平衡可持续森林管理的电镀一小时后的35毫米培养皿。如果使用盖玻片,我们删除的PM的一半,替换与SFM,然后重复两次。泛滥的成像商会或洗涤盖玻片结果在一个非常低的血清含量(<0.5%)。短期文化不需要与胶质细胞滋养层培养,不需要再喂。
- 对于长期的文化,我们删除一个神经胶质细胞盖盖玻片,包含三个点的石蜡/凡士林和15毫米孔在35mm盘,初步电镀后一小时以上反转。从胶质菜空调的SFM毫升,然后添加到成像室。饲料长期的文化,我们的可持续森林管理,每2-3天中删除的三分之一,代之以新鲜, 预热和CO 2平衡可持续森林管理。
5。代表性的成果:
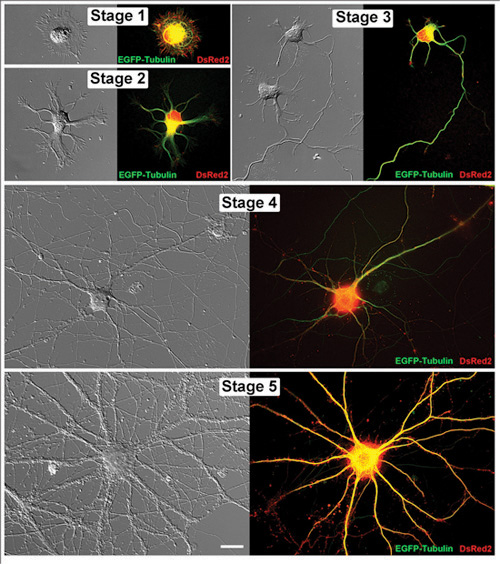
图1。生活海马神经元在连续的发展阶段。配对生活代表的海马神经元的图像显示为微分干涉对比度的图像和相应的荧光显微镜。这些细胞已pCAX向量与EGFP -微管蛋白和DsRed2转。在随后的日子里在体外 (DIV):第1阶段(1DIV),第2阶段(1DIV),第3阶段(2DIV),第四阶段(11DIV)和第五阶段(32DIV)成像神经元。比例尺是20微米。
讨论
作为一个银行家协议,它使用大鼠神经元1,2的修改,这为培养的胚胎海马和皮质鼠标神经元的协议。我们已经用3,4,5,6,7,以及为培养小鼠和仓鼠神经元这一协议。该协议同样适用海马和新皮层神经元和类似Meberg和米勒8出版的协议。一般来说,我们使用长期培养的海马神经元,因为他们是很好的特点和更成熟的模型系统。此外,它们可能含有更均匀的人口比大脑皮层的神经元。然而,新皮层神经元的培养,使用此协议,也同样生存和分化(未发表数据)。海马和新皮层神经元的短期文化,我们经常使用。大脑皮层夹层结果比海马夹层(2.5 × 10 5%海马对神经元),这使得它的材料更好的选择免疫印迹例如,更多的神经元(1.5x10 6个神经元皮质对)。
任何小学文化,它是必不可少的,以尽量减少所需的时间从死亡的动物细胞电镀。它通常会采取10-20解剖成为始终在快速剥离和电镀。此外,龙沙Nucleofector工作时,它是关键在电过程迅速,作为神经元的活力迅速下降,如果他们都留在nucleofection缓冲区。
我们的成像与总内部反射荧光显微镜(TIRFM)进行。这种类型的显微镜只能够成像几百纳米超出盖玻片。因此,神经元的地区,我们经常形象,轴突的生长锥和树突棘,需要坚持直接盖玻片。因此,我们使用低密度的文化,需要长期培养的神经胶质喂养。我们已经使用了密度较高的文化(> 2 × 10 4细胞/ 厘米 2),没有胶质细胞的饲养层,长期培养,发现他们很少喂养很好的生存。然而,这些神经元的树突棘常常过于远离基板TIRFM形象,虽然他们可以很容易地与宽视场显微镜或共聚焦显微镜检测。
在大多数我们的研究,我们转染电镀前的神经元,并有高达文化三个月成像荧光标记的蛋白质。这种荧光标记的蛋白质长期的表现,使用低浓度的DNA(1 -2μg),我们不生产过度表达在神经元的文物给了我们信心。但是,这个过程也可以被用于研究蛋白质的过度表达,如果使用高量的DNA(10 -20μg)。我们使用的质粒,转染神经元通常含有EGFP或mCherry融合蛋白,虽然我们也标签DsRed2或EGFP单独的神经元的胞浆。这电技术的工作原理以及与向量的数量。我们宁愿含有β-肌动蛋白启动子与CMV增强子和β-珠蛋白的质粒,聚尾巴(pCAGGs或pCAX质粒)9,由于相对较高的水平表达,而他们是由神经元的耐受性良好在短期和长期的文化。一般来说,蛋白质在约4小时电镀内开始表达,达到成像足够的水平在10 - 24小时10。我们已成功地用于巨细胞病毒启动子驱动的质粒在短期文化,但发现它们可能会导致高层次的过度表达,杀死神经细胞长期培养。不过,我们已经发现,低密度培养的神经胶质空调帮助与巨细胞病毒启动子驱动的质粒转染神经元的生存,而密度较高的(非胶质美联储)文化。
披露声明
致谢
所有的程序获得批准委员会威斯康星大学动物护理,并按照美国国立卫生研究院的指引。我们感谢她Nucleofector设备的大量使用凯瑟琳Kalil博士。我们也感谢登特实验室成员协议的意见。这项工作是支持由NIH R01 - NS064014,达纳基金会和白厅基金会的赠款,以EWD
克里Viesselmann,贾森Ballweg和德里克Lumbard同等贡献本文。
材料
*大部分储存于-80 ° C,可在-20 ° C储存以及试剂。储存在-80 ° C延长其保质期和稍微比较一致的文化的结果。
参考文献
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。