需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
前肿瘤反应性T细胞的体外扩增Bryostatin 1/Ionomycin手段和共同的γ链细胞因子配方
摘要
为有效的协议体外描述从肿瘤引流淋巴结或其他淋巴组织的继发性肿瘤轴承主机的肿瘤反应性T细胞的扩张。该协议有选择地扩大肿瘤特异性T细胞过继免疫治疗乳腺癌。
摘要
据报道,乳腺癌患者既存的免疫反应,对他们的肿瘤1,2。然而,这种免疫反应,未能提供完整的保护,对发展或复发的乳腺癌。为了克服这个问题,通过增加肿瘤反应性T细胞的频率,过继免疫治疗已聘用。扩大肿瘤特异性T细胞已被用于多种协议。然而,这些协议限制的肿瘤抗原体外抗原特异性T细胞的活化使用。最近,常见的伽玛链细胞因子如IL - 2,IL - 7,IL - 15和IL - 21已单独或联合使用的抗肿瘤免疫反应的3的增强。不过,目前尚不清楚制定工作,为扩大肿瘤反应性T细胞的最佳。在这里,我们提出了一个从FVBN202在收养的T细胞治疗乳腺癌HER-2/neu的阳性乳腺癌的转基因小鼠模型的肿瘤反应性T细胞的选择性激活和扩张的协议。该协议包括bryostatin-1/ionomycin(B / I)和IL - 2激活T细胞,在16个小时的肿瘤抗原的情况下。 /我的激活模仿细胞内的信号,导致T细胞的活化蛋白激酶C活性和细胞内钙离子增加, 分别为4。该协议具体激活肿瘤特异性T细胞,而造成不相关的T细胞。与IL - 7和IL - 15的B /我激活T细胞培养24小时,然后用IL - 2脉冲。 24小时后,T细胞被洗净,分割,并培养与IL - 7 + IL - 15增加4天。 前体外扩增的T细胞特异性肿瘤和抗肿瘤疗效是确定的。
研究方案
1。分离淋巴细胞5
- 分离肿瘤引流淋巴结或荷瘤FVBN202转基因小鼠的脾脏和单细胞悬液,准备在冰冷的RPMI1640含10%胎牛血清的补充。 /我在激活50毫升聚丙烯锥形管,结果在一个更大的T细胞产量相比,聚苯乙烯管。氯胺酮和甲苯噻嗪注射麻醉IP。颈椎脱位是用来作为一个“安乐死”的方法。
- 文化在完全培养基中的细胞(10 6细胞/ mL)bryostatin - 1(5纳米)和离子霉素(1μM)80 U / mL的IL - 2(Peprotech)含15%胎牛血清的16小时
- 清洗细胞与温暖的培养基(37℃)和文化与IL - 7(10毫微克/毫升)和IL - 15(10毫微克/毫升)(Peprotech)10 6细胞/ mL的完全培养基24小时的三倍。
- 脉冲的细胞与IL - 2(40 U / mL)的24小时
- 拆分与IL - 7和IL - 15细胞和文化,他们多为4天(10毫微克/毫升)。更改介质和细胞分裂,如果需要的话,每2天。
2。确定T细胞的细胞计数和流式细胞仪分析5折的扩展
- 通过光镜细胞计数
- 准备在适当的细胞台盼蓝稀释液(1:100),并添加到血球数微升
- 共9平方,并确定数乘以稀释倍数商会除以细胞计数细胞总数。结果将目前的数量× 10 4细胞/ ml。
- CD8 +和CD4 + T细胞的比例确定在流式细胞仪检测扩增细胞
- 座与anti-CD16/CD32抗体(Biolegend)非特异性结合的抗体通过培养Fc受体的细胞在冰上20分钟,然后洗细胞两次2毫升冰冷的PBS辅以1%的叠氮化钠。
- 培养FITC标记的CD4和冰20分钟的PE - CD8抗体染色的细胞,然后洗细胞两次2毫升1%FBS和0.1%的叠氮化钠的补充冰冷的PBS。
- 1%多聚甲醛固定细胞和运行在贝克曼FC 500的样本,并分析首脑会议4.3版软件。
3。确定体内的肿瘤特异性T细胞膨胀
- 文化体外扩大在辐照神经阳性MMC肿瘤细胞比例为10:1(15000 RAD)完全培养基中的淋巴细胞为 5小时24
- 收获上清和存放在-80℃直至使用。5,6
- 检测干扰素-γ使用小鼠IFN -γELISA法设置(BD Pharmingen公司)根据制造商的协议5,6。
4。确定抗肿瘤功能的前体外扩增的T 细胞 5,6
- 孵育T细胞与肿瘤细胞的效应:一个10:1的完全培养基中48小时的目标,在3 mL的完全培养基(RPMI - 1640 100U /毫升的青霉素,100μg/ mL链霉素,10%胎牛血清,谷氨酰胺和β为辅比率-巯基乙醇)和20U / mL的IL - 2在6孔培养皿中37 ° C / 5%的CO 2(Peprotech)。
- 执行三色为中性抗体染色(anti-c-Erb2/c-neu,克隆- 4,Calbiochem),其次是PE抗鼠IgG,膜联蛋白V - FITC和碘化丙啶(PI)根据制造商的协议(BD Pharmingen公司)
- 神经阳性肿瘤细胞的门和分析的可行性(膜联蛋白V-/PI-)的肿瘤细胞
5。乳腺癌的小鼠模型
FVBN202转基因雌性小鼠(Charles River实验室),可用于肿瘤反应性T细胞的来源。这些小鼠MMTV启动子调控下的一个激活的大鼠神经转基因过度表达,因此开发4-10岁7个月之间的自发乳腺癌。这些小鼠癌前病变的乳腺增生,导管原位癌(DCIS)前自发carcinoma8发展。自发荷瘤小鼠的T细胞的捐助者。
6。代表性的成果:
激活T细胞与B /第一天真不与体内肿瘤致敏的T细胞杀死了16个小时。之后的B /我的选择性的肿瘤反应性T细胞,他们扩大了在为期6天的的文化与γ链细胞因子(图1)的2.8倍。 CD8 +和CD4 + T细胞也同样扩大与γ链细胞因子(图2)。 体外扩大T细胞对肿瘤的高响应,供体鼠敏感地认识到,作为评估所生产的干扰素γ神经积极小鼠乳腺癌(MMC)(图3)肿瘤细胞的存在。扩大体内的T细胞可以诱导细胞凋亡在神经积极MMC肿瘤CELLS这样的肿瘤细胞的可行性,从92%下降到61%在48小时内(图4)。
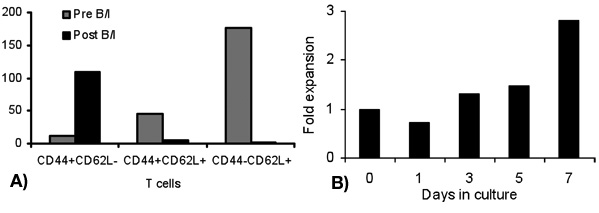
图1。折扩张在不同时间点淋巴细胞,激活B / I(1天)和γ链细胞因子体外扩增(3,5,7天)
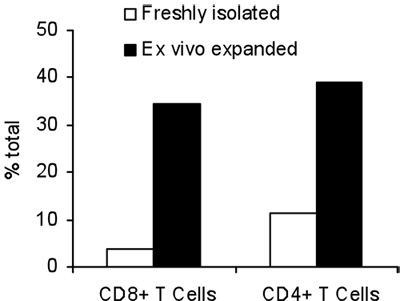
图2,前后7天的扩张与γ链细胞因子的CD4 +和CD8 + T细胞的总百分比。
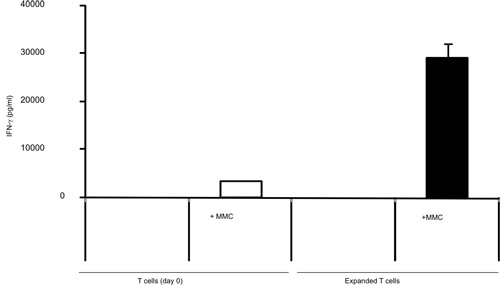
肿瘤刺激IFN -γ的生产从荷瘤小鼠与γ链细胞因子的扩大7天之前和之后中分离出的T细胞,用IFN -γELISA法图3。
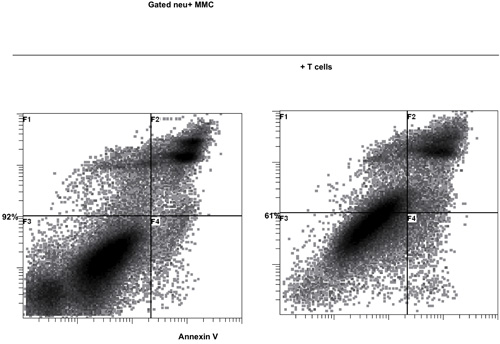
图4扩大与γ链细胞因子对神经积极的小鼠乳腺癌(MMC)肿瘤细胞的T 细胞的体外细胞毒性作用。
讨论
肿瘤反应性T细胞的选择性扩张效应的抗肿瘤作用,可建议使用B协议实现/我的激活和γ链细胞因子IL - 2,IL - 7和IL - 15的体外扩增。 IL - 2是T细胞的生长因子,可支持抗原特异性T细胞的分化和扩张,而IL - 7可以抑制T细胞的凋亡,并支持在扩张他们的生存能力。 IL - 15可以支持,收养T细胞治疗9-11后产生长期的抗肿瘤反应的重要的记忆性T细胞。改变这些细胞因子的顺序和组合,可能影?...
披露声明
致谢
这项工作是由美国国立卫生研究院R01 CA104757格兰特(MH Manjili)的支持。我们非常感谢VCU梅西癌症中心的支持和英联邦基金会为癌症研究。
材料
| Name | Company | Catalog Number | Comments |
| Bryostatin 1 | Sigma-Aldrich | B7431-10ug | |
| Ionomycin | Calbiochem | 407950 | |
| Mouse IL-7 | PeproTech Inc | 217-17 | |
| Mouse IL-15 | PeproTech Inc | 210-15 | |
| Human IL-2 | PeproTech Inc | 200-02 | |
| RPMI1640 | Invitrogen | 11875 | |
| FBS | Gemini Bio Products | 100-106 | |
| Penicillin/Streptomycin | Cellgro | 30-002-CI | |
| L- glutamine | Invitrogen | 25030081 | |
| β- mercapt–thanol | Sigma-Aldrich | M7522 | |
| anti-CD16/32 antibody | Biolegend | 101302 | |
| Annexin V-FITC Apoptosis Detection Kit | BD Biosciences | 556547 | |
| FITC-CD4 | Biolegend | 100406 | |
| PE-CD8 | Biolegend | 100708 | |
| anti-c-Erb2/c–Neu | Calbiochem | OP16 | |
| PE- anti mouse IgG | Biolegend | 405307 | |
| formaldehyde | Polysciences, Inc. | 04018 | |
| Hemocytometer | Hycor | 87144 | |
| Light microscope | VWR international | V200073 | |
| Mouse IFN-γ ELISA set | BD Biosciences | 555138 | |
| Cell culture flasks | Greiner Bio-One | 658175 |
参考文献
- Goodell, V., Waisman, J., Salazar, L. G., de la Rosa, C., Link, J., Coveler, A. L., Childs, J. S., Fintak, P. A., Higgins, D. M., Disis, M. L. Level of HER-2/neu protein expression in breast cancer may affect the development of endogenous HER-2/neu-specific immunity. Mol Cancer Ther. 7, 449-454 (2008).
- Disis, M. L., Knutson, K. L., Schiffman, K., Rinn, K., McNeel, D. G. Pre-existent immunity to the HER-2/neu oncogenic protein in patients with HER-2/neu overexpressing breast and ovarian cancer. Breast Cancer Res Treat. 62, 245-252 (2000).
- Liu, S., Riley, J., Rosenberg, S., Parkhurst, M. Comparison of common gamma-chain cytokines, interleukin-2, interleukin-7, and interleukin-15 for the in vitro generation of human tumor-reactive T lymphocytes for adoptive cell transfer therapy. J. Immunother. 29, 284-293 (2006).
- Bear, H. D., Roberts, J., Cornell, D., Tombes, M. B., Kyle, B. Adoptive immunotherapy of cancer with pharmacologically activated lymph node lymphocytes: a pilot clinical trial. Cancer Immunol Immunother. 5, 269-274 (2001).
- Morales, J. K., Kmieciak, M., Graham, L., Feldmesser, M., Bear, H. D., Manjili, M. H. Adoptive transfer of HER2/neu-specific T cells expanded with alternating gamma chain cytokines mediate tumor regression when combined with the depletion of myeloid-derived suppressor cells. Cancer Immunol Immunother. 58, 941-953 (2009).
- Cha, E., Graham, L., Manjili, M. H., Bear, H. D., Guy, C. T., Webster, M. A., Schaller, M., Parsons, T. J., Cardiff, R. D. IL-7 + IL-15 are superior to IL-2 for the ex vivo expansion of 4T1 mammary carcinoma-specific T cells with greater efficacy against tumors in vivo. Breast Cancer Res Treat. 89, 10578-10582 (2009).
- Kmieciak, M., Morales, J. K., Morales, J., Bolesta, E., Grimes, M., Manjili, M. H. Danger signals and nonself entity of tumor antigen are both required for eliciting effective immune responses against HER-2/neu positive mammary carcinoma: implications for vaccine design. Cancer Immunol Immunother. 57, 1391-1398 (2008).
- Stern, J. B., Smith, K. A. Interleukin-2 induction of T-cell G1 progression and c-myb expression. Science. 233, 203-206 (1986).
- Kittipatarin, C., Khaled, A. R. ex vivo expansion of memory CD8 T cells from lymph nodes or spleen through in vitro culture with interleukin-7. J Immunol Methods. 344, 45-57 (2009).
- Kokaji, A. I., Hockley, D. L., Kane, K. P. IL-15 transpresentation augments CD8+ T cell activation and is required for optimal recall responses by central memory CD8+ T cells. J Immunol. 180, 4391-4401 (2008).
- Le, H. K., Graham, L., Miller, C. H., Kmieciak, M., Manjili, M. H., Bear, H. D. Incubation of antigen-sensitized T lymphocytes activated with bryostatin 1 + ionomycin in IL-7 + IL-15 increases yield of cells capable of inducing regression of melanoma metastases compared to culture in IL-2. Cancer Immunol Immunother. 58, 1565-1576 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。