需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
显微切割的黑寡妇蜘蛛丝绸生产腺体
摘要
在这里,我们描述了一个有效的策略,以消除雌性黑寡妇蜘蛛腹部的丝生产腺体。此过程允许的七个不同的丝绸生产腺体高度纯化的时尚,一个调查研究蜘蛛丝的生产和纤维大会的重要的过程中迅速隔离。
摘要
现代蜘蛛自旋高性能纤维丝,具有广泛的生物学功能,包括运动,捕获猎物和保护发展的后代 1,2 。蜘蛛来完成这些任务的纺纱几个不同的光纤类型有不同的力学性能。这种专业化的光纤类型有发生,通过不同的丝腺,小biofactories功能的演变。这些biofactories制造和储存大量的丝蛋白纤维生产。通过一系列复杂的生化事件,这些丝蛋白是从液态转换成固体物质一经挤出。
机械的研究表明,蜘蛛丝都强于高强度钢3。了解蜘蛛丝线的结构和功能之间的关系的分析发现,蜘蛛丝主要包括蛋白质,或fibroins,在其蛋白质序列4块重复。通过翻译的丝绸的cDNA分析,作出贡献,以令人难以置信的蜘蛛丝的拉伸强度和可扩展性的分子共同签名正在揭开。由于蜘蛛丝的非凡的材料特性,世界各地的研究实验室都在竞相理解和模仿的纺纱工艺,生产人造丝纤维,商业,军事和工业应用。纺纱的研究实验室中的人造蜘蛛丝的主要挑战之一,涉及了从丝绸生产腺体的纤维的挤压过程中发生的生化过程的完整的理解。
在这里,我们提出了七个不同的丝绸生产cobweaving黑寡妇蜘蛛,其中包括主要和次要的ampullate腺体腺体[生产吊斗铲和脚手架丝绸] 5,6,tubuliform [综合蛋的情况下丝] 7隔离的方法,8,flagelliform [COB -织布未知功能],总[胶丝,aciniform [综合猎物包装和蛋的情况下线程] 9号和梨状[生产附件光盘丝绸] 10。这种方法是根据麻醉蜘蛛与二氧化碳气体,随后的分离从腹部的头胸部和腹部的显微切割获得的丝绸生产的腺体。随着丝绸生产的不同腺体分离,这些组织可用于检索不同的大分子,包括实时定量PCR,北部,免疫印迹,质谱(MS或MS / MS)分析,确定不同的生化分析新的蚕丝蛋白序列,蛋白质参与丝绸大会通路,或使用完整的组织细胞培养或组织学实验搜索。
研究方案
1。麻醉蜘蛛腹部和隔离
- 蜘蛛从一个玻璃瓶转移到一个纸箱内衬塑料(图1A)。我们通常从woodpiles,车库或灌木丛中收集的蜘蛛和玻璃罐的实验室,他们的房子。由于蜘蛛不能爬上塑料衬里,它提供了一个有效的方法来从一个玻璃瓶或咖啡可以转移到一个较小的小瓶anesthetizing目的的蜘蛛。虽然处理的蜘蛛,在这一点上,你应该穿两双乳胶手套或为安全起见,园艺手套。
- 虽然蜘蛛衬塑框,方法从背面的蜘蛛,让蜘蛛幻灯片的塑料培养瓶。蜘蛛后进入小瓶,立即将插头在上面(图1B)。我们建议使用一小瓶,大约为101.6毫米x 31.75毫米(长x宽)。这最大限度地减少二氧化碳气体的anesthetizing步骤所需的金额。
- 麻醉的蜘蛛,在每平方英寸5-10磅二氧化碳气体为10分钟(图1C)。这种气体的数量只会敲蜘蛛5分钟左右,因此麻醉后,你必须立即进行步骤1.4-1.5。
- 放置到一个小夹层菜的麻醉蜘蛛和使用产钳的位置蜘蛛背的一面向上(红色沙漏朝下)。
- 夹蒂(窄柄连接头胸部和腹部)释放其余的蜘蛛(图1D)的腹部。在培养皿过夜存放在冷冻的头胸部和丢弃后冻结的第二天。要小心蜘蛛的毒牙是目前这一细分市场上移动时头胸部。
- 拧紧腹部小夹层菜Sylgard材料,使用单一的昆虫针。通过从花梗裁剪(图1E)的孔插入昆虫针。这可以很容易地被认定为流体的地点是从剪裁的花梗新兴。确保的喷丝板(花梗的另一端)正朝着面向底部离您最近的。
2。拆除外骨骼
- 通过使用的microscissors对外骨骼的第一个切口,在孔从花梗裁剪开始。横向切割,直到背侧双方达成(图1F)。使用一对镊子,剥回前的外骨骼段,并在这个位置插入第二个接脚。第二针插入,打开从最初的横向切割解剖盘尾端(90 °角),并继续切割,直到达成的喷丝板(图1G)。这个切口将垂直或垂直的初始横向切割。切不要通过纵切口时,喷丝板(后相对的沙漏,它有一个圆形的外观)。如果不插入第二针,将导致在纺纱时垂直切口进行腹部。
- 淹没腹部解剖缓冲液(0.1 M的氯化钠,柠檬酸钠0.015中号,0.1%焦碳酸二乙酯)。
- 剥离剩余的外骨骼开始从最初的,外侧切口。当这是完成后,脂肪组织应清晰可见(图1H)。
3。丝绸生产腺体隔离
- 使用镊子,开始戏弄了脂肪层(图1H)。脂肪将有一个淡黄色的外观发白。继续,直到大部分的脂肪和丝腺都清晰可见。 tubuliform腺体组成的三双很长,圆柱形管,腹腔丰富。主要ampullate,这是对发现的,是一个大的,红新月会令人费解的长尾巴和远端近端管,宽度减小,因为它接近蜘蛛的喷丝板形壶腹。轻微ampullate是非常相似的形态主要ampullate的,但它明显变小。 flagelliform腺,也发生在对圆形和一个小圆柱锯齿形管走向的喷丝板向下延伸multilobular。总腺(对)是一个非常大的,multilobular的腺体,有一个非常大的的排泄管上有大的,不规则的裂片。 aciniform腺体发生在大量类似于短,小的指状的预测。梨状腺是最小的腺体在腹部,并有许多板结,类似于一个有许多小的排泄管道,向下延伸的喷丝板的风扇的圆柱形管道。
- 我们建议删除的腺体按照以下顺序:tubuliform,主要ampullate,flagelliform,轻微的ampullate,骨料,aciniform,然后梨状(图2A - B的)。
- 开始与tubuliform挑逗这些腺体休息日Ë腺体 - 他们应该坐在其他腺体的顶部(图2A)。在一个单一的蜘蛛有三种tubuliform腺体对。允许他们自由浮动的自由,但仍其管道连接到他们的喷丝板。
- 下一步,梳理了主要ampullate腺体。主要有两个ampullate腺体之一蜘蛛。在搬迁过程中,确保保持连接导管的腺体(图2A)。
- 继续梳理其余的腺体,远离对方,工作仔细,以避免穿刺腺体,尤其是汇总和flagelliform腺体。每个腺应该是自由浮动的喷丝板的外骨骼中的所有,它的退出点。还发现在对这些腺体。取出捏钳管道,并仔细拉,直到它打破了从出口点,每个腺。在对主要ampullate,flagelliform,未成年人ampullate,总腺体。 aciniform和梨状腺体发生多对。
- 取出捏钳管道,并仔细拉,直到它打破了由喷丝头向下从出口点,每个腺。我们通常存储腺体湿的,但是,我们不添加额外的缓冲区。
- 由于腺体中取出,放入无菌预先标记的1.5毫升离心管。个别腺体显示在图3A - G。保持这些腺体在冰上,然后闪在液氮冻结。以下闪光灯在液氮冷冻,放置在-80 ° C的存储。
4。代表性的成果
消除不同的腺体时,应格外小心,同时处理flagelliform和总腺体,因为这两种结构可以很容易刺破和损坏的镊子。此外,这是值得注意的形态flagelliform和汇总的腺体看起来非常相似,他们搬迁前,他们往往是相互交织在一起。为了防止在去除这些组织的交叉污染,应仔细挑逗剥离这些结构分开。此外,初次接触后的丝绸生产腺体,aciniform和梨状腺体将是最困难的立即可视化由于其较小的尺寸和解剖位置。经常有许多鸡蛋的存在。此外,应采取额外的护理需要时取出梨状腺,这个组织是非常粘,往往会坚持您的镊子。当这个程序是正确的,它有可能获得高度纯化的方式从单一的蜘蛛丝绸生产的全部七个腺体。通常情况下,可以恢复微克量的总RNA和蛋白质从一个单一的蜘蛛清扫。例如,使用qPCR的总RNA研究的一个tubuliform限制蛋白基因,TuSp1的mRNA水平(图4)所示。代表实验,涉及蛋白质裂解液从收集到的腺体,如质谱分析(MS / MS分析也可以使用)或氨基酸组成分析显示(图5-6),分别在解决方案的胰蛋白酶消化。


图1处理,麻醉,并去除从一个雌性黑寡妇蜘蛛腹部的外骨骼。一)转移到衬塑一个纸板箱,以方便移动到一个较小的塑料瓶蜘蛛的蜘蛛。二)蜘蛛放入一个塑料瓶,带插头。三)与二氧化碳气体麻醉的蜘蛛。 D)分离的头胸部从使用microscissors的腹部。五)固定在腹部解剖托盘使用驱虫引脚。 F)的后外侧切口,用镊子pealed用剪刀和外骨骼的一部分。 G)的切口垂直最初的横向切割。 H)去除脂肪层的外骨骼和曝光。

图2。七个不同的丝绸生产腺体,而在腹部的蜘蛛以及周围组织完好的可视化。一)图片的tubuliform,主要ampullate,flagelliform,汇总,在12倍的放大倍率轻微ampullate组织。二)12X放大倍率aciniform和梨状腺体的图像。


图3的照片后,他们从腹部去除丝绸生产的七个腺体。除aciniform和梨状腺体,这是在40X与20X放大倍率的所有图像被抓获。 a)主要ampullate腺体;二)主要和次要ampullate(右侧)的大小比较;三)tubuliform,D)flagelliform,E)聚合; F)的aciniform,G)梨形。

丝的基因,TuSp1,调查后,在不同的丝绸生产腺体TuSp1 mRNA水平从使用实时定量PCR(定量PCR)的总RNA以下隔离(不包括梨状腺)的表达模式的代表结果图4。腺体。
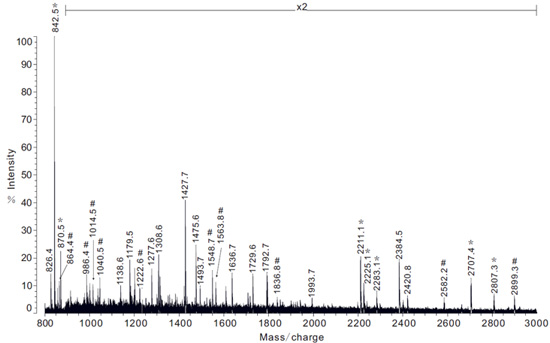
图5:从梨状腺取得的下列解决方案中的胰蛋白酶消化的蛋白提取物的质谱分析的例子。注:X2代表谱线强度的2倍放大倍率。 #符号显示频谱肽离子对应PySp1素地区的群众。

图6:从tubuliform腺体中提取的蛋白质的氨基酸组成轮廓的典型结果。注:ASX = ASP和ASN; GLX = Glu和Gln。蓝着色反映与极性侧链组的氨基酸,而红色着色代表与非极性侧链组的氨基酸残基。
Access restricted. Please log in or start a trial to view this content.
讨论
我们从黑寡妇蜘蛛丝生产腺体的显微解剖的方法提供了一种有效的手段,获得高度纯化的的丝绸生产的腺体。解剖在1.5至3小时就可以完成,产生了七个不同的一套完整的丝绸生产从cobweavers腺体。获得高度纯化的样品丝腺,让调查人员能够执行广泛的生化研究,包括确定新的丝绸或使用质谱分析mRNA水平的选择性表达的基因在不同的腺体内腺体管腔内容存储伴侣蛋白,并在体外培养特定腺体?...
Access restricted. Please log in or start a trial to view this content.
披露声明
致谢
这项工作是由一个NSF的锐格兰特MCB - 0950372题为黑寡妇蜘蛛丝的分子表征支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Electron Microscopy Sciences | SX0420-1 | 0.1 M in water |
| Diethyl pyrocarbonate | Sigma-Aldrich | D-5758 - 5 ml | 0.1% v/v |
| Sodium citrate | Sigma-Aldrich | S1804 - 1 kg | 0.015 M in water |
| Dissecting microscope | Leica Microsystems | Leica MZ16 | |
| Digital microscope camera | Leica Microsystems | DFC320 | Software - Leica Application Suite v2.8.1 |
| Vannas scissors | World Precision Instruments, Inc. | 500260 | |
| Stainless steel forceps | World Precision Instruments, Inc. | 501764 | Mini Dumont #M5S |
| Insect pins | Indigo Instruments | 33414-2 | Insect pins #2 |
| Small or large dissection dishes | Living Systems Instrumentation | DD-50-S or DD-90-S | 52 mm diameter x 18 mm H (Sylgard Depth ~6mm) or 93 mm x 22 mm |
| Drosophila culture vials | Carolina Biological | FR-17-3076 | Size is 31.75 mm diameter x 101.6 mm |
参考文献
- Vollrath, F., Knight, D. P. Int. J. Biol. Macromol. 24, 243-243 (1999).
- Gosline, J. M., Guerette, P. A., Ortlepp, C. S. J. Exp. Biol. 202, 3295-3295 (1999).
- Gosline, J. M., DeMont, M. E., Denny, M. W. Endeavour. 10, 31-31 (1986).
- Hinman, M. B., Jones, J. A., Lewis, R. V. Trends Biotechnol. 18 (9), 374-374 (2000).
- Lewis, R. V., Xu, M. Proc. Natl. Acad. Sci. 87, 7120-7120 (1990).
- Colgin, M. A., Lewis, R. V. Protein Sci. 7 (3), 667-667 (1998).
- Tian, M., Lewis, R. V. Appl. Phys. A-Mater. 82, 265-265 (2006).
- Hu, X., Lawrence, B., Kohler, K. Biochemistry. 44 (30), 10020-10020 (2005).
- Vasanthavada, K., Hu, X., Falick, A. M. J Biol Chem. 282 (48), 35088-35088 (2007).
- Hayashi, C. Y., Blackledge, T. A., Lewis, R. V. Mol. Biol. Evol.. 21 (10), 1950-1950 (2004).
- Blasingame, E., Tuton-Blasingame, T., Larkin, L. J Biol Chem. 284 (42), 29097-29097 (2009).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。