Method Article
RNA干扰在蜱
摘要
unfed蜱的dsRNA注入一种RNA干扰(RNAi)的方法描述。 RNAi是使用最广泛的基因沉默在其他基因操纵方法的使用受到限制,蜱技术。
摘要
蜱是野生和家养动物和人类的预留hematophagous体外寄生虫,被认为是全球第二蚊子人类疾病和最重要的载体媒介影响养牛业的全球 2 。蜱是在子类蜱螨亚纲,亚目,为了Parasitiformes Ixodida分类和分布在世界各地从北极到热带地区3。尽管努力控制蜱侵袭,这些体外寄生虫仍然是一个严重的问题,为人类和动物健康4,5。
RNA干扰(RNAi)是一个基于核酸的反向遗传学方法,涉及到基因表达的干扰,以确定一个代谢途径上的基因的功能,其效果。小干扰RNAs(siRNAs)是由双链RNA(dsRNA)的结果在一个强有力的序列特异性降解细胞质的mRNA含有相同的序列的dsRNA触发7-9发起的RNAi途径效应分子。由双链RNA发起的转录后基因沉默机制已经在所有真核生物中发现的研究迄今为止,和RNAi已迅速开发各种生物作为功能基因组学研究和其他应用程序10的工具。
RNA干扰已成为使用最广泛的基因沉默技术在蜱和其他生物的基因操纵的替代方法不可用,或者是不可靠的5,11。直到最近的RNAi 12,13应用受到了限制遗传特性的刻度。在短的时间内,RNA干扰已被提供,它已被证明是一个有价值的工具,为研究打勾基因功能,蜱病原体接口的特性和14蜱保护性抗原的筛选和表征。在这里,用于RNAi的dsRNA注入unfed蜱的方法是描述。它可能是从这个实验的方法获得的知识将有助于显着的基本生物系统的理解和疫苗的发展,控制蜱侵袭和防止蜱传播的病原体15-19传输。
研究方案
1。产生双链RNA。
- 综合寡核苷酸引物含有T7启动子序列在体外转录合成双链RNA(例如,为草原革栎 subolesin使用寡核苷酸引物D8AAT75:
TAATACGACTCACTATAGGGTACTGACTGGGATCCCCTGCACAGT 5' - 3'和D8DVT73:5' - TAATACGACTCACTATAGGGTACTCGAGCTTGGTGGAAAGGACG - 3')。 - 使用10 pmol每个寡核苷酸引物和蜱总RNA的1-10吴用RT - PCR扩增的靶基因。
- 净化的PCR产物。
- 使用8μL纯化的PCR产物合成的dsRNA。
- 量化法的双链RNA。
2。注射用双链RNA的刻度。
2.1。准备注射用的刻度。
- 晃动在每个解决方案,在50 mL一次性离心管,细网线在管顶屏幕保留蜱通过调迁的解决方案,首先,洗了一系列的解决方案中的蜱。洗涤蜱的解决方案的顺序是自来水,3%的双氧水,蒸馏水,70%的乙醇,用蒸馏水洗涤洗涤。
- 干纸巾吸干蜱。
- 数到20至50组的蜱,取决于实验,放置在一个1.25盎司塑料杯蜱从每个组配备一个紧密的盖子,并与实验组编号的标签。
2.2。勾选注射团队。
RNA干扰队由三人组成:(1)一个人,谁的立场上双粘性胶带贴一张红色的牙科用蜡每个刻度,(2)的人注射后监控蜱蜱(3)一个人注射蜱,呼吸的CO 2来激活它们并计数到实验组编号标记杯的生活蜱。所有团队成员都必须戴一次性手套。
2.3。安置注射蜱。
- 使用杜蒙罚款钳捕获蜱和地方双重粘性胶带贴3“× 6”红牙科用蜡表腹侧。蜱密切定位在5蜱组。
- 放置胶带超过5蜱的口器,以进一步抑制他们的小片,但同时离开身体最暴露,使注射过程中,可以通过蜱喷射器(图1)观察。
2.4。注射的刻度。
- 蜱将被注入在较低的外骨骼腹面右象限。
- 首先,刺穿一个洞在使用装有一个半“,29号针头(图2a)一个Monoject胰岛素注射器的外骨骼。
- 蜱立即注入0.2-0.5μL的双链RNA的解决方案-使用一个特制的汉密尔顿注射器1英寸,33号针头与45 °斜面点(5 × 10 5 × 10 的11%微升分子)(图2b) 。针应放入剔腔,以确保安置和保留的双链RNA。一些液体可能逃走,从注射部位(图2c)。应注意不要过度注入蜱,这将导致损失的血淋巴,并可能导致死亡的Tick。
- 清洁完成后,各实验组注射汉密尔顿注射器。在另一个实验组使用。首先填充注射器从一个烧杯中含有3%的双氧水,然后驱逐到物的容器,并重复15次。填充注射器从一个包含无菌水的烧杯中,然后驱逐到物的容器,并重复15次。小心不要弯曲汉密尔顿注射器的柱塞,柱塞,因为,如果弯曲不会顺利地移动和响应,以注射蜱需要温柔的触摸。
2.5。治疗注射后的刻度。
- 立即拿起双胶带注射用细镊子蜱和放置在一个塑料的回收容器(约6“× 6”,并用胶带环抱,以防止蜱逃生)。蜱将简要注射后无效,但应该很快就会开始抓取周围的菜。
- 呼吸二氧化碳到蜱后立即放置在回收容器中,他们帮助激活蜱2。一旦蜱爬行活跃,注射伤口迅速愈合,他们将最有可能生存。
- 计数的蜱,根据各实验组的数量和放置在一个标签的塑料杯,他们紧密装上盖子。更换蜱应注射,以取代任何,任何未来的实验组注射前死亡。
2.6。蜱举行。
- 放置在一个湿度室蜱(12小时灯:12小时黑暗的光照在22-25 ° C和95%相对humidity),并持有1天。
- 广场蜱,蜱喂养细胞,每一个实验组,粘到了羊,并让他们与同等数量的男性或女性uninjected蜱(取其性是不注射)饲料。雌蜱饲料饱食,从羊后10天喂养或控制女性删除那些已下车的收集和权衡的主机。
- 放置在纸箱中的蜱,直到完成产卵和湿度室举行。加权评估组中的所有蜱的卵块产卵。
2.7。 RNA干扰的刻度表型分析后。
- 评估喂奶后打勾确定蜱幸存,剔重,产卵和卵生育的数量,表型。然而,其他分析可能是执行上的靶基因和研究目标而定。
3。通过RT - PCR分析,以确认基因沉默。
- 剖析喂奶后注入控制和双链RNA注射组个人蜱唾液腺和胆量。
- 从个别组织样本中提取总RNA。
- 实时RT - PCR分析个别组织的目标基因的转录和RNA水平正常化,对蜱16S rRNA的使用genNorm法(ddCT Bio - Rad公司iQ5标准版,2.0版中实现的方法)。
- 解离曲线运行时的反应,以确保只有一个扩增形成的结束,在相同的温度范围内为每个样品一致的扩增产物变性。
- 比较mRNA水平(标准化的Ct值)控制喷油和双链RNA注射蜱使用学生的t检验(P = 0.05)之间。
4。代表性的成果:
该协议所述均使用在许多不同的ixodid打勾物种在我们实验室的RNAi(见表1)。量的dsRNA注入蜱随蜱的大小;较大的蜱种,可以容纳体积较大。负控制蜱应无关的双链RNA注射。几个dsRNAs如subolesin 14-19,22-25,27-32,34和β-肌动蛋白20,21可作为阳性对照。请注意,重要的是要洗的治疗,以避免混合的dsRNA解决方案之间的注射器。如果协议是正确的,应获得不少于5%的死亡率从24小时后注射过程。在蜱的基因敲除后的一个典型的表型是为了打勾的保护性抗原注射双链RNA池屏幕面板的刻度图3所示。
| 蜱种 | 双链RNA注射 | 参考文献 |
| 肩突硬蜱 | cDNA文库,subolesin,肌动蛋白,核苷酸,NF - kB的,akirin | 21,22,29,30 |
| 草原革栎 | subolesin,消费税,泛素,vATPase,硒蛋白M和W2A,造血干/祖细胞的蛋白,肌动蛋白的蛋白酶体26S亚基,ferritin1,varisin,akirin | 15,19,22,24,26,30-32 |
| 草原革marginatus | subolesin | 22 |
| 蜱americanum | cDNA文库,subolesin,akirin | 17,22,30 |
| 蜱hebraeum | subolesin,voraxin | 28 |
| 镰形扇头sanguineus | Rs86,subolesin | 22,23 |
| 镰形扇头microplus | 商品及服务税,泛素,硒,Bm86,Bm91,subolesin,胃肠道,GIII,EF1a,flagelliform蚕丝蛋白,血管性血友病 因素 | 16,18,25,27 |
| 镰形扇头annulatus | 泛,subolesin,EF1a,GIII | 16 |
表1。勾选其中的RNAi协议已使用的物种。
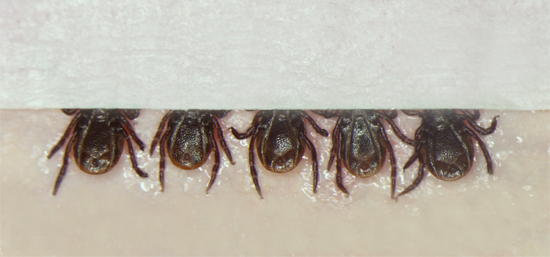
图1。蜱的位置,坚持一张红色的牙科用蜡粘在双磁带,腹侧起来。蜱被放置在5个一组,之后,一个是放置在为了进一步巩固,同时允许注射器注射过程中观察身体的蜱蜱的口器,小片胶带。

注射过程包括:(一)刺入较低的刻度外骨骼与胰岛素SY右象限图2 。灵厄,以创建一个注射部位装有29号针头,(b)立即在这个场地使用33号针头(三)最有可能会导致一些蜱血淋巴漏/汉密尔顿注射器注射的双链RNA流体。

图3。蜱六个组RNA干扰在其中被用来在蜱americanum蜱保护性抗原的屏幕面板。积极subolesin RNAi的控制和负无关的双链RNA控制相比,可以看出在蜱的表型变化。在这个实验中,各组蜱死亡率,重量,和产卵的RNAi效果进行统计分析。
讨论
虽然其他方法已被用于RNAi蜱14,33,注射双链RNA这里描述的是最广泛使用的unfed(表1)和美联储蜱 16,25,34 。 RNAi技术已被证明是一个有价值的工具,蜱基因功能的研究,蜱病原体接口的特性, 甄别和14,35蜱保护性抗原的特性。特别是,RNA干扰已成为最有价值的35蜱功能分析工具。
方法论,RNA干扰可能会演变为更有效的方法,可能允许在大量的个人基因敲除。双链RNA诱导的RNA干扰机制蜱应进一步完善,有助于更好地了解和利用这种在35,36这个物种的遗传方式。蜱RNAi的脱靶效应的程度也是一个重要的问题需要得到充分解决 14,27 。最后,RNAi技术将最有可能提供全面的贡献蜱基因调控的研究和系统生物学和蜱病原体的接口,并可能有一个疫苗的开发上的影响,控制蜱侵袭和蜱传播病原体的传播。
披露声明
致谢
我们感谢我们的实验室的成员,富有成果的讨论和技术援助。这个视频演示支持研究和兽医病理学部的副院长,兽医卫生科学中心,美国俄克拉荷马州立大学。 Ministerio DE Ciencia发送Innovación,西班牙(项目BFU2008-01244/BMC),中船重工壁间项目PA1002451樱资助这项研究是由食品动物研究的Walter R. Sitlington赋主席猴王,CVHS 2009 RAC补助,OAES动物健康基金和美国农业部,国家研究计划的竞争性赠款,号2007-04613。
材料
| Name | Company | Catalog Number | Comments |
| Access RT-PCR system | Promega | A1250 | |
| Purelink PCR purification kit | Invitrogen | K3100-02 | |
| Megascript RNAi kit | Ambion | AM1626M | |
| Red dental wax | Electron Microscopy Sciences | 72674 | |
| Plastic cups, 1.25 oz and lids | Solo Cup Company, Urbana Ill. | ||
| Fine forceps | Electron Microscopy Sciences | Various | |
| Insulin syringe | Monoject | Fitted with a ½", 29 gauge needle | |
| Hamilton syringe | Hamilton | 701SN,33/.375”/45DGR | Custom made |
| TriReagent | Sigma | 93289 | |
| iScript One-Step RT-PCR Kit with SYBR Green | Bio-Rad | 170-8892 | |
| Real-time PCR detection system | Bio-Rad | Several | Please refer to http://www.bio-rad.com/ |
参考文献
- de la Fuente, J. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front. Biosci. 13, 6938-6946 (2008).
- Peter, R. J. mosquito control-Lessons from the past, solutions for the future. Vet. Parasitol. 132, 205-215 (2005).
- Barker, S. C., Murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitol. 129, S15-S36 (2004).
- Willadsen, P. Tick control: Thoughts on a research agenda. Vet. Parasitol. 138, 161-168 (2006).
- de la Fuente, J., Kocan, K. M. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunol. 28, 275-283 (2006).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Cerutti, H. RNA interference: traveling in the cell and gaining functions. Trends Genet. 19, 39-46 (2003).
- Kavi, H. H. RNA silencing in Drosophila. FEBS Lett. 579, 5940-5949 (2005).
- Mello, C. C., Conte, D. J. r. Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Zhou, D. RNA interference and potential applications. Curr. Top. Med. Chem. 6, 901-911 (2006).
- Ramakrishnan, V. G. Application of RNA interference in tick salivary gland research. J. Biomol. Tech. 16, 297-305 (2005).
- Aljamali, M. N. RNA interference: applicability in tick research. Exp. Appl. Acarol. 28, 89-96 (2002).
- Aljamali, M. N. RNA interference in ticks: a study using histamine binding protein dsRNA in the female tick Amblyomma americanum. Insect. Mol. Biol. 12, 299-305 (2003).
- de la Fuente, J. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
- de la Fuente, J. Functional genomic studies of tick cells in response to infection with the cattle pathogen, Anaplasma marginale. Genomics. 90, 712-722 (2007).
- AlmazäN, C. Identification and characterization of Rhipicephalus (Boophilus) microplus candidate protective antigens for the control of cattle tick infestations. Parasitol. Res. 106, 471-479 (2010).
- de la Fuente, J. Identification of protective antigens by RNA interference for control of the lone star tick, Amblyomma americanum. Vaccine. 28, 1786-1795 (2010).
- Zivkovic, Z. Differential expression of genes in salivary glands of male Rhipicephalus (Boophilus) microplus in response to infection with Anaplasma marginale. BMC Genomics. 11, 186-186 (2010).
- de la Fuente, J. Reduction of tick infections with Anaplasma marginale and A. phagocytophilum by targeting the tick protective antigen subolesin. Parasitol. Res. 100, 85-91 (2006).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc. Natl. Acad. Sci U.S.A. 101, 1141-1146 (2004).
- de la Fuente, J. RNA interference screening in ticks for identification of protective antigens. Parasitol. Res. 96, 137-141 (2005).
- de la Fuente, J. The tick protective antigen, 4D8, is a conserved protein involved in modulation of tick blood ingestion and reproduction. Vaccine. 24, 4082-4095 (2006).
- de la Fuente, J. Synergistic effect of silencing the expression of tick protective antigens 4D8 and Rs86 in Rhipicephalus sanguineus by RNA interference. Parasitol. Res. 99, 108-113 (2006).
- de la Fuente, J. Autocidal control of ticks by silencing of a single gene by RNA interference. Biochem. Biophys. Res. Commun. 344, 332-338 (2006).
- Nijhof, A. M. Bm86, Bm91 and subolesin, in the silencing of the tick protective antigens. Int. J. Parasitol. 37, 653-662 (2007).
- Kocan, K. M. Silencing of the defensin, varisin, in male Dermacentor variabilis by RNA interference results in reduced Anaplasma marginale infections. Exp. Appl. Acarol. 46, 17-28 (2008).
- de la Fuente, J. Evidence of the role of tick subolesin in gene expression. BMC Genomics. 9, 372-372 (2008).
- Smith, A. The impact of RNA interference of the subolesin and voraxin genes in male Amblyomma hebraeum (Acari: Ixodidae) on female engorgement and oviposition. Exp. Appl. Acarol. 47, 71-86 (2009).
- Galindo, R. C. Tick subolesin is an ortholog of the akirins described in insects and vertebrates. Dev. Comp. Immunol. 33, 612-617 (2009).
- Canales, M. Conservation and immunogenicity of the mosquito ortholog of the tick protective antigen, subolesin. Parasitol. Res. 105, 97-111 (2009).
- Kocan, K. M. Silencing of genes involved in Anaplasma marginale-tick interactions affects the pathogen developmental cycle in Dermacentor variabilis. BMC Dev. Biol. 9, 42-42 (2009).
- Zivkovic, Z. Subolesin expression in response to pathogen infection in ticks. BMC Immunol. 11, 7-7 (2010).
- Karim, S. Functional genomics tool: gene silencing in Ixodes scapularis eggs and nymphs by electroporated dsRNA. BMC Biotechnol. 10, 1-1 (2010).
- Kocan, K. M. Transovarial silencing of the subolesin gene in three-host ixodid tick species after injection of replete females with subolesin dsRNA. Parasitol. Res. 100, 1411-1415 (2007).
- de la Fuente, J. Targeting the tick-pathogen interface for novel control strategies. Front. Biosci. 13, 6947-6956 (2008).
- Kurscheid, S. Evidence of a tick RNAi pathway by comparative genomics and reverse genetics screen of targets with known loss-of-function phenotypes in Drosophila. BMC Mol. Biol. 10, 26-26 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。