需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
对于高分辨率延时成像神经细胞迁移的一个器官型产后脑切片检测
摘要
本协议描述了一个器官的切片检测,产后脑和延髓迁徙流时间推移高分辨率成像成神经细胞迁移的优化。
摘要
产后大脑中的神经再生取决于三个生物事件的保养:祖细胞,成神经细胞迁移,以及分化和整合到现有的神经回路的新的神经元的增殖。在嗅球产后神经发生,这些事件被隔离在三个不同的域解剖学:扩散主要是发生在侧脑室室管膜下区(SEZ),移植的神经母细胞遍历喙迁徙流(RMS),和新的神经细胞分化和内的嗅球(OB)的整合。这三个领域作为理想的平台来研究细胞,分子和生理机制调节的生物事件明显。本文介绍了一个器官产后脑组织切片检测进行了优化,其中外条件紧密地模仿迁移神经母细胞在体内环境。我们表明,我们的检测提供了统一,导向,迅速运动神经母细胞内的RMS。此法将是非常适合的细胞自主和非自主神经细胞迁移的调节,利用交叉移植的方法,从不同的遗传背景的小鼠的研究。
研究方案
一,程序
下列技术应在无菌条件下进行,在层流罩,使用消毒工具。
器官片玻璃底部菜的制备
- 菜肴必须在无菌环境下编写的,使用消毒工具。
- 一个片介质150μL下降(见食谱)被放置在玻璃底部的一部分菜小心,以避免气泡在中期中心。
- 随着一个一次性注射器与一个23计针,胶水多个点(橡皮泥 - 埃尔默的,猫#E904)配备都放置在邻近的圆形盖玻片占用培养皿的中心广场边缘,离开之一端脱胶液体交换(图1)。上市类型的胶水在本议定书适用于切片或细胞没有毒性。必须给予玻璃盖玻片上,以避免任何胶水,因为这将扑来,阻挠切片成像后。一个nucleopore膜(直径25mm,孔径8.0μm - 滤纸,猫#110614)被放置在玻璃盖玻片上,使用的胶点,安全到位。这应该是使用一个微型镊子,同时确保气泡被困玻璃盖玻片和膜之间。
- 加入1 mL片介质膜之上。菜肴被放置在一个孵化器为30分钟,然后在冰上,直到准备使用。
产后早期脑提取
片准备从年轻的出生后的小鼠(P1 - P10)时获得最好的结果。
- 幼犬末期麻醉isofluorane或其他经批准的的方法(过量)。头,可喷用70%乙醇,以增加不育,其次是使用锋利的剪刀迅速断头。
- 头部稳定的微型镊子夹紧的下颌骨。纵向的皮肤切除,从脖子吻。头骨被切断纵向和前方开始,在枕大池1内侧和外侧削减2(每边一个 - 图2A)。应谨慎,以尽量减少接触潜在的皮层组织,颅瓣从大脑中删除了。
- 为了提高在vibratome切片组织的稳定性,大脑的最外侧的方面被删除两个矢状削减。大脑的尾部方面也将被删除削减小脑延髓基地(图2B)。
- 两个半球分开,沿中线裂顺利晋级,两半球都仔细挖出的头骨和放置,内侧表面向下,嵌入模具,(图2C - D)。
的主机大脑切片
- 嵌入模具的两个半球立刻布满了融化的3%低熔点DNA级琼脂糖凝胶(费舍尔,猫#BP1360 - 100)溶解在组织编制的缓冲区保持在37 ° C(见食谱)。 2分钟后,在平坦的水平表面稳定,以确保甚至琼脂糖硬化,模具定位在冰上完成设置。
- 一旦凝胶含有半球,它是从模具中取出,修剪,离开周围的脑组织凝胶2 - 3mm的。
- 凝胶包埋组织标本的vibratome光盘上,然后安装,与内侧的表面,并与氰基丙烯酸酯胶粘剂(Krazy胶水或同等学历)担保。必须采取申请只有极少量的胶水,因为太多,切片和细胞迁移毒性作用。胶块双方太多也会阻碍切割,在组织造成的潜在损害。
- 该光盘是安装在充满冰冷的组织编制中期vibratome标本托盘。
- 组织切片厚度在150微米,vibratome速度缓慢中程(将取决于所使用的vibratome,因此必须确定独立以获得最佳效果)。在我们的手中,是最佳的振动频率,最大设置时。最初的几片可能会被丢弃。
- 只要RMS的载片从刀片(RMS是由一个灰色的U形结构,从经济特区扩展到的OB肉眼可见)公布,他们都经过精心梳理出的凝胶模,并挖出用一个小的平头抹刀。切片放在载片培养基(图3A - B)的玻璃底菜nucleopore膜。一个典型的产后早期小鼠大脑会产生约2-3%半球RMS的部分时,切成150微米。至关重要的是,处理切片保持在最低水平,因为他们是很脆弱的。与切片的菜,然后转移到一个孵化器。
捐助者的大脑切片和RMS的移植
- 捐助者的大脑(大脑表达成神经细胞迁移的荧光记者)在250微米的厚度切片和切片收集在冰冷的组织准备缓冲区。
- epifluorescence能力与解剖显微镜下,这些片段可以立即置于RMS轻轻显微切割,采用微型镊子。一个镊子是用来稳定片,而另一个则是用来做小切口周围RMS,直到它从片公布。然后切成小植(直径约200-500微米),移植前切除的RMS。
- 定位上的nucleopore过滤器的主机片玻璃底菜含有从孵化器中删除,并置于解剖显微镜下。 RMS的使用可见光,明确界定和小切口是在起始段的RMS。
- 使用移液器20μL提示配备,单一捐助RMS植是在主机的RMS阴刻网站。外植体切口轻轻推入2组织之间建立联系。为了确保这种联系是稳定的,外植体推略有切片和nucleopore膜之间。
- 一旦与RMS的所有主机片移植,菜返回至少1小时的孵化器,以允许部分解决膜。神经母细胞开始从外植体迁移到主机后约1-2个小时的RMS。
神经细胞迁移的时间推移成像
- 玻璃底菜是从孵化器的孵化室在显微镜(图3C)。荧光的神经母细胞可成像间隔从0到10分钟,分析所需的类型而定。例如,我们的形象,通过设置在小于或等于2.5分钟间隔的迁徙过程中的单个神经母细胞周期的细胞骨架动力学。然而,人口迁移的方向和速度,如动态,更好地捕捉每隔5至10分钟不等。目标的选择是高度可变的,取决于品牌的显微镜。对于尼康C1的共聚焦显微镜观察,我们发现,干的20X镜头(尼康泛福陆公司,NA 0.75,WD0.35毫米)是最适合我们的分析。在此共聚焦系统的最佳效果,针孔打开一个中等大小(直径60微米)。成像是最合适的迁徙行为,仅限于细胞内的RMS厚度深,至少有20微米远离切面片之一。激光功率进行优化,以便它在最低限度,但个别神经母细胞的细节仍然可见。
- 片成像完成后,可以与冰冷的固定,以及新鲜配制的4%多聚甲醛,免疫染色,并在幻灯片上安装进一步成像。由于我们不与任何附着的基材,如层粘连蛋白的膜大衣,切片通常浮膜,一旦沉浸在染色缓冲区。部分成像,同时保持其150微米的厚度。它也可以冻存和冷冻切片,并使用一个低温恒温器,以获得原片较薄。然而,这将导致工件在染色以及改变组织的完整性的发病率增加。
二。材料/设备
器官片玻璃底部菜的制备
- 小注射器(1毫升)
- 23号针
- Nucleopore履带式蚀刻膜 - 直径25mm,孔径8.0μm - 滤纸,猫#110614
- 玻璃底培养皿 - 35mm的培养皿中,14毫米的微孔,1.5玻璃罩号 - 猫#MatTech P35G - 1.5 - 14 - C
- 橡皮泥 - 埃尔默,猫#E904
- 基础培养基鹰 - Gibco公司,CAT#21010
- 1M HEPES液(pH7.4)
- 1M ð -葡萄糖
- 100MM氯化钙2
- 100MM硫酸镁4
- 1M碳酸氢钠3
- DH 2 O
- 200MM大号-谷氨酰胺
- 青霉素链霉素
脑提取和嵌入
- 麻醉剂(isofluorane等)
- 微波炉
- 低熔点琼脂糖 - 费舍尔,猫#BP1360 - 100
- Krazy胶 - 猫#KG585
- 剥离一个单程的一次性嵌入模具(R - 40) - 22mmx40mm的矩形,20毫米深 - Polysciences,猫#18646C
脑切片和RMS移植
- Vibratome - 徕卡VT1000S和片准备的所有配件组件
- 10X汉克的平衡盐溶液 - Gibco公司,猫#14185
- Microdissecting钳#5 - #猫Roboz RS - 4976
- Microspatula - 费舍尔,猫#21-401-15
- 体视显微镜
定时成像器官切片
- 培养箱,5%的CO 2
- 倒置显微镜配备孵化器室和长途的工作目标(0.6或更高的NA)
三。食谱
组织解剖和切片准备(组织准备缓冲区的缓冲溶液)
| 原液 | 卷 | 最后Concetration |
| 10X的HBSS | 50毫升 | 1X |
| 1M HEPES(pH值7.4) | 1.25毫升 | 2.5MM |
| 1M ð -葡萄糖 | 15毫升 | 30MM |
| 1M氯化钙2 | 0.5毫升 | 1MM |
| 1M硫酸镁4 | 0.5毫升 | 1MM |
| 1M碳酸氢钠3 | 2毫升 | 4MM |
| DH 2 O | 430.75毫升 |
过滤消毒用0.2微米的过滤器和储存在4 ° C。
培养基器官切片,组织移植和成像(切片中等)
| 原液 | 卷 | 终浓度 |
| 基础培养基鹰 | 35毫升 | |
| 组织编制缓冲区 | 12.9毫升 | |
| 1M ð -葡萄糖 | 1.35毫升 | 20MM |
| 200MM大号-谷氨酰胺 | 0.25毫升 | 1MM |
| 青霉素链霉素 | 0.5毫升 | 100units / mL青霉素和为0.1mg / mL链霉素 |
过滤消毒用0.2微米的过滤器和储存在4 ° C。
低熔点琼脂糖凝胶的制备
低融点琼脂糖稀释0.3克/毫升,在50 mL锥形管(见食谱)在组织编制的缓冲区。在高功率微波管是在5-10秒的增量。增量数是依赖于总量为10毫升,3个增量(10-8-5秒,每个)应该足够了。管帽,小心拧开暖气增量之间,释放空气压力和避免管爆炸。必须谨慎,管的内容会非常热。一旦琼脂糖完全溶解,管维持在37℃水浴中至少5分钟,让温度稳定下来之前使用。长时间暴露在室温变硬的凝胶。虽然这必须尽可能避免,硬化凝胶可加热和前期准备的24小时内立即使用重新回炉。
对器官切片的免疫组织化学
共聚焦显微镜成像后,敷在被固定在4 ° C过夜,用4%甲醛的PBS。第过夜,然后封锁在4 ° C,10%与1%TRITON X的山羊血清(Sigma公司,卡特彼勒与一抗孵育过夜。#S26 - 36 - 23)的PBS随后在4 ° C荧光标记的羊抗体用于可视化(所有稀释比例为1:1000,在室温下1小时的潜伏期)。标记切片彻底冲洗5-6次,用冰冷的PBS之前,安装在载玻片上,coverslipping。
四。代表性的成果
我们的器官切片文化协议已经过彻底测试和迁移模式和方向的一致性,过去几年进行了优化。细胞从小鼠获得其中的红色荧光蛋白,TD -番茄,表达的是的巢蛋白启动子(巢的TD番茄)下诱导外植体移民的分析,揭示到的主机的RMS高度导向和快速tdTomato +神经母细胞迁移(图4A)。高放大倍率的时间推移的分析说明了一个在20分钟的影像会议(图4B)的成神经细胞迁移的整个长度出色的分辨率。
片与捐助TD -西红柿+固定细胞内的RMS不同的细胞成分的免疫染色。用荧光免疫组化(图5A),GFAP +的星形胶质细胞和CD31 +血管显露。高放大倍率的细胞骨架蛋白肌动蛋白和微管蛋白染色切片进行分析,揭示这些组件的非均匀表达,在迁移中的细胞(图5B)。
所用抗体这些例子:兔抗RFP(Abcam公司,1:250),兔抗GFAP(Dako公司,1:1000),鼠抗CD31(BD Pharmigen,1:100),鼠抗肌动蛋白(圣克鲁斯,1: 500),兔抗-微管蛋白(Sigma公司,1:1000),山羊抗小鼠Cy3标记(Chemicon公司,1:1000),羊抗兔AlexaFluor 647(Invitrogen公司,1:1000),山羊抗大鼠AlexaFluor 488(Invitrogen公司1:1000),羊抗兔AlexaFluor 488(Invitrogen公司,1:1000)。
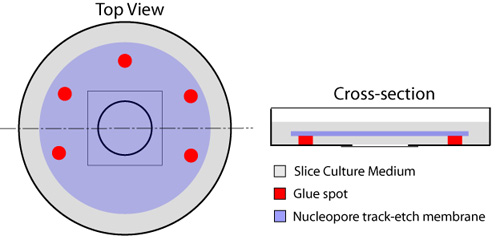
图1。器官片玻璃底菜。胶水的多个景点周围放置的圆形玻璃底的菜的分量(红色),留下一方,从下面的过滤器的介质交换的开放。一个片介质的150μL下降是摆在中心的玻璃盖玻片。一个nucleopore膜(蓝色),然后应用,有光泽的一面朝下,同时确保无气泡的玻璃盖玻片和膜之间被困。一个分片介质(灰色)的毫升扩散膜之上,菜孵育37 ° C前使用。
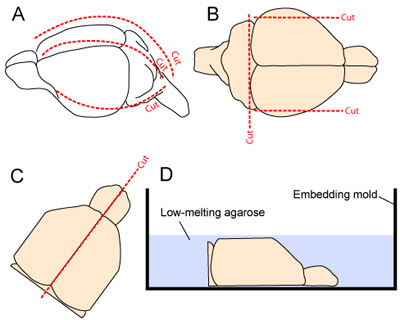
图2。脑切片的提取和准备 。 (一)头骨暴露,从颈部到头皮切开吻(中线沿虚线) 。然后切头骨在枕大池纵向和前方开始,由1内侧和横向削减2(每侧; 2A)(B)皮层最外侧的方面和中枢神经系统的尾部方面切除组织的稳定性,以改善在vibratome 切片(光盘版 )两半球分离,并放置在一个嵌入模具内侧面对跌3%琼脂糖凝胶溶解在组织编制的缓冲区之前。
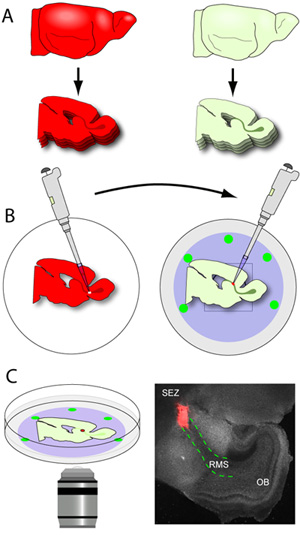
图3。脑切片和交叉移植。 (一)宿主组织切片厚度在150微米,而RMS的部分都经过精心定位平对冷玻璃底菜nucleopore膜(B)切片在捐助者的大脑(大脑在RMS表达荧光记者) 250微米的厚度,切片收集在冰冷的组织准备缓冲区。捐助国RMS显微切割和切成小植。使用配备一个20μL,提示一个移液器,个人的RMS植转移到在主机的RMS阴刻网站(三)1-2小时的潜伏期后,菜都转移到培养阶段共聚焦显微镜,捕获和迁移使用时间推移成像。显微照片是一个典型的片(灰色)成立(红色的外植体从tdTomato +的RMS一个捐助鼠标;红色虚线的线条勾勒出在主机片的RMS)移植后1小时的有代表性的低倍率形象。
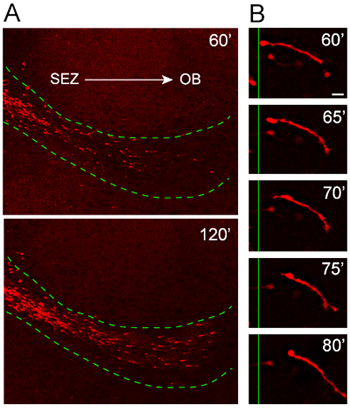
图4。到主机的RMS植的成神经细胞的迁移 。 (一)nestin的tdTomato +神经母细胞(红色)迁移到主机RMS(绿色虚线)移植后1小时外植体。 tdTomato +细胞入侵器官切片一个高度面向和快速的方式,距经济特区走向的OB移动的主机的RMS。(二 )的迁徙周期可以是高功率的时间推移一个神经细胞的图像观察到在约一个20分钟的时间内。比例尺= 10微米。
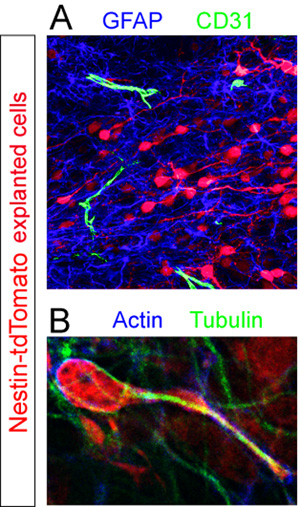
图5。免疫组织化学评估器官切片。Explanted神经母细胞(红色)被固定在迁移中12小时后移植。(一)荧光切片的免疫组织化学染色显示一个GFAP +的星形胶质细胞密集的游泳池(蓝色)和分散CD31 +血管(绿色) (二)内部主机片的RMS的一个孤立tdTomato的骨架+迁移细胞(红色)在一台主机的RMS透露合作免疫对肌动蛋白(蓝色)和微管蛋白(绿色)的抗体。
讨论
在RMS的神经元的迁移,是产后神经发生在1嗅球的重要组成部分。通过RMS的迁移发生在大脑表面相切的平面。切向迁移的神经母细胞是从他们的祖源的位置,以及其神经元的最终产品1,2,3的发散命运的放射状迁移细胞的独特。切线方向迁移的细胞在产后RMS相对纯净的人口使这种解剖学上定义的区域研究切向迁移的机制的最佳平台。破译神经细胞迁移的细胞和分子机制的关键是理?...
披露声明
致谢
我们感谢丹McWhorter在视频叙述议定书。这项工作是由美国国立卫生研究院批准5R01NS062182,衰老研究从美国联邦补助金,并授予HTG机构资金支持。
参考文献
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。