Method Article
蟹电压敏感染料Stomatogastric神经节神经元的光学成像
摘要
在这里,我们目前快速和高分辨率荧光详细的神经元活动的螃蟹stomatogastric节电压敏感染料成像的方法。
摘要
电压敏感染料成像神经元是神经网络是如何组织的理解的一个关键方法,以及如何参与神经元的同步活动出现的网络中不可或缺的的功能。在这里,我们目前的应用这种技术鉴定的格局产生蟹stomatogastric节神经元的方法。我们展示的电压敏感的荧光染料迪8 ANEPPQ这些神经元的装载和我们展示了如何形象染料使用的MiCAM02高速和高分辨率CCD相机的成像系统加载的神经元活动。我们证明使用BVAna MiCAM02成像系统的图像处理软件所记录的成像数据的分析。 stomatogastric蟹节的多个神经元的详细活动同步电压敏感染料成像应用与传统的电生理技术(细胞内和细胞外录音)打开从根本上为中枢模式发生器神经网络工作的理解了新的机遇。
研究方案
1。蟹Stomatogastric神经系统的制备
成人癌症pagurus L.获得从本地源(纽卡斯尔大学海洋实验室,德芙),并保持在过滤,充气海水(10 - 12℃)。动物麻醉后,他们在冰包装为20 - 40分钟前清扫。我们使用了孤立stomatogastric神经系统(STNS)1。 STNS被牵制在硅橡胶衬里(ELASTOSIL RT - 601,瓦克,慕尼黑,德国)培养皿,连续灌流(7 - 12毫升/分钟)用冷冻盐水(10-13℃)。由生理盐水(毫摩尔* L - 1):氯化钠,440; 26氯化镁2,氯化钙 ,13;氯化钾,11; trisma基地,10个;马来酸,5。生理盐水保持在恒温11 - 13℃,pH值7.4 - 7.6。
STNS解剖和准备的详细步骤,包括stomatoastric节(STG)desheathing,在朱庇特的文章Guttierez和Grashow 1。所有实验均按照1986年11月24 日 (86/609/EEC)与欧洲共同体理事会指令。图1A显示一个示意图STNS和图1B显示了一个典型的desheathed STG,它的神经元在神经节的后部分的平面半圆安排。
与STNS培养皿是固定的成像显微镜的操作平台(BW51 WI;奥林巴斯,东京,日本)与橡皮泥。 ,显微镜载物台和显微镜安装在振动隔离表(Scientifica,阿克菲尔德,英国),以防止在运动的光记录文物。电机stomatogastric节(STG)中产生的模式是使用2-4外录音监控。这是通过以下步骤:
- 围绕主电机神经(LVN)电气隔离洗澡(这是解剖舞台上,前培养皿放置成像显微镜的操作平台上做神经节是建立一个基于凡士林圆柱舱)。
- 两个不锈钢电极导线放置在这个车厢,另一个在洗澡作为参比电极。
- 差分信号记录,过滤,放大与AC差分放大器(Univ.德国凯泽斯劳滕)。
- 电机的神经节活动都受到监控使用示波器(DL708E;横河电机,东京,日本)和另外记录使用数据采集板(电源土木工程署,1401,剑桥电子设计,剑桥,英国)和穗2 v6.10软件(电子设计剑桥,剑桥,英国)。使用钉2 v6.10(电子设计剑桥,剑桥,英国)的文件进行了分析。
2。染料溶液的制备
我们使用的电压敏感的荧光染料迪8 ANEPPQ(剑桥生物科学)5,具有双重的正电荷,有利于通过积极的电流脉冲通过微电极的染料加载。染液应尽可能轻保护。染液准备如下:
- 染料5毫克混入1毫升的F - 127聚醚酸在DMSO(Invitrogen)的解决方案。
- 含有溶解染料的塑料瓶是旋转/在适马离心1-14分钟(Sigma公司,德国,Osterode)以分离较大的染料微粒可能阻塞的微电极在12000离心20分钟。
- 上清液(前200微升)的染料溶液是分开使用移液器和存储在一个单独的塑料瓶。这两个小瓶包装铝箔,以防止暴露在光线下。
- 染料溶液冷冻在-20 ° C
- 在此之前使用的染料溶液融化封闭和包裹的小瓶放在温水(25℃)水10-15分钟。
3。使用夏普微电极细胞内注射染料载入
我们用尖锐的微电极与染料加载神经元。要检查染料的加载,我们使用的MiCAM02成像系统(SciMedia,日本东京 ) 6。成像系统具有两个CCD相机:人力资源的相机有一个更大的传感器芯片(6.4毫米× 4.8毫米),提供更好的空间分辨率的最佳时间1.4毫秒的决议,HS相机有一个更小(2.9毫米× 2.1毫米),但更快的传感器芯片,允许更快的成像作为其最好的时间分辨率0.7毫秒。染料装载的步骤如下:
- 微电极被拉到一个P - 97烈焰红唇 - 布朗(萨特仪器,诺瓦托,美国加利福尼亚州)电极拉拔用10厘米长的,1毫米外径玻璃管,灯丝(8P GB100TF,科学的产品,霍夫海姆,德国)。电极被拉到有阻力范围25 - 40 3M氯化钾兆欧(适当的拉动参数设置遵循吸管由电极拉马制造商提供的菜谱)。
- 冰冻的染料溶液是熔化和极少量的是一个microfil针(MicroFil - 34G,世界精密仪器,萨拉索塔,佛罗里达州,美国) -吸进吸了染料的2 / 3左右的microfil针路填充。
- microfil针染料溶液注入微电极的尖端。微电极放置15分钟,在黑暗中。
- 微电极与3M KCl溶液回填。电极,然后放回另一个10-20分钟,让染料溶液,以达到精尖的电极由毛细管作用力在微电极吸进入一个黑暗的电极储物盒。
- 准备电极放入一个电极支架和固定探头到细胞内的放大器(IA - 251A,华纳仪器公司,哈姆登,CT,USA)。
- 细胞内放大器连接到数据采集板,提供了一个脉冲信号,从而推动了微电极的电流脉冲。
- 轻轻放入STG使用一个微电极操纵的神经元(PatchStar,Scientifica有限公司,阿克菲尔德,英国)膜微电极放置。以来的10倍目标的工作距离(UMPLFL10XW,NA 0.30,WD3.3毫米;奥林巴斯株式会社,东京,日本)的成像显微镜非常小,微电极应定位在一个斜位(约30 °)和运动微电极进入正确的位置,需要重新聚焦显微镜物镜和移动电极的几个步骤。要启动微电极是移动中的位置等,其尖端STG以上。直到电极尖端的焦点出现在显微镜的目标是降低。然后,它是进一步下调,但没有那么多触摸微电极。微电极降低,直到它重新出现在目标的重点。重复这些步骤,直到神经元出现在明确目标的重点平面。微电极降低,直到它接触和轻轻地穿透选定STG神经元的膜。这是使用示波器监视。
- 细胞内的电极是用来记录选定STG神经元的活动,以确定给予其活动的个人资料和其活性和STG活动外电极2,3,7记录之间的关系神经元。
- 电流注入模式切换到细胞内的放大器和用于正向电流步骤到最后1秒和1秒的差距没有进入微电极的电流注入分离的微电极注入10 NA为30分钟。注入电流驱动器,带正电的染料分子记录的神经元。如果设备是可用的多个神经元可能同时注入。
- 进入注射期,注射结束后10分钟内的神经元的染料蔓延检查。要做到这一点,我们用10倍的目标和照明的超低纹波卤素光源(HL - 151; Moritex,东京,日本)的MiCAM02成像系统(SciMedia有限公司,日本东京)通过过滤器的立方体MSWG2(与480-550 nm激发过滤器;奥林巴斯株式会社,东京,日本)。成像系统是使用192 × 128像素的分辨率,成像时间40毫秒,“hbin'模式,和10%成像会议帧的HR相机。如果染料充填成功成像显示在微电极的位置,周围神经元染补丁,并吹来的补丁后10分钟和30分钟后,拍摄的图像之间的成长。如果染料扩散是不够的,30分钟后,更多的注射时间是理所当然的。另外,一个新的染料电极也可使用。
- 拉出电极的神经元和神经元是留给至少20-30分钟放松。在这段时间内,下一个神经元可注射用染料。
4。成像染色神经元
染料灌装过程后,可成像的单个神经元的活动。另外两个或两个以上的神经元可填充到图像的几个STG神经元的同步活动。原则很多,可能所有STG的神经元可充满染料。神经元的成像是MiCAM 02使用HR相机的成像系统。的成像过程如下:
- 该显微镜的目标是改变成像数据采集和高透光效率20倍的目标(XLUMPLFL20XW/0.95,NA 0.95,WD2.0毫米;奥林巴斯株式会社,日本东京)。这在客观收集更多的光线,提供更详细的图像的神经元,10倍的目标,也给出了更高的放大倍率。贝因克更多的光线,已经与这个目标,也是我们可以用较低的光照强度,减少潜在照片的损害可能造成神经元的染料成像可见少量染料加载的有效手段。
- 显微镜的操作阶段,是成像的神经元在客观领域和目标集中到他们的位置。
- 外记录的数据也送入MiCAM 02成像系统,通过它的模拟输入通道。这使得比较容易的光信号和相应的电机模式或细胞外记录的峰值在分析阶段有关。
- MiCAM 02系统设置为使用96 × 64像素的分辨率成像时间2.2毫秒或48 × 32像素分辨率的成像时间1.5毫秒。在这两种情况下的“hbin”设置可以使用,如果不是很强的神经元的染色。
- 光照水平尽可能低(即神经元的染料仍然应该产生足够的荧光成像),以避免照片调制和照片记录的神经元的损害。
- 房间的光线和所有其余的光源被关闭。此外,一个黑色的窗帘可关闭各地的录音装置,以防止从外部来源的光线照射。
- 成像会被设定为4 - 16秒长之间。
- 染色神经元的自发活动,是在几个成像会议记录。
5。光学成像数据分析
要分析成像数据,我们使用的BVAna MiCAM 02成像系统相关的软件(版本10.08; SciMedia有限公司,日本东京)。该软件支持的成像数据的可视化,以及提供一系列的分析工具。对数据的分析和解释的步骤如下:
- 每个记录的神经元上选择一个适当的圆形区域利益。通常情况下,我们使用2 - 3感兴趣的调查在48 × 32像素分辨率的神经元,6像素半径地区 - 8像素地区利益的半径为调查96 × 64分辨率的神经元。
- 时间平滑的数据可能是必要的,尤其是当染料产生荧光(低背景值数据量相对较低,表明这可能是由于光线较暗,用于或低水平染料加载,例如在记录神经元的突起)。通常在这种情况下,我们使用的时间平滑与3 - 5个时间单位。
- 除了光学录音,我们还可以显示通过选择显示成像系统的模拟输入外记录。
- 光学数据的可视化和模拟输入的参数应设置适当的,以在计算机屏幕上看到的所有录像。
- 考虑的神经细胞,细胞外记录,从LVN和基于早期细胞内记录神经元的分类的光录音,有可能确定神经元的身份,并从记录的神经活动有关其活动神经。
- 据预计,光学记录清楚地表明,和不平均多个类似的事件,相应的细胞外记录的尖峰和亚阈值的事件,如由其他神经元的活动的抑制性突触后引起的潜力的神经活动的需要。
- BVAna软件的数据导出功能,可用于出口利益所选择的地区,也是模拟输入,包含了从LVN录音计算的光学录音。导出的数据可以进一步使用其他数据分析软件,以及在最简单的情况下(如微软Excel(微软雷德蒙,华盛顿州,美国)可能使用额外的可视化和数据处理)进行处理和分析。
6。代表性的成果
图2显示了一个STG记录从LVN蟹幽门中枢模式发生器的两个神经元(唱片,横向幽门神经元; PD,幽门扩张神经元)的同步录音。其细胞内的录音的基础上确定的LP和PD神经元的光学记录表明,的确这些匹配相应的LP和PD神经元的胞外录音。有一个一致的12 ms延时穗峰之间的光学和 LVN录音(参见图2插图)由于之间的神经节和外录制现场轴突的传输延迟。所提交的数据也显示,在对应记录神经元的高峰的胞体的神经活动显然是检测到。
s/ftp_upload/2567/2567fig1.jpg“ALT =”图1“/>
图1。)stomatogastric中枢神经系统(STNS)的示意图。 COG,连合神经节; OG,食管神经节; STG,stomatogastric节; STN,stomatogastric神经; LVN,侧脑室神经。二)蟹stomatogastric节(STG) - 图像显示STG神经元的半圆形后安排。
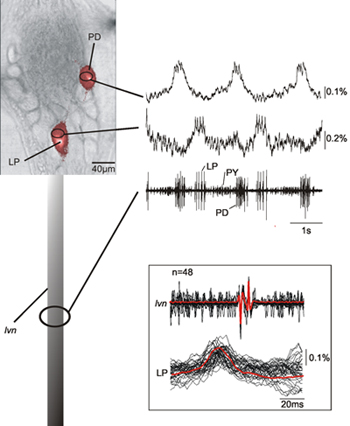
图2同时记录单扫了PD和LP神经元连同LVN的录音。数据显示,光学记录和神经匹配非常好,我们可以找出相应的记录形成的神经尖峰神经活动。插图显示了几个LP动作电位扫描覆盖 - 光学和电子记录 - 和展示他们的平均光学和电子记录活动之间的匹配。由于这样的事实,我们的光学记录方法不过滤掉低频成分的数据,我们也能够记录缓慢的膜电位变化特征为PD和LP神经元的14。
讨论
电压敏感染料成像8,9 STG神经元相结合,与传统的电方法(内和外电极录音),可以更好地了解如何小,众所周知,仍然复杂的神经系统的工作原理。 STG是一个中枢模式发生器(CPG)神经网络(包括和胃幽门磨节奏网络)10,11,从而更好地了解一个新兴的功能特性的STG也将有助于了解如何在一般的原型中央人民政府网络生成自己的网络级的功能。 CPG网络发挥关键作用在电机控制12,并在较高的认知功能13,从而更好地理解其紧急性质可能有一个在神经科学的许多领域产生重大影响。
披露声明
致谢
我们承认和纽卡斯尔大学的科学,农业与工程学院计算机科学学院的支持下,由乌尔姆大学,由SciMedia有限公司(日本东京)。
材料
| Name | Company | Catalog Number | Comments |
| MiCAM02 | SciMedia | Imaging system | |
| BVAna v.10.08 | SciMedia | Data analysis software for the MiCAM 02 imaging system | |
| HL-151 | Moritex, Tokyo, Japan | Ultra-low ripple halogen light source | |
| BX51 WI | Olympus Corporation | Upright microscope for epifluorescence imaging | |
| 20x imaging objective | Olympus Corporation | XLUMPLFL20XW/0.95 | NA 0.95, WD 2.0mm |
| 10x imaging objective | Olympus Corporation | UMPLFL10XW | NA 0.30, WD 3.3mm |
| Filter cube with 480-550 nm excitation filter and 590nm emission filter | Olympus Corporation | MSWG2 | |
| Antivibration table | Scientifica Ltd | 63-534 | |
| PatchStar electrode manipulator | Scientifica Ltd | PS-7000C | Micro-electrode manipulator |
| CED Power 1401 | Cambridge Electronic Design | Data acquisition board | |
| DL708E Oscilloscope | Yokogawa | Intracellular amplifier | |
| AC differential amplifier | University of Kaiserslautern, Germany | Extracellular amplifier | |
| P-97 Flaming – Brown type electrode puller | Sutter Instrument Co. | Electrode puller | |
| Sigma Microcentrifuge 1-14 | Sigma-Aldrich | Centrifuge | |
| Genex Pipettors Mline | Scientific Laboratory Supplies LTD | PIP7774 | PIP7774 |
| Glass micropipette with filament | Science Products | GB100TF 8P | Glass for micr–lectrodes |
| MicroFil – 34G | World Precision Instruments, Inc. | Microfil needle | |
| Spike 2 v6.10 | Cambridge Electronic Design | Electrophysiology software | |
| Di-8-ANEPPQ | Cambridge BioScience | BT61014 | Fluorescent voltage sensitive dye |
| F-127 Pluronic Acid, DMSO | Invitrogen | P-3000MP | Solvent |
| NaCl | Sigma-Aldrich | S9888 | Crab saline component |
| CaCl2 . 2H2O | Sigma-Aldrich | C3881 | Crab saline component |
| KCl | Sigma-Aldrich | P3911 | Crab saline component, electrolyte solution |
| MgCl2 . 6H2O | Sigma-Aldrich | M9272 | Crab saline component |
| Trizma base | Sigma-Aldrich | T1503 | Crab saline component |
| Maleic acid | Sigma-Aldrich | M0375 | Crab saline component |
| Elastosil RT-601 | Wacker, Munich, Germany | Lining of Petri dishes |
参考文献
- Gutierrez, G. J., Grashow, R. G. Cancer borealis stomatogastric nervous system dissection. J Vis Exp. , (2009).
- Bartos, M., Nusbaum, M. P. Intercircuit control of motor pattern modulation by presynaptic inhibition. J. Neurosci. 17, 2247-2256 (1997).
- Blitz, D. M., Nusbaum, M. P. Motor pattern selection via inhibition of parallel pathways. J Neurosci. 17, 4965-4975 (1997).
- Stein, W., Smarandache, C. R., Nickmann, M., Hedrich, U. B. Functional consequences of activity-dependent synaptic enhancement at a crustacean neuromuscular junction. J Exp Biol. 209, 1285-12300 (2006).
- Loew, L. Potentiometric dyes: Imaging electrical activity of cell membranes. Pure & Appl Chem. 68, 1405-1409 (1996).
- Tominaga, T., Tominaga, Y., Yamada, H., Matsumoto, G., Ichikawa, M. Quantification of optical signals with electrophysiological signals in neural activities of Di-4-ANEPPS stained rat hippocampal slices. J Neurosci Meth. 102, 11-23 (2000).
- Heinzel, H. G., Weimann, J. M., Marder, E. The behavioral repertoire of the gastric mill in the crab, Cancer pagurus: an in situ endoscopic and electrophysiological examination. J Neurosci. 13, 1793-1803 (1993).
- Zecevic, D., Wu, J. -. Y., Cohen, L. B., London, J. A., Höpp, H. P., Falk, C. X. Hundreds of neurons in the Aplysia abdominal ganglion are active during the gill-withdrawal reflex. J Neurosci. 9, 3681-3689 (1989).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. J Neurosci. 26, 10925-10933 (2006).
- Nusbaum, M. P., Beenhakker, M. P. A small-systems approach to motor pattern generation. Nature. 417, 343-350 (2002).
- Marder, E., Bucher, D. Understanding circuit dynamics using the stomatogastric nervous system of lobsters and crabs. Ann Rev Physiol. 69, 291-316 (2007).
- Grillner, S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 52, 751-766 (2006).
- Yuste, R., MacLean, J. N., Smith, J., Lansner, A. The cortex as a central pattern generator. Nat Rev Neurosci. 6, 477-483 (2005).
- Stein, W. Modulation of stomatogastric rhythms. J Comp Physiol A. 195, 989-1009 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。