需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
展示新型引力光谱仪的使用拉伸和测量纤维蛋白
摘要
这是一步一步引导显示的目的,操作,和代表从小说的引力谱仪结果。
摘要
大分子结构的研究已成为澄清的分子机制和功能的关键。有能力的测试力量的依赖在蛋白质的结构特点的几个有限的,但重要的bioinstruments。规模一直是限制参数准确,研究人员可以窥视奈米世界的分子,如核酸,酶,和电机蛋白质,执行维持生命的工作。原子力显微镜(AFM)以及纤维蛋白的天然结构调整,以确定用电子显微镜看齐的距离分辨率。然而,在AFM力研究,是典型的力量远远比单个分子可能会遇到1,2。光陷阱(OT)的确定被困珠之间的相对距离都非常好,他们可以传授非常小的力量3。然而,他们不屈服正在研究分子的精确的绝对长度。分子模拟提供支持的信息,这样的实验,但在有限的能力来处理同样大的分子大小,长的时间框架,并说服一些研究人员在没有其他辅助证据2,4的情况下。
引力谱仪(队)的能力提供了一个独特的组合,填补了一个调查阿森纳一个关键的利基。该仪器能产生力量通常用98%或更好的精度从femtonewton范围nanonewton范围。目前距离测量,是能够解决绝对分子长度下降到5纳米,和相对珠对类似的光学陷阱与精密分离距离的。此外,政府飞行服务队可以确定伸展或开卷的力量接近平衡是,或提供了一个分级的力量,对任何测量的结构性变化并列。它甚至有可能,以确定有多少个氨基酸残基参与开卷事件在生理负荷力2。在那里有广泛的力量,必须先于任何检测的校准方法不同,政府飞行服务队的要求没有这样的力量校准5。通过其他方法的补充优势,政府飞行服务队会的桥梁,在了解至关重要的蛋白质等大分子的纳米力学的差距。
研究方案
小说“政府飞行服务队配置
政府飞行服务队由几个基本组成部分:一个普通的光镜,赤道仪,一个摄像头,和一台电脑[图1]。根据政府飞行服务队的设计也是必不可少的密封流细胞室保存的样品。光镜下安装的赤道仪上,这样的范围可分为空间不同方向旋转。这种能力允许的静态重力向量被利用,使样品可以在向量动态导向,使重力可以传授piconewton程力载荷样品。相机取代光显微镜的目镜,所以它可以记录样品的方向变化。这是数字化的原始数据,由计算机操纵解释成实际的力量和距离测量的数据。密封流室,被设计为允许无样品损失在太空中自由程度。驻留在会议厅内的样品分子之一总站附近拴“挂靠”珠粘腔表面。与此相反的终点是一个“移动”珠,是从腔表面的限制。正是这种移动珠,可以采取行动的引力时伸展栓分子在如此低的力量负载缓冲液[图2]。样本只是看起来像一个在显微镜下的微对,尽管它确实需要一些经验来辨别对既珠坐在流腔表面分子的附件加上良好的可用双。修改系统之一,是一个浮动的平台,除了持有政府飞行服务队和弹簧暂停。在此配置中,一旦样品已到一个位置旋转引力作用于样品,平台和它的所有组件可以被丢弃,对弹簧常数。近自由落体,在移动珠是接近零,而且弹簧的最大延伸,引力乘以两倍之多。在这种方式,可以绘制分级响应力/距离来衡量不同的力载荷的单个分子行为。
1。微球的制备
- 浸约10毫克,0.04%,3 - 氨丙基(切用丙酮)两分钟的玻璃或硅珠。
- 有两个变化的双蒸水冲洗和离心机在2000年5分钟的XG颗粒。弃上清。
- 添加5毫升耦合缓冲液(0.01 mol吡啶切割用双蒸水,调节pH值至6.0),和动摇这种混合物大力。离心分离,上面所述。重复此步骤三次。
- 珠子的湿滤饼,加2毫升5%的gluteraldehyde溶液(降低耦合缓冲gluteraldehyde)。用力振摇。
- 在油烟机,旋转珠/ gluteraldehyde混合物在室温下3小时。
- 离心,吸出上清液。
- 通过大力摇晃他们洗净耦合缓冲液5毫升的珠子和离心,吸出上清液。重复此三次。
- 珠新增约15μL所需的抗体,并用力振摇。珠子应为16-24小时旋转。
- 引擎盖下,添加5毫升1 M甘氨酸淬火液(切割用双蒸水甘氨酸和调整pH至7.0)。大力撼动这种混合物,并旋转30分钟。
- 离心,吸出上清液。
- 加入5毫升的洗涤缓冲液(的0.01 M Tris,pH值7.0; 0.1%的叠氮化钠; 0.1%BSA,0.15 M氯化钠(NaCl);和0.001 M EDTA)。撼动这种积极,离心,吸出上清液。重复此步骤,三个额外的时间。
- 更改缓冲区低盐缓冲液(0.1 M的氯化钾; 0.02 M咪唑; 5毫米氯化镁2,调整pH至7.0)。重复三次。
2。样品附件,以微
- 以少量的准备珠(约2μL,每个珠子的蛋糕不过,如果有一个直径批次之间的巨大差异,是非常有利的周围使用的大,小珠的8:1比例),并将它们添加到与缓冲液的离心管中。的蛋白质浓度降低至5微米左右,使用的缓冲液。准备至少400μL,包括总体积的缓冲液,蛋白质,和珠。
- 这种混合物在1 3个小时的RPM左右旋转(如果蛋白质太多的激动,它会聚集和变得毫无用处)。
3。幻灯片商会准备
- 0.01%的硝酸纤维素(戊酯)厚外套显微镜幻灯片。让这个幻灯片干燥约10分钟。
- 用锋利的玻璃切割机,切盖的幻灯片,以使一腔。这就要求玻璃条。
- 用事实整个边缘两侧的真空润滑脂涂抹的玻璃和耙它ORY边缘。
- 按油脂涂到干燥硝化棉条涵盖的幻灯片上创建的幻灯片表面一个盒子。
- 移液器约2μL珠/蛋白质混合物的玻璃箱内表面上轻敲pipetter。
- 新增约20-400μL低盐商会是多么大的缓冲区。
- 按盖玻片上框已经完成密封和缓冲室真空润滑脂涂顶部。
- 让幻灯片上水平的地方坐,所以珠有充裕的时间来定位自己的硝化棉。
4。政府飞行服务队的数据采集
- 摩政府飞行服务队滑入阶段
- 监视器政府飞行服务队的相机记录和合法的搜索“珠对”小微是赤道附近的大微重视。
- 当一个潜在的珠对发现,经过深入重点,以确定是否“移动”珠是不是表面上的幻灯片休息。
- 一旦确定一个合适的一对是,注意角度移动珠距离D 最大 (D 最大的耦合微球的重心之间的最大距离)。移动到位置的范围,收购视频。
- 政府飞行服务队的旅行的角度应该是足够的记录d 分 ,D 最大 ,d分,可以称之为取决于分子的长度为25-90度。
- 对记录旅行d 分D MAX和d 分 。
- 这是一个好主意,也拍一部电影的背景,所以它可以减去进行分析后。
- 如果执行政府飞行服务队的下降,移动范围,D最大记录至少每秒60帧的下降。关键部分是第一次振荡,但记录时间长,也可用于动态研究。
5。政府飞行服务队的数据分析
- 原始视频转换成数字化的“阈值”的形象,并在imageJ运行宏,以确定视频的每一帧中的每个珠子的中心位置。这也是下拉视频。
- 转储的X,Y和面积数据到Excel ImageJ和积点。
- 如果适当珠对被收购视频,图中的一个明显的驼背是珠被自己最亲近的(d 分 )的指示,并在图的顶点D最大的位置。
- 利用这些数据,每个珠子的半径应确定正是在ImageJ嵌套的公式把所有这些信息是:
D = [(G罪α)2 +(G COSα+ D 最大 - G)2] 0.5
G = [d 分 2 + R B 2 - (R A + R B)2] 0.5 = R B罪β
C = D 最大 - R -克
(D =质心之间的距离,G =重力力;α=在物镜的平行度的角度 ; R B =半径移动珠 ; R A =半径的锚定珠;β=角断轴附件锚定珠赤道。 - 使用移动珠装半径,这也产生了它的体积,并给予珠的密度,移动磁珠上的分子赋予的力量,可以计算后的溶剂的浮力减去piconewtons。这种方法措施拴在piconewtons分子的力量和计算绝对分子长度之间的纳米抗体附件F = V(DB)A(F =力,V =体积,D =玻璃微球的密度 ,=加速由于重力作用,B =流离失所水的密度) 。
6。代表性的成果:
如果珠准备做是正确的话,将会有最低珠聚集,虽然有可能仍然是一个偶然的珠丛。当通过的范围来看,应该有一个合理的分配是否配对或在会议厅内的珠。
重要的是要尽可能减少振动;要做到这一点无论是空气表,特殊的冲击吸收拥有EQ装载三脚架的脚,或系统上,利用可用于隔振弹簧。
关于密封流室的另一项有用的技巧是让我们站在一个水平表上约五分钟后,它已经完全构造。这允许任何独立的大珠浮动硝化棉层通过缓冲和休息。如果幻灯片,而不是直接安装完成后,研究者将继续处理字面上的视野,飞珠;如果这发生在视频采集,它可以腐败日Ë实验。如果这样做是正确的,珠飞行是显着最小化和清洁的视频效果。
当一个潜在的珠对确定由政府飞行服务队运营商,它通过初步旋转它来监视两人的行为是很有用的。在极少数情况下,大珠不紧紧贴到幻灯片中。如果发生这种情况,也没有使用,因为它是至关重要的,挂靠在一个固定的位置,通过收购期间珠留在利用对。如果对是稳定的,不会出现“挂靠珠滚”,那么它适合用于实验。
磁珠分离的距离与角度相对重力变化曲线可以用来评估所获得的数据。一个很好的代表结果会显示一个高原上的小分离和移动珠释放本身由于重力的影响,锚定珠,图表将显示更多的分离。这样下去,直到一个很好的高峰达到被称为 D最大的曲线开始向下再次回到基线 d分[图1] 。在理想的条件下,这个签名是对称的。一个不具代表性的的结果将显示一个与显示没有明显的d分- D - D最大最小模式的不连贯的模式图;或片之间的灰尘,它会显示量级,表明可能为单一分子过高的分离珠,或者移动珠是根本不重视。发现一双,拍摄,处理,分析的过程中有许多停止珠对不当扑杀的差距。所以,如果你到整个过程结束,你有一个分子的长度,与以前的结果是一致的,可以非常有信心,原珠对具有代表性,可以在结果中包括。一个很好的一天,大约一半的射门珠对可以通过成为合法的数据点。例如,MF20和MF30抗体之间的肌球蛋白卷曲的长度,被称为基于EM数据和原子力显微镜,数据接近100纳米2,7,8,9。如果结果是这个长度,几次样品汇总。这里给出的结果是标准GFS循环实验,证明了96纳米的距离± 5 nm的[图2]同意密切配合MF30测量(肌球蛋白subfragment - 2的N -末端结合)和MF20 (光meromyosin结合)抗体对肌球蛋白的分离距离从文学价值推导[图3]。
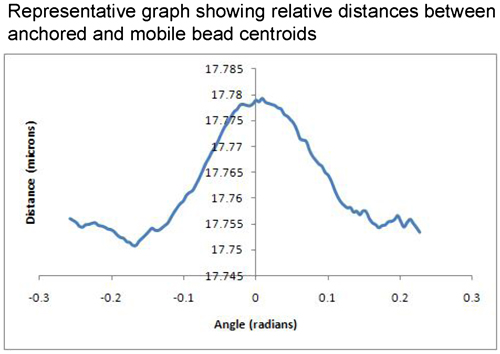
图1。政府飞行服务队的配置。政府飞行服务队的主要部分的标签。
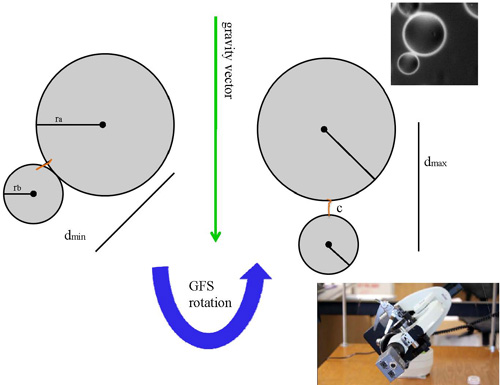
图2。示意图政府飞行服务队的原则。左边显示的质心移动珠从质心锚定珠的最低的距离。政府飞行服务队是旋转,移动珠赞同重力这也是栓分子轴平行运行的载体。在这个位置,移动和锚定珠的重心之间的距离是最大的。右上角显示一个从GFS电影的代表片。右下方是政府飞行服务队接受旋转的图像。
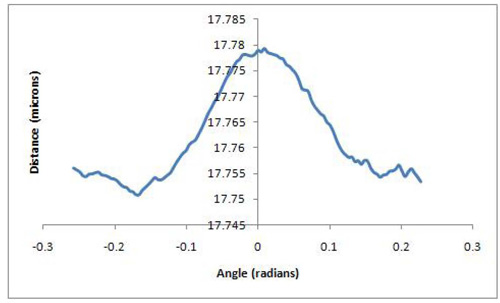
图3代表性的结果显示在图的左边d 分 ; D的相对分离的17.78微米的最大;和返回到D周围约17.75微米的珠子之间的相对分离的基准分。
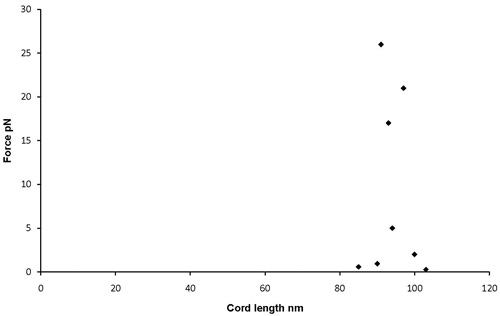
图4。代表GFS循环的实验显示MF20和MF30抗体,平均96纳米之间的距离结果。这代表了S2的大致时间。
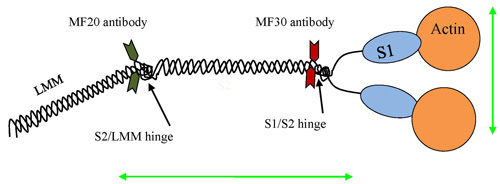
图5。肌球蛋白Ⅱ的二聚体,用于显示可能与政府飞行服务队使用,包括抗体和/或肌动蛋白附件附件。不同的附件的可能性,允许不同的政府飞行服务队的战略来衡量不同地区,或使用武力的垂直或平行杆的肌球蛋白二聚体域。
讨论
当转换到数字阈值的代表性的电影,它是为阈值的图像,以保持在每帧视频同一地区的关键。 ,因为在珠对珠彼此独立的,任何在阈值方面的漂移,也可能导致珠的重心之间的相对距离的漂移和引进重大错误。控制阈值面积减少的5倍,从26纳米的距离测量误差为5 nm。同样至关重要的是获得一个准确的测量半径为珠的珠子之间的比例,最终产生距离和力值的计算是非常重要的。
披露声明
致谢
基于这种材料是由国家科学基金会的支持下批准号0842736的工作。
材料
| Name | Company | Catalog Number | Comments |
| 3-Aminopropyltriethoxysilane | Polysciences, Inc. | 919-30-2 | |
| Acetone | Fisher Scientific | A18P-4 | |
| Pyridine | Sigma-Aldrich | 110-86-1 | |
| Glutaraldehyde | Fisher Scientific | G7776 | |
| Glycine | Research Organics | BP381-1 | |
| Tris | Sigma-Aldrich | 9682T | |
| Sodium azide | Amresco | 71289 | |
| BSA | Sigma-Aldrich | AMR-0332-100G | |
| NaCl | Sigma-Aldrich | S7653 | |
| EDTA | MSI | E9884 | |
| Nitrocellulose | Sigma-Aldrich | 60443 | |
| N-N Dimethyl Formamide | Extracted from Large New | D4254 | |
| Rabbit skeletal myosin II | Zealand White Rabbits (7-8) | NA | |
| MF30 antibody (9-10) | Developmental Studies Hybridoma Bank | MF30 | |
| MF20 antibody (6) | Hybridoma Bank | MF20 | |
| Lab microscope | Boreal | WW57905M00 | |
| Equatorial mount | Celestron | CG-5 | |
| Digital video cam | Sony Corporation | XCDV60 | |
| Caliper release | Cabelas | IA-415482 | |
| Compression spring | Jones Spring Co. | 723 | |
| Extension spring | Jones Spring Co. | 770 | |
| ImageJ | National Institutes of Health | NA | |
| Fire-i drivers & application | Unibrain | 3.80 | |
| Excel | Microsoft | NA |
参考文献
- Schwaiger, I., Sattler, C., Hostetter, D. R., Rief, M. The myosin coiled-coil is a truly elastic protein structure. Nat. Mater. 1, 232-235 (2002).
- Root, D. D., Yadavalli, V. M., Forbes, J. G., Wang, K. Coiled-coil nanomechanics and uncoiling and unfolding of the superhelix and alpha-helices of myosin. Biophysical Journal. 90, 2852-2866 (2006).
- Nishizaka, T., Miyata, H., Yoshikawa, H., Ishiwata, S., Kinosita, K. Unbinding force of a single motor molecule of muscle measured using optical tweezers. Nature. 377, 251-254 (1995).
- Gawalapu, R. K., Root, D. D. Fluorescence labeling and computational analysis of the strut of myosin's 50 kDa cleft. Arch. Biochem. Biophys. 456, 102-111 (2006).
- Kellermayer, M. S. Z. Visualizing and manipulating individual protein. Molecules Physiol. Meas. 26, R119-R153 (2005).
- Shimizu, T., Dennis, J. E., Masaki, T., Fischman, D. A. Axial arrangement of the myosin rod in vertebrate thick filaments: immunoelectron microscopy with a monoclonal antibody to light meromyosin. J. Cell Biol. 101, 1115-1123 (1985).
- Godfrey, J. E., Harrington, W. F. Self-association in the myosin system at high ionic strength. I. Sensitivity of the interaction to pH and ionic environment. Biochemistry. 9, 886-893 (1970).
- Root, D. D., Stewart, S., Xu, J. Dynamic docking of myosin and actin observed with resonance energy transfer. Biochemistry. 41, 1786-1794 (2002).
- Xu, J., Root, D. D. Conformational Selection during Weak Binding at the Actin and Myosin Interface. Biophys. J. 79, 1498-1510 (2000).
- Sattin, B. D., Pelling, A. E., Goh, M. C. DNA base pair resolution by single molecule force spectroscopy. Nucleic Acids Res. 32, 4876-4883 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。