Method Article
研究膜蛋白的构象动力学原位网站的荧光标记
摘要
我们将介绍一种方法,措施以及具体站点的使用对单个细胞的荧光的构象变化的分析膜蛋白的离子转运的动力学。这种技术是适应离子通道,转运和离子泵并可以被用来确定蛋白亚基之间的距离限制。
摘要
两个电极电压钳电(TEVC)是一个强大的工具来调查的膜蛋白的种类繁多,包括离子通道, 离子泵3,运输车4的离子transport1机制。最近的事态发展相结合特定地点的旁边TEVC荧光团的标签,同时在特定的残留物和单细胞表面上的这些蛋白质的功能研究的构象动力学。
我们将描述一个方法同时监测使用电压钳荧光的荧光和电流的变化来研究膜蛋白的构象动力学。这种方法可以用来检查网站专门以下的半胱氨酸更换和网站的荧光团的标签5,6膜蛋白的分子运动。此外,这种方法提供了一种方法,以确定7,8特定的残留物之间的距离限制。这是通过选择性地将供体和受体荧光基团,以两个利益的半胱氨酸残基突变。
总之,这些实验爪利维斯卵母细胞的表面上所需的蛋白质的功能表达。这些卵母细胞的表面积大,使轻便功能的测量和一个强大的荧光信号5。它也可能随时 改变,如pH值,配体或阳离子/阴离子对膜蛋白的 4机制,它可以提供进一步的信息外 条件。最后,最近的事态发展也使选择下面的第二个蛋白质9共同表达的内部离子的操纵。
我们的协议是在多个部分中描述。首先,半胱氨酸扫描突变进行荧光团的标签是由残留物位于跨膜区和胞外域的接口完成。随后的实验设计,以确定的蛋白质的构象变化后的残留物,这表明荧光强度(<5%)3大变化。其次,这些变化中的荧光强度相比,膜蛋白的动力学参数,以相关的构象的动态功能的蛋白质 10 。这使得一个严格的生物物理分析,目标蛋白的分子运动。最后,两个残留的全酶可与供体和受体荧光基团标记,以确定距离的限制,使用捐助photodestruction方法。它也可以监控蛋白亚基的相对运动,与供体和受体荧光基团的标签。
研究方案
1。蛋白表达的影响
克隆到一个适合如pTLN 11或pSG01MX 12 爪蟾卵母细胞表达载体膜蛋白的利益。优化载体含有5'和3' 爪蟾 β-珠蛋白非翻译区11,12,一个独特的酶切位点,和RNA的启动子站点位于前5'UTR区11。最佳表达在卵母细胞,mRNA的合成和mRNA合成前质粒线性化,分别需要这些组件。
2。半胱氨酸突变
- 一个凯特-杜利特尔情节,以确定目标蛋白质的跨膜蛋白质的氨基酸序列(ProtScale ExPASy)13。数据显示疏水性与序列号。显示正面的价值观的残留物是最有可能发现的跨膜结构域。使用该地块位于跨膜区和胞外域将突变为半胱氨酸之间的接口,以确定最有可能的残留物。作为确定的跨膜域和胞外区的接口不能使用凯特杜利特尔情节完整的确定性预测,重要的是要研究预计将在界面的残留。这个地区的蛋白质fluorophore.During构象变化的预测运动的荧光将移动之间的亲水性和疏水性的环境之间的更多的水淬少,水淬环境。这些预测在环境变化都将导致荧光强度的变化。
- QuickChange快速定点突变试剂盒(Stratagene公司)是用于生成单胞外半胱氨酸结构。简单地说,混合5μL10X反应缓冲液,2μL5纳克/μL的质粒DNA,1.25μL为100 ng /μL向前和反向引物,1μL的dNTP(100毫米),和39.5μL双蒸水。最后,添加1μLPfuTurbo DNA聚合酶(Stratagene公司)。这一步使用的引物设计应与利益外残留的半胱氨酸突变。
- 方案以下规格的热循环:1周期在95 ° C 30秒,在95 ° C 12-18周期为30秒,55℃1分钟,68℃,每KB质粒长度1分钟。从每个引物的熔融温度,退火温度(55℃)直接计算。最后一个步骤,可以编程的温度保持在4 ° C,如果反应是在一夜之间。周期数取决于基因突变。使用多种氨基酸插入的点突变,16个周期为一个单一的氨基酸变化,或18个周期为12个周期。
- 加入1μLDpnI(New England Biolabs公司)反应混合物,由吹打混合,离心1分钟(6000转)。孵育1小时,在37℃水浴彗星。
- 解冻排名前10位电胜任细胞(Invitrogen)的冰和孵化无菌SoC媒体(20毫克/毫升蛋白胨,酵母提取物5毫克/毫升,1 mg / mL的氯化钠,0.4 mg / mL的氯化钾,0.02 M Mg 2 +的 ,0.02 M葡萄糖,ddH2O)在37℃直至需要。分装20μL到1.5 mL离心管的细胞和细胞添加1μL酶切的DNA。
- 填充用冰水细胞Porator(Life Technologies公司),设置为330μF的电容,充电速度快,电压增压至4kΩ的电阻。
- 吸取20μL的细胞/ DNA溶液进入细胞的porator比色皿。细胞Porator放入试管,盖上盖子,接上电源线,然后转动拨盘到正确的比色皿。设置电源充电和举行“”直到电压读取430。转动拨盘的手臂,然后按触发。如果有爆裂声,重试电。
- 移液器从试管细胞,将它们传输到1.5毫升SoC媒体。孵育1.5小时,在37℃,用颤抖的彗星。
- 转移30μL的SOC /电池解决方案,以LB /氨苄青霉素琼脂平板(10毫克/毫升蛋白胨,酵母提取物5毫克/毫升,10毫克/毫升氯化钠,15毫克/毫升琼脂,DDH 2 O为100 ng /μL氨苄青霉素)。盘上的细胞扩散板,并在37 ° C过夜。
- 板块和收获单菌落接种5毫升文化包含LB /氨苄青霉素(10毫克/毫升蛋白胨,酵母提取物5毫克/毫升,10毫克/毫升氯化钠,为100 ng /μL氨苄青霉素DDH 2 O)媒体。摇37 ° 16-20小时的彗星。
- 执行DNA小量使用Nucleospin质粒试剂盒(马歇雷格尔)。琼脂糖凝胶电泳定性研究的产品。 Quantitiate使用Nanodrop 2000C分光光度计(Thermo Scientific的)的DNA的产量。
- 验证插入突变DNA测序。
3。 mRNA的合成
- 在50μL反应体积线性的DNA,消化3微克质粒DNA与5μL的适当的缓冲和限制性内切酶1μL1小时,在37.0 ° C。
- 使用高纯度的PCR产物纯化试剂盒(罗氏应用科学部),加350μL结合缓冲液中消化样品瓶和旋涡简要。使用此套件,因为它包含guanidiniumisothiocyanate这使得产品的RNA级。
- 离心柱和收集管负载与消化的DNA溶液列。 18000克离心20秒,并丢弃流过。
- 加入500μL缓冲液洗列。在18000克离心20秒,并丢弃流经。
- 加入200μL缓冲液洗列。离心30秒或直到列在18000干克
- 离心柱放置在一个灭菌的1.5 mL离心管中,并添加50μLDEPC处理过的水列。洗脱由G.离心30秒18,000
- 集中洗脱的DNA约15微升3μL的溶液在0.5微克。
- 选择正确的mMessage mMachine套件(Ambion公司)的质粒DNA(SP6,T7)的子网站序列。添加5μL1的NTP盖组合,3μL,线性DNA从前面的步骤,1μL转录缓冲,和适当的RNA聚合酶1μL。 1.5-2小时在37 ° C。
- 新增至少30分钟的降水12.5μL从工具包,氯化锂,15μLDEPC水,混合简要(不涡),在11000克离心10秒,并储存在-20 ° C。
- 离心机预冷到4 ° C和全速离心沉淀后至少15分钟。
- 棕色沉淀离心后应在试管底部可见。仔细去除上清液,并添加150μL,冷却70%的RNA级乙醇至-20 ° C在4 ° C离心5分钟全速。
- 删除的Eppendorf Vacufuge加上清完全,简要地干(1-2分钟),并在12μLDEPC水溶解现在的白色颗粒。 Quantitiate使用一个Nanodrop 2000C分光光度计(Thermo Scientific的)的mRNA的产量。
4。卵母细胞去除
- WPI的机构动物护理和使用委员会已批准该协议。
- 青蛙操作之前,应禁食12小时,以防止在手术过程中呕吐。
- 请0.5-3.0克MS - 222的解决方案,溶解在水中的。添加碳酸氢钠,直至溶液的pH值7.0-8.0。 MS - 222用作青蛙麻醉手术过程中。重要的是穿在任何时候都丁腈手套,而MS - 222处理和准备一种化学罩下的解决方案
- 沉浸在MS - 222解决方案的青蛙,直到青蛙已经失去了扶正和脚趾捏反射。要检查反应迟钝,捏青蛙的脚趾。
- 将湿尿布垫吸水侧背侧青蛙。这就避免了青蛙的皮肤损害。接近青蛙在任何时候都保持湿纸巾,青蛙必须保持湿润整个手术。如果青蛙的眼睛是开放的,重要的是沾有生理盐水溶液。如果青蛙显示觉醒的迹象,倒到青蛙麻醉的解决方案,等到青蛙变得反应迟钝。执行程序,然后再继续第二个脚趾捏。
- 请向左或青蛙的中线右侧小体腔切口。切口应交替双方后续手术。
- 青蛙的外观带来的卵巢取出卵巢。青蛙的皮肤避免接触卵巢。如果出血发生,适用于无菌棉条的压力,直到出血停止。
- 缝合切口,使用3.0-4.0爱惜康薇乔缝合材料(强生公司)间断缝合模式。缝合时,使用的手术器械,将比分扳成一次一结,避免接触皮肤的青蛙。同样重要的是缝合体腔和皮肤层分开。这是鸡蛋和非洲爪蟾卵母细胞收获的美国国立卫生研究院指南“(见: http://oacu.od.nih.gov/arac/XenopusOocyte_101007_Fnl.pdf) 。
- 手术后,青蛙不能接受至少2个月的运作。如果青蛙是足够健康,接受后续手术,还应当确定。每个青蛙的第 6 次手术终端可以进行最多6个手术。
5。的卵母细胞Defoculation和基因注射
- 分离出卵巢叶划分成更小的部分的剪刀。团块转入林格氏液+ CA与胶原酶2 +(8.6g / L的氯化钠,0.3克/ L的KCl和0.33 g / L的氯化钙2)。
- 轻轻摇动在18 ° C,2小时的消化解决方案如果大多数卵母细胞分离,用林格氏液的卵母细胞-的Ca 2 +(8.6 g / L的NaCl和0.3克/ L的KCl) 。孵育10分钟林格氏液中的卵母细胞-的Ca 2 + 。
- 将卵母细胞林格氏液+的Ca 2 +。
- 25 mRNA的吴注入卵母细胞,在50 NL Nanoject II自动纳升进样器(德拉蒙德)终体积,与3.5“德拉蒙德毛细管注:根据目标蛋白的mRNA量的变化。
- 注射后,孵化的卵母细胞林格氏液3-7天(90毫米氯化钠,氯化钾2毫米,5毫米MOPS,2毫米氯化钙 2,pH值7.4)和1毫克/毫升庆大霉素,在18 ° C在黑暗中的8。
6。网站特定的荧光标记
- 在测量之前,孵化的卵母细胞样缓冲液(氯化钠110毫米,2.5毫米的柠檬酸钠,和10毫米MOPS /在pH 7.4的Tris)为45分钟和45分钟后上样缓冲液(100毫米氯化钠,1毫米氯化钙 2 , BaCl 2 5毫米,5毫米NiCl 2,和10毫米,在pH 7.4)的公开资讯观测站/三,提高细胞内Na +浓度 14 。
- 对于荧光测量,在加载后的缓冲区,其中包含所需的荧光基团[前5微米的孵化卵母细胞。四甲- 6 -马来酰亚胺(TMRM)或荧光素- 5 -马来酰亚胺(FM),为5-10分钟。荧光团的标签后,洗净染料后加载缓冲区3详尽的卵母细胞。
7。电
- 拉硼硅毛细管(1B150F - 4,世界精密仪器)使用微量拉马(PC - 10型,Narishige)的微电极。填写带3米氯化钾的电极,并测试阻力。电阻值应在0.5-1.5MΩ的15之间。
- 配备一个535DF50激发过滤器,一个565 EFLP排放过滤器,和一个570DRLP分色镜扫描实验半胱氨酸(欧米茄光学)荧光显微镜(卡尔蔡司,Axio上考官荧光显微镜)。
- 放置在一个RC - 10室(华纳仪器)在荧光显微镜下阶段的卵母细胞和卵母细胞轻轻插入编造电极。使用涡轮增压的TEC - 05X放大器(NPI电子),保持在一个恒定的值的膜电位和测量穿过细胞膜以下解决方案交流,或通过改变膜电位的离子流。对于并发的荧光测量,使用一个100瓦的钨丝灯源激发捐助者的荧光基团和一个PIN - 022A光电二极管(联合检测技术)检测荧光强度的变化。放大器和光电二极管接口,通过一个Digidata 1440A数据采集系统(Axon仪器)利用计算机数据采集和记录pCLAMP10软件(Axon仪器)。
- 半胱氨酸扫描,测量荧光强度的变化在固定电流电压pCLAMP 10软件(Molecular Devices公司)是由控制步骤。根据利益的膜蛋白,细胞外液是设计,以确保固定的电流。
- 关联荧光强度的变化,有针对性的蛋白质的功能测量。
8。各向异性的测量和测定距离的限制。
- 应采取各向异性测量距离测量8一起计算κ2值的范围。各向异性措施的相对流动的荧光,由于旋转16。使用偏光过滤器(利诺斯光电公司),FM或TMRM以下利益的氨基酸残基的偏振光激发发出的光的平行和垂直测量。测量下采取的解决方案交换条件和恒定的膜电位,以确定荧光团的流动性。
- 各向异性是由R =(| |我⊥)/(| | + 2I⊥)我| |是平行光发射和我⊥是垂直发射光16。要计算距离测量误差,κ2 MAX = 2 / 3(1 + F 路 + F RA + 3F 路 * F RA)和κ2 分 = 2 / 3(1 - (六路 + F RA)/ 2 ),其中F RD =(R D / R O)0.5和F RA =(R A / R O)0.5,R a是TMRM各向异性,R D是各向异性的FM,和R O是每个荧光基团的根本各向异性 8 。
- 为了测量距离的限制,使用全酶,它有两个入口外半胱氨酸RESIDUES。随着卵母细胞,将举行在一个恒定的膜电位,因此在测量距离不变,但并不需要是一个功能的蛋白质的构象状态的荧光变化。孵育后负载缓冲液含1微米调频(受体荧光)和TMRM(供体荧光基团)4微米,在黑暗中冰30分钟,或只有1微米调频的卵母细胞。这使得8并没有受体荧光标记holoenzymes测量。配备一个475DF40激发滤光片,530DF30排放过滤器,并505DRLP分色镜的显微镜。
- 测量捐助的时间依赖性,受体荧光基团的存在和缺乏漂白。在这些测量的时间过程中,溶液流应该是连续的的。否则,随着时间的推移诱导荧光增加的热可观察到。在photodestruction与受体荧光基团的区别是用于计算的两个残基之间的距离。 Holoenzymes只包含捐助荧光基团,将经验与受体荧光基团photodestruction率比holoenzymes更快。 Holoyenzymes包含一个供体和受体荧光基团,将呈现缓慢photodestruction率接近其他8时。
- 使用pClamp10 Clampex功能,平均至少4个卵母细胞的录音photodestruction捐助荧光团的结果。
- 一旦结果已经平均,使用指数函数(单指数,双指数),以获得最适合的曲线。最适合的曲线可以用来确定photodestruction捐助荧光团,并没有受体的时间常数。
- 确定的能量转移效率方程:E = 1 -Γ 的DA /ΓD 17,其中GDA是指供体/受体荧光基团对ΓD指只有捐助荧光团的时 间常数时间常数。
- 使用福斯特equation17,E = 1 /(1 + R 6 / R O 6),标记的半胱氨酸残基之间的距离可以决定; E是FRET的效率,R是供体和受体荧光基团之间的距离 ,和R O配对17对捐助者和受体的效率在50%的距离。由方程管辖R O R O =(9.7x10 3JΦD N -4κ2)其中J是捐助排放和受体吸收光谱重叠正常化,ΦD是捐助排放未经受体荧光基团的量子产率, n是折射率,κ2偶极-偶极相互作用8取向的因素。
9。蛋白亚基的相对运动
- 使用双半胱氨酸与受体和捐助荧光团标记的结构。对于这些实验中,在两个半胱氨酸残基之间的距离将被测量的变化。由于这种情况下,每个残基的荧光强度在下面的标签应该是独立的构象状态的蛋白质8。因此,在荧光共振能量转移的任何改变,将是一个供体和受体荧光基团之间的距离变化的结果。
- 配备一个475AF40激发滤光片,595AF60排放过滤器和505DRLP分色镜的显微镜。对于这些实验中,捐助者和兴奋受体荧光基团的荧光测量。使用适当的方法(交流电压,配体,解决方案),激活的膜蛋白,并同时测量荧光强度的变化。在荧光强度的增加表明,两个荧光基团,从而两个残留逐渐靠拢。荧光强度降低,表明这两个荧光基团和两个残留物正在进一步分开。最后,没有荧光强度的变化表明,两个荧光基团,从而两个残基的蛋白质的构象变化后在同样的距离。
10。代表性的成果
与特定的荧光团标记的细胞外半胱氨酸残基,使调查后膜蛋白构象变化的运动。图1显示了一个典型的电压钳荧光跟踪。荧光强度的变化(降低跟踪),这是从一个更疏水环境的亲水性,或从更多的水淬的荧光运动少,水淬环境,在后的解决方案交换蛋白的构象变化的结果(上跟踪)。
此技术可伸展DED,以确定两个残基之间的距离限制。这样的实验结果如图2所示。在接受器flurophore(红色)的存在,漂白发生在较慢的速度比没有受体荧光基团(黑)。漂白率是直接关系到两个荧光基团之间的距离,根据福斯特方程17。这样的结果可以相关的蛋白质的不同构象状态,由两个电极电压钳在串联进行实验验证。
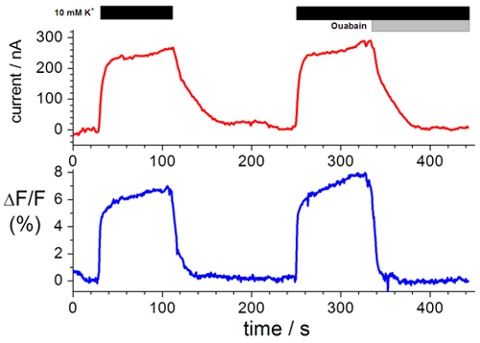
图1。离子运输和荧光强度的变化代表录音。顶部,电流钳测量Na +的测试解决方案和K +测试解决方案,在10μm和10 mM的哇巴因存在的存在。的底部,在串联测量电流钳测量 3,8,19荧光强度的变化。
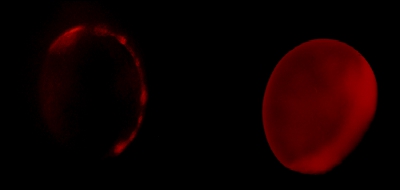
图2的时间依赖性漂白。捐助者photodestruction是测量的情况下(黑色)和受体荧光(红色)的存在。每个跟踪平均4个卵母细胞的录音。
讨论
我们所描述的实验方法,结合现场特定的荧光团的标签和两个电极电压钳研究膜蛋白的结构和功能之间的关系。这种技术可用于获得在离子转运膜蛋白的构象动力学的时间分辨的信息。此外,这种方法可以根据各种蛋白质,如离子泵,离子通道和运输工作。
除了在一个特定的残留调查的构象动力学,它也可以利用荧光共振能量转移,以确定在全酶的距离限制。测定残留以及测量亚基之间的相对运动之间的距离,可以帮助解决涉及门控机制的关键问题。
披露声明
材料
| Name | Company | Catalog Number | Comments |
| 试剂/设备 | 公司 | 试剂/设备 | 公司 |
|---|---|---|---|
| 100W钨丝灯源 | 卡尔蔡司显微成像 | 荧光素- 5 -马来酰亚胺 | Invitrogen公司 |
| 1B150F - 4 | 世界精密仪器 | 高纯度PCR提取试剂盒 | 罗氏公司 |
| 3.0-4.0爱惜康薇乔 | 强生公司 | mMessage mMachine套件 | Ambion公司 |
| 475AF40激发过滤器 | 欧米茄光 | MS - 222 | Sigma - Aldrich公司 |
| 505DRLP分色镜 | 欧米茄光 | Nucleospin质粒试剂盒 | 马歇雷-纳格尔 |
| 马歇雷-纳格尔 | 欧米茄光 | Nanodrop 2000C Sprectrophotometer | Thermo Scientific的 |
| 535DF50激发过滤器 | 欧米茄光 | PC - 10微管拖轮 | Narishige |
| 560DRLP分色镜 | 欧米茄光 | pCLAMP 10软件 | Axon仪器 |
| 565ALP排放过滤器 | 欧米茄光 | PfuTurbo DNA聚合酶 | Strategene |
| 565EFLP排放过滤器 | 欧米茄光 | 引脚- 022A光电二极管 | 联合检测技术 |
| 570DRLP分色镜 | 欧米茄光 | 偏光过滤 | 利诺斯Phtonics公司 |
| 利诺斯Phtonics公司 | 欧米茄光 | QuickChange快速定点Mutagenisis套件 | Stratagene公司 |
| Axio上考官荧光显微镜 | 卡尔蔡司显微成像GMBH | RC - 10荧光商会 | 华纳仪器 |
| 华纳仪器 | Life Technologies公司 | 四甲- 6 -马来酰亚胺 | Invitrogen公司 |
| Digidata 1440A数据采集系统 | Axon仪器 | 十佳Electrocompetent细胞 | Invitrogen公司 |
| DPN我 | New England Biolabs公司 | 涡轮Tec的05X放大器 | 非营利机构 |
参考文献
- Cole, K. S., Moore, J. W. Potassium Ion Current in the Squid Giant Axon: Dynamic Characteristic. Biophys. J. 1, 1-14 (1960).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Dempski, R. E., Friedrich, T., Bamberg, E. The beta subunit of the Na+/K+-ATPase follows the conformational state of the holoenzyme. J. Gen. Physiol. 125, 505-520 (2005).
- Miller, A. J., Zhou, J. J. Xenopus oocytes as an expression system for plant transporters. BBA - Biomembranes. 1465, 343-358 (2000).
- Cha, A., Bezanilla, F. Characterizing Voltage-Dependent Conformational Changes in the Shaker K+ Channel with Fluorescence. Neuron. 19, 1127-1140 (1997).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct Physical Measure of Conformational Rearrangement Underlying Potassium Channel Gating. Science. 271, 213-216 (1996).
- Koch, H. P., Larsson, P. H. Small-scale molecular motions accomplish glutamate uptake in human glutamate transporters. J. Neurosci. 25, 1730-1736 (2005).
- Dempski, R. E., Hartung, K., Friedrich, T., Bamberg, E. Fluorometric Measurements of Intermolecular Distances between the α- and β-Subunits of the Na+/K+-ATPase. J. Biol. Chem. 281, 36338-36338 (2006).
- Geys, S. A., Bamberg, E., Dempski, R. E. Ligand-Dependent Effects on the Conformational Equilibrium of the Na+,K+-ATPase As Monitored by Voltage Clamp Fluorometry. Biophys. J. 96, 4561-4561 (2009).
- Geibel, S., Kaplan, J. H., Bamberg, E., Friedrich, T. Conformational Dynamics of the Na+/K+-ATPase Probed by Voltage Clamp Fluorometry. Proc. Natl. Acad. Sci. U.S.A. 100, 964-969 (2003).
- Lorenz, L., Pusch, M., Jentsch, T. J. Heteromultimeric CLC chloride channels with novel properties. Proc. Natl. Acad. Sci. U.S.A. 93, 13362-13366 (1996).
- Mruk, K., Kobertz, W. R. Discovery of a Novel Activator of KCNQ1-KCNE1 K+ Channel Complexes. Biophys. J. 177a, (2009).
- Kyte, J., Doolittle, R. F. A method for diplaying the hydropathic character of a protein. J. Mol. Biol. 157, 105-132 (1982).
- Rakowski, R. F. Charge movement by the Na/K pump in Xenopus oocytes. J. Gen. Physiol. 101, 117-144 (1993).
- Tsunoda, S. P., Hegemann, P. Glu 87 of Channelrhodopsin-1 Causes pH-dependent Color Tuning and Fast Photocurrent Inactivation. Photochem. Photobiol. 85, 564-569 (2009).
- Cha, A., Bezanilla, F. Structural implications of fluorescence quenching in the Shaker K+ channel. J. Gen. Physiol. 112, 391-391 (1998).
- Förster, T. . Ann Physik. 2, 55-75 (1948).
- Dong, X., Stothard, P., Forsythe, I. J., Wishart, D. S. PlasMapper: a web server for drawing and auto-annotating plasmid maps. Nucleic Acids Res. 32, W660-W664 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。