需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
为极化上皮细胞注射质粒的小GTP酶的功能分析
摘要
本文详细介绍了在极化上皮细胞,利用显微注射技术的小GTP酶的过度表达和分析所涉及的程序。
摘要
上皮细胞分化成生化和功能上截然不同的心尖和基底域心尖域面临的'自由'的表面和基底外侧膜与基板和邻近细胞接触的质膜。这两种膜域是分开的紧密连接,形成一个扩散屏障。心尖,基底极化可以成功详文化Madin Darby狗肾细胞(MDCK),如上皮细胞接种在高密度聚碳酸酯过滤 器和培养1 2数天。如RalA,Cdc42的,Rab8,Rab10和Rab13 3 4 5 6 7 Ras超家族小GTP酶的数组是受细胞极性的建立和维护。所有GTP酶一样,这些蛋白质之间的一个无效的GDP结合状态和积极的GTP结合状态的周期。核苷酸结合区域的特定的突变与此骑自行车的干扰8。例如,Rab13T22N是永久锁定在国内生产总值的形式,并因此被称为“显性负”,而Rab13Q67L再也不能水解GTP,从而锁定在“显性活跃” 状态 7 。要分析其功能,在细胞中都占主导地位的消极和主导的GTP酶活跃等位基因通常表示在高水平干扰9内源性蛋白的功能。一种优雅的方式来实现的过度表达水平高,在很短的时间介绍质粒编码有关的蛋白质直接进入极化细胞过滤器支持采用显微注射技术种植的原子核。这往往是记者质粒共注射编码质膜是专门排序根尖或基底域的受体结合。常用的分析货物分拣基底域A货是一个温度敏感等位基因的水泡性口炎病毒糖蛋白(VSVGts045)10。 ,这种蛋白质不能正确折叠在39 ° C,因此将保留于内质网(ER),而利益调节蛋白在细胞质中装配。转向至31 ° C将允许VSVGts045正确折叠,离开的ER和旅游质膜 11 。这追逐通常是在放线菌酮的存在,以防止进一步的蛋白质的合成,导致清洁结果。在这里,我们详细描述了显微注射到极化细胞和随后的孵化,包括温度变化,使一个基底排序所涉及的监管蛋白质的综合分析质粒的程序。
研究方案
1。质粒DNA的分离
- 内毒素游离DNA,根据制造商的协议,使用一个Sigma - Aldrich公司内毒素maxiprep套件准备。该套件为我们的,因为它可靠从DNA制剂中删除任何内毒素。与细胞核的DNA注入内毒素会导致细胞死亡。
- 添加100μL酚/ chlorofom /异戊醇(25:24:1),以孤立的DNA,涡和13,000 RPM的Eppendorf离心1分钟旋转。上层水相转移到一个新的管,加100μL氯仿/异戊醇(24:1),涡旋和上面一样旋转。转移上层水相,含有DNA到一个新的管。这一步是需要删除任何蛋白质的DNA,从而防止堵塞的显微注射针。
- 添加醋酸钠(pH值6.0)的终浓度为300毫米和2 x卷100%的乙醇沉淀的DNA。在-20 ° C过夜孵育。 13,000 RPM的Eppendorf离心20分钟旋转的DNA,用70%乙醇洗一次,并悬浮在300μL内毒素自由水(Sigma - Aldrich公司)。
- 确定DNA的浓度。一个典型的DNA浓度范围从1到5微克/μL。
2。 MDCK细胞的培养
- 分割MDCK细胞。计数细胞和种子4 × 10 5细胞到清晰的12毫米Transwell小过滤器(0.4微米孔径,康宁中光学,3460) 。对于一个实验,其中包含一个模拟喷射控制和两种不同的突变Rab蛋白需要种子三滤。
- 文化MDCK细胞在MEM培养基2毫米L -谷氨酰胺,0.1 mg / ml的青霉素/链霉素和7%(体积/体积)胎牛血清(= MEM生长介质),在37 ° C和5%的CO 2。
- 更改媒体每天都在基底室。这有助于多极化进程,因为它模仿的上皮细胞在动物体内的情况。
- 播种后2天的检查,在显微镜细胞是否是在一个封闭的单层增长。如果你无法检测到任何孔,在单层执行第3天的实验。如果还有洞,执行你的第4天的实验。
3。显微注射过程及注射后孵化
- 实验当天准备了5毫升的MEM生长介质,加上每个过滤器和地方50毫米,60 × 15毫米板HEPES成39℃培养箱。此外,设立一个12孔板与1毫升的MEM增长的媒体,加上50毫米HEPES和0.1毫克/毫升酮每个过滤器,并成31 ° C培养箱地方。
- 打开显微注射显微镜,并设置其加热阶段至39 ° C。我们使用了激烈的阶段倒置显微镜(AXIOVERT 200,卡尔蔡司显微成像,公司),10X和32X的目标,和Eppendorf公司Femtojet(Injectman NI2)。最后,打开氮气罐,用氮气供应的航空表。
- DNA稀释过滤后的水(使用过滤0.2微米)的终浓度为0.2毫克/毫升的总量在10 - 100μL。随后,旋转的Eppendorf离心30分钟13000转的DNA。删除的顶端部分,并将其放置在一个新的管。这一步确保加载到您的稀释的DNA显微注射针时,您就可以准确载入“干净”的DNA。现在你的DNA显微注射准备。
- 准备你的细胞,通过其培养皿第一过滤掉。用手术刀片(羽毛手术刀片,不锈钢,11),切出到5毫升,39℃温暖的MEM生长介质,再加上50毫米(60 × 15毫米板)的HEPES过滤器过滤器支架和地方。称取下来,用手术刀片切割使用的过滤器在培养板。把它放置在过滤器等手术的刀片孔周围的过滤器的中间。培养板放置到显微镜的加热阶段。
- 装入一个显微注射针“(Femtotip二,Eppendorf公司,930000043)2-3μL稀释的DNA(=模拟喷射控制,在这种情况下,质粒编码VSVGts045 - GFP),捻针的保护盖,让它掉落到地板。现在的针是准备将其持有的拧紧。要做到这一点,按你injectman的菜单键,并确保阀门关闭。用螺丝将其持有的针,谨防不拧在针得太紧,可能会导致破损。现在,再次按菜单键,应用P C防止在microinjeciton过程中被吸进针媒体。最后,挖掘你的操纵杆来擦除存储归巢。
- 为了降低针到细胞,使用10倍的目标,并把上面的液体光柱的针。现在的焦点上的细胞,将焦点再次转动对焦轮180 °,并找到针。随后,慢慢移动成为关注的焦点针,然后再带出的重点(努力使细胞再次成为关注的焦点),转化为针CUS再次。重复,直到针接触介质的表面,此时你会看到的是一个光环。当你到达一个点,在该细胞中的重点,但针仍然是模糊的(即焦平面)32X目标和良好的粗设置改变。
- 设置触摸针尖顶膜,并减去约10微米的细胞核下方的顶膜铺设约10微米的z限制。
- 当您设置了Z -限制,找到合适的注射压力。开始在95 PSI。如果压力过高,你的细胞会炸掉。如果你的压力过低时,你会看到一个白点,保持,但没有别的情况。一个成功的注入,你会看到一个没有一个细胞大小的改变相变。为注射针,带几个微米的焦平面尽可能快。针对上述针(即单个细胞中)的细胞核,并按下游戏杆注射按钮,但不按住按钮。
- 孔手术的刀片,在于你的细胞内注入100-500细胞。当你完成后,请将您的细胞培养皿中和手术刀片成39℃培养箱,孵育2小时。在此期间,VSVGts045 - GFP的表达和分泌到急诊室。然而,在39 ° C,VSVGts045 - GFP不能正确折叠,因而不能离开急诊室。同时,小GTP酶的利益,会积聚在细胞质中的合作注入实验。
- 2 h后,你的细胞放入1毫升的MEM生长介质,加上50毫米的HEPES和0.1毫克/毫升酮为2小时31 ° C在12孔板孵育在这个追逐期间,VSVGts045 - GFP将正确折叠,离开急诊室,并传递到细胞表面。
- 重复步骤3.1 - 3.10(过滤器(注入质粒编码VSVGts045 - GFP和V5例如标签Rab13T22N)和三个注入质粒编码VSVGts045 - GFP和V5例如标签Rab13Q67L)。每次注射需时约20 - 60分钟。然而,这是绝对至关重要的每一个过滤器以同样的方式来对待整个温度变化的孵化和表面染色,直到您修复的细胞。固定后,您可能会染色协议的执行在同一时间所有过滤器的其余部分。
4。表面染色,免疫荧光分析
请注意,为了避免漂白VSVGts045 - GFP GFP信号,保护用铝箔覆盖在所有后续程序由轻标本。
- 如果你想进行表面染色,你的细胞在培养皿中放置到金属板在冰上和洗你的细胞与冰冷的PBS 2 +(PBS [0.2克/升的氯化钾,0.2克/升KH 2 PO 4 1X , 8克/升氯化钠和2.17克/升NA 2 HPO 4 × 7 H 2 O]加0.1克/升氯化钙和0.1克/升氯化镁2 × 6 H 2 O)。随后,30μL认识到,在这种情况下,你的蛋白的胞外区的抗体鼠标TK1单克隆抗体(IgG 抗体 1,从已故的托马斯克瑞斯获得),到上冰的金属板放在干净的封口膜。放在你的细胞倒挂下降到过滤器的抗体添加到过滤器的背面滴几滴。孵育在冰1小时。
- 放置到一个12孔板的细胞,3X与冰冷的PBS 2 洗 +(或RT暖PBS洗涤2 +,恕不另行表面染色),并修复3%多聚甲醛在室温下15分钟。
- 一次洗涤细胞用PBS 2 +的PBS 2 + 5分钟离开。
- 阻断/通透性缓冲区(BPB)(2%[WT / VOL] BSA,0.4%[WT / VOL]皂素在PBS 2 +)与10%[VOL /卷]山羊血清培养的细胞。孵育1 h在室温下。
- 稀释的主要抗体检测所表达的RAB GTP酶,在这个例子中反V5(鼠单克隆抗体IgG 2A,Invitrogen公司),1:200的BPB。在10分钟13,000转的Eppendorf离心旋转的稀释抗体。干净的封口膜的抗体溶液30μL,置于湿室。过滤器上放置倒挂的抗体下降到细胞孵育1 h RT。
- 位置细胞(右侧朝上)到12孔板和洗5倍以上30分钟在室温下的BPB。
- 稀释适当的二次抗体,在这种情况下,羊抗鼠IgG 1 Alexa的594标记(VSVG检测表面上,Invitrogen公司),和Cy5标记的抗体识别的Rab GTP酶,在这个例子山羊抗鼠IgG 2A Cy5标记(杰克逊ImmunoResearch),进入BPB的1:200和自旋以上。 30μL抗体溶液到干净的封口膜,在湿室和过滤上攻细胞抗体下降到。孵育1 h在室温下。
- 重复步骤4.6。
- 到去离子水和地方ř 3X细胞过滤器上的DIP到microslides ight朝上。细胞上,加入10-15微升安装(10%[WT /卷]的DABCO [WT /卷,50%的甘油蒸馏水)。广场18 × 18毫米的微型玻璃盖的顶部和使用面巾纸轻轻按压到细胞微玻璃盖。密封指甲油。
- 共聚焦显微镜分析的标本。我们用一个微LSM的510卡尔蔡司显微成像,公司配备一个63X的水浸泡镜头。
- 对于数字的编制,调整,并结合使用的程序,如Adobe Photoshop和Adobe Illustrator的图像。
5。代表性的成果
小GTP酶的共同表达对如何干扰VSVG排序的例子,请参阅无论根尖missorting 3,4或抑制表面交付7发表文章。
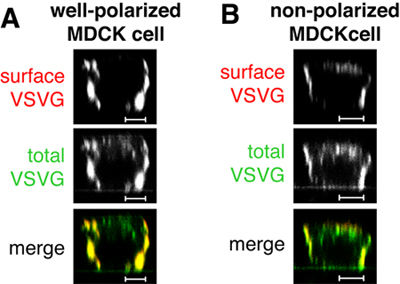
图1。在模拟注射,即注射质粒VSVGts045 - GFP,这种蛋白质被传递到基底表面的极化MDCK细胞表面染色(红,图1)来判断。请注意,并非所有的VSVGts045 - GFP是在追截过程中的基底膜31 ° C的广泛总蛋白的胞内信号(绿色证明,图1 A和B)。 VSVGts045 - GFP在没有得到很好的极化的细胞也将交付顶膜(图1 B)。如果您的控制标本的样子,就像在图1的B细胞你可以不信任你的数据和重复实验与更好的极化的细胞。比例尺是5微米。
讨论
一个成功的显微注射实验的最关键步骤的质量和纯度的DNA和你的细胞的极性。没有极化的细胞,注射控制将已经mistargeted VSVG和实验,不能使用。如果质量差的DNA,DNA可能会堵塞导致较差或没有所需的蛋白质的表达在所有的注射针头。另外,最好是用已知的导致高表达水平,如pRKV的表达质粒。
如果你想要测试的其他货物的蛋白质排序,温度变化协议可以被修改。例如,低密度...
披露声明
致谢
这项工作是由一个从(GM070736)国家卫生研究院授予阁下Fölsch。 SF昂是支持的A * STAR研究生奖学金,RS康是由细胞和分子基础的疾病培训计划(GM8061)的支持
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 加热阶段AXIOVERT 200显微镜 | 卡尔蔡司公司 | 自定义顺序 | |
| Injectman NI2 Femtojet显微 | Eppendorf公司 | 自定义顺序 | |
| Femtotips二(显微注射针) | Eppendorf公司 | 930000043 | |
| Microloader技巧 | Eppendorf公司 | 930001007 | |
| 清除12毫米Transwell小过滤器支持 | 康宁中光学 | 3460 | |
| 无内毒素质粒maxiprep套件 | Sigma - Aldrich公司 | NA0400 |
参考文献
- Mellman, I., Nelson, W. J. . Nature reviews. 9 (11), 833-833 (2008).
- Rodriguez-Boulan, E., Kreitzer, G., Musch, A. . Nature reviews. 6 (3), 233-233 (2005).
- Ang, A. L., Fölsch, H., Koivisto, U. M. . The Journal of cell biology. 163 (2), 339-339 (2003).
- Kroschewski, R., Hall, A., Mellman, I. . Nature cell biology. 1 (1), 8-8 (1999).
- Moskalenko, S., Henry, D. O., Rosse, C. . Nature cell biology. 4 (1), 66-66 (2002).
- Schuck, S., Gerl, M. J., Ang, A. . Traffic (Copenhagen, Denmark). 8 (1), 47-47 (2007).
- Nokes, R. L., Fields, I. C., Collins, R. N. . The Journal of cell biology. 182 (5), 845-845 (2008).
- Collins, R. N. Molecular cell. 12, 1064-1064 (2003).
- Hall, A. . Science (New York, N.Y. 279 (5350), 509-509 (1998).
- Scales, S. J., Pepperkok, R., Kreis, T. E. . Cell. 90 (6), 1137-1137 (1997).
- Keller, P., Toomre, D., Diaz, E. . Nature cell biology. 3 (2), 140-140 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。