需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一个视神经挤压伤的小鼠模型,研究视网膜神经节细胞生存
摘要
该协议显示了如何逆行标记视网膜神经节细胞,以及如何随后视神经挤压伤,以分析视网膜神经节细胞的存活和凋亡。这是一个为不同类型的视神经病变,包括青光眼的实验性疾病模型。
摘要
视神经损伤可导致轴索变性,逐渐死亡的视网膜神经节细胞(RGC的),在不可逆的视力丧失结果。在人类疾病的例子包括:外伤性视神经病变和青光眼视神经病变。它的特点是典型的视神经头的变化,逐步视神经病变,和视网膜神经节细胞的损失,如果不加控制,导致视力下降和失明。
视神经粉碎(ONC)损伤的小鼠模型,是一个重要的外伤性视神经病变的实验疾病模型,青光眼等,在此模型中,挤压伤到视神经,导致逐步视网膜神经节细胞的凋亡。这种疾病模型可以用来研究神经元死亡和生存,这是必要的治疗措施的发展的一般过程和机制。此外,药理学和分子的方法,可以在此模型中,识别和测试潜在的治疗试剂,治疗视神经病变的不同类型。
在这里,我们提供了一步一步演示(一)基线逆行标记视网膜神经节细胞(RGC的)第1天,(二)在4天的视神经挤压伤,(三)收获的视网膜和分析研资局在一天的生存11,(四)代表结果。
研究方案
所有的设备和试剂使用无菌。所有动物实验获得批准的动物护理和使用的聂/美国国立卫生研究院委员会(ACUC)(动物研究协议聂- 570),并根据美国国立卫生研究院的准则和法规执行。
1。基线逆行标记视网膜神经节细胞(RGC的)第1天
这一程序的目的是标签的视网膜神经节细胞的神经示踪染料注射入小鼠视神经挤压伤的前三天,上丘逆行。染料将逆行采取由视网膜神经节细胞,并提供生活RGC的一个标记(图1)。这种方法产生的变化不大可行的视网膜神经节细胞1-5重现标签。
- 深麻醉鼠标。清洁的头顶上的头发。放置在一个小的立体定位仪鼠标。保护oinment是适用于两只眼睛。三次使用碘伏和70%的酒精擦洗消毒头部皮肤。
- 做一个切口,在皮肤暴露的头骨,并保持干燥和清洁用3%双氧水。
- 识别和标记的前囟门。钻前囟门后面,和2.9毫米,0.5毫米,横向到每个半球7中线以上的孔上丘。在钻井过程中,应用生理盐水孔钻,以防止二次热损伤的网站。
- 使用立体测量设备和汉密尔顿注射器,注入每个半球上丘荧光金神经示踪染料(1微升3%生理盐水中荧光色素)非常缓慢的脑骨表面1.6毫米的深度。
- 缝合切口部位。为镇痛丁丙诺啡皮下注射。
- 将鼠标移动到一个温暖而干燥的地区和监测,直到它能够保持直立的姿势,并返回到其家笼。首3天的标签程序后,全身性镇痛药(例如,丁丙诺啡)和外用抗生素软膏,每天两次给予密切监测和鼠标。
2。第4天的视神经挤压伤
在此过程中,我们将应用挤压伤到视神经,导致主损伤的轴突(图2),这将导致的视网膜神经节细胞逐渐死亡。
- 三天后示踪染料应用,鼠标深感麻醉。使用解剖显微镜,一只眼结膜切开约4点钟位置,用一双弹簧剪刀。
- 轻轻地转移轨道的肌肉,并把它们放在一边。退出眼球暴露在白色的视神经。非常小心,不要破坏任何血管。
- 随着跨动作钳对援助,适用于约2毫米的眼球一个挤压伤到视神经,约3秒钟。非常谨慎,不损伤眼动脉,引起出血。
- 挤压伤完成后,切口缝合。
- 在小鼠从麻醉中复苏,给一个皮下注射丁丙诺啡镇痛。
- 移动鼠标到一个温暖,干燥的地区,监视它,直至它能够保持直立的姿势,并返回到其家乡笼。前三后挤压伤过程,全身镇痛药(例如,丁丙诺啡)和外用抗生素软膏,每日两次,鼠标密切监察。
3。收获的视网膜和分析研资局生存11天
这一程序的目的是收获retinaeto分析视网膜神经节细胞的存活。
- 在第11天(ONC后7天),鼠标是由CO 2输液和颈椎脱位安乐死。
- 眼睛被摘除的一双轨道施加压力钳的帮助。
- 两个小时的眼睛是在4%多聚甲醛溶液固定,PBS洗3次。剖析视网膜。视网膜清扫的过程已经被发表在2010年通过的Jove Gustmann,S. 等 。6,因此不会在这里描述。
- 尚存的视网膜神经节细胞的图像在视网膜定义地区使用荧光显微镜,可以算作视网膜神经节细胞密度。带或不带荧光标记的视神经挤压伤视网膜神经节细胞的一个代表性的结果如图3所示。
4。代表性的成果:
分析视网膜神经节细胞的生存,视神经挤压伤后7天,收获的视网膜,固定,夷为平地,安装。视网膜图像,分别用荧光显微镜。与健侧正常řetina(左,正常),可行的视网膜神经节细胞的数量(绿色,逆行到上丘注射荧光金神经示踪染料标记)是显着的视网膜与视神经挤压伤(右,ONC)(图3) 。
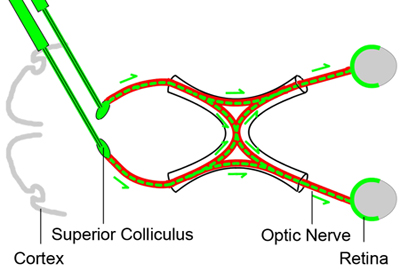
图1。基线逆行标记视网膜神经节细胞
为了算可行的视网膜神经节细胞,视神经挤压伤后不同时间点逆行标记视网膜神经节细胞注射到大脑中的三天丘的视神经前一个神经示踪染料(绿色)(红色),挤压伤。由于视网膜神经节细胞的轴突位于上丘,将采取示踪染料由视网膜神经节细胞逆行,并提供生活RGC的一个标志。
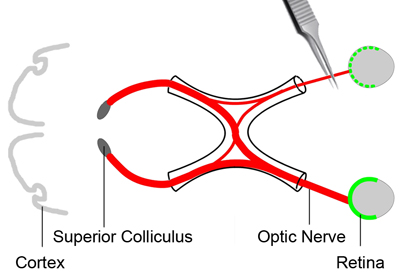
图2。视神经挤压伤
为了分析视网膜神经节细胞存活的状态,挤压伤是适用于视神经(红色),导致主轴突的损害。这将导致的视网膜神经节细胞逐渐死亡。三天示踪染料(绿色)注射后,老鼠被麻醉。一只眼结膜切开。偏离轨道的肌肉,并把它们放在一边。暴露在退出其眼球的视神经。应用挤压伤到视神经约2毫米的眼球约3秒钟,用一双跨动作钳。
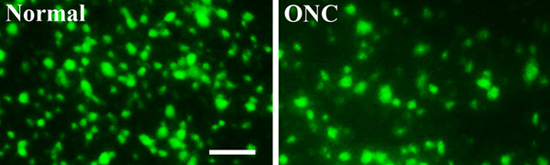
图3。荧光标记的视网膜神经节细胞,视神经挤压伤或不
分析视网膜神经节细胞的生存,视神经挤压伤后7天,收获的视网膜,固定,夷为平地,安装。视网膜图像,分别用荧光显微镜。可行的视网膜神经节细胞(绿色荧光金神经示踪染料注射到上丘逆行标记)与未受伤的正常的视网膜(左,普通)相比,明显的视网膜,视神经挤压伤(右,ONC )(图3)。比例尺:50微米
讨论
视神经挤压伤的小鼠模型研究RGC的死亡和生存的过程中是非常有用。这种模式也常常用于研究不同的试剂和RGC的凋亡和生存的基因的影响。这个模型的一个优点是它具有高度的重复性,最小的变化。
然而,需要特别照顾,在此模型中的几个步骤。首先,使视神经挤压伤时,它是必不可少的,不要用力过猛,而不是粉碎太久,因为它们可能导致眼动脉,因此随后的视网膜缺血?...
披露声明
致谢
我们的研究是由美国国立卫生研究院,美国国家眼科研究所院内研究计划的支持。
材料
| Name | Company | Catalog Number | Comments |
| Stereotaxic apparatus | ASI Instruments | SAS-4100 | |
| Dissecting microscope | World Precision Instruments, Inc. | PZMIV-BS | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel Blades #15 | Fine Science Tools | 10015-00 | |
| Microdrill | Fine Science Tools | 18000-17 | |
| Suture needle | Fine Science Tools | 12050-03 | |
| Spring scissors | Fine Science Tools | 16144-13 | |
| Dumont #5 forceps | Fine Science Tools | 11252-50 | |
| Hamilton syringe | Hamilton Co | 88400 | |
| Gauze sponges | Office Depot | 674889 | |
| Fluorochrome | Sigma-Aldrich | 39286 | |
| Alcohol | Sigma-Aldrich | 459844 | 70% |
| H2O2 | Sigma-Aldrich | H3410 | 3% |
参考文献
- Yoles, E. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Investigative ophthalmology & visual science. 33, 3586-3591 (1992).
- Fisher, J. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21, 136-142 (2001).
- Levkovitch-Verbin, H. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Investigative ophthalmology & visual science. 41, 4169-4174 (2000).
- Li, Y. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. The Journal of clinical investigation. 118, 913-923 (2008).
- Tang, Z. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. The Journal of experimental medicine. 207, 867-880 (2010).
- Gustmann, S., Dunker, N. In vivo-like organotypic murine retinal wholemount culture. J Vis Exp. , (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。