需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微生物源使用特定的人类和动物病毒的追踪成本效益的方法
摘要
这项研究描述为粪/尿污染或使用人/猪/牛的DNA病毒,腺病毒和提出的MST工具多瘤病毒,具体量化的qPCR在水中的硝酸盐污染的来源识别成本效益的方法。
摘要
微生物污染的环境,代表着一个重大的健康风险。古典细菌的粪便指标显示有显著的局限性,病毒更耐许多失活过程和标准的粪便指标不告知的污染源。成本效益的方法为水和分子检测病毒浓度的发展,有利于病毒的适用性作为粪便污染的指标,并作为微生物源追踪(MST)工具。腺病毒,多瘤病毒是DNA病毒感染具体包括人类在内的脊椎动物物种,并坚持在粪便和/或研究所有地区的尿液排出体外。在以往的研究中,我们建议人类腺病毒(HAdV)和JC多瘤病毒定量PCR(qPCR)(JCPyV)作为人类粪便污染指数的量化。最近,我们已经制定了具体量化的POR qPCR实验电影的腺病毒(反对家庭暴力伙伴关系)和牛多瘤病毒(BPyV)每1-10试管基因组副本的敏感动物粪便污染的标记。在这项研究中,我们目前所应遵循的程序,以确定在使用这些工具的水样本的污染来源。作为代表性的结果为例,提出高水平的硝酸盐在地下水的病毒分析显示。
低或中度污染水域的病毒检测需要从几升的水至少到一个更小的体积,一个过程,通常包括两个系列的浓缩步骤的病毒浓度。这有些繁琐的程序,观察病毒回收率的变异显著妨碍同时处理大量的水样。
为了消除由两个步骤的程序所造成的瓶颈,我们已经申请了一个一步到位的协议,在以前的studieS和适用于水基质的多样性。该程序包括:10升的水样酸化,絮凝脱脂奶,重力沉淀絮凝材料,沉淀,离心收集,在磷酸盐缓冲液10毫升沉淀再悬浮。病毒集中用于提取病毒核酸和具体利益的腺病毒和多瘤病毒是由qPCR的量化。使用这种低成本的浓度的方法,可同时分析大量样品。
该程序已应用于洗浴水,海水和河水的分析,在这项研究中,我们目前的地下水样品分析的结果。这种高通量的定量方法是可靠的,简单,成本效益。
研究方案
1。病毒颗粒的浓度水样中
- 水样的采集和空调
- 收集最低为2 10%的样本大号平底塑料容器和过程控制作为一个额外的样品复制。这最后的样本将会被添加与已知的病毒颗粒量,并作为控制使用。
注意:建议有特殊独立的材料加标样品(瓶,管件,等)。 - 检查校准conductimeter,如果有必要重新调整。准备一个额外的塑料10升容器中使用以前调整到足够的导电性(见下文1.6)的自来水阴性对照。
- 加标样品:样品添加量控制病毒的标准(每10升水的基因组约10份)。混合搅拌避免喷溅和气溶胶。阳性对照可包括在腺病毒小号少见株UCH作为HAdV - 35或噬菌体MS2等。
- 如果样品呈现高量的悬浮物(沙或其他材料),让泥沙为15分钟。转移到一个新的容器中的水。
- 水样的pH值调整为3.5(± 0.1)1 N盐酸。病毒的浓度,这一步很重要,所以一定要确保pH值已适当调整。清水彻底剧烈搅拌混合,同时加入的HCl。 (注:如果pH值超过3.5添加1 M氢氧化钠)。
- 调整的电导率。如果样品电导率1500μS/ cm或更高,这一步是没有必要的。如果电导率超过1500μS/厘米形成的絮凝物质(絮状物)不能保证较低,所以调整到1500μS/ cm的电导率此外人工海盐(Sigma公司)。大力搅拌,同时加入海盐混合。
- 之前和之后,空调以及一个记录样品的pH值S的盐酸量使用。电导率也应调整pH值后记录。始终消毒用新鲜的盐酸溶液的pH计和conductimeter电极,脱氯10%的钠tiosulphate溶液,最后用蒸馏水冲洗。
- 收集最低为2 10%的样本大号平底塑料容器和过程控制作为一个额外的样品复制。这最后的样本将会被添加与已知的病毒颗粒量,并作为控制使用。
- 絮凝前1%的脱脂奶粉的制备系统(PSM)
- 检查校准pH计和conductimeter,如果有必要重新调整。
- 准备在1升人工海水溶解10克脱脂奶粉(DIFCO)絮凝预脱脂奶粉溶液(1%的PSM,W / V)(33.3克的人工海盐溶解在1 L脱氯自来水和高压灭菌)和仔细调节pH至3.5 1N盐酸。絮体应该是可见的的。准备24小时的解决方案之前,使用或储存于4 ° C脱氯使用1毫升的10%,每100毫升水tiosulphate溶液。
- 目前在水样病毒颗粒的絮凝
- 添加1%的PSM 100毫升到10 L的水样。
- 搅拌8-10 h的样本,以使病毒吸附到的絮体。使用定时关机搅拌后8-10小时。
- 停止搅拌,让絮体沉积物的比重为8-10小时
- 收集和重新溶解的絮体。离心
- 使用蠕动泵和塑料管连接到一个塑料吸管去除上清。应加标样品上清收集到一个瓶子,根据内部程序和消毒。在所有情况下照顾不收集沉淀。
- 收集成离心瓶(约500毫升)的絮体的泥沙。
- 平衡此外PSM的pH值3.5盆。
- 离心机在高速离心机的盆,在30分钟8000 XG 4 ° C。只要停止离心机,小心地取出离心机离心机盆。
- 很克ently倒出上清液。按照传染性物质的适当措施。
- 添加7毫升磷酸盐缓冲液溶解沉淀在每个离心瓶。
- 絮体已被解散后,测量和添加磷酸盐缓冲液总体积达到10毫升。
- 均质涡旋病毒集中和分配到10毫升干净的微管,应冻结在-80℃直至需要在进一步的分析。
2。核酸提取
- 执行与QIAamp病毒RNA试剂盒制造商的说明的核酸提取。该套件使一个自动化平台的使用(如Qiacube,QIAGEN)。
3。人类腺病毒(HAdV),JC多瘤病毒(JCPyV),猪腺病毒(反对家庭暴力伙伴关系)和牛多瘤病毒定量PCR(BPyV)
- 定量样品中的基因组副本
- 准备使用TaqMan环境PCR扩增预混试剂2X(Applied Biosystems公司)的qPCR在一个干净的独立的区域组合。反应在96孔光学反应板与光学胶盖覆盖的地方。表1描述了主结构的浓度,引物和探针。
- 一旦组合已经做好准备,分装15μl,包括控制(见3.2)。将一个目标后,除了反应总体积25μl(15μl混合+加入10μl样品或标准)。
- 添加核酸提取的样品在一个单独的区域(10μL)。运行直接和十倍稀释重复每个样品纯化水。盖井样品含有粘合剂盖的一部分,继续以下步骤盖的其他部分。
- 从10 0 10 6一式三份GC/10μl添加的DNA标准悬浮液(10μL)的稀释和使用专为斯坦一个微量准的DNA。明智的做法是添加标准配备销毁质粒DNA,每次使用后清洁微量的紫外线辐射面积。含标准的预切胶盖,盖井。
注意:要准备用于在基因组复制的量化标准悬浮液,应克隆到质粒和线性目标DNA区域。在下面的地址,你会发现对如何建立标准曲线在qPCR的质粒DNA模板的详细过程:
http://www.appliedbiosystems.com/support/tutorials/pdf/quant_pcr.pdf - 执行到一个适当的系统选择适当的参数(考虑使用粘合剂的封面和总量在每口井等)的qPCR。以下激活AmpliTaq黄金10分钟在95℃,40个扩增循环执行如下:15在95 ° C小号和HAdV,JCPyV BPyV,15日95章第1分钟在60 ° C ° C,20岁,在55 ° C和为反对家庭暴力伙伴关系在60 20岁°彗星。
- 一旦反应完成后,用于存储数据,并在用户的设备手册所述的结果。 DNA的金额将被定义为纠正稀释倍数后,需要时获得的数据的中位数。
- 控制
- 使用阳性和阴性对照。检测必须包括一个以上的非模板对照(NTC)证明混合不产生荧光。明智的做法是执行积极的过程控制,以评估潜在的酶抑制由于抑制剂目前在研究的样本。
- 两个不同稀释度的标准DNA和过程控制的qPCR实验记录结果。使用结果的灵敏度和检测效率相关的质量控制(QC)计划,以备控制图。
- 确认结果
- 积极的结果可能会进一步证实,采用巢式PCR扩增和核苷酸测序,生产株的核苷酸序列的额外数据检测1,5,6,7,9,12。
所述的程序之后,人类和动物病毒检测和洗浴水,海水和河水2,3量化。作为一个代表性的例子,提出高水平的硝酸盐地区地下水样品进行了评估,以确定污染的来源。十公升水样收集了来自4个不同井在西班牙东北部地区的农村。五复制被收集在每个福祉用于过程控制的人类腺病毒2号种子的复制。根据图1所代表的协议处理样品。四个复制分析研究的4个地点之一,表明反对家庭暴力伙伴关系的积极结果(平均值7.74 × 2 GC / L),这将是相关的采样点周围地区的猪泥浆和支持粪猪污染的地下水中硝酸盐(见表2)的来源。
4。代表性的成果:
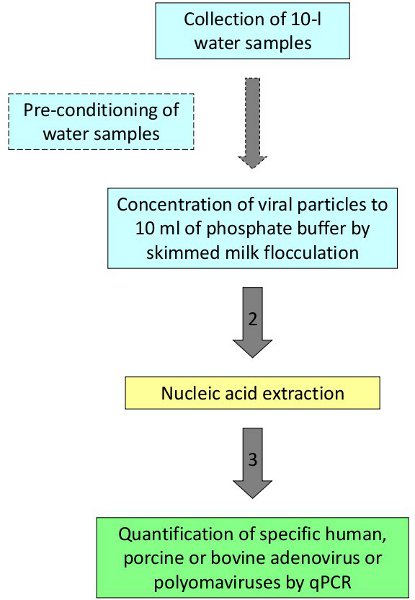
图1:在水中病毒的检测和量化的过程。
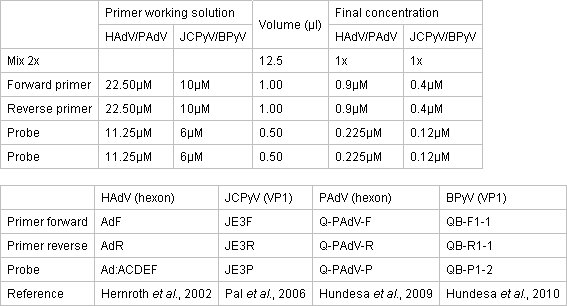
qPCR实验的引物和探针的浓度见表 1 。。

表2:动物和人类腺病毒和地下水样品中的多瘤病毒的检测和量化。
N多的复制分析
积极%的比例复制
( - )非检测
讨论
描述的步骤将履行为日常的环境和公众健康实验室的拟合方法的条件是:重现性好,质量可靠,简单和成本效益。该协议是简单的,但它必须严格遵守。低电导率样品中没有添加人工海水盐的要求的浓度将大大降低病毒的复苏将的情况下,如果搅拌时间对絮凝显着降低(例如少于5小时)。
目前应用的MST工具一般都是基于分子生物学技术。由不同的群体开发的研究显示出?...
披露声明
两项专利申请量在2009年,以保护知识产权的协议,为反对家庭暴力伙伴关系和BPyV量化。
致谢
部分支持这项工作是由西班牙政府“部教育Ÿ Ciencia”(项目AGL2008-05275-C01/ALI),由欧盟研究框架7 VIROBATHE资助项目(合同号513648),VIROCLIME(合同号243923 )和水的加泰罗尼亚机构,通讯社Catalana艾瓜(ACA),Departament去控制我Millora dels Ecosistemes游泳。在研究开发,玛塔Rusiñol是加泰罗尼亚政府“AGAUR”(FI - DGR)的研究员。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 高速离心机(8000 XG) | Berckman库尔特 | 阿凡提J - 20XP | |
| pH计,温度计和conductimeter | Afora | LPPC3003 | |
| 塑料管长100-200厘米 | Deltalab | 350059 | |
| 无菌毕业于一次性移液器 | Labclinics | PN10E1 | |
| 1.5和10-15毫升(Eppendorf公司,猎鹰等)的无菌塑料管 | Afora | KA298/00 | |
| 离心机壶(500毫升) | Fisher Scientific则 | SE5753512 | |
| 磁力搅拌器和磁铁(每样本) | Fisher Scientific则 | 10510 | |
| 平底的玻璃或塑料容器,允许使用磁力搅拌器 | Deltalab | 191642 | |
| 一个蠕动泵取出上清液(或水喷射真空泵) | 沃森的马洛 | 323E / D转换 | |
| 定时关机搅拌后8-10小时 | Deltalab | 900400 | |
| 盐酸(1N和0.1N) | Panreac | 141020.1611 | |
| 氢氧化钠(1N) | Panreac | 131687.1211 | |
| 人工海水的海盐 | 西格玛 | S9883 | |
| 脱脂牛奶(SM) | DIFCO | 232100 | |
| 磷酸盐缓冲液pH值75 | 1:2 V / V无菌娜2 HPO 4 0,2中号的NaH 2 PO 4 0.2,在pH 7.5中号 | ||
| 硫代 | Panreac | 121879.1209 | 请在水中10%的解决方案 |
| QIAamp病毒RNA试剂盒 | Qiagen公司 | 52904 | |
| 96孔光学反应板(500个单位) | 应用生物系统公司 | 43426659 | |
| 光学粘合剂覆盖(100个单位) | 应用生物系统公司 | 4311971 | |
| TaqMan探针环境PCR扩增预混试剂2X | 应用生物系统公司 | 4396838 |
参考文献
- Bofill-Mas, S., Clemente-Casares, P., Major, E. O., Curfman, B., Girones, R. Analysis of the excreted JC virus strains and their potential oral transmission. J. Neurovirol. 9 (4), 498-507 (2003).
- Bofill-Mas, S., Albinana-Gimenez, N., Clemente-Casares, P., Hundesa, A., Rodriguez-Manzano, J., Allard, A., Calvo, M., Girones, R. Quantification and stability of human adenoviruses and polyomavirus JCPyV in wastewater matrices. Appl. Environ. Microbiol. 72 (12), 7894-7896 (2006).
- Calgua, B., Mengewein, A., Grunert, A., Bofill-Mas, S., Clemente-Casares, P., Hundesa, A., Wyn-Jones, A. P., López-Pila, J. M., Girones, R. Development and application of a one-step low cost procedure to concentrate viruses from seawater samples. J. Virol. Methods. 153 (2), 79-83 (2008).
- Hernroth, B. E., Conden-Hansson, A. C., Rehnstam-Holm, A. S., Girones, R., Allard, A. K. Environmental factors influencing human viral pathogens and their potential indicator organisms in the blue mussel, Mytilus edulis: the first Scandinavian report. Appl. Environ. Microbiol. 68, 4523-4533 (2002).
- Hundesa, A., Bofill-Mas, S., de Motes, M. a. l. u. q. u. e. r., Rodriguez-Manzano, C., Bach, J., Casas, A., M, ., Girones, R. Development of a quantitative PCR assay for the quantitation of bovine polyomavirus as a microbial source-tracking tool. J. Virol. Methods. 163 (2), 385-389 (2010).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Albinana-Gimenez, C., Rodriguez-Manzano, N., Bofill-Mas, J., Suñen, S., E, ., Girones, R. Development of a qPCR assay for the quantification of porcine adenoviruses as an MST tool for swine fecal contamination in the environment. J. Virol. Methods. 158 (1-2), 130-135 (2009).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Bofill-Mas, C., Albinana-Gimenez, S., N, ., Girones, R. Identification of human and animal adenoviruses and polyomaviruses for determination of sources of fecal contamination in the environment. Appl. Environ. Microbiol. 72 (12), 7886-7893 (2006).
- Layton, B. A., Walters, S. P., Lam, L. H., Boehm, A. B. Enterococcus species distribution among human and animal hosts using multiplex PCR. J. Appl. Microbiol. 109, 539-547 (2010).
- de Motes, M. a. l. u. q. u. e. r., Clemente-Casares, C., Hundesa, P., Martín, M., Girones, R. Detection of bovine and porcine adenoviruses for tracing the source of fecal contamination. Appl. Environ. Microbiol. 70 (3), 1448-1454 (2004).
- Pal, A., Sirota, L., Maudru, T., Peden, K., Lewis, A. M. Real-time PCR assays for the detection of virus-specific DNA in simples with mixed populations of polyomaviruses. J. Virol. Methods. 135 (1), 32-42 (2006).
- Stapleton, C. M., Kay, D., Wyer, D. a. v. i. e. s., Watkins, C., Kay, J., McDonald, C., Porter, A. T., J, ., Gawler, A. Evaluating the operational utility of a Bacteroidales quantitative PCR-based MST approach in determining the source of faecal indicator organisms at a UK bathing water. Water Res. 43, 4888-4899 (2010).
- Wang, J., Horner, G. W., Keef, O., S, J. Detection and molecular characterization of bovine polyomavirus in bovine sera in New Zealand. N. Z. Vet. J. 53, 26-30 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。